Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión On-line ISSN 2078-8452
Pastos y Forrajes vol.38 no.4 Matanzas oct.-dic. 2015
ARTÍCULO DE INVESTIGACIÓN
Salinidad en Cuba y tratamientos pregerminativos de hidratación-deshidratación de semillas
Salinity in Cuba and pre-germination hydration-dehydration treatments of seeds
Mayté Pernús1 y J. A. Sánchez1
1Instituto de Ecología y Sistemática; Ministerio de Ciencia, Tecnología y Medio Ambiente, Carretera de Varona 11835, Calabazar, Boyeros, La Habana 19, CP 11900, Cuba
Correo electrónico: mayte@ecologia.cu
RESUMEN
La salinidad de los suelos es uno de los principales factores abióticos que afectan el establecimiento y la productividad de las plantas, efecto que se incrementa a escala global. Una ecotecnología de fácil implementación que ha probado ser eficiente para mejorar la germinación, el crecimiento y la productividad de las plantas cultivadas y silvestres, en diferentes escenarios de estrés (e.g., hídrico, calórico, ácido y salinidad), es el tratamiento de hidratación-deshidratación (HD) de las semillas. En esta revisión se informa sobre el estado de salinidad de los suelos cubanos, los principales efectos de la salinidad en las plantas y las diferentes tecnologías que existen para el manejo de los suelos salinos. Se discuten los efectos positivos de los tratamientos de HD en el comportamiento de las plantas en condiciones de salinidad, así como aspectos teóricos y prácticos relacionados con la aplicación de estos procedimientos fisiológicos para facilitar su introducción en las prácticas agroforestales y silvopastoriles.
Palabras clave: estrés, manejo del suelo.
ABSTRACT
Soil salinity is one of the main abiotic factors which affect the establishment and productivity of plants, effect that is increased at global scale. An easily implemented ecotechnology which has proven to be efficient to improve the germination, growth and productivity of cultivated and wild plants, in different stress scenarios (e.g. hydric, heat, acid and salinity), is the hydration-dehydration (HD) treatment of the seeds. This review reports about the salinity status of Cuban soils, the main effects of salinity on plants and the different technologies that exist for the management of saline soils. The positive effects of the HD treatments on the performance of plants under salinity conditions are discussed, as well as theoretical and practical aspects related to the application of these physiological procedures to facilitate their introduction in agroforestry and silvopastoral practices.
Key words: stress, soil management.
INTRODUCCIÓN
La salinidad de los suelos constituye uno de los principales factores de estrés abiótico que provocan que disminuya la productividad de los cultivos (Munns y Tester, 2008). Se estima que existen más de 800 millones de hectáreas a nivel mundial afectadas por salinidad (FAO, 2014). En Cuba, según datos de la Oficina Nacional de Estadística e Información (ONEI, 2013), el 14,9 % de la superficie agrícola y el 9,1 % de la superficie del país se encuentran afectados por sales.
El estrés salino en las plantas limita la toma de agua por las raíces, y ocasiona cambios similares a los que ocurren ante un estrés hídrico, como la reducción inmediata de la velocidad de crecimiento. En adición, puede inducir toxicidad iónica si entran a la planta excesivas cantidades de sales (Munns, 2002), y, como consecuencia de estos efectos primarios (osmótico e iónico), promueve la formación de especies reactivas al oxígeno; lo que da lugar a un estrés secundario, conocido como estrés oxidativo (Zhu, 2001).
Considerables esfuerzos se han destinado al conocimiento de los cambios fisiológicos y bioquímicos que tienen lugar en las plantas sometidas a salinidad (Prisco y Gomes, 2010). La comprensión de los complejos mecanismos de tolerancia a dicho estrés (Zhu, 2002; Deinlein et al., 2014) constituye la base para el desarrollo de cultivares que produzcan económicamente en esta condición (Prisco y Gomes, 2010). Además del mejoramiento genético, varios métodos tecnológicos y técnicas de cultivo se emplean en el manejo de los suelos afectados por las sales, aunque algunos no son económicamente viables (Ruiz et al., 2007) y otros pueden comprometer la preservación del medio ambiente, como la aplicación de fertilizantes químicos por encima de los niveles óptimos para el agua de riego (Cuartero et al., 2006).
Por su parte, los tratamientos de hidratación-deshidratación (HD) de las semillas constituyen un procedimiento fisiológico conocido que mejora la germinación, el establecimiento y la productividad de las plantas en condiciones ambientales adversas (Sánchez et al., 2001a; Paparella et al., 2015). Esta ecotecnología es de fácil implementación, de bajo costo y riesgo; y una vía para desarrollar una agricultura más sustentable en países pobres o en vías de desarrollo (Maiti y Pramanik, 2013). En Cuba, la efectividad de estos tratamientos ha sido comprobada en un amplio número de cultivos y plantas nativas en diversos escenarios ambientales, tales como: estrés hídrico y calórico, acidez, etc. (Sánchez et al., 2003a, 2007; Montejo y Sánchez, 2012). Sin embargo, debido posiblemente a su pobre divulgación en el medio rural, los tratamientos de HD son de poca aplicación en el país, y menos aún para incrementar la tolerancia de las plantas a la salinidad. Un fenómeno similar ocurre en otras regiones subdesarrolladas del mundo, fundamentalmente en América del Sur y países africanos, pero no en el continente asiático (Vanangamudi et al., 2006).
En la presente revisión se ofrece información sobre el estado de la salinidad de los suelos en Cuba, los principales efectos de la salinidad en las plantas y diferentes alternativas que existen para el manejo de los suelos salinos. También se discuten aspectos teóricos y prácticos relacionados con la aplicación de los tratamientos de HD en las semillas, con el objetivo de facilitar su extensión a la práctica productiva en condiciones de estrés salino.
Salinidad en Cuba
Según Ortega (1986), las principales fuentes de sales en los suelos cubanos son los sedimentos salinos formados en condiciones continentales durante las fases de aridez pleistocénica, seguidos de la intrusión marina en los acuíferos cársicos abiertos al mar. Las zonas más importantes de acumulación continental de sedimentos salinos pleistocénicos son la depresión Cauto-Guacanayabo, el Valle de Guantánamo y el norte de las provincias centrales. Sin embargo, dicho autor plantea que el clima húmedo de Cuba favorece el lavado natural de las sales; por lo que los suelos con salinización primaria o natural son poco extensivos y están asociados a las ciénagas costeras.
En la mayor parte de los suelos afectados de Cuba, la salinidad es secundaria; entre las causas que la producen se encuentran: la deforestación de las tierras altas y las ciénagas costeras, el uso de agua salinizada de acuíferos con intrusión marina, la elevación del manto freático salinizado, así como el uso de agua de riego de mala calidad (Ortega, 1986; González-Núñez et al., 2004). Además, se estima que el aumento del nivel del mar debido al cambio climático comprometerá grandes extensiones de tierra; lo que repercutirá negativamente en los recursos de la flora y la fauna que mantengan relación con las áreas afectadas (Álvarez y Mercadet, 2012).
De acuerdo con la información del mapa de salinidad, que aparece en el Nuevo Atlas Nacional de Cuba (Obregón, 1989), se conoce que un millón de hectáreas de suelos agrícolas están afectadas por salinidad y más de un millón tienen problemas potenciales; y las provincias orientales son las más afectadas (González-Nuñez et al.; 2004). Sin embargo, estas cifras deben ser superiores en la actualidad, aunque no aparecen nuevos reportes en la literatura científica.
Efectos de la salinidad en las plantas
La salinidad de los suelos afecta la germinación, el crecimiento y el desarrollo de las plantas. Su efecto negativo se debe principalmente a dos componentes: el osmótico y el iónico. El primero se deriva de la dificultad que tienen las plantas para tomar agua de un suelo salino (por la disminución del potencial hídrico del suelo); mientras que el segundo radica en la toxicidad iónica que puede provocar un exceso de sales en el interior de la célula (Munns y Tester, 2008).
Las plantas han desarrollado la capacidad de detectar tanto el componente osmótico como el iónico del estrés salino (Deinlein et al., 2014). El estrés reconocido activa señales de transducción que transmiten información entre células individuales y a través de toda la planta. Como consecuencia, se producen alteraciones de la expresión génica a nivel celular, que influyen en el metabolismo y desarrollo de toda la planta (Buchanan et al., 2000). Sin embargo, la resistencia o sensibilidad a un estrés depende de la especie, el genotipo y la edad de la planta; así como de las características del estrés: severidad, duración, número de exposiciones y combinación de estreses (Buchanan et al., 2000).
Según señalan Munns y Tester (2008), existe una división general de las plantas de acuerdo con su tolerancia a la salinidad: halófitas (flora natural de suelos altamente salinos) y glicófitas (plantas sensibles a la salinidad); en este último grupo se incluyen muchas de las especies comestibles. Los avances en la biología molecular, y en especial el uso de mutantes de Arabidopsis thaliana (L.) Heynh. _especie que constituye un excelente modelo experimental para estudios moleculares en las plantas_, permiten comprender mejor los mecanismos de tolerancia de las plantas a la salinidad desde un punto de vista fisiológico y bioquímico (Prisco y Gomes, 2010). Una larga lista de genes y factores de transcripción involucrados en dicha tolerancia se han identificado en la búsqueda de cultivares resistentes (Amudha y Balasubramani, 2011).
El componente osmótico de la salinidad hace que la respuesta de las plantas a este tipo de estrés sea muy similar a los cambios que ocurren en respuesta a un estrés hídrico (Munns, 2002; Zhu, 2002). Se plantea, además, que el efecto iónico de la salinidad toma más tiempo en provocar alteraciones en el metabolismo de las plantas que el incremento de la presión osmótica del medio (Munns y Tester, 2008).
Ante un estrés hídrico, las señales químicas provenientes de las raíces son transportadas vía xilema a las hojas, lo que resulta en una disminución de la pérdida de agua por transpiración (cierre estomático) y una reducción del crecimiento foliar (Schachtman y Goodger, 2008). Implicados en esta señalización se encuentran el ácido abscísico (ABA), regulador clave de la conductancia estomática; así como el pH, las citoquininas y el malato (Schachtman y Goodger, 2008). Unido a la expansión y división celular, la fotosíntesis es uno de los primeros procesos que se ven afectados ante un estrés hídrico o salino (Chaves et al., 2009); aunque la relación causa-efecto entre fotosíntesis y tasa de crecimiento puede ser difícil de esclarecer (Munns y Tester, 2008).
Detectado probablemente como cambios de turgencia, el estrés osmótico regula la biosíntesis del ABA y activa en las células vegetales numerosas proteína-quinasas y sistemas de fosfolípidos que generan diversos mensajeros moleculares (Zhu, 2002). Además del ABA, otros reguladores del crecimiento vegetal como el etileno, el ácido jasmónico y el ácido salicílico están implicados en la respuesta de las plantas a la salinidad (Chávez et al., 2012).
Uno de los mecanismos fisiológicos más relevantes en la tolerancia de las plantas al déficit hídrico lo constituye el ajuste osmótico (Amudha y Balasubramani, 2011). Este es definido como el incremento de solutos por célula, independientemente de los cambios que resultan por la pérdida de agua, y se lleva a cabo por la acumulación de iones en la vacuola o la síntesis de solutos compatibles en el citosol (Taiz y Zeiger, 2006). Entre los solutos compatibles (compuestos orgánicos que no interfieren en el metabolismo celular) se encuentran la prolina y la glicina betaína, que también pueden tener funciones protectoras (Amudha y Balasubramani, 2011).
En relación con el componente iónico de la salinidad, se conoce que una elevada concentración de Na+ en el medio interfiere directamente en la toma de K+ (macronutriente esencial), además de inactivar las enzimas e inhibir la síntesis de proteína (Buchanan et al., 2000). El exceso de Na+ intracelular o extracelular es detectado por un mecanismo sensorial aún no identificado. Sin embargo, un camino de señalización basado en genes altamente sensibles a la salinidad o genes SOS (del inglés, Salt Overly Sensitive) se ha identificado para el aspecto iónico de la salinidad. Mediado por Ca2+, este camino de señalización resulta en la expresión y cambios en la actividad de transportadores de iones como Na+, K+ y H+. De este modo, el influjo de Na+ es controlado por el transportador de membrana HKT1. El exceso de este ión puede ser excluido de la célula por medio de SOS1 (antiporte Na+/H+ de membrana plasmática); o secuestrado en la vacuola por acción de NHX (antiporte Na+/H+ del tonoplasto), según señalan Zhu (2003) y Deinlein et al. (2014).
Además, la salinidad promueve la formación de especies reactivas al oxígeno (EROs) o ROS (del inglés, Reactive Oxigen Species), tales como el anión superóxido (O-2), el peróxido de hidrógeno (H2O2) y el radical hidroxilo (OH•), que son capaces de oxidar lípidos de membranas, desnaturalizar proteínas y reaccionar con el ADN, provocando mutaciones (Prisco y Gomes, 2010). Sin embargo, las células vegetales producen EROs como segundas mensajeras en cascadas de transducción de señales, en diversos procesos como el ciclo celular, la muerte celular programada; así como en la defensa frente a condiciones de estrés biótico y abiótico (Foyer y Noctor, 2005). Dichas EROs son producidas durante reacciones involucradas en el metabolismo normal, como la fotosíntesis y la respiración; pero las condiciones de estrés incrementan su formación a partir de estas y otras fuentes como la fotorrespiración (Mittler, 2002).
Debido a que las EROs son tóxicas pero también participan en eventos de señalización, las células vegetales deben regular sus concentraciones (Mittler, 2002). Para ello, las plantas han desarrollado sistemas de defensa que incluyen enzimas antioxidantes como superóxido dismutasa, ascorbato peroxidasa y catalasa; y compuestos no enzimáticos como ascorbato, glutatión y tocoferol (Foyer y Noctor, 2005).
Existen, en general, tres aspectos importantes e interconectados que tienen lugar en las plantas tolerantes a la salinidad. Estos son: el control del crecimiento (división y expansión celular), el cual debe reanudarse, pero con una tasa reducida; el restablecimiento de la homeostasis frente a las nuevas condiciones de estrés; y el control y reparación de daños o desintoxicación (Zhu, 2001). Muchos de los cambios inducidos por el estrés salino en las células vegetales pueden considerarse como parte de las señales de desintoxicación. Estos incluyen hidrólisis de fosfolípidos, cambios en la expresión de genes que codifican para proteínas LEA (del inglés, Late Embryogenesis Abundance), chaperonas moleculares, proteinasas que eliminan proteínas desnaturalizadas y activación de enzimas involucradas en la generación y eliminación de EROs y otras proteínas desintoxicadoras (Zhu, 2002).
Según Prisco y Gomes (2010), la salinidad altera inicialmente la absorción de agua y nutrientes y la permeabilidad de las membranas. Dichas alteraciones repercuten en el balance hídrico y nutricional de la planta, y provocan cambios en el metabolismo y el balance hormonal, así como en la producción de EROs. Todos estos cambios comprometen la expansión y división de las células y el crecimiento vegetativo y reproductivo, aceleran la senescencia de las hojas y resultan en una muerte eventual de la planta.
Manejo de los suelos salinos
Para progresar en el uso y la explotación sostenible de los suelos salinos, es necesario partir de un diagnóstico adecuado. Un conjunto de indicadores provenientes de los análisis físicos y químicos de las muestras de suelo son utilizados, según la finalidad del estudio, para la caracterización y evaluación de los suelos afectados por sales (Otero et al., 2014).
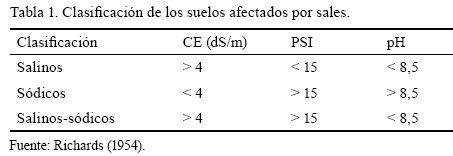
En función de estos indicadores existen varios sistemas de clasificación, pero el más empleado es el propuesto por el Laboratorio de Salinidad de Estados Unidos (Richards, 1954). Este sistema se basa en indicadores de fácil obtención, como son la conductividad eléctrica del extracto de saturación (CE), el porcentaje de sodio intercambiable (PSI) y el pH, a partir de lo cual se divide a los suelos afectados por sales en tres grupos (tabla 1): suelos salinos (presentan altos valores de CE), suelos alcalinos o sódicos (tienen un alto PSI) y salinos-sódicos (combinan un exceso de sales solubles con un alto PSI).
Una vez evaluados los suelos, se pueden aplicar diferentes alternativas para su manejo, entre las que se destacan: los métodos hidrotécnicos (lavado de suelos), los físicos (intensidad de labranza, nivelación, inversión de perfiles), los químicos (intercambio de sodio por calcio mediante el uso de sales cálcicas o de ácidos) y los biológicos (abonos orgánicos, establecimiento de cultivos tolerantes). Aunque las clasificaciones de los métodos varían, así como las prácticas de mejoramiento que ellos agrupan, varios autores coinciden en que los mejores resultados se obtienen con la aplicación combinada de estos (González et al., 2002a; Mesa, 2003).
El método más utilizado para la recuperación de los suelos salinos es el lavado o lixiviación de las sales solubles con agua de baja salinidad. Este método consiste básicamente en aplicar una lámina grande de agua para disolver las sales y removerlas de la zona radical del cultivo; aunque para lavar un suelo salino es indispensable que este sea permeable y que existan adecuadas condiciones de drenaje (Serrato et al., 2002).
La recuperación de los suelos sódicos se ha realizado principalmente cambiando el sodio en el complejo coloidal por otro catión; para ello se aplica ácido sulfúrico (H2SO4) y yeso agrícola (CaSO4 2 H2O); también se ha hecho de forma mecánica, al mezclar la capa superficial con el empleo de un arado, y mediante el uso de plantas halotolerantes (Sánchez y Arguello, 2006; Ruiz et al. 2007). Sin embargo, no es fácil ni económico eliminar o disminuir las concentraciones de sodio en el suelo. Los métodos químicos resultan costosos para las grandes extensiones, tanto por la cantidad de material que se utiliza como por su aplicación, ya que en algunos casos se requiere de equipos especializados (Ruiz et al., 2007).
Zúñiga et al. (2011) evaluaron una serie de tecnologías no convencionales para la recuperación de suelos degradados por sales en el Valle del Cauca, Colombia; para ello aplicaron tres tratamientos alternativos: biofertilizantes, biopolímeros y electromagnetismo, comparados con enmienda química convencional (yeso-azufre) y un testigo absoluto (solo drenaje). Según la respuesta agronómica de un cultivo de maíz (Zea mays L.), los tratamientos basados en el uso de microorganismos (biofertilizantes y electromagnetismo) fueron los más efectivos. El uso de biorremediación con bacterias halófitas capaces de capturar sodio (Sánchez y Arguello, 2006), así como los aislamientos nativos y las cepas comerciales de rizobios (López et al., 2011), también son alternativas que se han estudiado.
Otra alternativa para el mejoramiento y el aprovechamiento de los suelos salinos es el cultivo de pastos forrajeros con propiedades excretoras de sal, debido a que reducen la salinidad, y además se puede aprovechar su cobertura vegetal. En tal sentido, Ruiz et al. (2007) obtuvieron resultados positivos con tres especies de zacate: Sorghum sudanense (Piper) Stapf, Lolium perenne L. y Cynodon dactylon (L.) Pers. En Argentina, al igual que en muchos países, existen plantaciones de arbustos tolerantes a la salinidad como Jatropha curcas L., que producen aceites de uso industrial y constituyen otro ejemplo de la incorporación productiva de las plantas en tierras afectadas por la salinidad (Taleisnik y López, 2011). Sin embargo, debe tenerse en cuenta que la incorporación de plantas tolerantes a la salinidad en suelos afectados puede incrementar la acumulación de sales en los estratos superiores. Esto ocurre si las plantas usan el agua freática salina para cubrir sus requerimientos hídricos, como se ha informado en plantaciones de Eucalyptus, Acacia y Prosopis (Taleisnik y López, 2011).
Por otra parte, el mejoramiento genético contribuye al aumento tanto de la recuperación de áreas subutilizadas, como del rendimiento de aquellas zonas donde la salinidad es un factor limitante de la producción agrícola (Lamz y González, 2013); aunque es un método que involucra gran cantidad de recursos y considerable tiempo (Argentel et al., 2010). A pesar del conocimiento sobre los mecanismos de tolerancia a la salinidad, la obtención de plantas resistentes está limitada debido al gran número de genes involucrados y a que su efecto depende de otros genes, del nivel y composición de la salinidad, así como de otros factores ambientales (Cuartero et al., 2006). Otra limitante es que los cultivares desarrollados deben ser tolerantes a la salinidad y, a la vez, productivos (Turan et al., 2012).
Además de la obtención de genotipos tolerantes a la salinidad, Cuartero et al. (2006) destacaron tres técnicas de cultivo que pudieran incrementar la productividad de las plantas en los suelos salinos: 1) el incremento de la humedad relativa alrededor de las plantas; 2) el uso de injertos en las raíces, capaces de reducir el efecto de la salinidad, de manera que puedan combinarse caracteres deseados; y 3) el empleo de pretratamientos como la exposición de las semillas y las plántulas a condiciones de estrés salino o hídrico antes de la siembra.
Entre las principales tecnologías aplicadas en Cuba para combatir la salinidad se encuentran: el lavado de los suelos, mediante el establecimiento de adecuados sistemas de irrigación-drenaje; la aplicación de materia orgánica y enmiendas químicas; el uso de cultivos tolerantes a la salinidad; y el cultivo intensivo de arroz, de manera que año tras año, en los suelos dedicados a dicho cultivo disminuye la concentración de sales, y después estos pueden emplearse para otros cultivos o en sistemas de rotación (González-Núñez et al., 2004).
También se ha trabajado en programas de mejoramiento genético y existen en Cuba dos variedades de arroz tolerantes a la salinidad (IACUBA-25 e INCA LP-7), liberadas a la producción (González et al., 2002b). Sin embargo, la liberación de variedades con buen comportamiento productivo en condiciones de campo con problemas de salinidad no ha sido fructífera (Lamz y González, 2013). Teniendo en cuenta que la selección de plantas tolerantes a la salinidad es un proceso largo, en Cuba se trabaja en la búsqueda de indicadores eficientes para la selección temprana de genotipos con mejor comportamiento agronómico (Lamz y González, 2013; Lamz et al., 2013). Otras vías fisiológicas alternativas y promisorias han sido poco exploradas, tales como los tratamientos de HD de las semillas, aspecto que se discute a continuación.
Tratamientos de hidratación-deshidratación (HD) de las semillas
Los tratamientos pregerminativos de HD de las semillas han resultado eficientes para acelerar y uniformar la germinación, revigorizar semillas envejecidas, e incrementar el rendimiento de los cultivos en condiciones ecológicas óptimas y adversas. Dichas técnicas son conocidas fundamentalmente como acondicionamiento de semillas o "seed priming", revigorización de semillas o "seed reinvigoration" y robustecimiento de semillas o "seed hardening" (Khan, 1992; Taylor et al., 1998; Welbaum et al., 1998a; McDonald, 2000; Sánchez et al., 2001a); aunque el término más empleado en la literatura científica es acondicionamiento o "seed priming", independientemente de los objetivos que se persigan.
La característica común es que todas estas técnicas implican absorción controlada de agua (Varier et al., 2010). Esta se puede definir como la toma de agua que inicia los eventos tempranos de la germinación, pero no lo suficiente como para permitir la emergencia de la radícula, seguida de una deshidratación (McDonald, 2000). Las semillas pueden ser hidratadas en soluciones osmóticas, en agua o en partículas sólidas (Taylor et al., 1998). La toma de agua es controlada en función del equilibrio de potenciales químicos (Heydecker et al., 1973), limitación de la cantidad de agua añadida (Henckel, 1982), o en función del tiempo de inmersión en agua (Orta et al., 1998).
En la generalidad de las semillas frescas y sin dormancia, la absorción de agua muestra un patrón trifásico: una rápida absorción inicial debido al bajo potencial hídrico de las semillas (fase I), seguida de un período de longitud variable en que el contenido de agua se incrementa muy poco (fase II) y, finalmente, se reanuda el incremento en la toma de agua, debido a la emergencia de la radícula (fase III) (Bewley y Black, 1994). Durante este proceso, tienen lugar diferentes eventos biofísicos, fisiológicos y bioquímicos (Bewley, 1997; Obroucheva y Antipova, 1997; Welbaum et al., 1998b). El tiempo en el cual cada fase es completada puede variar desde horas hasta semanas, en dependencia de la especie, las características de las semillas y las condiciones de germinación (Bewley, 1997). Las semillas envejecidas y/o con dormancia pueden no sobrepasar la fase I o la fase II de dicho patrón; ya sea porque tengan bajo vigor germinativo, estén muertas, o porque la dormancia imponga restricciones en la toma de agua y en el desarrollo metabólico del embrión (Bewley y Black, 1994; Sánchez et al., 2004).
En el acondicionamiento, las semillas progresan a través de las fases I y II, sin llegar a la fase III (fig. 1). Sin embargo, en los tratamientos robustecedores desarrollados por Henckel (1982), las semillas fueron hidratadas hasta la emergencia incipiente del embrión; mientras que para revigorizar semillas envejecidas, cortos períodos de hidratación (sin llegar a la fase II) han demostrado ser suficientes (Sánchez et al., 2004, 2005). La utilidad de cada tratamiento dependerá de los cambios que provoca en las semillas el nivel de hidratación alcanzado (Sánchez et al., 2001a). Por lo tanto, para que el efecto del tratamiento sea homogéneo, todas las semillas deben alcanzar el mismo nivel de humedad. Cuando se utilizan soluciones osmóticas, la barrera de absorción de agua se establece sobre la base del equilibrio de potenciales hídricos (solución-semillas); en las técnicas en que la hidratación ocurre en agua, la homogeneidad se puede lograr sometiendo a las semillas a dos o más ciclos de hidratación parcial-deshidratación (Orta et al., 1998).
Los tratamientos acondicionadores, además de producir la activación general del aparato metabólico relacionado con la fase pregerminativa, restauran la integridad de las células (autorreparación enzimática de las membranas) a través de la síntesis de lípidos, proteínas, ARN y ADN (Bewley y Black, 1994; Bewley, 1997); logran eliminar o reducir la dormancia en las semillas y hacen que se exprese fenotípicamente la adaptación de las plantas a condiciones de estrés ambiental (Sánchez et al., 2001a; Paparella et al., 2015).
Varier et al. (2010) resumieron los eventos metabólicos que tienen lugar en las semillas durante el acondicionamiento (fig. 1), entre los que destacan: 1) la sincronización de todas las células del embrión en la fase G2 del ciclo celular, de manera que tras la reimbibición, la división celular procede de manera uniforme; 2) la reparación del ADN dañado, asegurando la disponibilidad de una plantilla libre de errores para la replicación y la transcripción; y 3) la inducción de la síntesis y la activación de las enzimas que catalizan la descomposición y la movilización de las reservas de almacenamiento, las enzimas antioxidantes como catalasa y superóxido dismutasa, así como las proteínas de choque térmico o HSPs (del inglés, Heat Shock Proteins), que funcionan como chaperonas moleculares.
Los efectos beneficiosos del acondicionamiento se conservan aún después de secar las semillas; sin embargo, la deshidratación es una etapa crucial (McDonald, 2000). Se ha planteado que muchas semillas son tolerantes a la desecación durante las fases I y II, pero frecuentemente se vuelven intolerantes en la fase III (Taylor et al., 1998). Una rápida deshidratación después del acondicionamiento puede dañar las semillas, lo que resulta en una pérdida irreversible de las ventajas obtenidas durante la hidratación (Welbaum et al., 1998a). Por otra parte, el acondicionamiento puede reducir la longevidad de las semillas con alto vigor (Varier et al., 2010).
El éxito o el fracaso de los tratamientos están influenciados por una compleja interacción de factores, que incluyen: la especie de planta, las sustancias empleadas, el potencial hídrico de la solución, la luz, el oxígeno, la temperatura, la duración de la hidratación, el vigor de la semilla, la deshidratación, así como las condiciones y el tiempo de almacenamiento después del tratamiento (Parera y Cantliffe, 1994). Los lotes de semillas varían en su respuesta al acondicionamiento, incluso dentro de un mismo cultivar. Debido a esta variabilidad, las condiciones óptimas para llevar a cabo el acondicionamiento deben ser determinadas para cada lote de semillas (McDonald, 2000).
Existen modelos predictivos para establecer las condiciones óptimas en que deben realizarse los tratamientos, teniendo en cuenta principalmente tres variables: el potencial hídrico de la semilla, la temperatura y la duración del tratamiento (Gummerson, 1986; Bradford y Haigh, 1994; Bradford, 1995); pero estos modelos no pueden ser generalizados a todas las especies (Sánchez et al., 2001a). Como regla general, la mejor temperatura para el acondicionamiento se aproxima a la temperatura óptima de germinación para una especie en particular (Bradford, 1986). Por lo tanto, determinar la temperatura óptima de germinación y la dinámica de absorción de agua para la especie (o lote de semilla) objeto de estudio constituye un paso de gran utilidad antes de implementar un tratamiento de HD.
El acondicionamiento de las semillas ha ganado mucha popularidad en la inducción de tolerancia a la salinidad en plantas relativamente poco tolerantes (Iqbal y Ashraf, 2013). Aunque aún se estudian sus bases, los efectos beneficiosos van desde las etapas de germinación y establecimiento, hasta incrementos en la productividad de las cosechas (tabla 2). Diferentes soluciones pueden ser empleadas en la etapa de hidratación; sin embargo, la imbibición de las semillas en agua destilada y la posterior deshidratación constituyen un método rápido y simple para mejorar el funcionamiento de la germinación en condiciones salinas (Rehman et al., 1998a), tal como se ha propuesto para otras condiciones de estrés (Sánchez et al., 2001a; Vanangamudi et al., 2006).
En adición, los tratamientos de HD se han aplicado en combinación con choques térmicos (Sánchez et al., 2001b, 2006) y ácidos (Sánchez et al., 2007), y se lograron incrementos significativos en la germinación y el vigor de las plántulas en condiciones de estrés calórico y acidez del medio, respectivamente. Según Henckel (1982), una breve exposición de las semillas a condiciones de germinación subletales puede inducir la subsecuente resistencia de las plantas a condiciones letales. La expresión fenotípica de esta relación genotipo-ambiente se traduce en profundos cambios bioquímicos y fisiológicos, que permanecerán latentes en condiciones ambientales idóneas (Henckel, 1982; Heydecker, 1982). En este sentido, también podrían implementarse tratamientos de HD en combinación con choques salinos.
En Cuba se ha estudiado el efecto de los tratamientos de HD de las semillas en un gran número de especies de interés agrícola, en sistemas silvopastoriles y en árboles tropicales pioneros (Orta et al., 1998; Sánchez et al., 1999a, 1999b, 2001a, 2001b, 2003a, 2003b, 2005, 2006, 2007; Montejo et al., 2002, 2004, 2005; González et al., 2005, 2008, 2009a, 2009b). Con dichos tratamientos se logró mejorar la germinación y el establecimiento de las plántulas en diferentes condiciones de estrés abiótico. Por ejemplo, en semillas de árboles tropicales pioneros (tabla 3) los tratamientos robustecedores incrementaron significativamente la germinación en condiciones extremas de sequía (estrés hídrico y calórico) en relación con el tratamiento control (Sánchez et al., 2011). Aunque los resultados son positivos, es una técnica de poca aplicación en el país.
Hasta donde se conoce, no hay estudios en Cuba sobre el papel de estas técnicas en el mejoramiento de la respuesta de las plantas a condiciones de estrés salino. Esto podría ser una línea importante de investigación, no solo por su interés teórico, sino por la significación práctica que podría tener su aplicación en los sistemas agrícolas y de repoblación forestal en condiciones ecológicas adversas o cambiantes, tal como se propone en los posibles escenarios ambientales inducidos por el cambio climático.
CONSIDERACIONES FINALES
La salinidad del suelo afecta la productividad de los cultivos en todo el planeta y también compromete la permanencia de la vegetación en los ecosistemas naturales, aspectos que tendrán mayor impacto de acuerdo con los escenarios ambientales propuestos por el cambio climático. En este sentido, en esta contribución se evidenció que los tratamientos pregerminativos de HD constituyen una ecotecnología adecuada para incrementar la tolerancia de las plantas a la salinidad y a otras condiciones de estrés abiótico (incluida la combinación de estreses). Por tanto, dicho tratamiento fisiológico podría ser una herramienta promisoria para mitigar los efectos adversos de la salinidad en la germinación, el establecimiento y el rendimiento de las plantas. También, partiendo del principio de que las plantas en condiciones naturales están sometidas a múltiples condiciones de estrés, sería adecuado aplicar los tratamientos pregerminativos de HD de las semillas en combinación con otros tratamientos robustecedores de tipo fisiológico (e.g., choque térmico, ácido o salino) para mejorar el comportamiento reproductivo de las plantas en condiciones ecológicas adversas, y, como modelo experimental, para conocer la capacidad adaptativa de las plantas en condiciones ambientales cambiantes.
AGRADECIMIENTOS
Agradecemos a Lázara Otero y Patricia Ortega-Rodés por los conocimientos brindados sobre el efecto de la salinidad en los suelos y las plantas, respectivamente. También a Guillermina Hernández, Jessica Pérez y Dariel López por sus comentarios y búsqueda de información. Esta investigación fue realizada en el marco del proyecto "Potenciar y sostener la conservación de la biodiversidad en tres paisajes productivos del Ecosistema Sabana- Camagüey".
REFERENCIAS BIBLIOGRÁFICAS
1. Abbasi, M.; Azarnivand, H.; Alizadeh, O. & Hedayati, A. Seed treatments to improve germination of Agropyron elongatum seeds under salt stress. Int. J. Agron. Plant. Prod. 4 (4):603-609, 2013.
2. Afzal, I.; Basra, S. M. A. & Iqbal, A. The effects of seed soaking with plant growth regulators on seedling vigor of wheat under salinity stress. J. Stress Physiol. Biochem. 1 (1):6-14, 2005.
3. Álvarez, A. & Mercadet, Alicia. El sector forestal cubano y el cambio climático. Revista Anales de la Academia de Ciencias de Cuba. 4 (4):1-11, 2014.
4. Amoghein, M. B.; Amoghein, R. S.; Tobeh, A. & Jamaati-e-Somarin, Sh. The effect of Osmopriming and Hydropriming on the different index of germination and early growth of wheat under salty stress. Int. Res. J. Applied Basic. 4 (7):1924-1931, 2013.
5. Amudha, J. & Balasubramani, G. Recent molecular advances to combat abiotic stress tolerance in crop plants. Biotechnol. Mol. Biol. Rev. 6:31-58, 2011.
6. Argentel, L.; López, R. D.; González, L. M.; López, R. C.; Gómez, E. & Fonseca, I. Evaluación de la tolerancia a la salinidad en estadios tempranos y finales del desarrollo en triticales (X Triticum secale). Cultivos Tropicales. 31 (1):48-53, 2010.
7. Arora, N.; Bhardwaj, R.; Sharma, P. & Arora, H. K. 28-Homobrassinolide alleviates oxidative stress in salt treated maize (Zea mays L.) plants. Braz. J. Plant Physiol. 20:153-157, 2008.
8. Ashraf, M. & Rauf, H. Inducing salt tolerance in maize (Zea mays L.) through seed priming with chloride salts: Growth and ion transport at early growth stages. Acta Physiol. Plant. 23:407-414, 2001.
9. Askari Nejad, H. The effects of seed priming techniques in improving germination and early seedling growth of Aeluropus macrostachyus. Int. J. Adv. Biol. Biom. Res. 1 (2):86-95, 2013.
10. Bakht, J.; Shafi, M.; Jamal, Y. & Sher, H. Response of maize (Zea mays L.) to seed priming with NaCl and salinity stress. Span. J. Agric. Res. 9 (1):252-261, 2011.
11. Bejandi, T. K.; Sedghi, M.; Sharifi, R. S.; Namvar, A. & Molaei, P. Seed priming and sulfur effects on soybean cell membrane stability and yield in saline soil. Pesq. Agropec. Bras. 44 (9):1114-1117, 2009.
12. Ben Fredj, Mariem; Zhani, K.; Hannachi, C. & Mehwachi, T. Effect of NaCl priming on seed germination of four coriander cultivars (Coriandrum sativum L.). Eurasia J. Biosci. (7):21-29, 2013.
13. Ben Fredj, Mariem; Zhani, K.; Hannachi, C.; Mehwachi, T. & Belanger, A. Effect of priming on growth, biochemical parameters and mineral composition of different cultivars of coriander (Coriandrum sativum L.) under salt stress. J. Stress Physiol. Biochem. 10 (3):84-109, 2014.
14. Benincasa, P.; Pase, R.; Quinet, M. & Lutts, S. Effect of salinity and priming on seedling growth in rapeseed (Brassica napus Del. var. oleifera). Acta Scientiarum. Agronomy. 35 (4):479-486, 2013.
15. Bewley, J. D. Seed germination and dormancy. Plant Cell. 9 (7):1055-1066, 1997.
16. Bewley, J. D. & Black, M. Seed: physiology of development and germination. New York, London: Plenum Press, 1994.
17. Bradford, K. J. Manipulation of seed water relations via osmotic priming to improve germination under stress conditions. Hort. Sci. 21:1105-1112, 1986.
18. Bradford, K. J. Water relations in seed germination. In: J. Kigel and G. Galili, eds. Seed development and germination. New York: Marcel Dekker. p. 351-396, 1995.
19. Bradford, K. J. & Haigh, A. M. Relationship between accumulated hydrothermal time during seed priming and subsequent seed germination rates. Seed Sci. Res. 4:63-69, 1994.
20. Buchanan, B. B.; Gruissem, W. & Jones, R. L. Biochemistry and molecular biology of plants. Rockville, USA: American Society of Plant Biologists, 2000.
21. Chaves, M. M.; Flexas, J. & Pinheiro, C. Photosynthesis under drought and salt stress: regulation mechanisms from whole plant to cell. Ann. Bot. 103 (4):551-560, 2009.
22. Chávez, Licet; Álvarez, A. & Ramírez, R. Apuntes sobre algunos reguladores del crecimiento vegetal que participan en la respuesta de las plantas frente al estrés abiótico. Cultivos Tropicales. 33 (3):47-56, 2012.
23. Cuartero, J.; Bolarín, M. C.; Asíns, M. J. & Moreno, V. Increasing salt tolerance in the tomato. J. Exp. Bot. 57 (5):1045-1058, 2006.
24. Deinlein, U.; Stephan, A. B.; Horie, T.; Luo, W.; Xu, G. & Schroeder, J. I. Plant salt-tolerance mechanisms. Trends Plant Sci. 19 (6):371-379, 2014.
25. FAO. Extent of salt-affected soils. Rome: FAO, 2014. http://www.fao.org/soils-portal/manejo-del-suelo/manejo-de-suelos-problematicos/suelos-afectados-por-salinidad/more-information-on-salt -affected-soils/es/. [24/10/2014].
26. Ferreira Dos Santos, Allivia R.; Silva-Mann, Renata; Ferreira, R. A. & Souza-Brito, A. de. Water pre-hydration as priming for Moringa oleifera Lam. Seeds under salt stress. Trop. Subtrop. Agroecosys. 14 (1):201-207, 2011.
27. Foyer, Christine H. & Noctor, G. Oxidant and antioxidant signalling in plants: a re-evaluation of the concept of oxidative stress in a physiological context. Plant Cell Environ. 28 (8):1056-1071, 2005.
28. González, L. M.; Ramírez, R. & Aguilera, R. Los suelos salinizados y su utilización en la producción agrícola. Alimentaria. Revista de tecnología e higiene de los alimentos. 339:103-107, 2002a.
29. González, L. M.; González, María C. & Ramírez, R. Aspectos generales sobre la tolerancia a la salinidad en las plantas cultivadas. Cultivos Tropicales. 23 (2):27-37, 2002b.
30. González, Yolanda; Reino, J.; Sánchez, J. A.; Fung, Carmen & Machado, R. Validación de la técnica de hidratación-deshidratación en semillas de Leucaena leucacephala cv. Cunningham. Pastos y Forrajes. 28 (2):117-126, 2005.
31. González, Yolanda; Sánchez, J. A.; Reino, J.; Muñoz, Bárbara C. & Montejo, Laura. Efectos combinados de escarificación y de hidratación parcial en la germinación de semillas frescas de leguminosas. Pastos y Forrajes. 31 (4):321-326, 2008.
32. González, Yolanda; Sánchez, J. A.; Reino, J. & Montejo, Laura. Efecto de los tratamientos de hidratación-deshidratación en la germinación, la emergencia y el vigor de las plántulas de Albizia lebbeck y Gliricidia sepium. Pastos y Forrajes. 32 (3):255-262, 2009a.
33. González, Yolanda; Sánchez, J. A.; Reino, J.; Muñoz, Bárbara C.; Montejo, Laura; Machado, R. & Fung, Carmen. Tecnología de hidratación-deshidratación para recuperar semillas envejecidas conservadas en bancos de genes. Matanzas, Cuba: EEPF Indio Hatuey, 2009b.
34. González-Núñez, L. M.; Tóth, T. & García-Bermejo, D. Integrated management for the sustainable use of salt-affected soils in Cuba. Universidad y Ciencia. 20 (40):85-102, 2004.
35. Gummerson, R. J. The effect of constant temperatures and osmotic potential on the germination of sugar beet. J. Expt. Bot. 37 (6):729-741, 1986.
36. Henckel, P. A. Fisiología de la resistencia de las plantas al calor y a la sequía. Moscú: Nauka. [en ruso], 1982.
37. Heydecker, W. Estrés y germinación de semilla En: A. A. Khan, ed. Fisiología y bioquímica de la latencia y germinación de las semillas. Moscú: Kolos. p. 273-319. [en ruso], 1982.
38. Heydecker, W.; Higgins, J. & Gulliver, R. L. Acelerated germination by osmotic seed treatment. Nature. 246 (1):42-44, 1973.
39. Iqbal, M. & Ashraf, M. Salt tolerance and regulation of gas exchange and hormonal homeostasis by auxin-priming in wheat. Pesq. Agropec. Bras. 48 (9):1210-1219, 2013.
40. Janmohammadi, M.; Moradi Dezfuli, P. & Sharifzadeh, F. Seed invigoration techniques to improve germination and early growth of inbred line of maize under salinity and drought stress. Gen. Appl. Plant Physiol. 34 (3-4):215-226, 2008.
41. Kandil, A. A.; Sharief, A. E.; Abido, W. A. E. & Ibrahim, M. M. O. Response of some canola cultivars (Brassica napus L.) to salinity stress and its effect on germination and seedling properties. J. Crop Sci. 3 (3):95-103, 2012.
42. Khan, A. A. Preplant physiological seed conditioning. Hort. Rev. 14:131-181, 1992.
43. Lamz, A. & González, María C. La salinidad como problema en la agricultura: la mejora vegetal una solución inmediata. Cultivos Tropicales. 34 (4):31-42, 2013.
44. Lamz, A.; González, María C. & Reyes, Yanelis. Indicadores bioquímicos para la selección temprana de genotipos de arroz (Oryza sativa L.) con tolerancia a la salinidad. Cultivos Tropicales. 34 (1):11-17, 2013.
45. López, R. C.; Samson, R.; Vandamme, P.; Eichler-Löbermann, Bettina & Gómez, E. Respuesta de combinaciones Rhizobium-Clitoria ternatea en condiciones de estrés salino en el Valle del Cauto en Cuba. Rev. Mex. Cienc. Pecu. 2 (2):199-207, 2011.
46. Maiti, R. & Pramanik, K. Vegetable seed priming: a low cost, simple and powerful techniques for farmers´ livelihood. Int. J. Bio-resource and Stress Manag. 4 (4):475-481, 2013.
47. McDonald, M. B. Seed priming. In: M. Black and J. D. Bewley, eds. Seed technology and its biological basic. Sheffied: Academic Press. p. 286-325, 2000.
48. Mesa, Dianelis. Obtención de plantas resistentes a la salinidad para suelos salinos cubanos. Rev. cub. Cienc. agríc. 37 (3):217-226, 2003.
49. Mittler, R. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7 (9):405-410, 2002.
50. Montejo, Laura & Sánchez, J. A. Efecto de los tratamientos de semilla, la procedencia y el riego en el establecimiento de Hibiscus elatus. Pastos y Forrajes. 35 (3):247-274, 2012.
51. Montejo, Laura; Sánchez, J. A. & Muñoz, Bárbara C. Incremento de la germinación en semillas de fruta bomba por aplicación de tratamientos pregerminativos de hidratación-deshidratación. Cultivos Tropicales. 23 (4):27-31, 2002.
52. Montejo, Laura; Sánchez, J. A. & Muñoz, Bárbara C. Efecto de tratamientos de hidratación-deshidratación en semillas almacenadas de Talipariti elatum. Pastos y Forrajes. 27 (4):331-338, 2004.
53. Montejo, Laura; Sánchez, J. A. & Muñoz, Bárbara C. Tratamientos pregerminativos de escarificación ácida y de hidratación parcial en la germinación y el vigor de Talipariti elatum. Pastos y Forrajes. 28 (2):107-115, 2005.
54. Munns, Rana. Comparative physiology of salt and water stress. Plant Cell Environ. 25 (2):239-250, 2002.
55. Munns, Rana & Tester, M. Mechanisms of salinity tolerance. Annu. Rev. Plant Biol. 59:651-681, 2008.
56. Obregón, A. L. Mapa de salinidad, escala 1: 2 000 000. Madrid: Instituto de Geografía de la Academia de Ciencias de Cuba, Instituto Cubano de Geodesia y Cartografía, Instituto Geográfico Nacional de España, 1989.
57. Obroucheva, N. V. & Antipova, O. V. Physiology of the initiation of seed germination. Russ. J. Plant Physiol. 44:250-264, 1997.
58. ONEI. Panorama ambiental, Cuba 2012. La Habana: Oficina Nacional de Estadística e Información, 2013.
59. Orta, R.; Sánchez, J. A.; Muñoz, Bárbara C. & Calvo, E. Modelo de hidratación parcial en agua para tratamientos revigorizadores, acondicionadores y robustecedores de semillas. Acta Bot. Cub. 121:1-8, 1998.
60. Ortega, F. Las causas de la salinidad de los suelos de Cuba. Ciencias de la Agricultura. 27:126-136, 1986.
61. Otero, Lázara; Francisco, A.; Gálvez, V.; Morales, R.; Sánchez, Inalvis; Labaut, Martha et al. Caracterización y evaluación de la salinidad. La Habana: Instituto de Suelos, 2014.
62. Paparella, S.; Araújo, S. S.; Rossi, G.; Wijayasinghe, M.; Carbonera, D. & Balestrazzi, A. Seed priming: state of art and new perspectives. Plant Cell Rep. 34 (8):1281-1293, 2015.
63. Parera, C. A. & Cantliffe, D. J. Presowing seed priming. Hort. Rev. 16:109-141, 1994.
64. Prisco, J. T. & Gomes, E. Fisiologia e bioquímica do estresse salino em plantas. En: H. R. Gheyi; N. da S. Dias y C. F. de Lacerda, eds. Manejo da salinidade na agricultura: Estudos básicos e aplicados. Fortaleza, Brasil: INCTSal. p. 143-160, 2010.
65. Rafique, N.; Raza, S. H.; Qasim, M. & Iqbal, N. Pre-sowing application of ascorbic acid and salicylic acid to seed of pumpkin and seedling response to salt. Pak. J. Bot. 43 (6):2677-2682, 2011.
66. Rashid, A.; Hollington, P. A.; Harris, D. & Khan, P. On-farm seed priming for barley on normal, saline and saline-sodic soils in North West Frontier Province, Pakistan. Eur. J. Agron. 24 (3):276-281, 2006.
67. Rehman, S.; Harris, P. J. C. & Bourne, W. F. Effects of presowing treatment with calcium salts, potassium salts, or water on germination and salt tolerance of Acacia seeds. J. Plant Nutr. 21 (2):277-285, 1998a.
68. Rehman, S.; Harris, P. J. C. & Bourne, W. F. The effect of hardening on the salinity tolerance of Acacia seeds. Seed Sci. Technol. 26:743-754, 1998b.
69. Richards, L. A. (Ed.). Diagnosis and improvement of saline and alkali soils. United States: Departament of Agriculture, 1954.
70. Ruiz, E.; Aldaco, R. A.; Montemayor, J. A.; Fortis, M.; Olague, J. & Villagómez, J. C. Aprovechamiento y mejora de un suelo salino mediante el cultivo de pastos forrajeros. Téc. Pec. Méx. 45 (1):19-24, 2007.
71. Sánchez, J. A.; Calvo, E.; Muñoz, Bárbara C. & Orta, R. Comparación de dos técnicas de acondicionamiento de semillas y sus efectos sobre la conducta germinativa del pepino, pimiento, tomate. Cultivos Tropicales. 20 (4):51-56, 1999a.
72. Sánchez, J. A.; Calvo, E.; Muñoz, Bárbara C. & Orta, R. Efecto de los tratamientos pregerminativos de hidratación-deshidratación sobre la germinación, establecimiento, floración y fructificación del pepino. Agron. Costarricense. 23 (2):193-204, 1999b.
73. Sánchez, J. A.; Hernández, G.; Reino, J. & Muñoz, Bárbara C. Enhanced germination, emergence and seedling vigour of Leucaena leucocephala using hardening hydration and acid shock treatments. Seed Sci. Technol. 35 (1):224-231, 2007.
74. Sánchez, J. A.; Muñoz, Bárbara C. & Fresneda, J. Combined effects of hardening hydration-dehydration and heat shock treatments on the germination of tomato, pepper and cucumber. Seed Sci. Technol. 29 (3):691-697, 2001b.
75. Sánchez, J. A.; Muñoz, Bárbara C.; Hernández, L.; Montejo, Laura; Suárez, A. G. & Torres-Arias, Y. Tratamientos robustecedores de semillas para mejorar la emergencia y el crecimiento de Trichospermum mexicanum, árbol tropical pionero. Agron. Costarricense. 30 (1):7-26, 2006.
76. Sánchez, J. A.; Muñoz, Bárbara C. & Montejo, Laura. Efectos de tratamientos robustecedores de semillas sobre la germinación y establecimiento de árboles pioneros bajo condiciones de estrés. Ecotropicos. 16 (2):91-112, 2003a.
77. Sánchez, J. A.; Muñoz, Bárbara C. & Montejo, Laura. Invigoration of pioneer tree seeds using prehydration treatments. Seed Sci. Technol. 32 (2):355-363, 2004.
78. Sánchez, J. A.; Orta, R. & Muñoz, Bárbara C. Tratamientos pregerminativos de hidratación- deshidratación de las semillas y sus efectos en plantas de interés agrícola. Agronomía Costarricense. 25 (1):67-91, 2001a.
79. Sánchez, J. A.; Muñoz, Bárbara C.; Reino, J. & Montejo, Laura. Efectos combinados de escarificación y de hidratación parcial en la germinación de semillas envejecidas de leguminosas. Pastos y Forrajes. 26 (1):27-33, 2003b.
80. Sánchez, J. A.; Reino, J.; Muñoz, Bárbara C.; González, Yolanda.; Montejo, Laura & Machado R. Efecto de los tratamientos de hidratación- deshidratación en la germinación, la emergencia y el vigor de plántulas de Leucaena leucocephala cv. Cunningham. Pastos y Forrajes. 28 (3):209-220, 2005.
81. Sánchez, J. A.; Suárez, A. G.; Montejo, Laura & Muñoz, Bárbara C. El cambio climático y las semillas de las plantas nativas cubanas. Acta Bot. Cub. 214:38-50, 2011.
82. Sánchez, Ligia C. & Arguello, H. Capacidad de bacterias halófitas para capturar sodio in vitro y su posible aplicación en biorremediación en suelos salinos-sódicos. NOVA. 4 (6):19-32, 2006.
83. Schachtman, D. P. & Goodger, J. Q. D. Chemical root to shoot signaling under drought. Trends Plant Sci. 13:281-287, 2008.
84. Sedghi, M.; Nemati, A.; Amapour-Balaneji, B. & Gholipouri, A. Influence of different priming materials on germination and seedling establishment of milk thistle (Silybum marianum) under salinity stress. World Appl. Sci. J. 11 (5):604-609, 2010.
85. Serrato, R.; Ortíz, A.; Dimas, J. & Berúmen, S. Aplicación de lavado y estiércol para recuperar suelos salinos en La Comarca Lagunera, México. Terra. 20 (3):329-336, 2002.
86. Souza, Cíntia L. M. de; Souza, M. O. de; Oliveira, L. M. de & Pelacani, C. R. Effect of priming on germinability and salt tolerance in seeds and seedlings of Physalis peruviana L. Afr. J. Biotechnol. 13 (19):1955-1960, 2014.
87. Taiz, L. & Zeiger, E. Plant Physiology. Massachusetts: Sinauer Associates Inc. Publisher, 2006.
88. Taleisnik, Edith & López, D. Leñosas perennes para ambientes afectados por salinidad. Una sinopsis de la contribución argentina a este tema. Ecología Austral. 21 (1):3-14, 2011.
89. Tavili, A.; Zare, S.; Moosavi, S. A. & Enayati, A. Effects of seed priming on germination characteristics of Bromus species under salt and drought conditions. American-Eurasian J. Agric. & Environ. Sci. 10 (2):163-168, 2011.
90. Taylor, A. G.; Allen, P. S.; Bennett, M. A.; Bradford, K. J.; Burris, J. S. & Misra, M. K. Seed enhancements. Seed Sci. Res. 8 (1):245-256, 1998.
91. Turan, S.; Cornish, Katrina & Kumar, Shashi. Salinity tolerance in plants: Breeding and genetic engineering. AJCS. 6 (9):1337-1348, 2012.
92. Vanangamudi, K.; Natarajan, K.; Saravanan, T.; Renuca, R.; Natarajan, N.; Umarani, R. et al. Seed hardenig, pelleting, and coating. Principles and practices. Delhi, India: Satish Serial Publishing House, 2006.
93. Varier, A.; Vari, Alice K. & Dadlani, M. The subcellular basis of seed priming. Curr. Sci. India. 99 (4):450-456, 2010.
94. Welbaum, G. E.; Bradford, K. J.; Khu-Ock, Y.; Booth, D. T. & Oluoch, M. O. Biophysical, physiological and biochemical processes regulating seed germination. Seed Sci. Res. 8 (2):161-172, 1998b.
95. Welbaum, G. E.; Shen, Z.; Oluoch, M. O. & Jett, L. W. The evolution and effects of priming vegetable seeds. Seed Technol. 20 (2):209-235, 1998a.
96. Yagmur, M. & Kaydan, D. Alleviation of osmotic stress of water and salt in germination and seedling growth of triticale with seed priming treatments. Afr. J. Biotechnol. 7 (13):2156-2162, 2008.
97. Zhu, J. K. Plant salt tolerance. Trends Plant Sci. 6 (2):66-71, 2001.
98. Zhu, J. K. Salt and drought stress signal transduction in plants. Annu. Rev. Plant Biol. 53:247-273, 2002.
99. Zhu, J. K. Regulation of ion homeostasis under salt stress. . Curr. Opin. Plant Biol. 6:441-445, 2003.
100. Zúñiga, O.; Osorio, J. C.; Cuero, R. & Peña, J. A. Evaluación de tecnologías para la recuperación de suelos degradados por salinidad. Rev. Fac. Nal. Agr. Medellín. 64 (1):5769-5779, 2011.
Recibido el 16 de abril de 2015
Aceptado el 16 de octubre de 2015