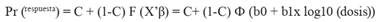INTRODUCCIÓN
El parasitismo gastrointestinal constituye una amenaza importante para la producción de rumiantes en el trópico. Por décadas, el control parasitario en pequeños rumiantes se ha desarrollado sobre la base de tratamientos antiparasitarios convencionales arbitrarios que, en muchas ocasiones, se aplican con frecuencia mensual, lo que ha conllevado a la aparición de genotipos de parásitos resistentes a la mayoría de los productos químicos (Arece-García et al., 2017)
En este contexto, la búsqueda de alternativas de control constituye un reto para los investigadores. En los últimos años, la aplicación de la medicina verde ha ganado espacio, lo que ha permitido valorizar los recursos vegetales (Romero-Benavides et al., 2017; French, 2018). Se ha informado actividad antihelmíntica en diferentes plantas y sus partes, con variabilidad en los resultados, en función de la familia de la planta y de la composición química de los compuestos bioactivos (Borges y Borges, 2016). El Departamento de Agricultura de los Estados Unidos y la Red de Información de Recursos de Germoplasma han identificado 1 030 plantas con compuestos químicos que tienen actividad antihelmíntica. Por su alto contenido de aceite, Jatropha curcas L. se considera una planta oleaginosa. Los frutos cosechados pueden producir hasta 25 % en peso de aceite, después de descascarados y prensados (Alherbawi et al., 2021). La composición mayoritaria de este aceite es de 64 % de triacilgliceroles, 12 % de compuestos hidrocarbonados y 9 % de ácidos grasos libres, entre los que se encuentran el oleico, linoleico, palmítico y esteárico (Neupane et al., 2021). A su vez, presenta una composición similar a la de muchos aceites comestibles. Sin embargo, no se ha comercializado para consumo humano por sus efectos tóxicos, atribuidos a los ésteres de forbol, curcina, entre otros (Phulia et al., 2018). De ahí que el aceite de J. curcas se utilice, fundamentalmente, para la producción de biodiesel (Yaqoob et al., 2021).
A pesar de poseer estas sustancias tóxicas, se ha detectado actividad antimicrobiana, así como molusquicida y anticancerígena, entre otras aplicaciones biológicas (Bosou et al., 2020; Rahu et al., 2021). En la pasada década, se desarrolló una investigación que demostró el efecto antihelmíntico del extracto etanólico de las semillas de J. curcas en la inhibición de la eclosión de los huevecillos y la migración de las larvas de Haemonchus contortus in vitro (Monteiro et al., 2011).
Del proceso de extracción del biodiesel del aceite de las semillas de J. curcas se obtiene la fracción rica en glicerol (FRG), como resultado de la transesterificación del mismo (Salaheldeen et al., 2021). Este producto se puede incluir en la nutrición de los rumiantes por sus propiedades glucogénicas (Khattab, 2015) y se han estimado valores energéticos superiores al Zea mays L. (Mach et al., 2009). El objetivo del presente estudio fue evaluar el efecto que ejerce la fracción del aceite de J. curcas, rica en glicerol, en la eclosión de huevos de nematodos gastrointestinales de ovejas
MATERIALES Y MÉTODOS
Obtención del aceite y la fracción rica en glicerol de J. curcas. Se utilizaron frutos maduros de J. curcas, nativa de Cuba, cosechados en la provincia de Guantánamo. Se secaron al sol y se descascararon para la obtención de las semillas. Estas se prensaron con la utilización de una máquina expeler, con potencia de 7,5 kW, velocidad de 1 400 r.p.m. y capacidad de 200 kg de semillas/hora. El aceite en bruto obtenido se filtró mediante un filtro prensa, con el propósito de garantizar un filtrado de 25 micrones. Posteriormente, el aceite se sometió a un proceso de calentamiento a 105 ºC para la extracción de todas las impurezas solubles y volátiles, incluyendo el agua (Rizo, 2019). La FRG se obtuvo del proceso del biodiesel mediante transesterificación del aceite con metanol e hidróxido de sodio como catalizador (Che Hamzah et al., 2020).
A la FRG se le determinó su densidad y se prepararon soluciones acuosas de trabajo en concentraciones de 100; 50; 25; 12,5; 6,25; 3,125 y 1,56 mg de FRG/mL de solvente.
Prueba de inhibición de la eclosión de huevos. Los huevos se colectaron de estrongílidos mediante la técnica de Hubert y Kerboeuf (1992) y se depositaron en placas de cultivo celular de 24 pocillos de fondo plano (Corning™) para su enfrentamiento con cada una de las concentraciones de la FRG antes mencionadas, sobre la base de un diseño completamente aleatorizado con seis réplicas por tratamiento. Se utilizó como control una solución de glicerina PA (10 %, v/v) (AppliChen PanReac).
Se incubaron durante 48 h y transcurrido ese tiempo, se detuvo la eclosión con 10 µL de solución de Lugol. Se contaron las larvas y los huevos en su totalidad y se determinó el porcentaje de eclosión (Marie-Magdeleine et al., 2010; Busari et al., 2021).
Análisis de la composición química de la FRG. Para la determinación del perfil de compuestos químicos, se utilizó la técnica de cromatografía gaseosa (cromatógrafo de gases Thermo Scientific), acoplada a un espectrómetro de masas (GC-MS). Se usó una temperatura del inyector y del detector FID de 250 ºC, con flujo de 1 mL/min. Los ácidos se identificaron por comparación de sus tiempos de retención y sus espectros de masas, con una biblioteca de datos de espectros de masas de compuestos conocidos.
Cuantificación de los ésteres de forbol en FRG. La FRG de J. curcas se mezcló con metanol (1:1, v:v) y se analizó mediante cromatografía en fase reversa, con la utilización de columnas C-18, en sistemas HPLC acoplados a un espectrómetro de masas con analizador de tiempo de vuelo (MS-TOF-Agilent Technologies 6230 TOF LC/MC, USA). La muestra se analizó por triplicado y se usó el metanol como control para determinar el estado limpio de la columna. Se utilizó como estándar de ésteres de forbol el forbol-12-miristato-13-acetato (PMA, SIGMA-Neu et al., 2018).
Análisis estadístico. Los porcentajes de eclosión, según las concentraciones de la FRG, se compararon mediante un análisis de varianza simple. Previo a ello, los valores se transformaron mediante el arcoseno de la raíz del valor, y se verificó el cumplimiento de los supuestos de normalidad y homogeneidad de las varianzas. Se utilizó un nivel de significación de 0,05 y las medias se compararon mediante el test de Tukey. Se aplicó el paquete estadístico SAS, versión 9.0.
Se realizó un análisis de regresión Probit mediante el paquete estadístico SAS, versión 9.0, con el fin de determinar la concentración letal media (CL50) para la eclosión de los huevecillos. Se aplicaron los valores del grupo control positivo para la corrección de los resultados, siguiendo el modelo de González-Garduño et al. (2014), donde:
RESULTADOS Y DISCUSIÓN
Los resultados de la eclosión de huevecillos, según la concentración de la FRG de J. curcas, se muestran en la tabla 1. La FRG redujo considerablemente (p < 0,05) la eclosión de los huevecillos, con un efecto dosis dependiente y constituye el primer informe conocido de actividad ovicida de la FRG de J. curcas en nematodos parásitos.
Tabla 1 Promedio del porcentaje de eclosión de huevos y concentración letal media (CL50) en diferentes concentraciones de la fracción rica en glicerol de J. curcas.
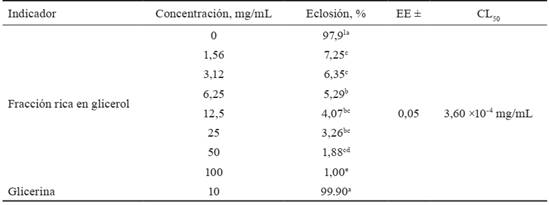
CL: concentración letal media
Letras desiguales en una misma columna difieren a p < 0,05
Se han informado resultados similares al presente estudio, pero con partes de la planta. En este sentido, Monteiro et al. (2011) evaluaron el extracto etanólico de semilla de J. curcas y obtuvieron una inhibición de la eclosión de 99,8 % en una concentración de 50 mg/mL. En la inhibición de la eclosión de huevecillos, Eguale y Giday (2009) informaron en el extracto acuoso e hidroalcohólico de esta parte de la planta CL50 de 0,1 y 0,23 mg/mL respectivamente, cifras superiores a las registradas en el presente estudio, que fueron de 3,60 ×10-4 mg/mL (tabla 1).
Salles et al. (2014) afirman que esta planta posee moléculas de alto y bajo peso molecular (corte de 12 kDa) y sostienen que los inhibidores de tripsina son el principal candidato en la interferencia del desarrollo embrionario de los huevecillos. Aun cuando no se determinó en el glicerol la presencia de inhibidores de la tripsina, no se ha informado su presencia en este coproducto, debido quizás al propio proceso de transesterificación, que conduce a la desnaturalización de las proteínas.
Es posible que existan otras sustancias en la FRG, como son las sales, que hayan influido en este resultado, sobre todo porque en la transesterificación del aceite para la obtención del biodiesel se rompe el enlace éster de los ésteres de forbol, y ocurren reacciones de oxidación, transesterificación y epimerización (Goel et al., 2007). Esto coincide con los resultados de este estudio, donde no se encontraron los ésteres de forbol en la FRG (fig. 1). También se corresponde con lo informado por Herath et al. (2017), quienes tampoco hallaron ésteres de forbol en la FRG de J. curcas.
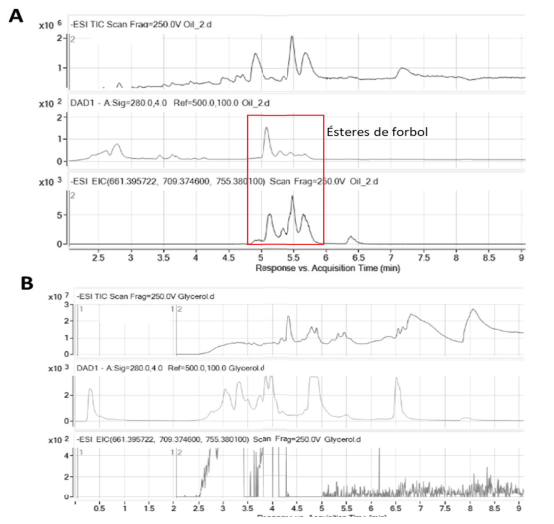
Figura 1 Detección de los ésteres de forbol mediante MS-TOF en la fracción rica en glicerol. Análisis de una muestra de aceite de J.curcas
En el análisis de la FRG mediante cromatografía gaseosa no se registraron restos de metanol que pudieran ser potencialmente tóxicos para los huevos (tabla 2). Se halló, como mayor constituyente, el glicerol (74,80 %) y ácidos carboxílicos de cadena larga, a diferencia de un estudio desarrollado por Pradhan et al. (2012). Estos autores encontraron en el glicerol de J. curcas materia no saponificada, mono y diglicéridos, así como trazas de éteres de metilo.