Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Ortopedia y Traumatología
versión impresa ISSN 0864-215X
Rev Cubana Ortop Traumatol vol.26 no.2 Ciudad de la Habana sep.-dic. 2012
ARTÍCULO DE REVISIÓN
Empleo de la medicina nuclear y las técnicas de imágenes en las afecciones del sistema óseo
Use of nuclear medicine and imaging techniques in disorders of the bone system
Emploi de la médicine nucléaire et des techniques par image dans les affections du système osseux
Lic. Daylín Hernández Falcón,I Dr. C. Luis Oscar Marrero Riverón,II Dr. C. Oscar E. Ledea LozanoI
I Centro Nacional de Investigaciones Científicas. La Habana, Cuba.
II Complejo Científico Ortopédico Internacional "Frank País". La Habana, Cuba.
RESUMEN
La medicina nuclear es la especialidad médica que se ocupa del diagnóstico, tratamiento e investigación médica mediante el uso de radioisótopos como fuentes abiertas. A menudo, las personas presentan diferentes condiciones patológicas óseas como la osteoporosis, el cáncer de hueso primario, las metástasis óseas, la artrosis y la artritis. Como objetivo de esta revisión se presentaron estadísticas internacionales y nacionales, y se evaluó la incidencia de esas afecciones. Además, se identificaron los radiofármacos más empleados en la actualidad para el diagnóstico y tratamiento de las enfermedades óseas, así como el uso combinado con las técnicas de imagen más utilizadas mediante la revisión de diferentes estudios clínicos. Se expuso la utilidad de la gammagrafía ósea para el diagnóstico y la confirmación de las afecciones estudiadas. Igualmente, se presentó el empleo de nuevas técnicas como las tomografías por emisión de fotón único o por emisión de positrones. Se observó que el radioisótopo más empleado para el diagnóstico de enfermedades del sistema óseo es el 99mTc por sus características físicas y químicas, mientras que para terapia se emplean 186Re, 188Re, 153Sm, 177Lu, 32P, 89Sr, 85Sr, 117mSn, según el tipo, ubicación y magnitud de las lesiones y la disponibilidad del radioisótopo. En la actualidad, el desarrollo de los radiofármacos se ha centrado en la combinación de estos radioisótopos con diferentes biomoléculas para mejorar sus propiedades y ampliar su campo de aplicaciones.
Palabras clave: radioisótopos, radiofármacos, diagnóstico, radioterapia, sistema óseo.
ABSTRACT
Nuclear medicine is the medical specialty that deals with clinical diagnosis, treatment and research through the use of isotopes as open sources. Bone diseases such as osteoporosis, primary bone cancer, bone metastases, arthrosis and arthritis are common among the population. The objective of this review was to present international and national statistics, and evaluate the incidence of these disorders. Additionally, a review was conducted of various clinical studies to identify the radiopharmaceuticals most frequently used to diagnose and treat bone disease, and their combination with the most common imaging techniques. A presentation was made of the usefulness of bone gammagraphy and the confirmation of the disorders studied. Reference was also made to the use of new techniques such as single photon emission tomography or positron emission tomography. It was found that the radioisotope most commonly used to diagnose diseases of the bone system was 99mTc, due to its physical and chemical characteristics, whereas 186Re, 188Re, 153Sm, 177Lu, 32P, 89Sr, 85Sr, 117mSn are used for therapeutic purposes, depending on the type, location and magnitude of the lesions and the availability of the radioisotope. At present, radiopharmaceutical development centers on combining these radioisotopes with various biomolecules to improve their properties and broaden their field of application.
Key words: radioisotopes, radiopharmaceuticals, diagnosis, radiotherapy, bone system.
RÉSUMÉ
La médecine nucléaire est la spécialité médicale s'occupant du diagnostic, du traitement et de la recherche médicale au moyen de radioisotopes comme sources ouvertes. Les personnes sont souvent touchées par différentes conditions pathologiques osseuses telles que l'ostéoporose, le cancer d'os primaire, les métastases osseuses, l'arthrose, et l'arthrite. Le but de cette révision est de présenter des statistiques internationales et nationales, et d'évaluer l'incidence de ces affections. Grâce à la révision de différentes études cliniques, on a également identifié les traceurs isotopiques les plus souvent utilisés de nos jours pour le diagnostic et le traitement des maladies osseuses, ainsi que l'emploi combiné des techniques par image les plus fréquentes. L'utilité de la gammagraphie osseuse pour le diagnostic et la confirmation des affections étudiées a été mise en évidence. De nouvelles technologies telles que les tomographies par émission de photon unique ou par émission de positons a été également présentées. On a trouvé que le radioisotope le plus souvent utilisé pour le diagnostic des maladies du système osseux est le 99mTc, dû à ses caractéristiques physiques et chimiques, tandis que pour la thérapie, les 186Re, 188Re, 153Sm, 177Lu, 32P, 89Sr, 85Sr, et 117mSn sont utilisés selon le type, la localisation et la magnitude des lésions, et la disponibilité du radioisotope. Aujourd'hui, le développement des traceurs isotopiques est axé sur la combinaison de ces radioisotopes avec différentes biomolécules pour améliorer leurs propriétés et élargir leur champ d'applications.
Mots clés: radioisotopes, traceurs isotopiques, diagnostic, radiothérapie, système osseux.
INTRODUCCIÓN
El descubrimiento de los rayos X y, posteriormente, de los isótopos radiactivos permitió que comenzaran las investigaciones y aplicaciones de las técnicas nucleares en la medicina, para el diagnóstico y el tratamiento de diversas afecciones. La Organización Mundial de la Salud ha definido la medicina nuclear como la especialidad que se ocupa del diagnóstico, el tratamiento e investigación médica mediante el uso de radioisótopos como fuentes abiertas.1 Se denomina isótopo de un elemento químico a aquel núclido que tiene el mismo número atómico, pero diferente número másico.
La medicina nuclear ha progresado vertiginosamente, es una especialidad indispensable en la actualidad para la detección y el tratamiento de enfermedades como el cáncer.
El cáncer sigue siendo la principal causa de mortalidad a nivel mundial a pesar de las mejoras en la detección, el diagnóstico precoz y los tratamientos; constituye uno de los principales propósitos terapéuticos de la aplicación de las técnicas nucleares. Nuevas estrategias terapéuticas basadas en una mejor comprensión de la biología del cáncer, los tratamientos específicos y terapias personalizadas se necesitan con urgencia.
El diagnóstico y los tratamientos dirigidos al hueso tienen el potencial de identificar y reducir la capacidad de las células tumorales a permanecer en estado latente y, además, prevenir las metástasis óseas; así como tratar otras enfermedades que afectan con frecuencia al sistema óseo.
Este trabajo tuvo como objetivos identificar los radioisótopos y radiofármacos más empleados en la actualidad para el diagnóstico y tratamiento de las enfermedades óseas, tanto a nivel internacional como en Cuba, mediante evidencias clínicas. Igualmente, estudiar estadísticas internacionales y nacionales de este tipo de afecciones y evaluar su incidencia.
AFECCIONES DEL SISTEMA ÓSEO
El hueso desempeña funciones biomecánicas, protectoras y metabólicas en el organismo. El tejido óseo se compone por las células óseas y la matriz extracelular; mientras que, como órgano, el hueso incluye además otros tejidos como el cartílago, el tejido conectivo fibroso, la médula ósea y los vasos sanguíneos.2 Algunas afecciones como la osteoporosis y las metástasis, que se presentan con gran frecuencia en la población mundial, están asociadas a la secreción alterada de la calcitonina. La base de otras enfermedades óseas como son el envejecimiento esquelético y los focos de fractura es el desbalance del equilibrio entre las funciones osteoblásticas y osteoclásticas.2
La osteoporosis se define como un trastorno esquelético sistémico caracterizado por masa ósea baja y deterioro de la microarquitectura del tejido óseo, con el consecuente incremento de la fragilidad ósea y una mayor susceptibilidad a las fracturas.3 Esta afección es la más frecuente de las enfermedades óseas metabólicas, que afecta a 1 de cada 5 mujeres de más de 45 años, a 4 de cada 10 de más de 75 años y al 90 % de las mujeres mayores de 90 años.4,5 La fractura de cadera es la manifestación clínica más importante de la osteoporosis, debido al enorme impacto socio sanitario que causa. Se calcula que la mortalidad alcanza 30 % durante el primer año en los mayores de 70 años y 50 % queda con algún grado de invalidez.6 Diferentes estudios realizados evidencian que en EE. UU. la osteoporosis cobra 25 millones de víctimas, mientras que otros 34 millones están en riesgo de desarrollar la enfermedad y 80 % son mujeres. Es difícil evaluar el impacto de la osteoporosis sobre América Latina, porque se cuenta con pocos datos confiables, pero se estima que para 2050 los latinoamericanos sufrirán 655 mil fracturas de cadera.7 En Venezuela, 30 % de la población mayor de 50 años presenta osteoporosis. En Brasil se producen aproximadamente 100 mil fracturas de cadera anualmente. En Chile hay más de un millón de habitantes con más de 65 años de edad y todos ellos, pero sobre todo las mujeres, son víctimas potenciales de fracturas de cadera, de muñeca o de vértebra.8
La repercusión de la osteoporosis en la población anciana del área de salud del policlínico Plaza de la Revolución en Cuba ha sido analizada mediante un estudio ambulatorio con la sexta parte de todas las personas con 65 añoso más. El 100 % de estas personas presentó algún signo radiográfico de osteoporosis y el 19 % de fracturas óseas; a pesar de que Cuba, por sus características geográficas, climatológicas y el mestizaje de su población, parece poco favorable para la aparición de osteoporosis.9
Los datos obtenidos evidencian que la incidencia de la osteoporosis en la población mundial es relativamente alta y en Cuba no es una excepción. La severidad de la osteoporosis difiere poco entre los 2 sexos y presenta una tendencia a incrementarse con la edad, con un comienzo relativamente temprano, antes de 65 años.
Por su parte, el cáncer de hueso es un tumor maligno, que destruye el tejido óseo normal. Los tumores malignos que empiezan en el tejido óseo se denominan cáncer óseo primario y el que se disemina a los huesos desde otras partes del cuerpo se denomina metástasis óseas. La incidencia de tumores óseos malignos es relativamente baja en comparación con otros tipos de tumores primarios, representa solo 0,6 % de los casos de cáncer presentados en Cuba en 2006, pero el desarrollo de metástasis óseas en tumores primarios es muy común. El 86 % de los pacientes con cáncer avanzado sufren de dolor, causado en su mayoría por metástasis ósea.10,11
Las células metastásicas invaden el segmento óseo y sus contornos, cambian sus patrones de expresión génica y modifican su fenotipo.12,13 La avidez de las células malignas por el tejido óseo se explica por la irrigación propia de los huesos, especialmente del compartimento medular. También los huesos albergan una gran variedad de tipos celulares y un medio rico en factores de crecimiento, citoquinas y quimoquinas, que constituyen un medio adecuado para el crecimiento celular.14
Existen tres tipos de lesiones radiográficas. Las más frecuentes son las lesiones líticas (75 %). Los cánceres primarios que más las producen son los de riñón, pulmón y mama. Las lesiones blásticas por primarios de próstata, cervicouterino y mama, no son tan comunes (15 %). Por último, las lesiones mixtas se pueden presentar en todos los casos, especialmente en mama y pulmón con una frecuencia de 10 %.15,16
Los hallazgos clínicos más comunes en pacientes con sarcomas óseos son el dolor y el crecimiento de una masa ósea, aunque el dolor generalmente no es un buen indicador de la malignidad.17
Los tipos comunes de cáncer óseos primarios incluyen el osteosarcoma, el cual se origina del tejido osteoide en el hueso, con frecuencia en la rodilla y en el húmero; los condrosarcomas originados en el tejido cartilaginoso y el sarcoma de Ewing, que suelen originarse en el hueso.18 La mayoría de los sarcomas óseos (especialmente osteosarcomas y sarcomas de Ewing) ocurren en pacientes pediátricos y adultos jóvenes y se desarrollan en las extremidades.19
Las causas de la mayoría de los tumores malignos del esqueleto no son conocidas aunque se han identificado factores que aumentan la posibilidad de padecerlos. Las personas que han recibido altas dosis de radioterapia externa, tratamientos anticancerosos y las que tienen implantes, los presentan con frecuencia. Algunas enfermedades hereditarias como exostosis múltiple, síndrome de Rothmund-Thomson y el retinoblastoma hereditario, pueden aumentar el riesgo de cáncer de hueso.20
Una muestra estadística retrospectiva de los pacientes afectados por tumores malignos del sistema osteomioarticular en Cuba ha sido obtenida a partir del diagnóstico realizado por el Servicio de Investigación y Desarrollo del Complejo Científico Ortopédico Internacional "Frank País", en el período comprendido entre enero de 1990 y diciembre de 1999. La variedad histológica, localización, edad y sexo fueron aspectos considerados en este estudio. En el trabajo se halló que los tumores malignos más frecuentes en los pacientes atendidos durante la etapa resultaron el osteosarcoma, el tumor de células gigantes y condrosarcomas, localizados con mayor frecuencia en el ámbito de la rodilla, el fémur y la tibia; predominantemente en pacientes menores de 25 años. También se presentaron otros tumores como el fibrohistiocitoma maligno, sarcoma de Ewing, fibrosarcoma, sarcoma sinovial y mieloma múltiple, entre otros, pero con menor frecuencia.21
Las estadísticas presentadas por la Dirección Nacional de Registros Médicos y Estadísticas de Salud de Cuba en 2010, muestran que la tasa bruta de mortalidad por tumores malignos en huesos y cartílagos por cada 100 000 habitantes se ha incrementado de modo gradual, desde la década de los ochenta hasta la actualidad, con 1,0 en 1980; 1,4 a inicios del actual siglo y de 1,7 en 2010. La tasa de mortalidad por cada 100 000 personas mayores de 80 años se presentó de 14,8 para los hombres y 12,5 para las mujeres.22
La mayoría de los sarcomas óseos hoy día son tratados con cirugía y quimioterapia. Los pacientes con condrosarcomas primarios son la excepción y generalmente se tratan solo con intervención quirúrgica.23,24 El empleo de la quimioterapia en los tumores de hueso ha incrementado la supervivencia a largo plazo, y contribuye a enormes avances en el tratamiento posterior de los sarcomas de hueso.25
La artrosis es una enfermedad degenerativa que también afecta el sistema óseo, específicamente las articulaciones, manifestándose por la presencia de dolor tras el ejercicio físico. Su frecuencia va aumentando con la edad y desde el siglo pasado se estima que se presenta al menos en una articulación en más de 80 % de las personas de 60 años.26 En Cuba, un estudio realizado en 300 individuos adultos, reportó la artrosis como el diagnóstico más frecuente entre los evaluados, con una frecuencia de 19,6 %.27
En el caso de las artritis pueden ser procesos inflamatorios poliarticulares, oligoarticulares o monoarticulares, y con mucha frecuencia toman las articulaciones de las manos. La presencia de la artritis puede deberse al desgaste de los cartílagos, al exceso de ácido úrico o ser de causa desconocida como en el caso de la reumatoide.28 La sinovitis crónica es una manifestación articular de la artritis reumatoide, la hemofilia y otras enfermedades sistémicas.29
Las afecciones que afectan al sistema óseo son múltiples y muy variadas. La osteoporosis, las metástasis, la artrosis y artritis, así como los tumores óseos, son las que se presentan con mayor frecuencia, en este orden de incidencia según lo planteado antes que implica un impacto social y económico considerable. Por esta razón, solo se tuvieron en cuenta las ya mencionadas en este trabajo. La población más anciana es la más propensa a padecer de enfermedades en el sistema óseo, y las mujeres, en particular, tienen mayor riesgo debido a la alta incidencia de la osteoporosis y artritis luego de la menopausia.
Diferentes métodos de diagnóstico y tratamiento se han desarrollado para cada una de las enfermedades óseas; entre ellos se destaca el empleo de la medicina nuclear, lo que constituye el objetivo fundamental de este trabajo.
EMPLEO DE LAS TÉCNICAS DE IMAGEN EN EL SISTEMA ÓSEO
Todas las técnicas de imagen utilizadas en el diagnóstico de las lesiones óseas pueden incluirse en 2 tipos complementarios de exploración: las morfológicas o anatómicas y las funcionales. A estas últimas corresponden las técnicas de medicina nuclear (gammagrafías), que dependen de los cambios fisiológicos.3
Existen dos tipos complementarios de exploración para el diagnóstico de las lesiones óseas: las morfológicas o anatómicas y las funcionales. A estas últimas corresponden las técnicas de medicina nuclear (gammagrafías), que dependen de los cambios fisiológicos.2
La gammagrafía ósea se define como un estudio morfofuncional del esqueleto, basado en la distribución de un radiotrazador en la matriz mineral ósea introducido en el recambio iónico mineral.2,11
La adquisición de imágenes se realiza por dos procedimientos de administración del radiofármaco. La gammagrafía ósea simple consiste en la adquisición de una imagen de cuerpo entero (bidimensional) de una determinada región, a las 2 h de la administración del radiofármaco. La técnica trifásica consiste en la adquisición de imágenes en 3 fases correspondientes a diferentes tiempos transcurridos tras la inyección del radiofármaco.30
Los patrones patológicos de la gammagrafía ósea se caracterizan porque las lesiones son hípercaptadoras-hipocaptadoras, únicas o múltiples y se acompañan o no de deformación de la morfología normal del hueso.31 El hallazgo normal en un patrón gammagráfico óseo de un adulto muestra mayor captación en aquellas zonas donde existe elevada vascularización, como son la columna vertebral, pelvis y epífisis de huesos largos.3
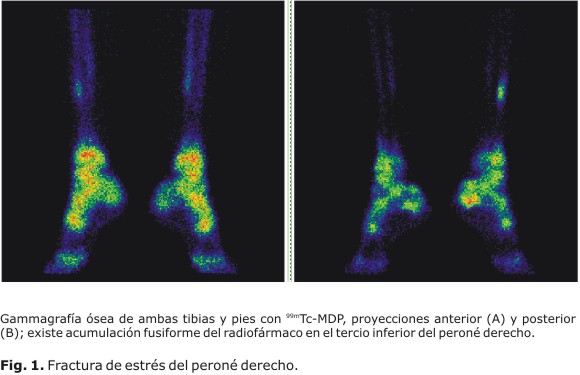
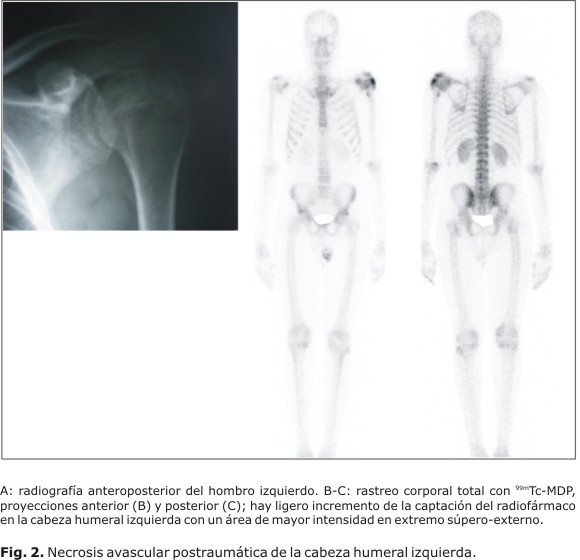
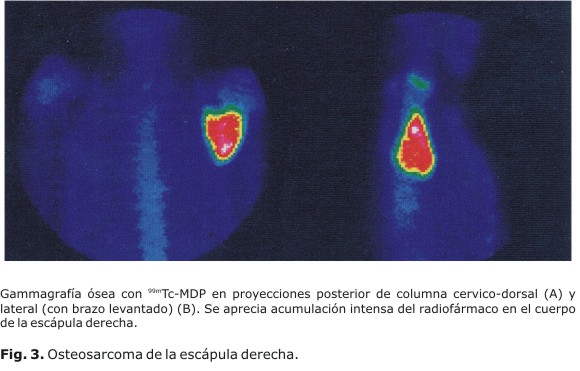
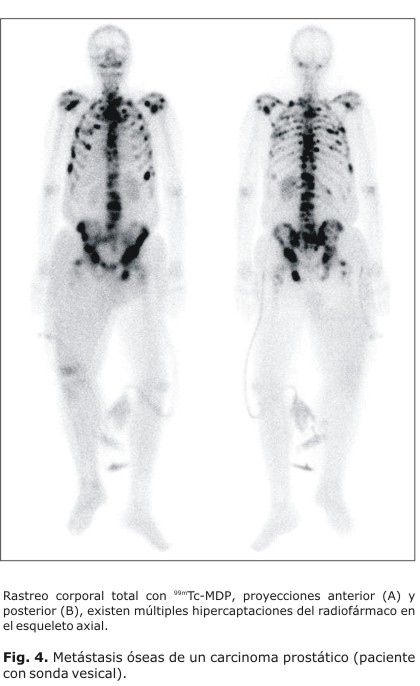
La gammagrafía ósea es útil para evaluar afecciones traumáticas (Fig. 1) y ortopédicas (Fig. 2). Se detectan lesiones óseas benignas como displasia fibrosa, encondromatosis, enfermedad de Paget, osteomalacia, entre otros; su indicación frecuente es la evaluación de sospecha de tumores a la radiografía, para confirmar etiología. La utilidad de la gammagrafía ósea ante la presencia de los tumores primarios malignos radica sobre todo en el caso del osteosarcoma más que para detectar la extensión local del osteosarcoma (Fig. 3) (en que tiene mayor utilidad la resonancia magnética), en detectar si se trata de una lesión única o no. Las metástasis óseas (Fig. 4) son las enfermedades que con más frecuencia tienen indicaciones en la medicina nuclear. Entre las indicaciones en la cual el estudio muestra alta utilidad, destacan también la evaluación de prótesis óseas para el diagnóstico de posible infección periprotésica y de aflojamiento, o el diagnóstico diferencial entre ambas, las enfermedades metabólicas y los injertos óseos para evaluar la viabilidad y respuesta osteoblástica en cualquier localización. Sin embargo; esta técnica no es adecuada para el diagnóstico de osteoporosis, por la inespecificidad de la gammagrafía; aunque presenta cierta utilidad en los trastornos articulares. Puede demostrar sinovitis asociada o no a cambios degenerativos y es útil para detectar artropatías.4 El diagnóstico de la osteoporosis se ha realizado mediante la densitometría ósea para evaluar la mineralización de los huesos con americio 241 y con gadolinio 153,37 aunque actualmente se emplean equipos basados en ultrasonidos y en absorciometría radiológica de doble energía (DEXA, del inglés dual energy x-ray absorciometry).32
En las últimas décadas del siglo XX y comienzos del siglo XXI se han desarrollado nuevas técnicas en el campo de la medicina nuclear, como la tomografía por emisión de fotón único (SPECT) o la tomografía por emisión de positrones (PET).
La tomografía por emisión de positrones permite la identificación de alteraciones bioquímicas y fisiológicas en el cuerpo y valora el nivel de actividad metabólica y de perfusión de diferentes sistemas orgánicos. Esta se basa en la detección de los rayos gamma emitidos por una sustancia radiactiva, como la 2-fluoro-2-desoxiglucosa marcada con 18F (18FDG). Una de las aplicaciones principales de esta es la detección de tumores primarios, metastásicos y recidivas tumorales tras el tratamiento.33
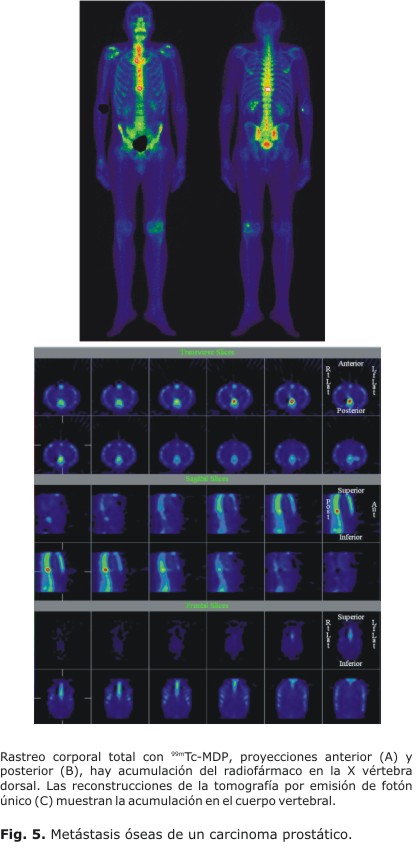
La tomografía por emisión de fotón único consiste en la adquisición volumétrica de un sector del cuerpo. El principal beneficio de la SPECT es la mejora de la detección de la lesión y de la localización anatómica, consiguiendo una mejor sensibilidad diagnóstica (Fig. 5). La tomografía por emisión de fotón único ósea ha probado ser especialmente útil para la detección de lesiones en estructuras anatómicas grandes y complejas, como en la columna.34
Algunos autores compararon la gammagrafía con tecnecio 99 metaestable (99mTc), SPECT y SPECT acoplada con TAC en pacientes con lesiones óseas focales del esqueleto axial. La visibilidad de la lesión fue significativamente mejor con SPECT que con gammagrafía planar. La gammagrafía puede ser suficiente para la diferenciación de lesiones en el esqueleto axial pero son las otras dos las que ofrecen mejores resultados en el diagnóstico, la última es más específica. Los equipos híbridos SPECT-TAC y PET-TAC mejoran la resolución espacial de las técnicas de medicina nuclear convencional.35,36
La gammagrafía ósea es uno de los principales métodos diagnósticos en las lesiones del aparato músculoesquelético. Su empleo constituye una ventaja dentro de la medicina por ser una técnica no invasiva, inocua y con mínimas dosis de radiación. Las pruebas diagnósticas son seguras, no son dolorosas, y tienen una buena relación costo-beneficio. La sensibilidad, facilidad y seguridad en su realización, la han hecho una prueba diagnóstica altamente solicitada, lo cual permite, en conjunto con otras pruebas, un excelente rendimiento diagnóstico. El aspecto más negativo de estos exámenes es que, dada su gran sensibilidad, existen muchas y variadas enfermedades que pueden presentar hallazgos positivos y limitar su especificidad.
Estos conocimientos en manos de recurso humano capacitado y acompañado de tecnología de punta, ayudan a precisar quién se beneficia con la terapia médica y a quién ayuda más la terapia quirúrgica.
EMPLEO DE RADIOISÓTOPOS Y RADIOFÁRMACOS EN EL SISTEMA ÓSEO
Los radionúclidos se utilizan en medicina nuclear en formas químicas simples o en estructuras moleculares complejas como trazadores o marcadores, llamados radiofármacos. Estos son seleccionados con la finalidad de que, mediante sus características bioquímicas sigan un determinado camino metabólico, fijándose en diferentes estructuras donde pueden ser detectados. La administración de radiofármacos se hace por diferentes vías: oral, intravenosa, inhalatoria, intracavitaria (intratecal, intraarticular, intraabdominal, etc.), pero la oral y la intravenosa son las más usadas. Transcurridas 3 h de la inyección, prácticamente todo el radiotrazador se habrá incorporado al hueso o habrá sido eliminado.8
Los efectos secundarios que pueden producirse con el empleo de los radiofármacos son: hipertensión arterial, alteraciones respiratorias, arritmias, sabor metálico, eritema, leucocitopenia y trombocitopenia, rash o urticaria y fotofobia, entre otros. Estos deben ser reversibles y no suelen ser de gravedad.11
El radiotrazador más utilizado para la realización de la gammagrafía ósea y de la mayor parte de las exploraciones de medicina nuclear es el 99mTc.37 Los radiofármacos habitualmente usados para el rastreo óseo incluyen los difosfonatos orgánicos: hidroxietilendifosfonato (HEPD, por su nombre en inglés), metilen-difosfonato (MDP, por su nombre en inglés) y el hidroxi-difosfonato (HDP, por su nombre en inglés), todos ellos marcados con 99mTc.38-40 La utilización de pirofosfatos también es posible.41,42 Los compuestos tienden a acumularse en las áreas de mayor metabolismo del hueso por la acción de la enzima sintetasa farnesil difosfonato.43,44 Se plantea que los fosfonatos de 99mTc quedan atrapados en el hueso, por intercambio con sus constituyentes normales en la capa de hidratación.2 Algunos autores consideran que la matriz colágena del hueso puede ser un punto de unión para el 99mTc, mientras que otros expresan que los mecanismos de captación ósea del 99mTc-MDP son la unión del radiofármaco al catión Ca2+ de los cristales de la hidroxiapatita (HA) y el colágeno.45
El 99mTc-MDP se acumula primero en el espacio perivascular, después en los fluidos óseos y luego en el hueso. Después de 3 h el 3 % está en sangre, 65 % se encuentra en tejido óseo, mientras que el porcentaje restante se excreta.41,44 Los radiofármacos como el 99mTc-MDP y el alendronato-99mTc (99mTc-ABP) han sido empleados y comparados para su uso en gammagrafías óseas, con calidad de imágenes similares pero menor radiación y exposición al paciente para el 99mTc-ABP.45,46Las deficiencias presentadas por los difosfonatos son su existencia como mezclas de compuestos iónicos con propiedades variables y la presencia de los 2 grupos fosfatos cercanos que pueden interferir en sus respectivas funciones. Se propone el empleo de difosfonatos que posean nitrógeno para quelar el radioisótopo, quedando libre de interferencias el grupo fosfato para su unión al hueso.47,48 Se ha sintetizado, por ello, el [99mTc] dipicolilamina-alendronato que ha mostrado alta afinidad a la HA, 98 % de rendimiento radioquímico y actividad específica de 22 MBq/µg.39
En Cuba, también se han desarrollado radiofármacos como la 99mTc-ciprofloxacina, con 99mTc obtenido a partir de un generador comercial de 99Molibdeno-99mTecnecio [Centro de Isótopos (CENTIS), La Habana]. La 99mTc-ciprofloxacina ha sido empleada para la evaluación de las infecciones bacterianas en las prótesis de cadera, que resulta útil en la diferenciación de los procesos inflamatorios e infecciosos. Se realizó un estudio en el departamento de Medicina Nuclear del Complejo Científico Ortopédico Internacional "Frank País" donde se hicieron gammagrafías óseas con 99mTc-MDP y 99mTc-ciprofloxacina a 1 h, a las 4 h y a 24 h después de la inyección; se obtuvo 100 % de sensibilidad, 75 % de especificidad y 93,3 % de exactitud diagnóstica.49 Por otra parte, esta técnica se emplea como alternativa para el diagnóstico de infecciones en los huesos y como agente para la detección de infecciones vertebrales.50
El tiempo de la proyección de la imagen en la gammagrafía ósea ha podido reducirse con nuevos radiofármacos bifuncionales y una mayor afinidad por el hueso. El 99mTc-mercaptoacetilglicilglicilglicina (MAG3) y el ácido 99mTc-6-hidrazinopiridina-3-carboxílico (HYNIC) conjugados con hidroxi-bifosfonato. El 99mTc-metoxi-isobutil-isonitrilo (MIBI) también permite visualizar lesiones focales en huesos como en la columna vertebral.51 En Cuba, este radiofármaco ha sido estudiado en el Complejo Científico Ortopédico Internacional "Frank País" para su utilización en gammagrafías óseas a pacientes con lesiones tumorales del esqueleto; se ha obtenido una sensibilidad de 100 %, una especificidad de 89,5 % y una exactitud diagnóstica de 94,7 %.52
El citrato de galio 67 (67Ga) y los leucocitos marcados con 99mTc o con 111In, también han sido empleados en la medicina nuclear con buena exactitud en los resultados.8,53 El marcaje de los leucocitos tiene como desventaja la necesidad de hacer una previa separación celular.54 La sensibilidad del 67Ga para detectar abscesos oscila entre 58 y 100 %, su especificidad entre 75 y 99 %. Las imágenes son muy precisas para detectar la respuesta al tratamiento en procesos como la osteomielitis crónica y las artritis infecciosas. En los procesos neoplásicos se puede utilizar el galio para diferenciar un sarcoma de una lesión benigna de partes blandas.33
Los leucocitos marcados con 111In han mostrado buenos resultados para detectar abscesos o procesos infecciosos agudos, incluidas la osteomielitis y las artritis sépticas. Su sensibilidad oscila entre 75 y 90 %, y su especificidad está alrededor de 91 %. Este método tiene como dificultades la necesidad de personal preparado dedicado durante por lo menos 3 horas al proceso para la separación de los leucocitos homólogos.55
Algunos investigadores no recomiendan el uso del 111In, porque no ofrece ventajas sobre el 99mTc y tiene características físicas similares al 99Mo. Por otro lado, recomiendan el empleo de 113mIn unido a agentes quelatantes como el etilen-diamina-tetrametilen-fosfonato (EDTMP) y el dietilen-triamina-pentametilen-fosfonato (DTPMP). Los mejores resultados en conejos lo obtuvieron con el 113mIn-EDTMP, que se localiza fundamentalmente en el esqueleto con menor contribución en los tejidos blandos.56,57
La fluorodesoxiglucosa (FDG) marcada con 18F es útil para la detección de infecciones agudas, actividad en osteomielitis crónica y de infección en el esqueleto axial, pero resulta más costosa y muestra dificultad para diferenciar inflamación e infección por tumor.58
Pese a la aparición de nuevos procedimientos como la 18F-FDG PET, la gammagrafía ósea sigue siendo empleada para el diagnóstico debido a las ventajas que presenta. El 99mTc ha resultado ser el radioisótopo más empleado por su fácil obtención, su energía gamma, su tiempo de vida media y a que no causa efectos secundarios.
El dolor es comúnmente experimentado por las personas cuyo cáncer se ha propagado a los huesos. Los radiofármacos para terapia paliativa del dolor deben poseer una alta afinidad por el tejido óseo afectado y permanencia en este, ser emisor beta o emisor de electrones, tener energía suficiente para llegar a las células responsables del dolor y un período de semidesintegración lo suficiente largo para producir una dosis de radiación que destruya o dañe de manera irreversible las células afectadas.59
Varios estudios se han llevado a cabo con el objetivo de determinar la eficacia y seguridad de los radioisótopos para controlar el dolor en pacientes con metástasis óseas, las complicaciones causadas por esta enfermedad. La administración sistémica de una sustancia radiactiva permite tratar múltiples metástasis de manera simultánea. Los radioisótopos empleados en estos estudios son el 89Sr, 153Sm, 186Re y el 32P. Al comparar el empleo de los diferentes radioisótopos o dosis de un isótopo radiactivo no se identificaron diferencias concluyentes. Los radioisótopos pueden proporcionar una reducción total del dolor de 1 a 6 meses, sin el aumento del uso de analgésicos, pero son frecuentes los efectos adversos graves, especialmente la leucopenia y la trombocitopenia.22,60
El alivio del dolor se inicia de 1 a 4 semanas después de la administración de los radioisótopos de vida más larga (32P, 89Sr, 117mSn), mientras que el tiempo de respuesta para los agentes de vida más corta (186Re, 188Re, 153Sm) es de 2 a 7 días. La duración de la respuesta también varía un poco, pero en general oscila entre 2 y 6 meses.23,58,61,62
El 153Sm es el emisor de partículas beta de energía más baja entre los radioisótopos que han sido estudiados mediante ensayos en estos tratamientos (0,81 MeV). Su química permite el diseño de radiofármacos como el 153Sm-etilen-diamino-tetrametilen-fosfonato (153Sm-EDTMP) o el 153Sm-lexidronam, los cuales poseen gran captación ósea y un alto grado de selectividad en su localización en el tejido metastático óseo, específicamente en las lesiones blásticas.63,64 Los efectos adversos más frecuentes del 153Sm-EDTMP, evaluados en un estudio realizado a pacientes con dolor crónico debido a metástasis óseas, consistieron en náuseas (20 %), seguido de vómitos (5 %).65
El 89Sr se suministra como disolución estéril inyectable de cloruro de 89Sr.66 Aproximadamente 70 % de la dosis es retenida por el esqueleto. La eliminación es por vía renal (2/3) y fecal (1/3).67 El efecto de este radioisótopo sobre el control del dolor a corto y a mediano plazo producido por metástasis óseas, ha sido demostrado por diferentes autores en estudios controlados aleatorios realizados a doble ciegas que tienen en cuenta las dosis, la autoevaluación del dolor hecha por el paciente y la incidencia de efectos secundarios.68-70 Su principal inconveniente es que no tiene acción sobre las metástasis líticas, por lo que su utilidad está muy limitada en la mayoría de los procesos neoplásicos.71
El 85Sr ha sido empleado además en la terapia paliativa del dolor por metástasis óseas siendo efectivo y bien tolerado para 72 % de los pacientes estudiados. La distribución en el cuerpo es similar a la del 99mTc-MDP.48,72 El empleo del 85Sr y 89Sr en estudios óseos ha presentado resultados similares, pero el primero ha dado como resultado un alto fondo que conduce a resultados erróneos.73,74
El efecto de la radioterapia en las metástasis óseas dolorosas se analizó en 1 157 pacientes con una supervivencia menor o igual que 12 semanas en Holanda. El 23,7 % de los pacientes sobrevivió 12 semanas después y 45 % respondió a la radioterapia paliativa para las metástasis óseas dolorosas.75
Los fosfonatos además han sido marcados con 177Lu con un rendimiento de marcación superior a 95 %. El radiofármaco es estable in vitro e in vivo, tiene alta captación ósea y rápida eliminación renal.76,77 El fosfonato ácido etilen-diamino-tetrametilen-fosfonato (EDTMP) y el 1,4,7,10-tetraazaciclododecano-1-,4,7,10 tetraaminometilenofosfonato (DOTMP) marcados con 177Lu, han sido propuestos como radiofármacos para la paliación del dolor óseo. El primero ha mostrado una mayor captación ósea.78,79
El 188Re es un emisor ß- de adecuada penetración en tejidos óseos y período de semidesintegración de 17 h.80 La dosis total aplicada a los tejidos es baja en relación con otros radioisótopos actualmente en uso. El 188Re-HEDP presenta una captación ósea selectiva y una rápida eliminación renal de la actividad no captada.42,81 Por otro lado, se ha sintetizado el [188Re (CO)3]-alendronato con más de 95 % de rendimiento de marcaje y actividad específica de 18,86 Bq/mg. Este radiofármaco ha demostrado tener alta afinidad en hueso y muy poca en tejidos blandos.82,83
El 186Re, empleado como 186Re-HEDP, tiene período de semidesintegración de 89 h y también emite radiación gamma permitiendo obtener imágenes y realizar cálculos dosimétricos individuales.21 En un estudio dirigido a 37 pacientes con metástasis se obtuvo 77 % de respuesta después de una única dosis de 34 mCi (1 258 MBq), con una reducción del dolor a 60 %.84 Hasta el momento no se han reportado diferencias en la respuesta o toxicidad del tratamiento paliativo entre 186Re-HEDP y 188Re-HEDP.85,86
El 32P-fosfato de sodio fue uno de los primeros agentes empleados en el tratamiento de metástasis óseas, con una efectividad entre 60 y 90 % para la paliación del dolor. Sin embargo, presenta el inconveniente de estar involucrado en muchos procesos metabólicos y puede afectarlos, en especial causar depresión de la médula ósea.87,88
Por otro lado, la radiosinoviortesis es un procedimiento de radioterapia metabólica consistente en la inyección intraarticular de radiofármacos para el tratamiento de la sinovitis crónica. Los productos comerciales existentes se basan en 90Y, 169Er, 186Re y 32P, aunque se investigan otros radionúclidos. Los investigadores del Centro de Isótopos en Cuba han desarrollado una suspensión de fosfato de cromo (III) marcada con 32P con alrededor de 90 % de las partículas de 1 a 5 µm y se establecieron además los métodos para obtener las suspensiones radiactivas correspondientes de 32P, 90Y, 68Ga y 177Lu.89
El 117mSn-DTPA ha reportado una ventaja terapéutica en estudios realizados en animales de 8 a 1 en comparación con el 32P-fosfato. En el empleo del 117mSn, se estima que la relación de dosis entre hueso y médula ósea es de 9 a 114. Ese aspecto es muy útil para minimizar el daño a la médula, esto aporta simultáneamente una alta dosis de radiación a las metástasis.90
En conclusión, los radioisótopos en la medicina nuclear se emplean con 2 fines diferentes: terapia o diagnóstico. El uso de los radioisótopos con fines de diagnóstico busca obtener información acerca del estado de salud del paciente. En la terapia con radiación, en cambio, se intenta tratar, o curar, un padecimiento por medio de la radiación. Muchos han sido los radioisótopos estudiados y aplicados en la terapia, sin embargo ninguno de ellos ha resultado ideal para tratar todas las enfermedades óseas. El empleo de los distintos radiofármacos ha permitido mejorar la calidad de vida de los pacientes y disminuir la mortalidad por enfermedades óseas, pero aún es necesario el empleo de técnicas complementarias y el estudio de nuevos radiofármacos que faciliten su uso en la medicina nuclear.
CONSIDERACIONES FINALES
En esta revisión se encontraron evidencias sobre la incidencia en la población mundial y nacional de diversas afecciones óseas, del empleo de técnicas de imagen y radiofármacos para su diagnóstico y tratamiento, así como su eficiencia.
Algunas afecciones como la osteoporosis y las metástasis resultaron muy comunes en la población mundial. Sus complicaciones disminuyen la calidad de vida y acarrean un alto costo en gastos para el tratamiento y la rehabilitación. Otras afecciones menos comunes como el sarcoma de Ewing u osteosarcomas, son igual de dañinas para la salud humana. Estas enfermedades no demostraron preferencias por algún sexo o edad, mientras que en el caso de la artrosis y artritis se presentaron mayormente en individuos de edad avanzada, sobre todo en mujeres.
El empleo de las técnicas de radioisotópos ha tenido un desarrollo ascendente, desempeñando un papel importante en el diagnóstico precoz de diversas enfermedades óseas y su tratamiento oportuno. Entre estas técnicas se encuentran la gammagrafía ósea, las tomografías por emisión de fotón único o por emisión de positrones. La primera es muy empleada por ser una técnica segura, de gran sensibilidad y buena relación costo-beneficio, aunque las 2 últimas ofrecen ventajas en cuanto a la especificidad de la información.
Se identificó el 99mTc como el radiofármaco más empleado en la actualidad para el diagnóstico de enfermedades del sistema óseo por sus características físicas y químicas, mientras que para terapia se emplean fundamentalmente: 186Re, 188Re, 153Sm, 177Lu, 32P, 89Sr, 85Sr, 117mSn. El desarrollo de los radiofármacos se ha centrado en la combinación de los radioisótopos con diferentes biomoléculas para mejorar su campo de aplicaciones. Los compuestos más empleados generalmente con esta finalidad son los difosfonatos o pirofosfatos. El empleo de cada uno depende sobre todo de las características de la enfermedad (tipo, ubicación y magnitud de las lesiones) y de su disponibilidad.
En Cuba, específicamente, se evidencia que la incidencia de la osteoporosis es algo alta. Los tumores malignos más frecuentes suelen ser el osteosarcoma, el tumor de células gigantes y los condrosarcomas, con predominio en pacientes menores de 25 años. La artrosis y artritis también representan un problema para la población cubana, por lo que se ha puesto empeño en investigaciones relacionadas con este tema. Se han dado pasos importantes en la obtención de radiofármacos para su empleo en las diferentes enfermedades que se presentan en el sistema óseo, con la 99mTc-ciprofloxacina y con la suspensión de fosfato de cromo (III) marcada con 32P.
Es importante que los ensayos clínicos incluyan cálculos más específicos del tamaño y las pérdidas estimadas adecuadamente para el seguimiento, para evaluar la eficacia real del empleo de los radioisótopos, determinar los compuestos más beneficiosos y seguros, la dosis óptima, la vía de administración y qué grupos se benefician más con la terapia.
REFERENCIAS BIBLIOGRÁFICAS
1. Degrossi E, Gariti M, Kavasima M. Nomenclador de Medicina Nuclear. Curso Anual de Auditoria Médica [citado 19 Sep 2012]. Disponible en: http://auditoriamedicahoy.net/biblioteca/Nomenclador_de_Medicina_Nuclear
2. Kanterewicz E. Anamnesis. Exploración física. Estudio analítico. En: Arboleya L, Pérez L, editores. Manual de enfermedades óseas. 2da ed. Sociedad Española de Reumatología. Madrid: Editorial Médica Panamericana; 2010. p. 6570. .
3. Muñoz Torres M, Varsavsky M, Avilés Pérez MD. Osteoporosis. Definición. Epidemiologia. Rev Osteoporos Metab Miner. 2010;2(3):5-75.
4. González Macías J, Rozman C, Farreras Valentí P. Osteoporosis. Principios de Medicina Interna. Vol. I. 14º ed. Nueva York: Editorial Harcourt; 2000: p.1233-42.
5. Krane SM, Michael FH. Enfermedades óseas metabólicas. En: Harrison J. Principios de Medicina Interna. Vol. II. 14º ed. Madrid: Editorial Mc Graw-Hill Interamericana; 1998. p. 2557-63.
6. Guerra García MM, Rodríguez Fernández JB, Puga Sarmiento E, Charle Crespo MA, Gómez Carvalho CS, Prejigueiro Santás lA. Incidencia de la fractura de cadera osteoporótica en Galicia en relación con la dispensación de medicamentos con indicación en su prevención y tratamiento. Aten Primaria. 2010. doi:10.1016/j.aprim.2010.04.010.
7. Hobecker O, Guayán VA, Mango Vorrath NP, Giménez SL. Impacto de la osteoporosis sobre la población. Rev Posgrado Cátedra Med. 2005;12(144):24-7.
8. Gajardo H. La Osteoporosis: huesos frágiles en nuestro futuro. Revista Creces; 1990(10).
9. Ochoa Torres F, Pereira Costa R. Encuesta sobre osteoporosis en un área de salud. Rev Cubana Endocrinol. 1997;8(2):135-41.
10. Van den Beuken-van EM, de Rijke JM, Kessels AG, Schouten HC, Van Kleef M, Patijn J. Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Ann Oncol. 2007;18(9):1437-49.
11. Nelson OS, Munro AJ, Tannock IF. Bone metastatic: pathophysiology and management policy. J Clin Oncol. 1991;9(3):509-24.
12. Colemana RE, Lipton A, Roodman GD, Guise TA, Boyce BF, Brufsky AM, et al. Metastasis and bone loss: Advancing treatment and prevention. Cancer Treat Rev. 2010;36(8):615-20.
13. Bodei Lam M, Chiesa C, Flux G, Brans B, Chiti A, Giammarile F. EANM procedure guideline for treatment of refractory metastatic bone pain. Eur J Nucl Med Mol Imaging. 2008;35(10):1934-40.
14. Mundy GR, Chen D, Zhao M, Dallas S, Xu C, Harris S. Growth regulatory factors and bone. Rev Endocr Metab Disord. 2001;2(1):105-15.
15. Guise TA, Mundy GR. Cancer and bone. Endocrinol Rev. 1998;19(1):18-54.
16. Roodman GD. Mechanisms of bone metastasis. N Engl J Med. 2004;350(16):1655-64.
17. Lietman SA, Joyce MJ. Bone sarcomas: Overview of management, with a focus on surgical treatment considerations. Cleveland Clin J Med. 2010;77(1):8-12.
18. Malawer MM, Helman LJ, O´Sullivan B. Sarcomas of bone. In: DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: Principles and Practice of Oncology. 7th ed. Philadelphia: Lippincott Williams and Wilkins; 2004.
19. Simon MA, Springfi DS. Surgery for bone and soft-tissue tumors. Philadelphia: Editorial Lippincott-Raven; 1998.
20. Pizzo P. Principles and Practice of Pediatric Oncology. 4th ed. Philadelphia: Lippincot, Williams and Wilkins; 2002.
21. Tamayo Figueroa A, Chao Carrasco L, Cárdenas Centeno O, Escandón León F, Reyes Álvarez J. Experiencia en tumores malignos en el Complejo Científico Ortopédico Internacional "Frank País". Rev Cubana Ortop Traumatol. 2003;17(1-2):53-6.
22. Anuario Estadístico de Salud 2010. Dirección Nacional de Registros Médicos y Estadísticas de Salud. La Habana: Ministerio de Salud Pública de Cuba; 2011.
23. Merchant TE, Kushner BH, Sheldon JM, LaQuaglia M, Healey JH. Effect of low-dose radiation therapy when combined with surgical resection for Ewing sarcoma. Med Pediatr Oncol. 1999;33(2):65-70.
24. Goldsby R, Burke C, Nagarajan R, Zhou T, Chen Z, Marina N, et al. Second solid malignancies among children, adolescents, and young adults diagnosed with malignant bone tumors after 1976: follow-up of a Children's Oncology Group cohort. Cancer. 2008;113(9):2597-604.
25. Mankin HJ, Lange TA, Spanier SS. The hazards of biopsy in patients with malignant primary bone and soft-tissue tumors. J Bone Joint Surg Am. 1982;64(8):1121-7.
26. Lawrence JS, Bremmer JM, Bier F. Osteo-arthrosis: prevalence in the population and relationship between symptoms and x-ray changes. Ann Rheum Dis. 1966;25(1):1-24.
27. Ministerio de Salud. Guía Clínica Tratamiento Médico en personas de 55 años y más con artrosis de cadera y/o rodilla, leve o moderada. Santiago: Minsal; 2009. p. 7.
28. Acosta Hernández RR. ¿Artritis o artrosis? Rev Cubana Med Gen Integr [revista en la Internet]. 2008 Sep [citado 2012 Mar 29];24(3): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252008000300001&lng=es
29. Sweeney SE, Firestein GS. Rheumatoid arthritis: regulation of synovial inflammation. Intern J Biochem Cell Biol. 2004;36(3):372-8.
30. Del Cura JL, Pedraza S, Gayete A. Radiología Esencial. t. I. Madrid: Ed. Médica Panamericana SA; 2009.
31. Carril JM, Banzo JI. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Sección II. Madrid: Jarpyo editores SA; 2004. p. 93-8.
32. Hill JW, Kolb DK. Química para el nuevo milenio. 8va ed. México: Prentice Hall Hispanoamericana SA; 1999. 704 p.
33. González P, Massardo T, Canessa J, Humeres P, Jofré MJ. Aplicaciones clínicas del PET. Rev méd. 2002;130(5):569-579. ISSN 0034-9887
34. Humeres P. Medicina nuclear: Aplicación en patología osteoarticular. Rev Chilena Radiol. 2002;8(2):77-83.
35. Strobel K, Burger C, Seifert B, Husarik DB, Soyka JD, Hany TF. Characterization of focal bone lesions in the axial skeleton: Performance of planar bone scintigraphy compared with SPECT and SPECT fused with CT. American Roentgen Ray Society AJR. 2007;188(5):467-74.
36. Even Sapir E, Flusser G, Lerman H, Lievshitz G, Metser U. SPECT/Multislice low-dose CT: a clinically relevant constituent in the imaging algorithm of nononcologic patients referred for Bone Scintigraphy. J Nucl Med. 2007;48(2):319-24.
37. Cortés Blanco A, Martínez Lázaro R. Condiciones autorizadas de uso humano en la práctica clínica de los generadores de molibdeno-99/tecnecio-99m (99Mo/99mTc) comercializados en España. Seguridad Nuclear. 2006;39(II trimestre):13-20.
38. Moore AE, Blake GM, Fogelman I. Quantitative measurements of bone remodeling using 99mTc-methylene diphosphonate bone scans and blood sampling. J Nucl Med. 2008;49(3):375-82.
39. Torres Martin de Rosales R, Finucane C, Mather SJ, Blower PJ. Bifunctional bisphosphonate complexes for the diagnosis and therapy of bone metastases. Chem Commun (Camb). 2009;(32):4847-9. PubMed. DOI: 10.1039/b908652h.
40. Fernández H, Patrício JP, Oliveira P, Oliveira A, Faria T, Pereira J, et al. Calcificação metastática detectada em cintigrafia óssea. Acta Med Port. 2010;23(4):731-4.
41. Turpin S, Lambert R. Role of scintigraphy in musculoskeletal and spinal infections. Radiol Clin North Am. 2001Mar;39(2):169-89.
42. Rohlina M, Larsson A, Hammarstrom L. Distribution of «Tc»-Labelled Phosphorus Compounds, 45Ca and 85Sr in Diphosphonate-treated Rats. Acta Radiol Therapy Physics Biol. 1977;16(4):513-24.
43. Drake MT, Clarke BL, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Clin Proc. 2008;83(9):1032-45.
44. Lenora J, Norrgren K, Thorsson O, Wollmer P, Obrant KJ, Ivaska KK. Bone turnover markers are correlated with total skeletal uptake of 99mTc-methylene diphosphonate (99mTc-MDP). BMC Medical Physics. 2009;9:3. ISSN 1756-6649
45. Montoya Molina CE, Sepúlpeda Méndez J, Arteaga de Murphy C, Menéndez Alafort L, Rolas Bautista JC, López Alvarenga JC. El 99mTc-alendronato como nueva opción en la gammagrafía ósea. Rev Invest Clin. 1997;49(5):373-7.
46. Álvarez Rodríguez E. Optimización del tratamiento con alendronato en osteoporosis [Tesis doctoral]. Madrid: Facultad de Medicina, Universidad Complutense de Madrid; 2008.
47. Ogawa K, Mukai T, Arano Y, Otaka A, Ueda M, Uehara T, et al. Rhemium-186-monoaminemonoamidedithiol-conjugated bisphosphonate derivatives for bone pain palliation. Nucl Med Biol. 2006;33(4):513-20.
48. Ogawa K, Mukai T, Inoue Y, Ono M, Saji H. Development of a Novel 99mTc-chelate-conjugated bisphosphonate with high affinityfor bone as a bone scintigraphic Agent J Nucl Med. 2006;47(12):2042-7.
49. Marrero Riverón LO, Álvarez Cambras R, Hernández Cairo A, Batista Cuellar JF, Guerra Ordoñez CA, Perera Pintado A. Valor de la gammagrafía con 99mTc-ciprofloxacina cubana en la detección de las prótesis de cadera infectadas. Rev Cubana Ortop Traumatol [revista en la Internet]. 2006 Jun [citado 2012 Mar 30];20(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-215X2006000100002&lng=
50. Sonmezoglu K, Sonmezoglu M, Halac M, Akgün I, Türkmen C, Önsel C, et al. Usefulness of 99mTc-Ciprofloxacin (Infecton) scan in diagnosis of chronic orthopedic infections: comparative study with 99mTc-HMPAO leukocyte scintigraphy. J Nucl Med. 2001;42(4):567-74.
51. Fonti R, Salvatore B, Quarantelli M, Sirignano C, Segreto S, Petruzziello F, et al. 18F-FDG PET/CT, 99mTc-MIBI, and MRI in evaluation of patients with Multiple Myeloma. J Nucl Med. 2008;49(2):195-200.
52. Marrero Riverón LO, Álvarez Cambras R, Cárdenas Centeno OM de, Tamayo Figueroa A, Perera Pintado A, Quintana Rodríguez FJ. Captación de 99mTc-MIBI en los tumores óseos. Estudio comparativo con el 99mTc-MDP. Rev Cubana Ortop Traumatol. 1999;13(1-2):6-18.
53. Meller J, Köster G, Liersch T, Siefker U, Lehmann K, Meyer I, et al. Chronic bacterial osteomyelitis: prospective comparison of 18F-FDG imaging with a dual-head coincidence camera and 111In-labelled autologous leucocyte scintigraphy. European J Nucl Med Molecular Imaging. 2002;29(1):53-60.
54. Palestro CJ, Kipper SL, Weiland FL, Love C, Tomas MB. Osteomyelitis: Diagnosis with 99mTc-labeled antigranulocyte antibodies compared with diagnosis with 111In-labeled leukocytes-initial experience. Radiology. 2002;223(3):758-64.
55. Shalom RB, Yefremov N, Guralnik L, Keidar Z, Engel A, Nitecki S, et al. SPECT/CT using 67Ga and 111In-labeled leukocyte scintigraphy for diagnosis of infection. J Nucl Med. 2006;47(4):6-10.
56. Subramanian G, McAfee JG, Rosenstreich M, Coco M. Indium-113m-Labeled polyfunctional phosphonates as bone-imaging agents. J Nucl Med. 1975;16(11):1080-4.
57. Seabold JE, Forstrom LA, Schauwecker DS, Brown ML, Datz FL, McAfee JG. Procedure guideline for indium-111-leukocyte scintigraphy for suspected infection/ inflammation. J Nucl Med. 1997;38(6):997-1001.
58. Meller J, Sahlmann CO, Scheel AK. 18F-FDG PET and PET/CT in fever of unknown origin. J Nucl Med. 2007;48(1):35-42.
59. Chiacchio S, Borso E, AlSharif AA, Boni G, Mariani G. Radiofármacos para el tratamiento paliativo del dolor en pacientes con metástasis óseas y su posible integración con la quimioterapia. Alasbimn J. 2010;13(50):1-5.
60. Mertens WC, Filipczack LA, Ben-Josef Edgar, Davis LP, Portes AT. Systemic bone-seeking Radionuclides for palliation of painful osseousmetastases: Current Concepts. CA Cancer J Clin. 1998(6);48:361-74.
61. Loblaw DA, Wu JS, Kirkbride P, Panzarella T, Smith K, Aslanidis J, et al. Pain flare in patients with bone metastases after palliative radiotherapy a nested randomized control trial. Support Care Cancer. 2007;15(4):451-5.
62. Chow E, Ling A, Davis L, Panzarella T, Danjoux C. Pain flare following external beam radiotherapy and meaningful change in pain scores in the treatment of bone metastases. Radiother Oncol. 2005;75(1):64-9.
63. Serafini AN, Houston SJ, Resche I, Quick DP, Grund FM, Ell PJ, et al. Palliation of pain associated with metastatic bone cancer using samarium-153 lexidronam: A double-blind placebo-controlled clinical trial. J Clin Oncol. 1998;16(4):1574-81.
64. Sartor O, Reid RH, Bushnell DL, Quick DP, Ell PJ. Safety and efficacy of repeat administration of samarium Sm-153 lexidronam to patients with metastatic bone pain. Cancer. 2007;109(3):637-43.
65. De la Calle AB, González González G, Fornés C, Martínez Calderón F. 153SM-EDTMP (Samario) como tratamiento del dolor óseo de origen metastático. Rev Soc Esp Dolor. 2006;13(3):159-63. ISSN 1134-8046.
66. Serafini AN. Therapy of metastatic bone pain. J Nucl Med. 2001;42(6):895-906.
67. Blake GM, Zivanovic MA, Blaquiere RM, Fine DR, McEwan AJ, Ackery DM. Strontium-89 therapy: measurement of absorbed dose to skeletal metastases. J Nucl Med. 1988;29(4):549-57.
68. Lewington VJ, McEwan AJ, Ackery DM, Bayly RJ, Keeling DH, Macleod PM, et al. A prospective randomized double-blind crossover study to examine the efficacy of strontium-89 in pain palliation in patients with advanced prostate cancer metastatic to bone. European J Cancer. 1991;27(8):954-8.
69. Porter AT, McEwan AJ. Strontium-89 as an adjuvant to external beam radiation improves pain relief and delays disease progression in advanced prostate cancer: results of a randomized controlled trial. Seminars in Oncology. 1993;20(3 Suppl 2):38-43.
70. Buchali K, Correns HJ, Schuerer M, Schnorr D, Lips H, Sydow K. Results of a double blind study of 89-strontium therapy of skeletal metastases of prostatic carcinoma. European J Nucl Med. 1988;14(7-8):349-51.
71. Robinson RG, Blake GM, Preston DF. Stromtium-89: treatment results and kinetics in patients with painful metastatic prostate and breast cancer in bone. Radiographics. 1989;9(2):271.
72. Giammarile F, Mognetti T, Blondet C, Desuzinges C, Chauvot P. Bone pain palliation with 85Sr therapy. J NucI Med. 1999;40(4):585-90.
73. Breen SL, Powet JE, Porter AT. Dose estimation in strontium-89 radiotherapy of metastatic prostatic carcinoma. J Nucl Med. 1992;33(7):1316-23.
74. Charkes ND. Some differences between bone scans made with 87mSr and 85Sr. J Nucl Med. 1968;10(7):491-4.
75. Meeuse JJ, Van der Linden YM, Van Tienhoven G, Gans ROB, Leer JW, Reyners AKL, et al. Efficacy of radiotherapy for painful bone metastases during the last 12 weeks of life. Cancer. 2010;116(11):2716-25.
76. Rutty Sola GA, Arguelles MG, Bottazzini DL, Furnari JC, Gómez Parada I, Rojo A, et al. Lutetium-177-EDTMP for bone pain palliation. Preparation, biodistribution and pre-clinical studies. Radiochimi Acta. 2000;88(3-4):157.
77. Chakraborty S, Das T, Banerjee S, Balogh L, Chaudhari PR, Sarma HD, et al. 177Lu-EDTMP: a viable bone pain palliative in skeletal metastasis. Cancer Biother Radiopharm. 2008;23(2):202-13.
78. Chang Y, Jeong J, Lee YS, Kim Y, Lee D, Chung JK, et al. Comparison of potential bone pain palliation agents Lu-177-EDTMP and Lu-177-DOTMP. J Nucl Med. 2008;49(1):93.
79. Puerta Yepes N, Pérez J, Nevares N, Zapata A, López Bularte A, Rojo A et al. 177LU-EDTMP: Estudio biocinético y dosimétrico de un kit de producción local de 177Lu-EDTMP para su uso como agente paliativo del dolor. Alasbimn J. 2001;53(13). ISSN: 0717-4055. Disponible en: http://www.alasbimnjournal.net/a/52
80. Vuèina J, Lukiæ D. Radionuclidic generators for the production of Technetium-99m and Rhenium-188 UDC 539.1. Physics, Chemistry Technology. 2002;2(4):235-43.
81. Savio E, Gaudiano J, Robles A, Balter H, Paolino A, López A, et al. 188Re-HEDP: Pharmacokinetics characterization, clinical and dosimetric evaluation in osseous metastatic patients with two levels of radiopharmaceutical dose. BMC Nuclear Med. 2001;1:2. Disponible en: http://www.biomedcentral.com/1471-2385/1/2
82. Torres Martin de Rosales R, Finucane C, Foster J, Mather SJ, Blower PJ. 188 Re (CO)3-dipicolylaminealendronate: a new bisphosphonate conjugate for the radiotherapy of bone metastases. Bioconjug Chem. 2000;21(5):811-5.
83. Palmedo H, Guhlke S, Bender H, Sartor J, Schoeneich G, Risse J et al. Dose escalation study with rhenium-188 hydroxyethylidene diphosphonate in prostate cancer patients with osseous metastases. Eur J Nucl Med. 2000;27(2):123-30.
84. Maxon HR, Schroder LE. Rhenium-186 (Sn) HEDP for Treatment of Painful Osseous Metastases: Results of a Double-blind Crossover Comparison with Placebo. J Nucl Med. 1991;32(10):1077-881.
85. Liepe K, Franke WG, Kropp J, Koch R, Runge R, Hliscs R. Comparison of rhenium-188, rhenium-186-HEDP and strontium-89 in palliation of painful bone metastases. Nuklearmedizin. 2000;39(6):146-51.
86. Torres L, Coca M, Batista J, Casaco A, López G, García I, et al. Biodistribution and internal dosimetry of the 188Re-labelled humanized monoclonal antibody anti-epidemal growth factor receptor, nimotuzumab, in the locoregional treatment of malignant gliomas. Nucl Med Comm. 2008;29(1):66-75.
87. Nair N. Relative efficacy of 32P and 89Sr in palliation in skeletal metastases. J Nucl Med. 1999;40(2):256-61.
88. Ziessman HA, O´Malley JP, Thrall JH. Medicina nuclear: los requisitos en radiología. 3ra ed. Madrid: Ed. Elsevier; 2007. p. 296-8.
89. Cruz Arencibia J, García Rodríguez E, Sagarra Veranes M, Morín Zorrilla J. Radiofármacos en radiosinoviortesis. Nucleus. 2010;47. ISSN 0864-084X.
90. Bishayee A, Rao DV, Srivastava SC. Marrow-spaing effects of 117mSn (4+) diethylenetriaminepentaacetic acid for radionuclide therapy of bone cancer. J Nucl Med. 2000;41(12):2043-50.
Recibido: 11 de enero de 2012.
Aprobado: 9 de julio de 2012.
Daylín Hernández Falcón. Centro Nacional de Investigaciones Científicas. Avenida 25, Esq. 158. AP 6214, Cubanacán, Playa. La Habana, Cuba. Correos electrónicos: daylin.hernandez@cnic.edu.cu; nuclear@fpais.sld.cu; oscar.ledea@cnic.edu.cu