Introducción
Los protozoarios del género Acanthamoeba son amebas de vida libre que presentan dos etapas dentro de su ciclo evolutivo: el trofozoito, que es la forma activa, y el quiste, que es una forma latente con poca actividad metabólica. Este microrganismo se encuentra ampliamente distribuido en la naturaleza y cuando entra en contacto con los seres humanos puede causar infecciones graves como la queratitis amebiana (QA) y la encefalitis amebiana granulomatosa.1
La queratitis causada por Acanthamoeba spp. es una infección grave de la córnea, muy dolorosa, que presenta síntomas como fotofobia, enrojecimiento y lagrimeo. Puede llevar a la pérdida de la visión si no es diagnosticada y tratada a tiempo. La enfermedad puede desarrollarse en personas inmunocompetentes y el factor de riesgo principal es el uso de lentes de contacto (LC), que sirven como vehículo para transportar el parásito a la córnea. Las LC se contaminan por malos hábitos como exposición al agua, ya sea en la ducha, en las piscinas, en el lavado o en el almacenamiento de LC al agua.2,3,4
La QA es considerada una enfermedad rara. Sin embargo, su frecuencia en la última década ha aumentado por el incremento de usuarios de LC y la exposición a factores de riesgo en estos. Se estima una prevalencia de 1,2 por millón de adultos y con cifras que varían de 0,2 a 2 por cada 100 000 usuarios de LC por año en países como EE.UU. y el Reino Unido. Las características de la patología hacen que el diagnóstico se alcance cuando el daño ya es severo. Otro factor que contribuye al diagnóstico tardío es el retraso de la consulta médica por parte de los pacientes usuarios de LC que están acostumbrados a pequeñas molestias en los ojos.1,3,5)
El cuadro clínico es un dato poco específico y poco orientativo para el diagnóstico de la enfermedad, ya que puede confundirse fácilmente con queratitis causada por herpes, hongos o bacterias, por lo que el estudio del laboratorio es fundamental para determinar de forma precisa la etiología. Se debe tener en cuenta que la enfermedad puede desarrollarse como una queratitis de etiología mixta, razón de los casos de diagnósticos erróneos.2,3,6
El diagnóstico se realiza a partir de hisopados o raspados de la lesión corneal; sin embargo, las LC o la solución de estos pueden ayudar al diagnóstico. Los métodos convencionales de diagnóstico incluyen el examen microscópico directo de raspaduras corneales, tinción con ácido periódico de Schiff, hematoxilina eosina, Giemsa y naranja de acridina. El cultivo en agar no nutritivo superpuesto con Escherichia coli es el estándar de oro para el diagnóstico de QA. Sin embargo, los métodos convencionales carecen de sensibilidad, son muy dependientes del observador y en el caso del cultivo se requiere un seguimiento muy largo con un periodo mínimo de seguimiento de 7 a 10 días, lo cual retrasa significativamente el diagnóstico.7
Los métodos moleculares, como las técnicas de reacción en cadena de la polimerasa (PCR), son ampliamente utilizados con fines diagnósticos, los cuales ofrecen resultados rápidos, sensibles y específicos. Los sistemas de PCR empleados para la detección de la ameba utilizan primers que amplifican el gen de la 18S rRNA de Acanthamoeba. Uno de los sistemas de PCR más utilizados es el descrito por Schroeder y otros, donde utilizan primers (JDP1 y JDP2) que amplifican la región ASA.S1 del gen 18S rRNA, cuyo producto varía de 423 a 551 pb, dependiendo de la especie. Otro sistema de PCR ampliamente utilizado es un sistema de PCR en tiempo real (qPCR) descrito por Qvarnstrom y otros, donde se amplifica una región del gen 18S rRNA cuyo producto amplificado es de 180 pb.8,9
En Paraguay, el único dato publicado sobre Acanthamoeba se limita al reporte de un caso clínico de una usuaria de LC que desarrolló QA, cuyo diagnóstico se realizó por método de cultivo estándar. Sin embargo, no existen datos sobre la frecuencia de Acanthamoeba en usuarios de LC, y el diagnóstico de este microrganismo no forma parte de la rutina de un laboratorio microbiológico; por tanto, no se cuenta con un protocolo estandarizado para la detección del parásito a nivel nacional, lo que genera una necesidad de métodos de diagnóstico que permitan detectar a la ameba en casos sospechosos.10
El objetivo de este trabajo fue estandarizar una técnica de reacción en cadena de la polimerasa en tiempo real para la detección del parásito e identificar Acanthamoeba en líquidos conservantes de lentes de contacto.
Métodos
El diseño del presente estudio fue observacional descriptivo transversal de casos consecutivos. La población enfocada hace referencia a usuarios sanos de LC y como población accesible se incluyeron usuarios sanos de LC de ambos uno y otro sexo, mayores de 18 años y que participaron de forma voluntaria expresada por la firma del consentimiento informado. Fueron excluidos los usuarios de LC que presentaron alguna patología ocular previa, así como aquellos que se encontraban bajo algún tratamiento ocular al momento del estudio. La cantidad total de participantes fue de 110, los cuales entregaron su líquido conservante usado para el análisis de laboratorio.
Colección de muestras
Los líquidos de conservación de LC fueron colectados en frasco estéril e identificados con un código para resguardar la identidad de los participantes. La muestra colectada se derivó al laboratorio de microbiología del Instituto de Investigaciones en Ciencias de la Salud (IICS) para su procesamiento. El líquido conservante se fraccionó en dos alícuotas, uno para el estudio molecular y otro para el cultivo.
Cultivo de Acanthamoeba
Las alícuotas destinadas para el cultivo fueron concentradas por centrifugación a 2 500 rpm. Se realizó examen del sedimento en fresco y se observó entre lámina y laminilla a 40X en búsqueda de quistes o trofozoitos. El resto del sedimento se cultivó en tubos que contenían medio agar no nutritivo sembradas con cepas ATCC 35218 de E. coli. El método utilizado fue el descrito por Pérez Irezábal y otros.11 Los tubos fueron incubados a 35 ºC y se realizó un seguimiento de seis semanas a cada muestra.
Extracción de ADN
Las alícuotas del líquido conservante destinadas a extracción de ADN fueron centrifugadas a 13 000 rpm por 10 minutos. Se descartó el sobrenadante, y el sedimento fue sometido a la extracción de ADN con el kit comercial Wizard® Genomic DNA (PROMEGA, EE.UU.), siguiendo las instrucciones del fabricante. Del mismo modo, aquellas muestras con cultivo positivo para Acanthamoeba se sometieron a extracción de ADN para su estudio molecular.
Reacción en cadena de la polimerasa en tiempo real
Para la estandarización de la técnica de qPCR se empleó ADN de Acanthamoeba sintetizado comercialmente (CP1) y ADN de Acanthamoeba aislado del cultivo de un caso de queratitis (CP2), empleando como mezcla de reacción SYBR®Green PCR Kit (Qiagen, Germany) y el termociclador Mic qPCR Cycler de Bio Molecular Systems (EE.UU.) y su software correspondiente para el análisis de curvas de fluorescencia. El protocolo empleado en este trabajo fue el descrito por Qvarnstrom y otros, utilizando primers Acant F (CCCAGATCGTTTACCGTGAA) y Acant R (TAACCTGCTAAATAGTCATGCCAAT). Para validar la calidad de las muestras recolectadas se realizó la detección de trazas de ADN humano en el líquido conservante, para el cual se amplificó el gen humano GAPDH, que sirve como control interno. Para este fin se emplearon primers Gap F (CCACCCATGGCAAATTCC) y Gap R (ATGGGATTTCCATTGATGACAAG). Aquellas muestras en las que no se detectó ADN humano fueron excluidas del estudio.9
Resultados
Las muestras recolectadas fueron sometidas al análisis del gen GAPDH. En 92/110 se detectaron trazas de ADN humano, las cuales fueron incluidas en este estudio para realizar el screening de Acanthamoeba (Fig. 1).
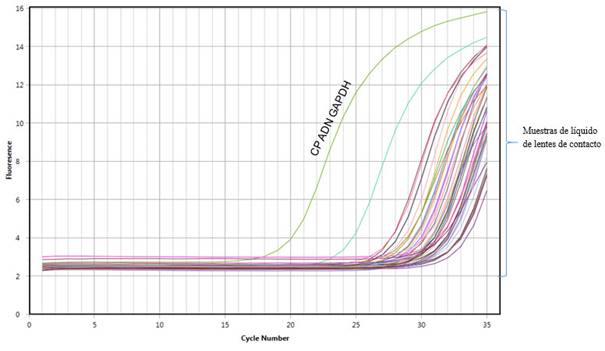
Fig. 1 Reacción en cadena de la polimerasa en tiempo real. Curvas de amplificación del gen humano GAPDH en muestras del líquido conservante de lentes de contacto.
Todas las muestras fueron procesadas por cultivo y en el 100 % de estas el examen en fresco fue negativo. Sin embargo, se obtuvo una muestra positiva para Acanthamoeba (1 %) posterior al cultivo; se observaron quistes y trofozoitos a las 48 horas de incubación en la muestra codificada como A77. Todas las muestras tuvieron un seguimiento de 6 semanas y las que fueron consideradas como negativas si tras ese periodo no se observaron quistes o trofozoitos.
La estandarización de la qPCR fue exitosa empleando las muestras control y para determinar la sensibilidad del método se amplificaron diluciones seriadas del CP1 previamente cuantificado por absorbancia ultravioleta (UV). En total se emplearon nueve diluciones con concentraciones desde 18 400 pg/µL hasta 0,25 pg/µL. Se obtuvo amplificación hasta la dilución que contenía 1 pg/µL y al realizar el análisis de la curva de melting no se observaron reacciones inespecíficas o dímeros de primers (Fig. 2).
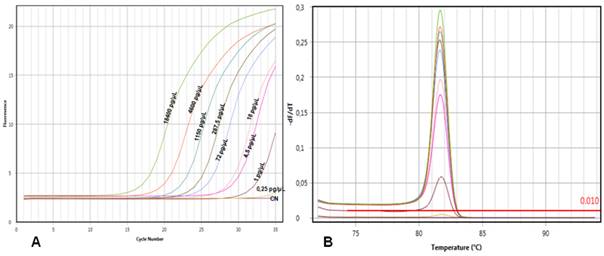
Fig. 2 Sensibilidad de la reacción en cadena de la polimerasa en tiempo real, sistema Qvarnstrom. A) Curvas de amplificación de distintas diluciones de ADN de síntesis comercial de Acanthamoeba. B) Curvas de melting.
Con los valores del ciclo umbral (cycle threshold - CT) y las concentraciones de las distintas diluciones se construyó una curva de calibración, la cual permitió establecer el punto de corte para la interpretación de los resultados por qPCR. El punto de corte fue un CT de 30 (Fig. 3).

Fig. 3 Curva de calibración de la reacción en cadena de la polimerasa en tiempo real del sistema Qvarnstrom realizado con distintas diluciones de ADN de síntesis comercial.
El análisis por qPCR del total de muestras del líquido conservante permitió detectar el aumento de la fluorescencia de forma tardía en la muestra A77 con CT de 31,50. Sin embargo, la amplificación del ADN obtenido del cultivo de dicha muestra (A77c) mostró un aumento exponencial de la fluorescencia con un CT de 16,54. Al realizar el análisis de la curva de melting se pudo comprobar que la curva amplificada del liquido A77 presenta una Tm muy similar a los controles positivos y que la curva de fluorescencia del ADN obtenido del cultivo presenta una Tm dentro del rango esperado para el producto de interés, con lo cual se confirma que el parásito aislado del cultivo corresponde a Acanthamoeba (Fig. 4).
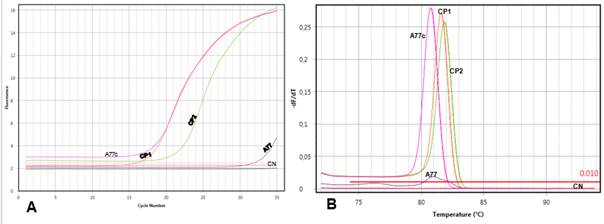
Fig. 4 Reacción en cadena de la polimerasa en tiempo real, sistema Qvarnstrom. A) Curvas de amplificación de la reacción en cadena de la polimerasa a en tiempo real de los controles y del ADN extraído de la muestra A77 del líquido conservante de lentes de contacto y del cultivo. B) Curvas de melting de los productos obtenidos. CP1: Control positivo 1. CP2: Control positivo 2. CN: Control negativo. A77c: ADN obtenido del cultivo de la muestra A77. A77: ADN obtenido del líquido conservante de lentes de contacto.
Discusión
La QA es un problema en el área de la oftalmología en Paraguay por la dificultad en su diagnóstico etiológico, lo cual responde a su sintomatología inespecífica y a la falta de métodos laboratoriales para la confirmación de los casos con sospecha clínica. La QA es una infección de la córnea muy dolorosa y que amenaza la vista si no se diagnostica y trata a tiempo. En nuestro país la sospecha clínica generalmente aparece por descarte cuando se han eliminado los otros agentes etiológicos, y en consecuencia el tratamiento se inicia meses después del inicio de la infección. De ahí la importancia de este estudio, en el que se estandarizó la qPCR para la identificación de este protozoario, poco frecuente pero devastador cuando causa una infección.
A nivel mundial cada vez se reportan más casos de pacientes afectados por esta patología, con asociación demostrada previamente entre la QA y el uso de LC. El 85 % de los casos reportados se presentan en usuarios de LC y el interés creciente por esta enfermedad responde principalmente a la afectación devastadora que origina en los ojos, la dificultad de su diagnóstico etiológico, el tratamiento prolongado de la enfermedad y el incremento cada vez mayor en el número de usuarios de LC. Se estima que a nivel mundial 70 millones de personas usan lentes de contacto.12,13,14
El diagnóstico de la QA se realiza por observación de quistes o trofozoitos en muestras clínicas, como raspado corneal o biopsia corneal, observación directa del parásito en tejido corneal por microscopia confocal, aislamiento del parásito por método de cultivo o identificación molecular en muestras clínicas. Si bien, el diagnóstico definitivo se realiza a partir de las muestras clínicas, pueden presentarse situaciones en las que no sea posible realizar una toma de muestra corneal, sobre todo cuando la afección es pequeña, y una toma de muestra puede generar una lesión más grande o empeorar la condición del paciente en dichas condiciones cuando se trata de usuarios de LC. El estudio de LC o el líquido conservante puede utilizarse como alternativa para ayudar al diagnóstico, el cual se complementa con los hallazgos clínicos y la sintomatología del paciente.14-16
El cultivo para Acanthamoeba en medio Page superpuesta con E. coli es altamente específico y permite la diferenciación de quistes a trofozoitos, así como también la multiplicación del parásito, lo que permite aumentar la carga parasitaria en la muestra analizada. Este cultivo, a diferencia del cultivo bacteriano, es más complejo y requiere un seguimiento por más tiempo. Dependiendo del estadio del parásito en el momento del cultivo puede tardar de días a semanas en detectarse, y requerir un seguimiento mínimo de 7 a 10 días. Lo ideal es realizar un seguimiento por lo menos 4 semanas, ya que los quistes tardan más en diferenciarse y en multiplicarse que si se encuentra en la forma de trofozoito, que es la forma replicativa del parásito. Por lo tanto, la principal limitación de este método es el tiempo que tarda en detectar el parásito y la baja sensibilidad, que puede variar de 0 a 77 %.
En este trabajo se empleó como control positivo para el cultivo una cepa de Acanthamoeba aislada de un caso de queratitis. Si bien la muestra llevaba 4 años almacenada en el laboratorio, en ella se observaron quistes al realizar el examen en fresco y se logró la diferenciación a trofozoitos, la cual se evidenció a la sexta semana de cultivo. Esto demuestra la gran capacidad de los quistes de Acanthamoeba de permanecer viables por mucho tiempo, lo cual coincide con lo reportado dentro de las características de este parásito y pone de manifiesto su potencial como patógeno.7,11,14,17,18
En este estudio se aisló Acanthamoeba a partir de una muestra (1 %) correspondiente al código A77 por método de cultivo. Si bien la frecuencia encontrada es baja, concuerda con lo esperado, ya que las muestras analizadas corresponden a usuarios sanos y esto coincide con otros estudios que se centran en la búsqueda del parásito en usuarios sanos de LC. La literatura reporta una frecuencia de 1 a 8 % en usuarios asintomáticos. En un estudio realizado por Gomes Dos Santos y otros obtuvieron resultados similares a lo reportado en este trabajo; aislaron el parásito de una sola muestra por el método de cultivo tras analizar 177 muestras de participantes voluntarios, usuarios sanos de lentes de contacto.19,20
La qPCR estandarizado en este trabajo fue descrito por Qvarnstrom y otros. Este sistema es la PCR de referencia del Centro para el Control y Prevención de Enfermedades (CDC) y los cebadores que utiliza fue diseñado a partir de 40 secuencias genéticas parcial o completa de la 18S rRNA de Acanthamoeba. Por lo tanto, permite detectar todas las variantes de Acanthamoeba, ya sean patógenas o ambientales. La detección del gen 18S rRNA con fines diagnósticos es ampliamente utilizado porque es parte de una repetición ribosómica que está presente en múltiples copias en cada célula. Se estima que Acanthamoeba tiene aproximadamente 600 copias de la unidad de repetición ribosómica, lo cual es ideal para ser objetivo diagnóstico para PCR. El sistema estandarizado presenta buena sensibilidad, lo cual fue posible determinar con las diluciones seriadas del CP1, y se logró detectar hasta la concentración de 1 pg/µL. Este resultado concuerda con lo reportado por los autores que determinaron un límite de detección de 0,8 ameba por cantidad total de muestra procesada. Thompson y otros reportaron límites de detección de 0,7 quistes por 10 µL de reacción y 2,3 trofozoitos por 10 µL para el mismo sistema. Teniendo en cuenta que la literatura reporta que el contenido de ADN en una célula de ameba es de 1 a 2 pg, se espera que el sistema estandarizado en este trabajo sea capaz de detectar hasta una ameba por muestra.8,9,21)
Aún con el acceso de qPCR con buena sensibilidad, este no pudo detectar la presencia de Acanthamoeba en el líquido conservante A77, probablemente por la baja carga parasitaria de este como consecuencia de la dilución del parásito en dicho líquido. Si bien se pudo observar un pequeño aumento en la fluorescencia de dicha muestra, esta se dio a un CT muy tardío, mayor a 30, que era el límite para lecturas significativas del sistema según la curva de titulación generada. El análisis de la curva de melting mostró una Tm similar a los controles positivos; sin embargo, consideramos que la muestra fue negativa, centrándonos en el hecho de que el CT excede los límites considerados como óptimos para la lectura de resultados de PCR en tiempo real. Esto muestra una región en la cual el método tendrá limitaciones para distinguir muestras positivas con cargas parasitarias muy bajas. Aquí es donde el método de cultivo muestra sus características de complementación a las técnicas moleculares gracias a la posibilidad de permitir el crecimiento y duplicación del parásito, y por tanto, es la combinación de métodos la que potencia la capacidad de detección.
Por otra parte, es importante considerar que en los líquidos de LC de portadores asintomáticos la carga parasitaria suele ser baja. Sin embargo, se espera que, en los casos de infección, las muestras clínicas presenten mayor carga parasitaria, y aumenten el potencial de ser detectado por qPCR. Con el objetivo de mejorar aún más los límites de sensibilidad de las técnicas moleculares, se podrían estandarizar en el futuro variaciones como PCR anidada o qPCR con sondas marcadas; por ejemplo, las de tipo Taqman. Asimismo, es importante resaltar que los datos laboratoriales siempre van de la mano con datos clínicos, por lo cual el criterio médico es fundamental para el tratamiento en casos sospechosos de infección por este parásito.
Es probable que la qPCR no haya podido detectar el parásito en la muestra A77, por la baja carga parasitaria que puede predisponer al efecto estocástico en el momento de la alícuota a ser procesada para la extracción de ADN. Si bien los métodos moleculares son altamente específicos, tienen limitaciones como todos los métodos diagnósticos, sobre todo cuando la cantidad de ADN presente en la muestra es muy baja o se encuentra diluida en grandes volúmenes de líquido conservante.
La detección del gen humano como de la albúmina, la β-globina o GAPDH son ampliamente utilizados como control interno en los sistemas de PCR. En este trabajo se estandarizó la detección del gen GAPDH humano como control interno, la cual nos permitió validar las muestras recolectadas para el estudio. Del mismo modo, la amplificación de este gen podrá ser evaluada en las muestras de raspadura corneal, lo cual va a permitir informar a los médicos sobre la calidad de las raspaduras corneales y, por lo tanto, optimizar la interpretación de los resultados emitidos.16,22,23
Contar con técnicas moleculares como la qPCR para la detección de Acanthamoeba a nivel nacional permitirá un diagnóstico etiológico más preciso para aquellos casos con sospecha de QA. La qPCR presenta ventajas sobre el método de cultivo, ya que nos permite detectar el parásito en dos días teniendo en cuenta el tiempo de extracción de ADN, la reacción dura aproximadamente 40 minutos y no se realiza una manipulación posterior a la amplificación; por lo tanto, no se corre el riesgo de contaminación por amplificaciones. Otra ventaja que presenta es que permite estimar la carga parasitaria por medio de la curva de calibración. En un futuro próximo esperamos que estas herramientas también puedan ser de utilidad en otras áreas como en el estudio de la prevalencia de este patógeno en muestras ambientales o en otro tipo de muestras clínicas, como en casos de patologías tan graves como la encefalitis amebiana granulomatosa.
Como conclusión, se logró la estandarización de un sistema de qPCR para la detección de Acanthamoeba a partir de muestras control. El sistema estandarizado presenta buena sensibilidad y podrá ser incorporado a los laboratorios que cuentan con acceso a equipos de qPCR para un diagnóstico rápido y más eficiente en casos de sospechas de QA. Recomendamos el uso combinado de métodos moleculares y cultivo para aumentar la potencia del diagnóstico, sobre todo en muestras donde la carga parasitaria es muy baja.














