Introducción
El glaucoma es una neuropatía óptica progresiva, en la que se producen cambios estructurales a nivel del nervio óptico (ONH) y la capa de fibra nerviosa retiniana (CFNR), que se traducen en una pérdida del campo visual (CV).1) Sin embargo, el proceso subyacente de la enfermedad es la pérdida de células ganglionares de la retina (CGR). Cuando se detecta un defecto visual glaucomatoso, aproximadamente el 28 % de las CGR2) y el 17 % del grosor de la CFNR3 se han dañado irreversiblemente.
A medida que nuestro conocimiento sobre el glaucoma ha evolucionado, también lo han hecho nuestras herramientas. La tomografía de coherencia óptica (OCT) ha continuado agregando parámetros para ayudar en la detección y manejo del glaucoma. Actualmente, la medida más utilizada para el diagnóstico clínico de este es la CFNR peripapilar.4,5 Sin embargo, recientemente se ha considerado primordial la detección del daño macular, a través del estudio del complejo de células ganglionares (CCG), que ha sido implicado en la fisiopatología y en el diagnóstico temprano de esta enfermedad.6,7,8,9
Antecedentes
Aunque nuestra comprensión acerca del glaucoma aumenta cada año, todavía hay una serie de conceptos erróneos sobre la enfermedad. Uno de los más importantes tienen que ver con el papel de la mácula en el daño glaucomatoso.
En general, los oftalmólogos que tratan el glaucoma no han prestado mucha atención a la mácula, porque se ha aceptado ampliamente que el glaucoma afecta principalmente la visión periférica de un individuo. Ese mito se perpetuó en el pasado porque la perimetría de Goldmann no permitía detectar pequeñas cantidades de pérdida de visión central. Además, antes del advenimiento de la OCT, no teníamos forma de analizar la condición de la estructura macular. Entonces, los oftalmólogos se enfocaron en la topografía del nervio óptico y los 30 grados centrales del campo visual.
Otra discrepancia ha sido la creencia de que el daño al campo visual central (y las CGR correspondientes) ocurre tarde en esta enfermedad, pero la tecnología actual ha revelado que algunos defectos maculares ocurren muy temprano en el proceso de esta. Además, pueden socavar significativamente la calidad de vida del paciente.
Función de la mácula
La mácula es la región dentro de ± 8° de la fijación central, que representa solo el 2 % del área retiniana.10 Esta región es vital para las tareas visuales cotidianas, como leer, conducir y reconocer rostros.
Zeimer y otros plantearon la hipótesis de que la pérdida de CGR en el glaucoma temprano es más probable que ocurra en esta estructura.11 Identificar un método preciso para medir esta pérdida permitiría la detección temprana del glaucoma y el monitoreo de su progresión.
La mácula ofrece una ventaja teórica sobre otras regiones a este respecto, dado que allí están concentradas y dispuestas en capas múltiples más del 50 % de todas las CGR, que es donde sucede el daño glaucomatoso; además, los cuerpos de las CGR tienen de 10 a 20 veces el diámetro de sus axones,10) y sus medidas son menos variables que las relacionadas con el nervio óptico, o incluso la CFNR peripapilar.2
Las 3 capas que nos interesan son las que comprenden lo que se ha denominado CCG (Fig. 1), que representa del 30 al 35 % del grosor total de la retina e incluye las 3 capas más internas de la mácula: la capa de fibra nerviosa de la retina (CFNRm), la capa de células del ganglio macular (GCLm) y la capa plexiforme interna (IPLm). Estas capas contienen respectivamente los axones, los cuerpos celulares y las dendritas de las CGR. 4
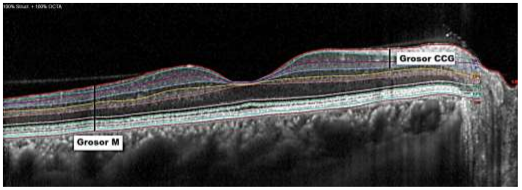
Fig. 1 Exploración mediante tomografía de coherencia óptica del dominio espectral de la mácula. El grosor de las células ganglionares está unido anteriormente por la línea roja (membrana limitante interna) y posteriormente por la línea azul (límite de la capa plexiforme interna). El grosor macular total (grosor M) está unido anteriormente por la membrana limitante interna (línea roja) y posteriormente por el epitelio pigmentario de la retina.
La evidencia reciente sugiere que el daño macular es común en ojos con glaucoma, especialmente en estadios iniciales de la enfermedad;12,13,14,15 y se puede presentar en forma de defectos locales arqueados, daño generalizado/difuso o una combinación de ambos.15
Zona de vulnerabilidad
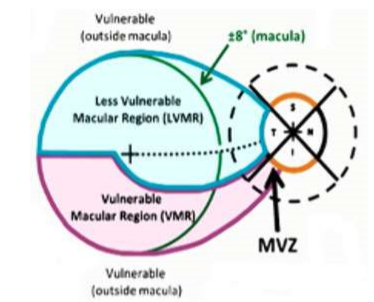
La relación estructura-función del daño glaucomatoso a la mácula ha sido descrita en detalle por Don Hood, de la Universidad de Columbia.12,13,14 La región más susceptible del disco óptico se ha denominado zona de vulnerabilidad macular de Hood. Tiene aproximadamente 27 grados de ancho y se encuentra dentro de los 8 grados más centrales a la parte más inferior (región paracentral inferior). Esto constituye la proyección en la mácula del daño a la región infero-temporal de la papila óptica, que se traduce en un déficit paracentral de campo visual. Esta correlación ha sido confirmada por datos del estudio ADAGES (African Descent and Glaucoma Evaluation Study),16 que encontró que una hemorragia en el disco inferotemporal está asociada a un déficit del campo visual central.
Las CGR en las regiones de la mácula que son más vulnerables al daño glaucomatoso (mácula inferior y región fuera de los 8 grados centrales de la mácula) se proyectan en los cuadrantes inferior y superior del disco óptico.13,15
No todas las partes de la mácula son igualmente vulnerables al daño glaucomatoso. Las CGR en las regiones menos vulnerables (mácula superior) se proyectan a la región temporal del disco (Fig. 2). Esto es importante, ya que los cuadrantes superior e inferior de la papila son los más vulnerables al daño glaucomatoso, mientras que el cuadrante temporal, conocido también como haz papilomacular, se afecta menos. Como resultado, esta parte de la mácula tiende a ser la última en perder la visión, lo que le permite a personas con glaucoma avanzado conservar la visión central hasta estadios muy avanzados de la enfermedad.17
Correlación entre el campo visual y el grosor macular
El glaucoma incipiente afecta a la mácula, pero este daño puede subestimarse o quedar infradiagnosticado con los campos visuales convencionales. Los patrones de prueba 24-2 y 30-2 son los de uso más común para diagnosticar y controlar el glaucoma. En estos patrones, los puntos de prueba están separados 6 grados, y solo cuatro ubicaciones de prueba (sin incluir el punto foveal central) corresponden a la mácula central. Hood y otros han demostrado que puede ocurrir un daño considerable entre estos puntos de prueba y pasarse por alto, o aparecer solo como una depresión leve.15 Puede suceder que hasta el 50 % de los pacientes con un defecto medio-moderado en el campo visual 24-2 presenten defectos en los 3º centrales.18
Es conocido que cuando hay un daño periférico se han perdido muchas células, pero si ese daño es central, por cada 3 decibeles que se pierden en un daño paracentral se ha perdido el 70 % de las células ganglionares.1
Protocolos de espesor macular
Existen 4 protocolos de espesor macular derivados de la OCT disponibles en el mercado, que ahora se utilizan para complementar las mediciones de CFNR y ONH en el diagnóstico y seguimiento de glaucoma. Los dispositivos difieren en las áreas muestreadas, así como en las capas que evalúan:
RTVue FD-OCT Optovue. Realiza un análisis del CCG. Brinda un mapa de grosor y de significancia codificado por colores. Además, una tabla resumen proporciona valores del grosor promedio, superior e inferior de este complejo.
Spectralis SD-OCT (Heidelberg Engineering, Inc., Heidelberg, Alemania): Incorpora el análisis de asimetría del polo posterior, que permite cuantificar de forma independiente todas las capas retinianas en la mácula, incluidas las mediciones separadas de las 3 capas más afectadas por el glaucoma: CFNRm, GCLm y IPLm. La forma en que este tipo de análisis aislado de células ganglionares mejora la capacidad diagnóstica glaucomatosa sigue sin estar clara.
Para interpretar correctamente este protocolo, debemos comprobar el mapa de color y el gráfico de escala de grises, en busca de cualquier asimetría entre el hemisferio superior e inferior. La OCT compara el grosor entre las mitades superior e inferior de la mácula. Normalmente, la mitad inferior tiene un grosor mayor (Fig. 3).
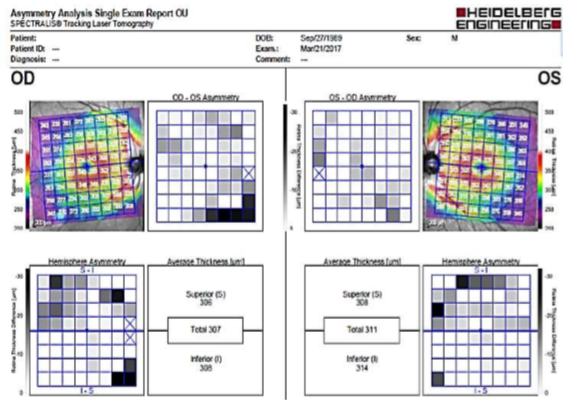
Fig. 3 Se muestra en la imagen de asimetría del hemisferio cómo el grosor macular inferior sigue un patrón típicamente arciforme, muy sugestivo de glaucoma. El mapa de grosor aparece en rojo/naranja a lo largo de los bloques de fibras nerviosas temporal superior e inferior, así como a lo largo de la capa de células ganglionares (anillo rojo), alrededor de la fóvea. La misma fóvea, así como la retina periférica, aparecen en color morado, provocado por valores fisiológicamente más delgados. Los cuadrados grises representan áreas más delgadas que en el hemisferio contrario. Se observan asimetrías que se presentan en patrones de arcos y conectadas.
El principal problema de este parámetro, es que no mide específicamente el CCG, que es el que se afecta en el glaucoma, sino todo el espesor de la mácula. Así que pudiera aparecer reducido en trastornos que afecten las capas externas de la retina, lo que podría actuar como un factor de confusión al evaluar la presencia de daño glaucomatoso.20
Cirrus HD-OCT Ganglion Cell Analysis (GCA) (Carl Zeiss Meditec, Inc.): Segmenta automáticamente las células ganglionares y las capas plexiformes internas (GC-IPL) de las capas retinianas restantes, pero omite la CFNR. Posteriormente, el sistema mide el grosor de estas dos capas retinianas dentro de un área de anillo elíptico (radio vertical de 2 mm, radio horizontal de 2,4 mm) de 14,13 mm, centrado en la fóvea, que corresponde al área de mayor densidad de CGR (Fig. 4).
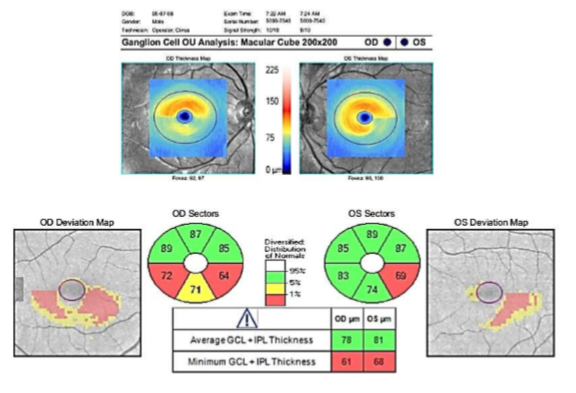
Fig. 4 El protocolo Cirrus HD-OCT macular cube 200 × 200 proporciona un grosor regional GC-IPL en seis sectores en forma de cuña. Los valores de GC-IPL macular se muestran en un mapa de grosor codificado por color en el que los colores "más cálidos" representan valores más gruesos, y los colores "más fríos" representan valores más delgados.
Topcon Maestro 3D OCT-1: Se introdujo en el mercado de EE.UU. en el año 2013. Ofrece tanto un escaneo de CCG como de GC-IPL.21) Se ha demostrado que la obtención de imágenes del CCG mejora la precisión diagnóstica en el glaucoma en comparación con el grosor macular total y funciona muy bien en comparación con la exploración CFNR.6,7,8,9
Es importante remarcar que los valores de grosor no deben ser comparados entre OCT diferentes, ya que cada uno tiene sus propias referencias anatómicas y estas no siempre tienen que coincidir.
Tomografía de coherencia óptica macular en la práctica clínica
El grosor macular es una medida altamente reproducible en OCT con coeficientes de variación intravisita e intervisita de < 1 %.12) A continuación se detalla su uso en la práctica clínica:
Diagnóstico
Detectar o confirmar daño glaucomatoso precoz. Es muy sensible en hipertensos oculares,22 sospecha de glaucoma6 y glaucoma de tensión normal.4,22 En el caso de la plataforma Spectralis, puede usarse como una métrica: el grosor macular general, la asimetría entre ojos, la progresión a lo largo del tiempo, así como los patrones arqueados de pérdida de CFNR que se extienden desde la mácula hacia la ONH. Solo en el glaucoma, el cambio del grosor macular es típicamente arciforme; no adquiere esta disposición cuando se afecta por otras enfermedades.11 En el caso del sistema CIRRUS, recomendamos identificar en el patrón de células ganglionares formas típicas, denominadas “en caparazón de caracol”. Son formas típicas de los defectos que vemos en la zona inferior.23 .Es importante señalar que cuantificar la pérdida de CGR en la mácula permite la detección temprana del daño glaucomatoso, en algunos casos incluso 5 años antes de que se pueda detectar el daño funcional.2
Realizar diagnóstico en casos especiales. Ha demostrado utilidad en algunos discos difíciles o situaciones especiales. En niños con glaucoma, el uso del OCT es atractivo, y se han demostrado medidas de grosor macular más bajas, que reflejan el rendimiento de la CFNR peripapilar.24 El hallazgo anterior es especialmente importante, porque generalmente en este grupo no se obtienen campos visuales confiables.
Los miopes presentan varios desafíos, ya que pueden tener cambios no progresivos en el campo visual debido a una papila oblícua, coloboma del nervio óptico o estafiloma del polo posterior.7 ) Además, la atrofia peripapilar, la esquisis retiniana y la tracción vítrea dan como resultado mediciones poco confiables de CFNR o se asocian a un mayor número de falsos negativos, en los que la CFNR sale absolutamente normal.8 Se ha demostrado que los mapas de grosor macular en tales ojos son útiles en la detección y manejo del glaucoma, porque contrario a la gran variabilidad que existe en la región peripapilar, la anatomía de la mácula permanece constante, salvo que exista alguna otra patología que la distorsione. También es útil en pacientes con mala fijación central.24
Identificar neuropatías ópticas no glaucomatosas. Debemos pensar que no estamos frente a un glaucoma cuando hay una incongruencia entre el aspecto del nervio y lo que estamos viendo en las células ganglionares; ante la presencia de patrones atípicos, sobre todo respeto del meridiano vertical; y si está asociado a algunos otros síntomas que no se corresponden con glaucoma.
Progresión
Se define como progresión un cambio mayor que la variabilidad esperada para el parámetro y la prueba concreta que se está utilizando.25 La detección de la progresión del glaucoma con OCT sigue siendo un desafío porque al evaluar los cambios estructurales a lo largo del tiempo es difícil discriminar entre el daño estructural glaucomatoso y la variabilidad de la medición o la pérdida estructural relacionada con la edad. En este sentido, el OCT macular abre otras posibilidades, por lo que es útil con más rapidez en la enfermedad o ya en los estadios muy avanzados.
En glaucomas leves nos va a servir para confirmar, en casos de duda, cuando no estemos seguros de si hay progresión estructural o no. La detección de la progresión en mapas de grosor macular se realiza mediante gráficos de comparación entre mapas en diferentes puntos de tiempo. Las pérdidas glaucomatosas son detectables por su forma arqueada en los mapas de sustracción.9) Esa es la característica típica del glaucoma. Si está en la misma región donde ha cambiado la capa de fibra nerviosa, nos refuerza o confirma que el cambio es muy probablemente causado por glaucoma.
Entre los ojos con glaucoma avanzado, el análisis de CCG puede ser una mejor alternativa sobre el análisis de CFNR para monitorear la progresión.8,9) En estos casos, las mediciones de la CFNR peripapilar no son útiles, por el efecto “suelo”,26) que se ha estimado alrededor de las 50-60 micras (Cirrus), y 40 micras (Spectralis). Sin embargo, la región macular todavía tiene un grosor residual. Eso responde en parte a que, en ojos normales, las células ganglionares se apilan unas seis capas en la mácula. Como resultado, el volumen ocupado por la capa de células ganglionares y la CFNR es considerable en esa ubicación. Eso es lo que hace posible seguir observando allí los cambios.
En un estudio de 98 ojos de 98 pacientes con glaucoma avanzado, Sung y otros27) encontraron que las mediciones de grosor macular medido con SD-OCT mostró tasas de pérdida significativamente más altas en pacientes con enfermedad progresiva versus enfermedad estable. Los investigadores postularon que el paquete papilomacular es más resistente al daño glaucomatoso que el CFNR peripapilar y, por lo tanto, puede continuar mostrando cambios en las últimas etapas de la enfermedad.
El parámetro GC-IPL es el último que alcanza el “suelo o piso”, lo que sugiere que es la medida más informativa para garantizar el monitoreo del glaucoma terminal.25Belghith y otros28 demostraron que en 35 ojos con glaucoma muy avanzado (MD ≤ 21 dB) fotografiados longitudinalmente durante aproximadamente 3,5 años (a intervalos de aproximadamente 6 meses) con el uso del OCT Spectralis, se detectó un cambio significativo en el grosor de GC-IPL en el 31 % de los ojos, en comparación con el 11 y el 5 % para la apertura de la membrana de Bruch-grosor mínimo del anillo (BMO-MRW) y CFNR, respectivamente. Además, en estos ojos muy avanzados la tasa media de cambio de GC-IPL fue significativamente diferente de cero, mientras que este no fue el caso de BMO-MRW y CFNR circumpapilar.
El seguimiento de la progresión con el GC-IPL mínimo, puede estar limitado por su reproducibilidad. Se requiere un cambio de 8 µm como promedio durante dos exámenes para considerar una progresión glaucomatosa.27
Al analizar la tasa de progresión, no existe un estándar para designar una tasa rápida de pérdida promedio de GC-IPL. Como referencia, los investigadores han informado que la tasa de pérdida promedio de GC-IPL es de -0,014 µm/año en pacientes sanos y de -0,57 µm/año en pacientes con glaucoma.5
Es importante recordar el envejecimiento fisiológico, que también se produce en las células ganglionares. En el caso del parámetro más utilizado (GC-IPL), se ha estimado una tasa media de cambio de grosor de -0,318 µm/año.29 Este grupo observó una reducción notable en la proporción de ojos con enfermedad progresiva sobre la base de parámetros maculares después de tener en cuenta este cambio relacionado con la edad.
Artefactos
A pesar de las mejoras en la tecnología del OCT, el facultativo debe ser capaz de interpretar con precisión los datos y conocer los posibles artefactos que pueden introducir un diagnóstico falso positivo o negativo.
La segmentación de la mácula y las medidas del complejo GC-IPL son propensas a errores e interpretaciones erróneas (6-10 % de los casos),8 especialmente cuando hay baja intensidad de señal, edema del nervio óptico o anomalías estructurales en las capas externas de la retina, que afecta la segmentación de las capas internas de esta.
Asrani reporta en un estudio transversal retrospectivo, donde se obtuvieron 131 escaneos de grosor macular, la presencia de artefactos de imagen en el 28,2 % de los casos, y seis de estos artefactos no eran obvios en la impresión final.30) Incluso, entre los ojos sanos, Kim y otros8 encontraron que el 40,4 % tenía artefactos en el análisis de las células ganglionares.
Ser capaz de distinguir el artefacto de la enfermedad verdadera se vuelve imprescindible en el cuidado del paciente y puede evitar realizar investigaciones innecesarias y costosas.
Validación como herramienta diagnóstica
Aunque algunos estudios muestran que el grosor de CFNRm en SD-OCT es menos preciso que la CFNR circumpapilar en el diagnóstico de glaucoma o la detección de glaucoma preperimétrico, los nuevos algoritmos de segmentación han aumentado la utilidad diagnóstica de la evaluación macular.20,21,23 Parámetros, como CFNRm, GC-IPL y CCG, pueden distinguir los ojos glaucomatosos de aquellos de sujetos sanos y puede diferenciar entre glaucoma temprano, moderado y avanzado.25,27,28
Cho y otros31 informaron correlaciones similares entre la sensibilidad media del campo visual, el CCG y el grosor de la CFNR en ojos glaucomatosos. En su informe, encontraron que para defectos tempranos del campo visual, el CCG mostró una capacidad de discriminación comparable con la de los parámetros de la CFNR. Otros estudios demuestran que GC-IPL es mejor parámetro para detectar glaucoma que la CFNR peripapilar en pacientes con afectación central del campo visual.23) Una vez que las pérdidas de CV son evidentes, hay una asociación significativa entre estos y los patrones de defectos de GC-IPL. Además, se ha demostrado GCLm significativamente más delgados en presencia de CV normal en ojos con glaucoma incipiente.31 Esto puede ser evidencia de glaucoma preperimétrico detectado solo por análisis de CCG.
El GC-IPL y el CCG son parámetros más sensibles al daño glaucomatoso temprano en la mácula que el grosor macular total.6,7 También puede funcionar mejor que la CFNR en la enfermedad avanzada.
Entre los parámetros de GC-IPL, el espesor mínimo tuvo un rendimiento diagnóstico superior para detectar los cambios glaucomatosos tempranos localizados que el grosor GC-IPL promedio total.5
Con los resultados actuales de la literatura se podría afirmar que no existen diferencias en la capacidad diagnóstica del grosor de las capas internas de la retina y el grosor de la CFNR peripapilar, así como otros parámetros de la cabeza del nervio óptico. Sin embargo, algunos estudios afirman que el grosor de las capas internas de la retina podrían ser un parámetro mejor para detectar el daño glaucomatoso en la mácula,12,13 mientras que la CFNR peripapilar podría ser mejor para detectar el daño que se produce fuera de la mácula.5 Por lo tanto, es necesario continuar desarrollando nuevas herramientas de imagen, ya que al día de hoy, la opción que ofrece mejor rentabilidad diagnóstica es la combinación de ambos métodos.5,25
El daño glaucomatoso a la mácula es frecuente y puede ocurrir temprano en la enfermedad. Las imágenes de OCT macular han demostrado ser prometedoras en el diagnóstico precoz y la detección del glaucoma. En los casos en que se obtienen mediciones poco confiables de CFNR, la medición macular es un indicador de diagnóstico superior.
En la mayoría de los estudios la CFNR supera el GCA. Sin embargo, en la actualidad hay una opinión generalizada, de que para optimizar nuestra capacidad de diagnosticar y monitorear el glaucoma debemos combinar a nivel estructural la CFNR y también la mácula. La información que obtenemos es complementaria.