Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. v.25 n.1 La Habana ene.-abr. 2010
BIOLOGÍA DE RAOIELLA INDICA HIRST (Acari: Tenuipalpidae) SOBRE ARECA CATECHU L.
BIOLOGY OF RAOIELLA INDICA HIRST (Acari: Tenuipalpidae) ON ARECA CATECHU L.
G. Flores-Galano*, A. Montoya*, H. Rodríguez**
* Facultad Agroforestal de Montaña (FAM). Centro Universitario de Guantánamo (CUG). El Salvador, Guantánamo, Cuba. correo electrónico: geiser@fam.cug.co.cu; **Grupo Plagas Agrícolas, Dirección de Protección de Plantas. Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, La Habana, Cuba. Correo electrónico: morell_66@censa.edu.cu
RESUMEN
Se estudió la duración del desarrollo y la reproducción de Raoiella indica sobre Areca catechu en condiciones de laboratorio a 25,42±1,21°C de temperatura y 57,54±6,54% de humedad relativa. Se utilizaron secciones de hojas de A. catechu y placas Petri de 10,5 cm de diámetro con algodón humedecido como unidad experimental. Se extrajeron hembras de R. indica de la cría establecida en el laboratorio y se colocaron en una unidad experimental. Se dejaron ovipositar por espacio de cinco horas y seguidamente se retiraron. A partir de ese momento se observaron diariamente y se registraron los cambios de fase y la duración de las mismas. Cuando comenzaron a emerger las larvas, estas se individualizaron hasta la aparición de los adultos, los cuales se observaron hasta su muerte. Se encontró una duración media del desarrollo de 31 días. La mayor duración la presentó la fase de huevo, mientras que la de protoninfa fue la menor. El período de preoviposición tuvo una duración media de 4 días, mientras que el período de oviposición puede durar hasta 17 días, con un valor medio de 11 días, y una longevidad de las hembras de hasta 30 días. El cociente sexual es de 0,56 favorable a las hembras. Se encontró una mortalidad de las fases inmaduras de un 14,6 % para las larvas; 7,3% para las protoninfas y 17,1% para las deutoninfas, lo que representa un 39% de mortalidad del total.
Palabras clave: Raoiella indica; Areca catechu; ácaro rojo de las palmera; duración del desarrollo
ABSTRACT
The development and reproduction of Raoiella indica on Areca catechu were studied under laboratory conditions at 25,42±1,21°C and 57,54±6,54% HR. The experimental units were leaf discs of A. catechu in Petri dishes (10,5 cm diameter) with water-saturated cotton. Gravid females were transferred to experimental unit and allowed to lay eggs for five hours. The duration of each life cycle stages were registered. The larvae that emerged were transferred to individual arenas and observed until adult appearance. The average duration of the life cycle was 31 days. The egg stage was the longest, while that of protonymphs was the shortest. The preoviposition period averaged 4 days, while the oviposition period can last 17 days, with an average of 11 days and a female longevity of 30 days. Sex ratio was 56% females. The mortality of immature stages was: 14,6% for larvae; 7,3% for protonymphs, and 17,1% for deutonymphs, with 39% total mortality.
Key words: Raoiella indica; Areca catechu; red palm mite; development duration
INTRODUCCIÓN
El ácaro rojo de las palmeras, Raoiella indica Hirst (Acari: Tenuipalpidae) se detectó por primera vez en el Caribe en el año 2004 (1). A partir de ese momento ha tenido una rápida distribución por la mayoría de las islas de la región (2,3). En el año 2008 invadió Venezuela (4) y la Florida (5); y en el 2009 se registró en México (6).
Ante esta amenaza, en la última actualización de la lista de Organismos Cuarentenadas para Cuba en el 2007 fue incluida R. indica dentro del grupo A1 por el comportamiento de plaga invasora en nuestra región. En correspondencia con esta decisión, el Centro Nacional de Sanidad Vegetal (CNSV) elaboró una encuesta a inicios del 2007 con el objetivo de lograr la detección temprana del ácaro rojo de las palmeras principalmente en plantas de interés de las familias Musaceae y Arecaceae. Como resultado de dicha encuesta, se detectó la presencia de R. indica en varios municipios de las provincias Guantánamo y Santiago de Cuba (7).
Esta especie invasora causa severas afectaciones en cultivos de interés económico como el cocotero y el plátano, así como en diversas plantas ornamentales (3,5). Por ser un fitófago de reciente introducción es importante conocer su comportamiento biológico en las áreas invadidas. Considerando esta necesidad y los pocos estudios realizado con esta especie en palmeras ornamentales (8), el presente trabajo tiene como objetivo determinar los parámetros biológico fundamentales de R. indica sobre Areca catechu L..
MATERIALES Y MÉTODOS
A partir de poblaciones salvajes procedentes de los muestreos realizados en las áreas verdes de la Facultad Agroforestal de Montaña (FAM) se estableció un cultivo puro de Raoiella indica por el método de sobrevivencia de hojas de A. catechu, en placas Petri de 10,5 cm de diámetro.
Para iniciar el experimento se extrajeron hembras de la cría establecida y se colocaron en una unidad experimental similar a la descrita anteriormente. Se dejaron ovipositar por espacio de cinco horas y seguidamente se retiraron las hembras. Los huevos obtenidos se observaron cada 24 horas y cuando eclosionaron, las larvas se individualizaron con la ayuda de un pincel 00. Se registraron los cambios de fase y la duración de las mismas hasta la emergencia de los adultos. Con estos datos se calculó la duración media del desarrollo, la desviación estándar y los valores máximos y mínimos absolutos, por fase y de huevo a adulto, en días, para ambos sexos y total. Se estimó la relación sexual a través de la expresión: hembra/hembra+macho y se determinó el número de individuos muertos naturalmente para cada fase y total.
Las hembras obtenidas del estudio del desarrollo se mantuvieron individualizadas en las unidades experimentales y se les colocó un macho de la cría durante 24 horas para garantizar la primera cópula. Una vez que se confirmó el apareamiento, se observaron diariamente hasta la muerte de las hembras, registrándose el número de huevos puestos.
Con los datos obtenidos se determinó la duración promedio, la desviación estándar y los valores máximos y mínimos absolutos de los periodos de preoviposición, oviposición, postoviposición y la longevidad de las hembras. Además se determinó la curva de sobrevivencia (% de hembras vivas/día), la fecundidad media y la tasa de oviposición diaria (huevos/hembra/día).
A partir de una cohorte de 55 huevos, se determinó el porcentaje de eclosión. Para ello, los huevos se observaron diariamente, considerándose no viables aquellos que no eclosionaron en un término de 15 días.
RESULTADOS Y DISCUSIÓN
El ácaro rojo de las palmeras tiene cuatro fases de desarrollo: el huevo, la larva con tres pares de patas, y dos estados ninfales, la protoninfa y la deutoninfa, cuatro pares de patas. A partir del huevo el cambio de fase está determinado por la presencia de la exuvia. Las características de cada una de estas fases se relacionan a continuación:
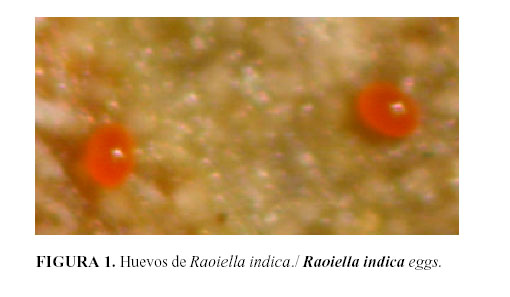
Huevo: Los huevos de R. indica se pueden encontrar de forma aislada o en grupos y presentan una coloración anaranjada (Fig. 1), los mismos recién puestos se adhieren a la superficie de la hoja. Próximos a la eclosión, los huevos adquieren una coloración blanco opaca. Según Hoy et al. (9) presenta en el extremo un filamento que se enrolla y puede tener una gota de agua adherida. Nageshachandra y Channabasavanna (10) describen dicha estructura como un filamento fino, de forma espiralada y con un ápice clavado, con una longitud de 170 a 210 µm.
Larva: El cuerpo de la larva es ovalado y de color rojizo, con movimientos iniciales lentos. Se alimentan generalmente por un período de 3-12 días, antes de comenzar el estado quiescente, que se puede prolongar entre 1-3 días. Nageshachandra y Channabasavanna (10), señalan que el cuerpo puede medir de 120 a 160 µm de largo y de 100 a 120 µm de ancho (Fig. 2).

Protoninfa: Inmediatamente después de la muda, el cuerpo de la protoninfa emerge con cuatro pares de patas. Es de color rojizo, se alimenta por un período de 2-5 días antes de comenzar el período quiescente, el cual puede demorar de 1-4 días. Son de tamaño mayor que las larvas. Hoy et al. (9) señalan que pueden alcanzar un tamaño de 180 a 200 µm de largo y 130 a 140 µm de ancho. La deutoninfa es similar a la fase precedente, pero presenta un tamaño mayor.
Adultos: La etapa quiescente precedente a la fase de adulto es de corta duración. El viejo exoesqueleto se rompe en forma transversal por varios movimientos del cuerpo y el ácaro comienza a quedar libre de la exuvia por sí mismo. El proceso de muda es similar para las diferentes fases de desarrollo.
Las hembras de R. indica tienen el cuerpo de forma oval, de color rojizo, con manchas oscuras sobre la parte dorsal del cuerpo producto a la alimentación. Tienen la región del opistosoma de forma casi cuadrada y hundida en la cara dorsal, posteriormente, su cuerpo se ensancha mucho más que el del macho (Fig. 3). Según Hoy et al. (9) la superficie dorsal es lisa, excepto por la presencia de unas depresiones puntuales. El cuerpo mide de 250 a 320 µm de largo por 190 a 290 µm de ancho (10).

Los machos son de menor tamaño que las hembras y con el opistosoma de forma más aguzada (Fig. 4). Estas características coinciden con la descripción dada por Welbourn (11), quien plantea que los machos tienen la parte posterior del cuerpo más aguzada y son más activos que las hembras. Mendonga et al. (12) destacan que presentan un aedeagus largo y afilado.

Se observó durante el estudio que los machos localizan las deutoninfas de las cuales emergerá una hembra y permanecen junto a ellas hasta que la misma emerge para efectuar la cópula. Al respecto Peña et al. (13), señalan que los machos y las hembras están sexualmente maduros cuando emergen y los machos buscan activamente a las hembras, lo cual sugiere la existencia de una feromona sexual. También refieren que cuando los machos localizan a una deutoninfa hembra en fase quiescente, suelen quedarse cerca de la misma y esperar hasta dos días a que se produzca la muda y copular a la hembra.
La Tabla 1 muestra la duración por fase y total del ciclo de desarrollo para ambos sexos. R. indica necesitó un tiempo relativamente largo para alcanzar la fase de adulto, aproximadamente 31 días. Para ambos sexos la fase de huevo tuvo la mayor duración, representando el 31 % de la duración total; mientras que la de protoninfa fue la menor. De los dos estados ninfales, la deutoninfa demora más, esto es lógico si se considera que en esta fase se producen los cambios morfofisiológicos que darán lugar al adulto. El coeficiente sexual fue de 56% favorable a las hembras. Esta duración del desarrollo es superior a la informada sobre cocotero, donde se señala que el ciclo de las hembras oscila entre 23-28 días y el de los machos de 20-22 días (9).
Con relación a la mortalidad de las fases inmaduras se encontró un 14,6 % para las larvas; 7,3% para las protoninfas y un 17,1% para las deutoninfas, lo que representa un 39% de mortalidad total, lo cual evidencia una baja posibilidad de sobrevivencia de los estados inmaduros de R. indica sobre este hospedante.
La duración en días, de los períodos de preoviposición, oviposición y postoviposición de R. indica se muestran en la Tabla 2. El período de preoviposición tuvo una duración media de 4 días, mientras que el período de oviposición llega a durar en las condiciones evaluadas hasta 17 días, con un valor medio aproximado de 11 días, así como una longevidad de las hembras de hasta 30 días. Estos valores son también inferiores a los informados por Hoy et al. (9), quienes plantean un período de oviposición de 40 días y una longevidad de 48 días, lo cual pudiera estar dado por la influencia de la planta hospedante.
La oviposición comienza, aproximadamente a partir del cuarto día siguiente de la emergencia de las hembras. El número de huevos puestos se incrementa desde el inicio de la oviposición y se mantiene elevado durante los 12 primeros días, momento a partir del cual decrece gradualmente y la hembra deja de ovipositar a los 21 días después del inicio de la puesta. El pico máximo de puesta se produce entre los 5 y 12 días. Los huevos alcanzaron un 91,11% de eclosión. La forma de la curva de sobrevivencia se correspondió con que una proporción importante de hembras viven durante el período de máxima oviposición y luego mueren poco a poco (Fig. 5). Esto se corresponde con una curva intermedia entre el tipo I y II, según señala Vera (14). La mortalidad se incrementó después que las hembras sobrepasaron la fase de máxima oviposición.
La fecundidad media de las hembras fue de 7,0±3,46 huevos, con mínimo de 2 huevos y un máximo de 12. La media general de huevos/hembra/día fue 0,29±0,15 huevos. R. indica presenta reproducción sexual y por partenogénesis arrenotokica, donde los óvulos no fecundados producen solo machos; mientras que los fecundados producen progenie hembra (10). Una hembra puede poner de 1 a 6 huevos diarios, con un promedio de 2 huevos/hembra/día. La fecundidad total puede ser de 27 a 162 huevos/hembra (15). Según Nageshachandra y Channabasavanna (10) las hembras fecundadas ovipositan una media de 22 huevos; mientras que las hembras vírgenes tienen una media de 18,4 huevos.
Los valores de fecundidad encontrados son inferiores a los indicados por otros autores para esta especie. Esto se puede deber a que se colocó solo un macho, y se conoce que varios machos por unidad experimental garantizan la posibilidad de múltiples cópulas, lo cual se considera imprescindible para alcanzar la máxima oviposición en muchas especies de ácaros. También la presencia de varios individuos proporciona un efecto de grupo que puede favorecer la oviposición. Este aspecto debe ser considerado en ensayos posteriores, para garantizar que la especie pueda expresar mejor sus potencialidades reproductivas. Sin embargo, el uso de un solo individuo es también común en estudios biológicos con ácaros.
Existen diversos informes que indican que la A. catechu es una planta hospedante de R. indica, siendo catalogada en la India como plaga de esta palmácea (16), sin embargo, en las condiciones bajo las cuales se realizó este estudio, R. indica no expresó todo su potencial reproductivo, lo cual pudiera estar dado, entre otros factores, por la influencia de la planta hospedante. Estos resultados refuerzan el criterio de diversos especialistas que han señalado la necesidad de profundizar en la determinación de los verdaderos hospedantes de R. indica, pues muchos de ellos solo pudieran ser hospedantes alternativos o transitorios.
REFERENCIAS
1. Fletchmann CHW, Etienne J. The red palm mite, Raoiella indica Hirst, a threat to palms in the Americas (Acari: Prostigmata: Tenuipalpidae). Syst Appl Acarol. 2004;9:109-110.
2. Kane EC, Ochoa R, Mathurin G, Erbe EF. Raoiella indica Hirst (Acari: Tenuipalpidae): An island-shopping mite pest in the Caribbean, 2005. (En línea). (Consultada: 13 jun 2007). Disponible en: http://www.sel.barc.usda.gov/acari/PDF/TrinidadHandout.pdf.
3. Rodrigues JCV, Ochoa R, Kane EC. First report of Raoiella indica Hirst (Acari: Tenuipalpidae) and its damage to coconut palms in Puerto Rico and Culebra Island. Internat J Acarol. 2007;33(1):3-5.
4. Vásquez C, Quirós M, Aponte O, Sandoval MF. First Report of Raoiella indica Hirst (Acari: Tenuipalpidae) in South America. Neotropical Entomology. 2008;37(6):739-740.
5. Peña JE, Mannion C, Howard FW, Hoy MA. Red Palm Mite, Raoiella indica Hirst (Acari: Prostigmata: Tenuipapidae). En: Encyclopedia of Entomology. Capinera J, Editor. Kluwer Academic Publishers, Dordrecht, The Netherlands, 2008.
6. NAPPO. Detecciones del ácaro rojo de la palma (Raoiella indica) en Cancún e Isla Mujeres, Quintana Roo, México. Notificación oficial de Plaga. Publicada 20-11-2009; 2009.
7. de la Torre PE, Suárez A, González AI. Presencia del ácaro Raoiella indica Hirst 1924 (Acari: Tenuipalpidae) en Cuba. Rev Protección Veg. 2010;25(1):1-4.
8. Cocco A, Hoy MA. Feeding, reproduction, and development of the red palm mite (Acari: Tenuipalpidae) on selected palms and banana cultivars in quarantine. Florida Entomologist, 2009;92(2):297-291.
9. Hoy Marjorie A, Peña JE, Nguyen Ru, Featured. EENY-397, 2006. (En línea). (Consultada: 12 jul 2007). Disponible en: http://www.creatures.ifas.ufl.edu/orn/plams/red_palm_mite.htm.
10.Nageshachandra BK, Channabasavanna GP. Development and ecology of Raoiella indica Hirst (Acari: Tenuipalpidae) on coconut. In: Griffiths DA, Bowman CE, Editors. Acarology VI. Ellis Horwood Publishers, Chicester, UK. 1984;2:785-798.
11.Welbourn C. Red palm mite Raoiella indica Hirst (Acari: Tenuipalpidae). Pest Alert, 2005. (En línea). (Consultada: 9 jun 2007). Disponible en http://www.daocs.state.fl.us/pi/enpp/ento/r.indica.html.
12.Mendonça RS, Navia D, Fletchmann CHW. Raoiella indica Hirst (Prostigmata: Tenuipalpidae), o ácaro érmelo das palmeiras- uma ameaça para las Américas. Brasilia: Embrapa Recursos Genéticos e Biotenología, 2005. Documentos 146.
(En línea). (Consultada: 8 jun 2007). Disponible en http://www.cenargen.embrapa.br/publica/trabalhos /doc146.pdf.
13.Peña JE, Mannion CM, Howard FW, Hoy MA. Raoiella indica (Prostigmata: Tenuipapidae): The Red Palm Mite: A potential invasive pest of palms and bananas and other tropical crops of Florida, 2006. University of Florida IFAS Extension, ENY-837 (En línea). (Consultada: 12 jul 2007). Disponible en: http://edis.ifas.ufl.edu/BODY_I N681.
14.Vera G. Técnicas demográficas. Vera J, editor. En: Temas selectos sobre ecología de poblaciones. Tema III: 1990; p. 61-99.
15.Moutia LA. Contribution to the study of some phytophagous acarina and their predators in Mauritius. Bull Entomol Res. 1958;49(1):59-75.
16.Yadav Babu RK, Manjunatha M. Seasonal Incidence of Mite Population in Arecanut. Karnataka J Agric Sci. 2007;20(2):401-402.
(Recibido 14-1-2010; Aceptado 10-3-2010)














