Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.31 no.2 La Habana mayo-ago. 2016
ARTÍCULO ORIGINAL
Actividad inhibitoria de un polímero de quitosana en el crecimiento vegetativo y la reproducción asexual de un aislado de Phytophthora palmivora Butler
Inhibitory activity of a chitosan polymer on vegetative growth and asexual reproduction of an isolate of Phytophthora palmivora Butler
Dianevys González-Peña FundoraI*, Guadalupe Gómez IzaguirreII, Ana Fernández MoralesII, Daymara Vaillant FloresII, Alejandro B. Falcón-RodríguezI
IInstituto Nacional de Ciencias Agrícolas (INCA). Carretera a Tapaste, km 31/2, San José de las Lajas, Mayabeque, Cuba.
IIInstituto de Investigaciones de Sanidad Vegetal (INISAV). Calle 110, No. 514 e/ 5ta B y 5ta F, La Habana, Cuba.
RESUMEN
El objetivo del trabajo fue evaluar el efecto de la quitosana sobre el crecimiento vegetativo y las fases de reproducción asexual del ciclo de vida de Phytophthora palmivora Butler. Soluciones con diferentes concentraciones de quitosana, que oscilaron desde 0,5 hasta 2,5g.l-1 se mezclaron con medio de cultivo V8 antes de verterse en placas Petri, donde luego se inoculó un disco de micelio del aislado. Se evaluaron aspectos morfoculturales y el crecimiento radial cuando las colonias del tratamiento control alcanzaron el extremo de la placa. El diámetro de las colonias del aislado disminuyó con el aumento de los niveles de quitosana en el medio y se alteró el patrón morfocultural de las mismas: exhibieron bordes irregulares y de aspecto arenoso. Sin embargo, los diámetros de las hifas observadas al microscopio óptico no variaron con relación al tratamiento control. Las concentraciones bajas del polímero (0,5 g.l-1) estimularon la formación de esporangios, mientras que el incremento de los niveles de quitosana redujo estos valores. La relación largo-ancho de los esporangios no se afectó por la concentración del compuesto. La germinación indirecta de los esporangios se inhibió con 1,0g.l-1 y se observó un movimiento aberrado de las zoosporas, pues se desplazaban con menor velocidad en presencia de 0,5g.l-1 del polímero. Además, se detuvo el proceso de germinación de los quistes después de haber sido incubados durante 3 horas con 0,5g.l-1 de quitosana.
Palabras clave: Phytophthora palmivora, quitosana, esporulación.
ABSTRACT
The aim was to evaluate the effect of chitosan on the vegetative growth and the asexual reproductive stages of the life cycle of Phytophthora palmivora Butler. Solutions of different chitosan concentrations, ranging from 0.5 to 2.5 g.l-1, were mixed with V8 culture media prior to add into Petri dishes, where a mycelial disc of the isolate was then inoculated. Morphocultural aspects and radial growth were evaluated when colonies from the control treatment reached the edge of the plates. The colony diameter of the isolate decreased with increases of chitosan levels in the culture medium, and the colony morphocultural pattern was altered showing irregular edges and sandy appearance. However, the hypha diameters observed under an optical microscope did not differ from the control treatment. Low polymer concentrations (0.5 g.l-1) stimulated sporangium production, while this was reduced by increases of chitosan levels. Sporangium length/width ratio was not affected by the compound concentration. In addition, the indirect sporangium germination was inhibited at 1g.l-1, and an aberrated zoospores movement was observed, with less speed at 0.5 g.l-1 of the polymer. Moreover, the cyst germination process was stopped after 3 hours of incubation with 0.5 g.l-1 of chitosan.
Key words: Phytophthora palmivora, chitosan, sporulation.
INTRODUCCIÓN
Phytophthora palmivora Butler es un microorganismo de amplia gama de hospedantes que provoca numerosos daños en diversos cultivos, tales como: el cacao (Theobroma cacao L.), la guayaba (Psidium guajava L.), el mango (Mangifera indica L.), la papaya (Carica papaya L.), la palma de aceite (Elaeis spp.) y el aguacate (Persea americana Mill.), entre otros (1, 2). Las enfermedades más importantes asociadas a este patógeno se caracterizan, generalmente, por pudriciones de la raíz, ennegrecimiento y presencia de cancros en los tallos, pudriciones de los frutos y tizón de la hoja (1).
La pudrición negra de la mazorca de cacao es una enfermedad causada por el género Phytophthora, que provoca importantes pérdidas económicas valoradas de hasta el 30% de la producción de cocoa a nivel mundial (3). En Cuba, específicamente en las provincias Granma y Guantánamo, se realizó recientemente un estudió donde se identificó que el 65% de la incidencia de dicha enfermedad, con relación al total de muestras procesadas para detectar hongos y oomycetes, está asociada a P. palmivora como agente causal (4).
El manejo adecuado de las enfermedades causadas por Phytophthora spp. requiere de nuevas alternativas que sean amigables con el ambiente. En este contexto emergen agentes de control biológico y compuestos naturales que se evalúan cada vez con mayor frecuencia. La quitosana constituye una de estas opciones, ya que posee importantes propiedades antimicrobianas, a la vez que induce resistencia sistémica en las plantas y favorece el desarrollo de las mismas (5, 6). También es un compuesto inocuo y biodegradable, que se obtiene de la quitina del exoesqueleto de crustáceos y en Cuba se considera un desecho de la industria pesquera (7, 8).
Se sugiere que la actividad antimicrobiana de la quitosana esté relacionada con su naturaleza policatiónica, dada por la exposición de los grupos aminos desacetilados en condiciones acídicas. Esto puede provocar desestabilización en las membranas de los microorganismos e inducir la lisis celular de diferentes estructuras vegetativas y reproductivas (9, 10).
En los últimos años se desarrollaron diversos estudios relacionados con el efecto de la quitosana sobre diferentes microorganismos; sin embargo, solo algunos trabajos reflejan su interacción con el género Phytophthora y la minoría se relaciona con su fase reproductiva (9, 10, 11). En particular, se desconoce la existencia de ensayos previos en P. palmivora, por lo que el objetivo del presente trabajo fue evaluar la influencia de un polímero de quitosana sobre el crecimiento y la esporulación de este microorganismo.
MATERIALES Y MÉTODOS
Se empleó un polímero de quitosana de 12% de grado de acetilación, que se obtuvo a través de un proceso de desacetilación básica de la quitina (11). Posteriormente, se disolvió en ácido acético al 1% y el pH se ajustó a 5,6 con KOH (2N).
El aislado de P. palmivora (Pp12) se obtuvo de cacao y provino del cepario del Instituto de Investigaciones de Sanidad Vegetal (INISAV). Las placas inoculadas con discos de 1 cm de diámetro y micelio del microorganismo se incubaron a temperatura de 28± 2°C, en condiciones de oscuridad, en medio de cultivo que contenía jugo de verduras V8 (20%), agar (15g.l-1), asparagina (2g.l-1) y carbonato de calcio (2g.l-1), tanto para los ensayos como para su conservación. El pH se ajustó a 5.6 con HCl (2N).
Efecto de la quitosana sobre las colonias e hifas de P. palmivora
Las soluciones de quitosana y el medio de cultivo V8 se esterilizaron por separado y se mezclaron justo antes de verter 20ml en las placas de 9 cm de diámetro para obtener concentraciones finales de quitosana de 0; 0,5; 1,0; 1,5; 2,0 y 2,5g.l-1. Posteriormente, las placas se inocularon con discos de micelio de P. palmivora de 1cm extraídos de la periferia de colonias de cinco días y se incubaron a 27°C en condiciones de oscuridad, a razón de siete placas por tratamiento.
Cada 24 horas, se evaluó el diámetro de las colonias hasta que estas alcanzaron el extremo de la placa, momento en el que se describieron las características morfoculturales del aislado, según refirieron Erwin y Ribeiro (1). Con un micrómetro ocular se midió el diámetro de 15 hifas por cada muestra y se tomaron tres placas por tratamiento que se tiñeron con lactofenol azul.
Número y porcentaje de germinación de esporangios en presencia de quitosana
Se colocaron discos con micelio del aislado Pp12 en placas Petri de 6 cm de diámetro que contenían 5 ml de las diferentes concentraciones de quitosana: 0; 0,5; 1,0; 1,5; 2,0 y 2,5g.l-1. Las placas se incubaron durante 48 horas a 25°C con luz constante.
La formación de esporangios se cuantificó en un microscopio óptico marca Olympus con un aumento de 200X. Con una escala ocular micrométrica se midieron las dimensiones de los esporangios y se calculó su relación largo/ancho, así como su porcentaje de germinación indirecta, en tres campos ópticos por placa, y a su vez, en tres placas por tratamiento.
Movimiento de las zoosporas en soluciones con quitosana
El desplazamiento de las zoosporas se evaluó a través de la estimación cualitativa de los cambios de velocidad y patrón de movimiento de las mismas. Para ello se utilizó la escala establecida por Fernández (12), donde la disminución de signos positivos implicaba la observación de un desplazamiento a menor velocidad.
Enquistamiento y de germinación de quistes incubados con quitosana
Las suspensiones de zoosporas (0,2ml) se mezclaron con diferentes soluciones de quitosana (0,2ml) en tubos eppendorf de 0,5ml, para obtener una concentración final de 0; 0,5; 1,0; 1,5g.l-1.
Se colocaron cuatro gotas de 20µl en dos portaobjetos en cámara húmeda a 27°C (12). Se cuantificó el número de zoosporas en movimiento, enquistadas y germinadas a los 60 y 180 minutos de incubación. Se empleó un microscopio Olympus y un aumento de 1000X. Las zoosporas se consideraron germinadas cuando el tubo germinativo fue superior a las dimensiones del quiste.
Análisis estadístico
En cada experimento se empleó un diseño completamente aleatorizado. Se procesaron los datos de la variable «diámetro de las colonias» a través del análisis de los intervalos de confianza para p£0,05. En los demás casos, los datos se analizaron a través de un ANOVA simple y las medias se compararon mediante la prueba de Tukey con un nivel de significación p£0,05. Para el análisis del porcentaje de germinación de esporangios, los datos se transformaron en arsenÖx. Después de evaluar la normalidad y la homocedasticidad se utilizó la prueba de Tukey para comparar las medias.
Los ensayos se repitieron en dos ocasiones. Los datos se analizaron en el programa estadístico SPSS, versión 15.01 y los gráficos se realizaron en SigmaPlot 2001, versión 7.0.
RESULTADOS Y DISCUSIÓN
Efecto de la quitosana sobre las colonias e hifas de P. palmivora
La quitosana inhibió el desarrollo del micelio del aislado de P. palmivora con relación al control, pues se observó menor crecimiento en aquellos tratamientos que contenían diferentes niveles del polímero (Fig. 1). Se desconoce algún estudio similar con respecto al efecto de la quitosana sobre esta especie y, aunque otros autores reflejan también las propiedades inhibitorias del polímero con similares concentraciones sobre hongos y otros oomycetes, como son Fusarium oxysporum Schltdl, Pythium ultimum Trow, Verticillium dahliae Kleb y Pyricularia grissea Sacc (13, 14), solo algunos trabajos informan resultados para el género Phytophthora (9, 11).
La disminución del diámetro de las colonias estuvo asociada al incremento de la concentración de quitosana en el medio. La mayor inhibición del radio de la colonia se observó para el tratamiento que contenía 2,5g.l-1, donde se observó un efecto fungistático, aunque no fungicida. Estos valores coinciden con los informados por Falcón et al. (11) para P. nicotianae, aunque a diferencia de los autores mencionados, en este estudio no se observó un efecto fungicida a la mayor concentración, lo que sugiere que el aislado empleado en el presente trabajo es más resistente a la presencia de quitosana.
Las colonias de P. palmivora fueron blancas, con bordes regulares, forma estrellada y micelio adherido al sustrato, similar a lo descrito por Machado et al. (15) para casi una centena de aislados de esta especie. La adición de quitosana al medio de cultivo provocó el crecimiento de colonias con bordes irregulares y aspecto arenoso, aunque la forma y el color no se afectaron (Fig. 2).
Los cambios morfoculturales indicidos por la presencia de quitosana se reflejan muy poco en las investigaciones de hongos y oomycetes, sobre todo en el género Phytophthora. En algunos casos se observó crecimiento inusual del micelio aéreo de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. y Botrytis cinerea Pers.:Fr. a concentraciones superiores a 1,5g.l-1, pero los autores no expresaron en qué consistían estas diferencias (16). Actualmente, la mayoría de los trabajos notifican el efecto de la quitosana sobre el diámetro de la colonia, aunque no en su apariencia, y esta última también está determinado por cambios que tienen lugar dentro de la hifa y que pudieran usarse como indicadores de daño.
Las hifas, observadas al microscopio óptico, no mostraron afectaciones en sus diámetros. Los valores de las medias oscilaron entre 4,7 y 5,8mm, sin diferencias estadísticas entre los tratamientos; en contraste con lo observado por otros autores, quienes informaron cambios debido a la agregación del micelio, ramificaciones excesivas, reducción de las hifas, hinchazón de la pared celular, vacuolización y desintegración del protosplasma en especies como Alternaria alternata (Fr.) Keissl., B. cinerea, Penicillium expansum Link y R. stolonifer (17, 18). Sin embargo, El Gaouth et al. (18) no observaron cambios significativos en estas estructuras para A. alternata, Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. y B. cinerea. Estas diferencias en el comportamiento de los microorganismos ante la presencia de quitosana pudo deberse a la cepa y a las propiedades físico químicas de la quitosana empleada.
Xu et al. (9) demostraron que las hifas de P. capsici se afectaron por la presencia de quitosana, en especial el sistema de vacuolas y plasmalemosomas. Estas estructuras están involucradas en la síntesis de la pared celular y no se observaron en los tratamientos que contenían el polímero, en los que había un menor crecimiento con relación al control (9), por lo que pudiera suponerse que procesos similares pueden ocurrir en el interior de las hifas de P. palmivora, que causen su efecto microbiostático.
Evaluación del número y del porcentaje de germinación de esporangios en presencia de quitosana
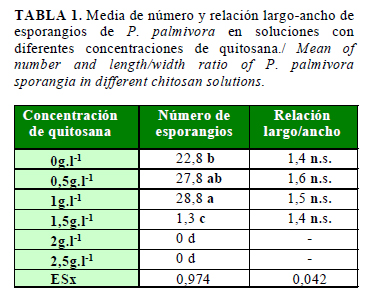
La formación y la germinación de esporangios de los aislados de P. palmivora se redujeron con la aplicación de soluciones de quitosana (Tabla 1). La adición de 1g.l-1 del polímero incrementó el número de esporangios con relación al control, pero las concentraciones superiores inhibieron la formación de estas estructuras.
El proceso de formación de esporangios fue sensible a la quitosana, ya que las concentraciones iguales o superiores a 2g.l-1 inhibieron completamente su presencia; sin embargo, el número se incrementó a bajas concentraciones del polímero. Se informaron resultados similares en A. alternata, lo que se consideró como una señal de estrés causada por la presencia de quitosana, a lo cual el microorganismo responde con la formación de estructuras reproductivas con el objetivo de perpetuar la especie (19).
La relación largo-ancho no varió en los tratamientos. Esta variable constituye un parámetro que se considera como un importante criterio taxonómico y que se emplea para clasificar las especies (20). Los valores obtenidos en la relación largo-ancho también coinciden con los informados por Machado et al. (15) para más de 80 aislados de diferentes países, en los que se incluye a Cuba.
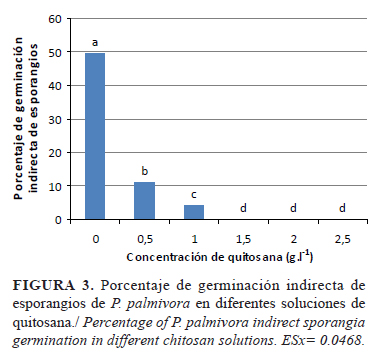
La germinación indirecta de los esporangios disminuyó significativamente a medida que aumentaron las concentraciones de quitosana en el medio (Fig. 3). Los niveles de 0,5g.l-1 provocaron la inhibición de la germinación indirecta de más del 50% de los esporangios, a la vez que a concentraciones iguales y superiores a 1,5g.l-1 redujeron este proceso en un 100%. Resultados similares se observaron en esporangios de P. capsici, donde la penetración de oligoquitosanas causó daños intracelulares y afectó el proceso de liberación de zoosporas (10).
Algunos trabajos informaron también la inhibición de la germinación de las esporas de diferentes hongos como A. alternata, Aspergillus niger van Tieghem, R. stolonifer y Mucor spp. (19, 21, 22) a concentraciones que varían desde 0,5g.l-1 y hasta 5g.l-1, aunque solo unos pocos están relacionados con especies del género Phytophthora (9, 10, 11).
Movimiento de las zoosporas en soluciones con quitosana
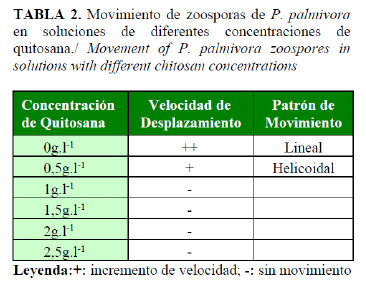
Las zoosporas de P. palmivora, que emergieron de los esporangios en el tratamiento control, se desplazaron a gran velocidad en el agua, con un movimiento rectilíneo a diferencia de aquellas en presencia de quitosana, pues disminuyeron su velocidad y mostraban un patrón de desplazamiento helicoidal, como se refleja en la Tabla 2.
La alteración del patrón y la velocidad de desplazamiento de las zoosporas, en presencia de quitosana, pudieran deberse al hecho de que este polímero induce cambios en la permeabilidad de las membranas celulares y en los influjos y eflujos de algunos nutrientes. Estudios recientes demostraron que la aplicación de quitosana sobre R. stolonifer provocó cambios en el pH del medio, la actividad H+ATPasa de la membrana, así como el eflujo de potasio (23). Si a estos resultados se le agrega que se ha demostrado que la alteración de la homeostasis del potasio está involucrada en la regulación del movimiento de las zoosporas de P. palmivora, P. megakarya y Phytophthora infestans (Mont.) de Bary (24), pudiera sugerirse entonces que los cambios observados en el presente trabajo se deban también al efecto de la quitosana sobre la alteración de la homeostasis del potasio, con lo cual se induce un movimiento aberrado y más lento de las zoosporas.
Enquistamiento y germinación de quistes incubados con quitosana
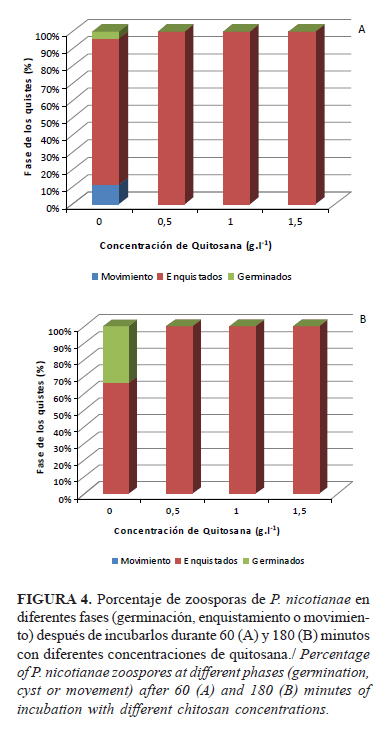
El proceso de germinación de los quistes de P. palmivora disminuyó con la inclusión de quitosana en la suspensión de zoosporas (Fig. 4). La incubación con 0,5g.l-1 del polímero durante tres horas provocó una inhibición total de la emisión del tubo germinativo, al menos durante el periodo experimentado.
Falcón et al. (11) evaluaron el efecto de iguales concentraciones de quitosana sobre zoosporas de P. nicotianae, que luego se inocularon en medio de cultivo, donde no observó crecimiento de colonias con 2g.l-1 del polímero después de ser embebidas durante seis horas en las soluciones. Sin embargo, esta inhibición pudiera variar en el tiempo, similar a lo observado por Pacheco et al. (25), quienes informaron que la germinación de las esporas de Penicillium digitatum (Pers.) Sacc se inhibió totalmente a las 12 hpi, aunque a las 24hpi el porcentaje fue de 56%, por lo que el daño pudiera ser reversible, o no total, y solamente estar afectando la velocidad de emisión del tubo germinativo.
En algunos casos se observaron quistes lisados, sin bordes definidos, similar a un conjunto de vacuolas, sin pared celular, pero confinadas a una región. En otros casos se observaron las paredes sin material interno, similar a lo informado por Sánchez-Domínguez et al. (26) en conidios de A. alternata.
En conclusión, la quitosana evaluada inhibió el desarrollo de aislados de P. palmivora. A pesar de las altas concentraciones evaluadas, se observó un efecto biostático pero no biocida, sobre el crecimiento de las colonias, con variaciones morfoculturales, aunque sin daños en el diámetro de las hifas. Las estructuras reproductivas fueron más sensibles que las vegetativas a los mismos niveles del polímero, inhibiéndose su formación y germinación a las concentraciones evaluadas.
AGRADECIMIENTOS
Los autores agradecen el apoyo de la Fundación Internacional para la Ciencia (International Foundation for Science -IFS F-4446-1 y F-4446-2) y de la Organización para la Prohibición de las Armas Químicas (Organization for the Prohibition of Chemical Wapongs: OPCW, por sus siglas en inglés), que contribuyeron mediante el financiamiento para equipamiento, reactivos, material informático e información científico-técnica.
REFERENCIAS
1. Erwin DC, Ribeiro OK. Phytophthora diseases worldwide. The American Phytopathological Society, St Paul, Minnesota, USA. 1996. 562 pág.
2. Machado M, Collazo C, Peña M, Renaud M-A, López MO, Coto O, et al. First report of Phytophthora palmivora Butler causing root rots on avocado (Persea americana Mill.) in Cuba. Canadian Jour Plant Pathology. 2012;34 (2):323-348.
3. Acebo-Guerrero Y, Hernández-Rodríguez A, Heydrich-Pérez M, El Jaziri M, Hernández-Lauzardo AN. Management of black pod rot in cacao (Theobroma cacao L.): a review. Fruits. 2012;67(1):41-48.
4. Martínez de la Parte E, Pérez L. Incidencia de enfermedades fúngicas en plantaciones de cacao de las provincias orientales de cuba. Rev Protección Veg. 2015;30(2):87-96.
5. El Hadrami A, Adam LR, El Hadrami I, Daayf F. Chitosan in Plant Protection. Mar Drugs 2010;8:968-987.
6. Falcón-Rodríguez AB, Wegria G, Cabrera JC. Exploiting plant innate immunity to protect crops against biotic stress: chitosaccharides as natural and suitable candidates for this purpose. En: New perspectives in plant protection. Edited by Ali R. Bandani. Croatia. INTECH. 2012; 139-166. ISBN: 978-953-51-0490-2.
7. Badawy MEI, Rabea EI. A Biopolymer Chitosan and its derivatives as promising antimicrobial agents against plant pathogens and their applications in Crop Protection. International Journal of Carbohydrate Chemistry. Volume 2011, Article ID 460381, 29 p.
8. Kaur S, Dhillon GS. The versatile biopolymer chitosan: potential sources, evaluation of extraction methods and applications. Crit Rev Microbiol. 2014;40(2):155-175.
9. Xu J, Zhao X, Han X, Du Y. Antifungal activity of oligochitosan against Phytophthora capsici and other plant pathogenic fungi in vitro. Pestic Biochem Physiol. 2007;87:220-228.
10.Xu J, Zhao X, Wang X, Zhao Z, Du Y. Oligochitosan inhibits Phytophthora capsici by penetrating the cell membrane and putative binding to intracellular targets. Pestic Biochem Physiol. 2007;88:167-175.
11.Falcón AB, Rodríguez AT, Ramírez MA, Rivero D, Martínez B, Cabrera JC, et al. Chitosans as bioactive macromolecules to protect economically relevant crops from their main pathogens. Biotecnol Apl. 2010;27(4):305-309.
12.Fernández A. Biología, epifitotiología, nocividad y control de Phytophthora nicotianae en Tabaco. Tesis Presentada en Opción al Grado Científico de Doctor en Ciencias Agrícolas. INISAV, 1998. 100pp.
13.Palma- Guerrero J, Jansson HB, Salinas J, López-Llorca LV. Effect of chitosan on hyphal growth and spore germination of plant pathogenic and biocontrol fungi. J Appl Microbiol. 2008;104:541- 553.
14.Echevarría A, Cruz A, Cárdenas RM, Rivero D, Ramírez MA, Rodríguez AT. Actividad antifúngica de la quitosana en el crecimiento micelial y esporulación del hongo Pyricularia grisea Sacc. Cultivos Tropicales. 2012;33(3):80-84.
15.Machado M, Peña-Marey M, Álvarez A, Díaz A, Zamora V, Coto O. Variabilidad intraespecífica de cepas de Phytophthora palmivora Butler (Butler) aisladas de plantaciones de aguacatero (Persea americana Mill.) en Cuba. Rev Protección Veg. 2013;28(3):178-184.
16.El Ghaouth A, Arul J, Grenier J, Asselin A. Antifungal activity of chitosan on two postharvest pathogens of strawberry fruits. Postharvest Pathology and Mycotoxins. 1992;82(4):398-402.
17.de Oliveira J, e.n., Soares I, Teixeira T. Changes in hyphal morphology due to chitosan treatment in some fungal Species. Braz Arch Biol Technol. 2012;55(5):637-646.
18.El Ghaouth A, Arul J, Asselin A, Benhamou N. Antifungal activity of chitosan on post-harvest pathogens: induction of morphological and cytological alterations in Rhizopus stolonifer. Mycol Res. 1992;96:769-779.
19.Sánchez-Domínguez D, Bautista-Baños S, Castillo P. Efecto del quitosano en el desarrollo y morfología de Alternaria alternata (Fr.) Keissl. An Biol. 2007;29:23-32.
20.de Silva DPP, Kumasi YSP, Pillai DS. Black pod disease of cocoa: isolation, identification of different Phytophthora species from cocoa growing areas of Sri Lanka and possible in -vitro control methods. Sri Lankan J Agric Sci. 2005;42:113-124.
21.Plascencia-Jatomea M, Viniegra G, Olayo R, Castillo-Ortega MM, Shirai K. Effect of Chitosan and temperature on spore germination of Aspergillus niger. Macromol Biosci. 2003;3:582- 586.
22.Hernández-Lauzardo AN, Hernández-Martínez M, Velázquez del Valle MG, Guerra-Sánchez MG, Melo-Giorgana GE. Actividad antifúngica del quitosano en el control de Rhizopus stolonifer (Ehrenb.: Fr.) Vuill. y Mucor spp. Rev Mex Fitopatol. 2007;25(2):109- 113.
23.García-Rincón J, Vega-Pérez J, Guerra-Sánchez MG, Hernández-Lauzardo AN, Peña-Díaz A, Velázquez-Del Valle MG. Effect of chitosan on growth and plasma membrane properties of Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. Pestic Biochem Physiol. 2010;97:275-278.
24.Appiah A, van West P, Osborne MC, Gow NAR. Potassium homeostasis influences the locomotion and encystment of zoospores of plant pathogenic oomycetes. Fungal Genet Biol.2005; 42:213-223.
25.Pacheco N, Larralde-Corona P, Sepulveda J, Trombotto S, Domard A, Shirai K. Evaluation of chitosans and Pichia guillermondii as growth inhibitors of Penicillium digitatum. Int J Biol Macromol. 2008;43:20-26.
26.Sánchez-Domínguez D, Ríos MY, Castillo-Ocampo P, Zavala-Padilla G, Ramos-García M, Bautista-Baños S. Cytological and biochemical changes induced by chitosan in the pathosystem Alternaria alternata-tomato. Pestic Biochem Physiol. 2011;99:250-255.
Recibido: 26-10-2015.
Aceptado: 2-2-2016.
* Autor para correspondencia: Dianevys González-Peña. Correo electrónico: dianevys84@gmail.com.
Dirección actual del autor: Department of Chemistry and Biochemistry, Faculty of Arts and Science, University of Lethbridge, 4401 University Drive, Lethbridge, Alberta, Canada. T1K 3M4.