Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Protección Vegetal
versión On-line ISSN 2224-4697
Rev. Protección Veg. vol.31 no.2 La Habana mayo-ago. 2016
ARTÍCULO ORIGINAL
Eficacia de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg para el control de Rhizoctonia solani Kühn en condiciones de campo
Efficacy of Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg in controlling Rhizoctonia solani Kühn under field conditions
Yusimy Reyes DuqueI, Danay Infante MartínezII, Benedicto Martínez CocaII
IDpto. Biología y Sanidad Vegetal, Universidad Agraria de La Habana (UNAH).Autopista Nacional km 23½. Apartado 10, San José de las Lajas, Mayabeque, Cuba. Correo electrónico: yusimy@unah.edu.cu.
IICentro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, Mayabeque, Cuba.
RESUMEN
El presente trabajo tuvo como objetivo establecer el momento y la dosis de aplicación de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg en condiciones de campo, para lograr el control de Rhizoctonia solani Kühn. Se evaluaron tres cepas (Ta.17, Ta.75, Ta.78) del antagonista en cuatro momentos de aplicación (semillero, trasplante, estrés hídrico y ahijamiento), donde las aplicaciones en los tres primeros momentos se realizaron al suelo y, para el último, de forma foliar. Posteriormente, las mejores combinaciones se evaluaron con tres dosis diferentes (3,5 x 1011 (1), 3,5 x 1012 (2) y 3,5 x 1013 (3) conidios.ha-1), bajo las mismas condiciones. Se empleó un diseño de parcelas subdivididas y sub-subdivididas para el último ensayo. Los resultados mostraron que todas las variantes evaluadas pueden ser empleadas como alternativas de aplicación en un programa de manejo del cultivo, pero se destacaron, con mayores valores de eficacia técnica (ET), las cepas Ta.17 y Ta.78 en la aplicación a las posturas y en el primer estrés hídrico. La cepa Ta.78, a la dosis mínima (1011 conidios.ha-1), mostró una ET superior al 70% que se mantuvo en las dosis superiores evaluadas. La dosis de 1011conidios.ha-1 de T. asperellum cepa Ta.78 fue efectiva para el control de R. solani, aplicada a las posturas en la fase de trasplante y al suelo en el primer estrés hídrico en el cultivo.
Palabras clave: arroz, control biológico, Cuba, Rhizoctonia, Trichoderma.
ABSTRACT
The objective of the present work was to establish the application time and dose of Trichoderma asperellum Samuels to control Rhizoctonia solani Kühn under production conditions. Three strains (T.17, T.75, T.78) of the antagonist were evaluated in four application times (seedbed, transplanting, first water stress and maximum tillering), where the applications were to the soil in the first three times and to the foliage in the last one. Subsequently, the resulting best combinations were evaluated at three doses (3.5 x 1011 (1), 3.5 x 1012 (2) and 3.5 x 1013 (3) conidia.ha-1), under the same conditions. A split plot design was used in the first test and a split split plot design in the second. The results showed that all the evaluated variants could be used as application alternatives in a management program of the crop, but the strains T.17 and T.78 applied to the seedlings or in the first water stress stood out with the highest values of technical efficacy (TE). The strain T.78 at the minimum dose (1011 conidia.ha-1) showed a TE superior to 70%, which remained at the higher doses evaluated The dose of 1011 conidia.ha-1 of T. asperellum strains T.78 applied to the seedlings in the transplanting or to the soil in the first water stress was effective to control R. solani.
Key words: biological control, Cuba, Rhizoctonia, rice, Trichoderma.
INTRODUCCIÓN
El arroz (Oryza sativa L.) es el principal alimento de la tercera parte de la población mundial, lo que significa aproximadamente 2000 millones de personas (1).
En Cuba, constituye la base de la dieta de la población, cuyo consumo es de 69,5 kg anuales per cápita, lo que la ubica entre las naciones de alto consumo. El rendimiento agrícola del cultivo en el país aún es bajo, muy inferior a la media mundial (2); por lo que no satisface la demanda interna y se requiere importar un alto porcentaje del arroz que se consume (3).
La producción de arroz en Cuba y en el mundo se ve afectada por varias plagas; en los últimos años se destaca el tizón de la vaina (Rhizoctonia solani Kühn). El aumento de la incidencia de esta plaga condujo a la disminución de los rendimientos entre el 20 y el 40% (4, 5, 6).
Para manejar el tizón de la vaina se emplearon medidas culturales, sin obtener resultados satisfactorios. El control más efectivo se alcanzó con el empleo de fungicidas químicos, opción que presenta desventajas ecológicas y económicas: resultan agresivos al ambiente y costosos para los agricultores, respectivamente. Estas dificultades motivaron la necesidad de introducir otras medidas de control que puedan emplearse solas o combinadas con los fungicidas químicos y, de esta manera, disminuir los efectos negativos que estos implican.
Reyes (7) obtuvo resultados satisfactorios con el uso de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg en condiciones de cantero y seleccionó tres cepas (Ta.17, Ta.75, Ta.78) como promisorias para el control de este patógeno en condiciones de producción.
El empleo de este antagonista en el cultivo del arroz fue poco estudiado; sin embargo, Correa (4) planteó que es una alternativa promisoria para el control de patógenos en este cereal. En los últimos años, algunos autores notificaron resultados alentadores para el control de R. solani y otros patógenos en arroz (8,9), pero añadieron que resultaban aún insuficientes los estudios sobre su efectividad en campo.
Este estudio tuvo como objetivo establecer el momento y la dosis de aplicación de T. asperellum cepas Ta.17, Ta.75, Ta.78 en condiciones de producción para el control de R. solani.
MATERIALES Y MÉTODOS
Momento de aplicación del biopreparado de T. asperellum a base de las cepas seleccionadas, en condiciones de producción
El experimento se realizó en la Cooperativa de Producción Agropecuaria (CPA) «Gilberto León» situada en el municipio San Antonio de los Baños, provincia Mayabeque, Cuba; en el periodo de diciembre de 2006 a julio de 2007. El suelo del sitio es Gley Vértico Típico (10), con pH 7,3 y con alta infestación natural por R. solani. Se empleó la variedad Perla de Cuba, que resulta susceptible al patógeno (4) en condiciones de aniego.
Se utilizaron las cepas T.17, T.75, T.78 de T. asperellum; para determinar el momento óptimo de aplicación se tuvieron en cuenta las fases de semillero, trasplante, primer estrés hídrico y el periodo de máximo ahijamiento. Durante el periodo experimental no se realizaron aplicaciones de productos fitosanitarios. Los momentos y las dosis de inoculación se muestran en la Tabla 1.
El biopreparado, a base de las cepas de Trichoderma anteriormente mencionadas, se realizó artesanalmente en el Laboratorio de Micología Vegetal (LMV). Se utilizó sustrato sólido de cabecilla de arroz, al que se le añadió agua destilada estéril y se distribuyó homogéneamente en frascos Rux y, posteriormente, se esterilizó en autoclave a 121ºC por 30 minutos. Después de 2 h de reposo, el sustrato se inoculó con una suspensión obtenida de cultivos puros esporulados de siete días, a la concentración de 107conidios.ml-1; a continuación se incubó a 28 ± 2ºC en posición horizontal hasta que el hongo colonizara y esporulara, sobre todo el sustrato y, finalmente, se llevó al área de secado. Se calculó la concentración por gramo y se realizaron los cálculos correspondientes para determinar la dosis de aplicación en campo.
Para la inoculación de las semillas se sumergieron 50 g en 100 ml de la suspensión de esporas de las cepas a la concentración indicada (Tabla 1), por cinco minutos; se dejaron secar al aire por 30 minutos y luego se procedió a la siembra. En el caso de las posturas, procedentes del área de semillero de la CPA, se sumergió el sistema radicular hasta la altura del cuello por cinco minutos, en 3 L de una suspensión de esporas de las cepas del antagonista, previamente preparada y homogeneizada, a la que se le agregaron 0,5 ml de Tween 80 por L. Las posturas se dejaron secar por 10 minutos y a continuación se realizó el trasplante.
En el primer estrés hídrico [15 días después del trasplante (ddt)], se realizó la inoculación al suelo con la suspensión de esporas de Trichoderma de las cepas seleccionadas, de forma homogénea y usando una asperjadora manual (MATABI) de 16 L, con boquilla cónica. Por último, se probó el efecto del hongo en el periodo máximo de ahijamiento (40 ddt), para lo que se realizó la aplicación foliar de la suspensión de esporas de las cepas en las parcelas previamente diseñadas para esta evaluación. La aplicación se realizó con la asperjadora manual anteriormente señalada, a baja altura, cubriendo vainas y suelo. Las inoculaciones se realizaron de manera separada para cada tratamiento (momento y cepa) y el trasplante se efectuó según las normas tecnológicas del cultivo, empleadas por la CPA.
Los ensayos se montaron en parcelas de 25 m2 de superficie, con 16 tratamientos (cuatro momentos de inoculación, tres biopreparados a base de las cepas seleccionadas de T. asperellum y un testigo sin aplicar el biopreparado), con un diseño sistematizado en franjas de tipo parcelas divididas, con tres repeticiones, donde la parcela principal se corresponde con el momento de aplicación y la dividida con las cepas de los biopreparados mencionados. Las muestras se tomaron completamente al azar, evaluando 10 macollas dentro de la parcela por repetición y se analizaron todas las plantas (enfermas y sanas) de cada macolla. Se evaluaron cinco macollas por repetición en el periodo de mayor susceptibilidad de la planta al patógeno, entre los 60 a 90 días de la germinación, teniendo en cuenta las plantas totales y enfermas. Con los datos obtenidos se calculó la ET de los aislamientos, según la fórmula de Abbott (11). Los datos en porcentaje se transformaron mediante la expresión 2 arcsen Öp (12). Se realizó un análisis de parcela dividida A x B, las medias se compararon por la prueba de Tukey al 5% de probabilidad con el paquete estadístico SPSS11.5 para Windows.
Dosis de aplicación del biopreparado de T. asperellum a base de los aislamientos seleccionados, en condiciones de producción
El experimento se diseñó con el biopreparado a base de las cepas y los momentos de aplicación seleccionados en el ensayo anterior. Los momentos se evaluaron de manera separada y combinada. Se trabajó en áreas no tratadas previamente con suspensiones conidiales de aislamientos de T. asperellum, pero con antecedentes de incidencia de R. solani, en la misma CPA y bajo iguales condiciones de producción. Se establecieron 24 tratamientos: tres momentos, dos biopreparados a base de las cepas seleccionadas de T. asperellum y tres dosis de aplicación 3,5 x 1011 (1), 3,5 x 1012 (2) y 3,5 x 1013 (3) conidios.ha-1, más un testigo sin aplicar el biopreparado por cada aislamiento en cada momento, de forma intercalada, en parcelas de 35 m2 de superficie. Se utilizó un diseño estadístico similar al ensayo anterior, pero en este caso con parcelas subdivididas, donde las sub-subparcelas fueron las dosis de aplicación del biopreparado, la subparcela_los biopreparados y la parcela principal_los momentos. La aplicación de las suspensiones conidiales de los biopreparados y el procesamiento de los datos se ejecutaron de igual forma al ensayo anterior.
Dadas las características del montaje y la tecnología del cultivo se dejaron franjas de 0,50 m sin sembrar entre parcelas de los aislamientos diferentes.
RESULTADOS Y DISCUSIÓN
Momento de aplicación del biopreparado de T. asperellum a base de las cepas seleccionadas, en condiciones de producción
El análisis no mostró interacción entre los momentos de aplicación y las cepas (p= 0,181), por lo que se analizó de forma independiente el efecto de los momentos de aplicación y las cepas utilizadas sobre la enfermedad.
La ET fue superior al 60% en todos los momentos de aplicación evaluados (Fig. 1). La inoculación a las posturas en el momento del trasplante mostró la mejor respuesta con 88,85%, así como la inoculación en el momento del estrés hídrico, con una eficacia superior al 80%. Estos tratamientos no difirieron entre sí ni con relación a los resultados de la aplicación a la semilla, la que no alcanzó 80% de eficacia.
Este último, a su vez, no difirió del momento de aplicación al inicio del ahijamiento, tratamiento que muestra los valores más bajos de eficacia (64,92%) en condiciones de campo.
El resultado en la fase de ahijamiento pudo estar relacionado con el corto tiempo que medió entre la aplicación y el momento de la evaluación. Por ser esta una aplicación tardía, el antagonista tuvo menor tiempo para adaptarse al medio y ejercer una acción de competencia o micoparasitismo frente a los fragmentos, libres en el suelo, de micelios y/o esclerocios del patógeno, previo al periodo de mayor susceptibilidad de la planta al Tizón de la vaina.
Los resultados de este ensayo sugirieron que todas las variantes evaluadas pueden ser empleadas como alternativas de aplicación en un programa de manejo del cultivo para disminuir la incidencia de esta enfermedad.
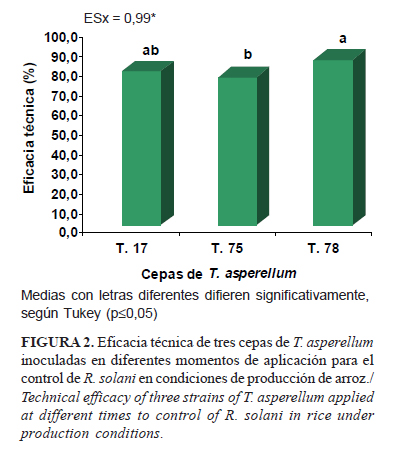
En campo, las cepas T.17 y T.78 de T. asperellum alcanzaron los mejores resultados de ET, superiores al 75% (Fig. 2). Se destacó, con el mayor porcentaje de eficacia sobre el patógeno, la cepa T.78 con un valor de 84,87%. La cepa T.75 presentó una eficacia ligeramente inferior, sin diferencias significativas respecto a T.17 pero sí para T.78.
Estos resultados son favorables, ya que la ET de las tres cepas fue superior al 70%. Los mismos evidenciaron la relación que existe entre la capacidad antagónica que puede expresar el antagonista con alta presión de selección en condiciones in vitro y ex vitro (7), con los resultados en condiciones de campo, donde el antagonista está expuesto a factores ambientales que podrían limitar su capacidad de control, como son las radiaciones solares y las temperaturas por encima de los 35ºC.
Los porcentajes de ET obtenidos en los diferentes momentos de aplicación del antagonista superaron lo informado por diversos autores que emplearon otras especies y aislamientos de este antagonista, pero estas diferencias podrían estar dadas por la dosis de aplicación del antagonista y/o la efectividad de los aislamientos seleccionados.
Así por ejemplo, Mathivanan et al. (8) notificaron una ET de 45,7% de T. viride en el control del tizón de la vaina en arroz en aplicaciones a la semilla en condiciones de campo; mientras que Cid (13) informó una ET de 58,0% de Trichoderma harzianum Rifai en aplicaciones previas al trasplante de posturas de tomate para el control de R. solani, pero a una dosis inferior (1,3 g de pellets.L-1 con 9 x 105 ufc.g-1) a la usada en este ensayo. Igualmente, García et al. (14) realizaron aplicaciones de T. harzianum en condiciones de campo y alcanzaron una ET de 30% sobre R. solani en papa y tabaco, la cual consideraron como adecuada.
Similares resultados a los del presente trabajo mencionaron Lokesha y Benagi (15) en ensayos de tratamientos a semillas de gandul (Cajanus cajan (L.) Millsp) con T. harzianum y Trichoderma virens (Giddens & Foster) Arx con una ET sobre el agente causal de la pudrición seca de la raíz (Macrophomina phaseolina (Tassi) Goid) de 90 y 93%, respectivamente. Los resultados alcanzados con las cepas de T. asperellum evaluadas confirmaron lo planteado por De Curtis et al. (16) sobre la alta eficacia de esta especie comparable con fungicidas sintéticos.
Los resultados de este experimento condujeron a la selección de las cepas T.17 y T.78 y de los momentos de aplicación: posturas en el trasplante y en el estrés hídrico para los ensayos de determinación de la dosis de aplicación.
Dosis de aplicación del biopreparado de T. asperellum a base de los aislamientos seleccionados, en condiciones de producción
El análisis sugirió que no había significación en la interacción entre los momentos, las cepas y las dosis de aplicación (p= 0,507), por lo que se evaluaron los efectos de las interacciones dobles, momento de aplicación*cepas (p= 0,012) y cepas*dosis de aplicación (p= 0,0001).
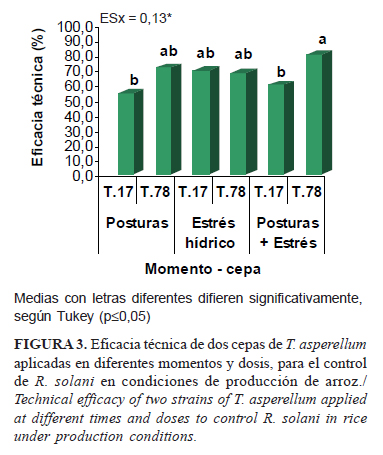
Resulta de gran importancia el hecho de que los dos momentos seleccionados y su combinación no difieran entre sí para la introducción de los resultados, ya que en dependencia de la tecnología de siembra del cultivo, los agricultores podrán seleccionar el momento más adecuado para realizar la aplicación del antagonista.
El tratamiento de posturas+estrés hídrico con la cepa T.78 (Fig. 3) mostró mayor control del patógeno con una ET de 79,5%. Valores similares a este, y sin diferir significativamente, se alcanzaron con esta cepa cuando se aplicó por separado para ambos momentos. La cepa T.17 solo mostró diferencias respecto a la 78 en el tratamiento postura más estrés hídrico.
Las dos cepas de T. asperellum mostraron alta eficacia en el control de R. solani. No obstante, T.78 resultó la mejor candidata a emplear y puede ser aplicada en cualquiera de los dos momentos seleccionados y su combinación. Se debe señalar que es importante consultar el historial de campo y seleccionar entonces el momento de aplicación más conveniente, en función de la intensidad con que se ha presentado la plaga. Desde el punto de vista fitotécnico, todos los momentos de aplicación son factibles a incorporar porque pueden combinarse con labores realizadas dentro del proceso productivo del cultivo por trasplante.
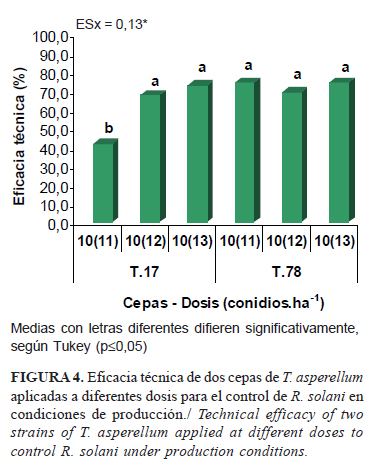
Todos los tratamientos mostraron alta ET (Fig. 4), superior al 60% para el control del patógeno, a excepción de Ta.17 a la dosis inferior (1011conidios.ha-1); la que no alcanza 50% de eficacia y difiere del resto de los tratamientos.
La cepa Ta.17 mostró tendencia a incrementar la eficacia técnica a medida que se incrementa la dosis aplicada.
La cepa T.78 reveló una elevada eficacia (74%) a la dosis mínima (1011 conidios.ha-1), la que se mantuvo en las superiores, aunque fue ligeramente inferior a la intermedia. Esta última cepa mostró una estabilidad mayor a T.17 en su actividad antagónica, la que también presentó resultados satisfactorios en el control de R. solani.
Según estos resultados, las dos cepas de T. asperellum son eficaces para el control del patógeno, aunque resulta mejor candidata la cepa T.78 (eficacia superior al 70%) para extender su uso y validar en otras condiciones de campo. La misma puede ser aplicada en condiciones de producción a dosis de 3,5x1011conidios.ha-1, aunque se debe tener en cuenta la presión de inóculo del patógeno en campo y, en función de esto, determinar la dosis más adecuada para la aplicación. No obstante, la introducción de estos resultados debe conllevar un análisis particularizado para cada agroecosistema arrocero en que se pretenda incorporar.
En la literatura consultada, los artículos no refieren la dosis como cantidad de conidios distribuidos por unidad de superficie (conidios.ha-1). En numerosas publicaciones se hace referencia a la concentración como «dosis», por lo que es difícil realizar una comparación objetiva entre los resultados del presente trabajo y los revisados.
Hanada et al. (17) también lograron disminución de la severidad de la enfermedad pudrición negra (Phytophthora palmivora (E. J. Butler) E. J. Butler) en cacao (Theobroma cacao L.) con aplicaciones de Trichoderma martiale Samuels en función de las «dosis» empleadas (1 x104 a 5 x 107conidios.ml-1); Jiménez (18), con tratamientos de 108 ufc.mL-1 y 109 ufc.mL-1 de T. virens, disminuyó la incidencia de algunos patógenos foliares (Botrytis sp., Alternaria sp. y Cladosporium sp.) en plantas de Protea L. entre 6,6 y 13,3%, respectivamente. Estos resultados evidenciaron que, a mayor dosis, el efecto sobre el patógeno es superior, similar a lo que se obtuvo en el presente trabajo con la cepa T.17.
Además de la alta eficacia de estas cepas T.17 y T.78 frente a R. solani, recientemente se informó la estimulación del crecimiento vegetal en arroz; efecto notificado por otros autores para el género Trichoderma (8, 19, 20, 21). Específicamente para la especie T. asperellum, Hoyos-Carvajal et al. (22) informaron que produce sideróforos, ácido indol acético y otras auxinas que estimularon el crecimiento en plántulas de frijol (Phaseolus vulgaris L.).
Los resultados alcanzados indicaron que la dosis de 1011conidios.ha-1 de T. asperellum cepa T.78 fue efectiva para el control de R. solani, aplicada a las posturas en la fase de trasplante y al suelo en el primer estrés hídrico en el cultivo.
REFERENCIAS
1. FAO. Seguimiento del Mercado del Arroz. En línea. 2010 junio 15. Fecha de acceso 28 de septiembre de 2010. URL disponible en: http://www.fao.org/es/esc/es/15/70/highlight_71.html.
2. FAOSTAT. En línea. 2014 Octubre 23. Fecha de acceso 24 de febrero de 2015. URL disponible en: http://faostat.fao.org/site/339/default.aspx.
3. Polón R, Castro R, Ruiz M, Maqueira LA. Práctica de diferentes alturas de corte en el rebrote y su influencia en el rendimiento del arroz (Oryza sativa L.) en una variedad de ciclo medio. Cultivos Tropicales. 2012;33(4):59-62.
4. Correa F. Principales enfermedades del arroz. p. 123-144. En: Pantoja A, Fischer A, Correa F, Sanit L, Ramírez A. (Eds.) Centro Internacional de Agricultura Tropical (CIAT). MIP en Arroz: manejo integrado de plagas; artrópodos, enfermedades y malezas. Caracas, Venezuela, 2007. 56 pp.
5. CAB International. Crop Protection Compendium CD. Wallingford, UK, 2006.
6. Instituto de Investigaciones del Arroz. Meneses R, Gutiérrez A, García A, Antigua G, Gómez J, Correa F, et al. Guía para el trabajo de campo en el manejo integrado de plagas del arroz. 5ta Edición. Sancti Spíritus, Cuba. 63p., 2008.
7. Reyes Y. Selección de aislamientos de Trichoderma promisorios para el biocontrol del Tizón de la vaina (Rhizoctonia solani Kühn) en arroz. Rev Protección Veg. 2012;27(1):68.
8. Mathivanan N, Prabavathy V, Vijayanandraj V. Application of Talc Formulations of Pseudomonas fluorescens Migula and Trichoderma viride Pers. ex S.F. Gray decrease the sheath Blight Disease and enhance the plant growth and yield in Rice. J Phytopathology. 2005;153:697-701.
9. Martínez B, Obret Y, Pérez S, Reyes Y. Antagonismo in vitro de cepas de Trichoderma spp. frente a Sarocladium oryzae (Sawada) W. Gams & D. Hawksworth. Rev Protección Veg. 2014;29(2):106-112.
10.Instituto de Suelos. AGRINFOR, Hernández A, Pérez J, Bosch D, Rivero L. Nueva Versión de Clasificación Genética de los Suelos de Cuba. La Habana. 1999. 64p.
11.Abbott S. A method of computing the effectiveness of an insecticide. J Econ Entomol. 1925;18:264-267.
12.Lerch G. La Experimentación Agrícola en las Ciencias Biológicas y Agrícolas. La Habana; 1977. 452pp.
13.Cid R. 2005. Control biológico de Rhizoctonia solani, Fusarium oxysporum f. sp. lycopersici y Fusarium solani en tomates bajo invernaderos. En línea. 2009 junio 15. Fecha de acceso 23 de febrero de 2010. URL disponible en: http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_agronomicas/montealegre_j/14.html.
14.García R, Riera R, Zambrano C, Gutiérrez L. Desarrollo de un fungicida biológico con base a una capa del hongo Trichoderma harzianum proveniente de la región Andina Venezolana. Fitosanidad. 2006;10(2):153.
15.Lokesha N, Benagi I. Biological management of pigeon pea dry root rot caused by Macrophomina phaseolina. J Agric Sci Karnataka. 2007;20(1):54-56.
16.De Curtis F, Lima G, Vitullo D, De Cicco V. Control of Rhizoctonia solani and Sclerotium rolfsii on tomato by delivering antagonistic bacteria through a drip irrigation system. Crop Protection. 2010;29 (7):663-670.
17.Hanada R, Pomella A, Soberanis W, Loguercio L, Pereira J. Control potential of Trichoderma martiale against the black-pod disease (Phytophthora palmivora) of cacao. Biological Control. 2009;50(2):143-149.
18.Jiménez A. Determinación de dosis y frecuencia de aplicación de Trichoderma virens para el control de enfermedades foliares en Protea L. bajo condiciones de campo. Universidad de Talca. En línea. 2009 junio 15. Fecha de acceso 7 de julio de 2010. URL disponible en: http://www.bionativa.cl/pdf/tesis/trichonativa/t6.pdf.
19.Harman G. Overview of Mechanisms and uses of Trichoderma spp. Phytopathology. 2006;96(2):190-194.
20.Donoso E, Lobos G, Rojas N. Efecto de Trichoderma harzianum y compost sobre el crecimiento de plántulas de Pinus radiata en vivero. Bosque. 2008;29(1):52-57.
21.Martínez B, Infante D, Reyes Y. Trichoderma spp. y su función en el control de plagas en los cultivos. Rev Protección Veg. 2013;28(1):1-11.
22.Hoyos-Carvajal L, Orduz S, Bissett J. Growth stimulation in bean (Phaseolus vulgaris L.) by Trichoderma. Biological Control. 2009;51(3):409-416.
Recibido: 25-12-2015.
Aceptado: 8-6-2016.