INTRODUCCIÓN
El Tizón temprano, causado por el hongo A. solani Sor., es una de las enfermedades foliares más importantes a nivel mundial y en Cuba, tanto en el cultivo de la papa como en el tomate (1). En el cultivo de la papa ataca tallos y tubérculos, además del follaje, y afecta el rendimiento, ya que puede ocasionar hasta 30 % de pérdidas en áreas con condiciones climáticas favorables para su desarrollo (2,3). En Cuba, se estimaron pérdidas entre 17 y 37 % en investigaciones con seis cultivares comerciales durante tres campañas (4).
El Tizón temprano es la enfermedad foliar más importante del cultivo de papa, después del Tizón tardío, y se presenta con mayor incidencia en las zonas ubicadas en regiones húmedas y cálidas (5).
Actualmente, el control biológico ocupa un lugar importante entre las prácticas de manejo de enfermedades de las plantas causadas por patógenos fúngicos (6), cuyo uso logra disminuir considerablemente la incidencia del fitopatógeno con el mínimo impacto para el ambiente y la salud humana (7).
Las especies del género Trichoderma son los antagonistas más utilizados para el manejo de enfermedades de plantas producidas por hongos, debido a su ubicuidad, su facilidad para ser aisladas y cultivadas, su crecimiento rápido en un gran número de sustratos y a que no atacan a plantas superiores (7,8).
Los mecanismos por los que las cepas del género Trichoderma enfrentan al fitopatógeno son, fundamentalmente, de tres tipos: competencia por espacio o nutrientes (7,9,10,11,12), producción de metabolitos antibióticos, ya sean volátiles o no (7,12), y parasitismo sobre estructuras de los hongos fitopatógenos (9).
El Centro Nacional de Sanidad Agropecuaria (CENSA) cuenta con cepas promisorias de T. asperellum identificadas y caracterizadas morfo, fisiológica y molecularmente, las cuales tienen efecto frente a una gama de hongos causantes de enfermedades en cultivos de importancia económica como: tomate (Solanum lycopersicum L.), pimiento (Capsicum annuum L.), tabaco (Nicotiana tabacum L.) y arroz (Oryza sativa L.) (13).
Teniendo en cuenta estos antecedentes, el presente trabajo tuvo como objetivo determinar el efecto de metabolitos de cepas de T. asperellum sobre A. solani, así como el efecto de la interacción pH-temperatura en el antagonismo sobre la base del crecimiento del patógeno.
MATERIALES Y MÉTODOS
Origen de los cultivos microbianos y producción de inóculos
El trabajo se realizó en el Laboratorio de Micología Vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA) (Latitud 22,991867; Longitud -82,153892), provincia Mayabeque, Cuba.
Como agente de control biológico, se utilizaron las cepas de T. asperellum Ta.1, Ta.12, Ta.25y Ta.85 procedentes de la Colección del Laboratorio de Micología Vegetal del CENSA, seleccionadas integralmente por su acción parasítica frente a A. solani en estudios previos (14). Para la obtención del micelio del hongo, se tomaron discos de 5 mm de diámetro de las cuatro cepas y se sembraron en placas Petri (90 mm de Ø) con medio Agar Malta (AM) (BIOCEN) durante 72 horas a 30±1°C y oscuridad.
Como agente patógeno, se usó el aislamiento de A. solani No. 160, previamente aislado de hojas de papa con síntomas típicos de Tizón temprano, procedentes de la provincia Las Tunas, perteneciente a la colección del Laboratorio de Micología Vegetal del CENSA. Para la obtención del micelio del hongo, se tomaron discos de 5 mm de diámetro y se sembraron en placas Petri con medio Papa Dextrosa Agar (PDA) (BIOCEN) durante siete días a 30±1°C y oscuridad.
Los inóculos de los hongos, para todos los experimentos, consistieron en discos de 5 mm de diámetro, que se tomaron a partir de la periferia de las colonias.
Efecto de metabolitos volátiles de T. asperellum sobre A. solani
El efecto de metabolitos volátiles se evaluó según la metodología descrita por Mokhtar y Dehimat (15), con algunas modificaciones. Se vertió medio de cultivo PDA en placas Petri (70 mm de Ø), tanto en la base como en la tapa de las mismas, y se sembró, centralmente en la base, un disco de T. asperellum . Cuidadosamente se colocaron las tapas de las placas sin disco sobre las bases de cada placa inoculada con el antagonista. Las placas se incubaron a 30±1°C a oscuridad por 48 horas. Posteriormente, se sembró, centralmente, un disco de micelio de A. solani de 5 mm en las tapas. Como testigo se sembró un disco del patógeno en la tapa de igual manera, pero sin el antagonista en la base. Las placas Petri se sellaron con doble parafilm. Se hicieron tres réplicas (placa) por tratamiento _ cepas T. asperellum (Ta.1, Ta.12, Ta.25, Ta.85) y A. solani (A. 160). Las placas se incubaron a 30 ±1°C.
El crecimiento micelial de A. solani se midió con una regla graduada cada 24 horas, hasta las 96 h. Se calculó el porcentaje de inhibición del crecimiento radial (PICR) según la fórmula de Samaniego et al. (16).
Efecto de metabolitos no volátiles de T. asperellum sobre A. solani
Para la obtención de las suspensiones miceliales a utilizar, se sembraron las cuatro cepas de T. asperellum en placas Petri (90 mm de Ø) contentivas de medio PDA y se incubaron durante siete días a 30±1°C. Posteriormente, se vertió agua destilada estéril en cada placa Petri y se raspó con una espátula, cuidadosamente, el contenido de la placa. Se maceraron por 30 segundos los fragmentos miceliales hasta romper los fragmentos grandes. Las suspensiones se filtraron a través de filtros miliporos de 0,45 µm (Sartorios) en vasos precipitados estériles. Se embebieron discos de 5 mm de micelio del patógeno por cinco minutos en el filtrado de cada una de las cepas, separadamente. Por último, se sembraron centralmente en placas Petri (90 mm de Ø) con medio de cultivo PDA. Como controles se usaron placas sembradas con discos del patógeno embebidos, por cinco minutos, en agua destilada estéril. Las placas se incubaron a 30±1°C y oscuridad. Por variante se hicieron cinco réplicas. Se midió el crecimiento radial del patógeno con una regla graduada cada 24 horas, hasta las 192 h. Se calculó el porcentaje de inhibición del crecimiento radial (PICR) según la fórmula de Samaniego et al. (16).
Efecto del pH sobre la interacción T. asperellum - A. solani a diferentes temperaturas
Para este experimento se usó el medio de cultivo PDA a los siguientes pH: 5,2; 6 y 7, comprobados después de la esterilización del medio. Se realizó el cultivo dual (CD) en las placas Petri (90 mm de Ø) con los medios ajustados a los diferentes pH, según Bell et al. (17). En una misma placa se sembró un disco de micelio de la colonia de Trichoderma y otro del patógeno, a una distancia aproximada de 70 mm. Seguidamente, las placas se sellaron e incubaron a las temperaturas: 20, 25, 30 y 35°C, a oscuridad. Se realizaron tres réplicas por tratamientos y, como controles, se dejaron placas sembradas de igual manera que las anteriores, pero sin el antagonista. Las evaluaciones del crecimiento de ambos hongos se realizaron con una regla graduada a las 18, 42, 66, 90 y 162 h.
El tipo de interacción hifal (lisis, vacuolización, granulación, enrollamiento y penetración) entre el antagonista y el patógeno se observó al microscopio óptico Zeiss (400/630x), a partir de fragmentos de micelio (tres réplicas por tratamiento), tomados de la zona de contacto entre ambos hongos.
Los datos de los experimentos se tabularon en Microsoft Excel y se procesaron mediante análisis de varianza factorial. Las medias se compararon según prueba de comparación de rangos múltiples de Tukey para un nivel de confianza de 95 %. Se empleó el paquete estadístico InfoStat/Profesional versión 1.1 (18).
RESULTADOS Y DISCUSIÓN
Efecto de metabolitos volátiles de T. asperellum en el crecimiento de A. solani
La inhibición del crecimiento micelial de A. solani, inducida por los metabolitos volátiles producidos por las cuatro cepas de Trichoderma, osciló de 16,22 a 73,08 %; a las 48 h se observaron diferencias significativas (p≤0,05) con el control (Tabla 1), con excepción de los metabolitos de la cepa Ta. 25. Los metabolitos volátiles de la cepa Ta. 85 mostraron diferencias estadísticas desde las primeras 24 h respecto al control, y a las 72 h, además, con los metabolitos de la cepa Ta. 25. No obstante, a las 96 h no se detectaron diferencias significativas en la inhibición del crecimiento del patógeno entre los metabolitos de las cepas, pero sí con el del control.
TABLA 1 Porcentaje de inhibición del crecimiento de A. solani por los metabolitos volátiles de las diferentes cepas de T. asperellum. / Percentage of mycelia growth inhibition of A. solani by the volatile metabolites of different strains of T. asperellum
| 24 h | 48 h | 72 h | 96 h | |||||
|---|---|---|---|---|---|---|---|---|
| mm | % | mm | % | mm | % | mm | % | |
|
|
1,60 ab | 38,46 | 5,60 a | 24,32 | 7,80 ab | 33,90 | 10,80 a | 26.03 |
|
|
1,80 ab | 30,77 | 6,00 a | 18,92 | 9,00 ab | 23,73 | 10,80 a | 26.03 |
|
|
1,40 ab | 46,15 | 6,20 ab | 16,22 | 9,40 b | 20,34 | 11,00 a | 24.66 |
|
|
0,70 a | 73,08 | 5,20 a | 29,73 | 6,40 a | 45,76 | 9,00 a | 38.36 |
| Control | 2,60 b | - | 7,40 b | - | 11,80 c | - | 14,60 b | - |
| ESx | 0,17 | 0,20 | 0,40 | 0,49 | ||||
| CV | 0,54 | 0,16 | 0,23 | 0,22 | ||||
Medias con letras diferentes, en una misma columna, difieren significativamente (p≤0,05).
En esta investigación se observó que no todas las cepas de Trichoderma, aún pertenecientes a la misma especie, tienen la misma efectividad inhibitoria sobre A. solani. La variabilidad de la capacidad antagónica de las cepas de Trichoderma utilizadas en este trabajo puede deberse a que cada cepa tiene diferente(s) mecanismo(s) de acción, velocidad de crecimiento, entre otras causas. Esto tiene relación con lo descrito por Hernández et al. (19), quienes notificaron que 20 de las 31 cepas de Trichoderma spp. produjeron metabolitos volátiles que inhibieron el crecimiento de Rhizoctonia solani Kühn entre 7,81 a 51,56 %. Esto confirma lo planteado por Martínez et al. (13), que los mecanismos de acción con fines de control biológico están más estrechamente relacionados con la cepa que con la especie de Trichoderma.
Los resultados están en correspondencia con los de Sanmartín et al. (7), quienes informaron que los metabolitos volátiles de cuatro cepas de T. asperellum inhibieron el crecimiento de Fusarium sp. y de Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. entre 42,4 % y 66,8 %, aunque no hubo diferencias significativas entre los metabolitos volátiles de las cepas frente al último patógeno. Mientras que Yao et al. (12) observaron inhibición significativa del crecimiento de Phytophthora infestans (Mont.) de Bary por los metabolitos producidos por el aislamiento HNA14 de Trichoderma. Resultados semejantes se notificaron por Stazzonelli et al. (11), pues observaron inhibición del crecimiento micelial de Sclerotinia sclerotiorum (Lib.) de Bary, entre 93, 33 y 89, 31 % por la emisión de metabolitos volátiles de 16 aislamientos de Trichoderma.
Los resultados de la presente investigación son similares a los Mokhtar y Dehimat (15), ya que usaron el mismo método y mostraron que las sustancias metabólicas volátiles de Trichoderma harzianum Rifai inhibieron el crecimiento micelial de Botrytis cinirea Pers.:Fr., Cladosporium sp., Stemphylium botryosum Wallroth entre 13,33 % y 50 %, respectivamente. Además, detectaron una disminución de la inhibición del crecimiento del patógeno con el paso del tiempo. Esto también se observó en el presente ensayo. Probablemente, este efecto se deba a que la acumulación de metabolitos tóxicos al patógeno disminuye con el tiempo, por lo que esta acción quizás solo tenga efecto fungistático.
Los resultados evidencian que las cepas de T. asperellum en estudio pueden manifestar su potencial antagónico en un periodo de 1 a 4 días. Esto se debe tener en cuenta como un indicador para la selección de cepas promisorias de Trichoderma para el manejo de A. solani en papa.
Efecto de metabolitos no volátiles de T. asperellum sobre el crecimiento de A. solani
Los metabolitos no volátiles de las cepas de T. asperellum inhibieron el crecimiento de A. solani desde 10,64 a 85,71 %, con diferencias significativas (p≤0,05) con el control a partir de las 48 h. Los metabolitos de la cepa Ta. 85 inhibieron el crecimiento de A. solani desde las 24 hasta las 192 h, con diferencias estadísticas respecto a las restantes variantes (Tabla 2). Los resultados de este ensayo mantienen la tendencia del experimento anterior, donde la cepa Ta. 85 muestra la mayor actividad antagónica y estabilidad. Stazzonelli et al. (11) informaron que los metabolitos no volátiles de 19 cepas de Trichoderma mostraron elevados porcentaje de inhibición del crecimiento de S. sclerotiorum. Similares resultados alcanzaron Montealegre et al. (20) y Hernández et al. (19), quienes obtuvieron inhibición del crecimiento de R. solani con metabolitos secundarios no volátiles producidos por Trichoderma spp.
De manera general, los resultados de este trabajo evidenciaron que Trichoderma tiene compuestos que, al ser excretados al medio, limitan el crecimiento del hongo patógeno. Este tipo de antagonismo, reconocido como antibiosis, es un modo de acción que pudiera estar asociado a una exoquitinasa extracelular, que provoca la liberación de algunos oligómeros de la pared del hongo diana e induce la expresión de endoquitinasas del micoparásito (21). Al ser estas liberadas, difunden y hacen que Trichoderma comience el ataque al hongo diana, antes del contacto físico entre ellos (22). Según estos resultados, la acción de metabolitos tóxicos (volátiles y no volátiles) de las cepas de Trichoderma es fungistática. Estos compuestos limitan la colonización del sustrato a los microorganismos en su radio de acción (13). Los resultados amplían los conocimientos sobre este género demuestran la existencia de cierta especificidad en el modo de acción de las cepas de T. asperellum evaluadas y ofrecen perspectivas para su uso y el de sus metabolitos. Esto pudiera contribuir al perfeccionamiento del manejo integrado del Tizón temprano en el cultivo de la papa.
TABLA 2 Porcentaje de inhibición del crecimiento de A. solani por los metabolitos no volátiles de las diferentes cepas de T. asperellum. / Percentage of mycelia growth inhibition of A. solani by non-volatile metabolites of different strains of T. asperellum.
| 48 h | 72 h | 96 h | 168 h | 192 h | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| mm | % | mm | % | mm | % | mm | % | mm | % | mm | % | |
|
|
0,90 b | 35,71 | 5,00 b | 44,44 | 9,60 b | 31,43 | 15,00 b | 10,71 | 28,60 ab | 12,27 | 33,00 b | 12,23 |
|
|
0,80 ab | 42,86 | 5,20 b | 42,22 | 9,00 b | 35,71 | 13,80 b | 17,86 | 28,20 ab | 13,50 | 33,60 b | 10,64 |
|
|
0,90 b | 35,71 | 6,20 b | 31,11 | 10,60 b | 24,29 | 13,60 b | 19,05 | 28,80 b | 11,66 | 32,80 b | 12,77 |
|
|
0,20 a | 85,71 | 2,80 a | 68,89 | 6,00 a | 57,14 | 9,40 a | 44,05 | 26,20 a | 19,63 | 29,40 a | 21,81 |
| Control | 1,40 b | 9,00 c | 14,00 c | 16,80 c | 32,60 c | 37,60 c | ||||||
| ESx | 0,10 | 0,44 | 0,54 | 0.52 | 0,49 | 0,59 | ||||||
| CV | 0,59 | 0,39 | 0,27 | 0,19 | 0,08 | 0,09 | ||||||
Medias con letras diferentes, en una misma columna. difieren significativamente (p≤0,05).
Efecto del pH sobre la interacción T. asperellum - A. solani a diferentes temperaturas
De manera general, se encontró que existe interacción entre los factores en estudio (pH, temperatura y cepa).
Al analizar los tres factores se observó que, para todas las cepas de T. asperellum evaluadas, la temperatura de 35°C afectó el crecimiento de A. solani a todos los pH (Fig. 1). Independientemente de la cepa, la mejor interacción pH-temperatura en la inhibición del patógeno en estudio es pH 5,2 y temperatura de 35oC; se destacan las cepas Ta. 12 y Ta. 85. La menor inhibición del patógeno se produjo a los pH 6 y 7 a las temperaturas 20 y 30oC.
Estos resultados indican que para diferentes ambientes, en dependencia de los valores del pH y de la temperatura, se necesitan cepas que tengan mayor plasticidad ecológica, para que su antagonismo pueda actuar en cualquier interacción de temperatura-pH.
En las bibliografías consultadas no se encontraron resultados del efecto antagónico de Trichoderma en la interacción pH-temperatura. No obstante, Petrișor et al. (22) tuvieron, con cepas de Trichoderma spp., mayor efecto inhibitorio del crecimiento de R. solani a pH 5,5 y temperatura 30°C. Ruano et al. (23) observaron que, de ocho aislados de Trichoderma, siete ejercieron inhibición sobre los aislados de Rosellinia necatrix Berl. ex Prill a 25°C.
Según Martínez et al. (13), las temperaturas entre 25 y 30oC están relacionadas con mayor desarrollo de Trichoderma, aunque pueden crecer a 35oC; esto está más relacionado con el aislamiento que con la especie. Estos mismos autores informaron que las especies de Trichoderma no son exigentes con relación al pH del sustrato; pueden crecer en suelos con pH desde 5,5 a 8,5, aunque los valores óptimos se encuentran entre 5,5-6,5, es decir, en un ambiente ligeramente ácido.
El Tizón temprano se desarrolla a temperaturas entre 10 y 35ºC y pH de 4,5 a 7,5 (2), por lo que para obtener una inhibición estable del crecimiento del patógeno se necesita seleccionar cepas de Trichoderma que expresen su antagonismo en ese intervalo. La cepa que cumple con estas condiciones, de manera general, es la Ta.85.

FIGURA 1 Crecimiento micelial de A. solani en CD con las cepas de T. asperellum bajo la interacción pH-temperatura a las 162 horas. / Effectiveness of the interaction pH-temperature on the inhibition of the micelial growth of A. solani at 162 hours.
En las interacciones hifales se observaron micoparasitismo, granulación, lisis y vacuolización de las paredes de las hifas de A. solani (Fig. 2); los tres últimos son los que predominan (Tabla 3). Esto es una evidencia de la presencia de enzimas extracelulares del antagonista con actividad lítica, como quitinasas, glucanasas y/o proteasas, entre otras (9), sobre las hifas del patógeno. Es de destacar que, independientemente que las cepas de Trichoderma a pH 5,2 mostraron la mayor inhibición del crecimiento de A. solani, la mayoría de estas ocasionaron lisis a pH 6 a las diferentes temperaturas, excepto a 25oC. Por otro lado, la mayor cantidad de interacciones hifales a los diferentes pH estuvo vinculada con las temperaturas: a pH 5,2 - 35 y 30oC, pH 6 - 30oC y pH 7 - 20 y 35oC. Los resultados pudieran servir para el manejo de las aplicaciones de este control biológico.
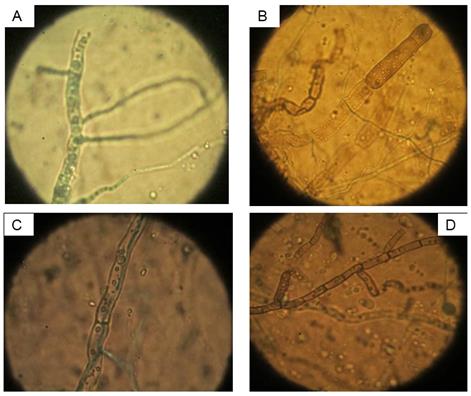
FIGURA 2 Interacciones hifales de cepas de T. asperellum sobre aislamiento de A. solani A: Ta.25-Granulación; B: Ta.12-Lisis; C: Ta.85-Micoparasitismo y D: Ta.85-Vacuolización. / Hyphal interactions of strains of T. asperellum on an isolate of A. solani A: Ta.25-Granulation; B: Ta.12-Lysis; C: Ta.85-Micoparasitism and D: Ta.85-Vacuolization
TABLA 3 Interacciones hifales de las cepas de T. asperellum frente a A. solani a diferentes pH y temperaturas. / Hyphal interactions of the strains of T. asperellum on A. solani at different values of pH and temperature.
| Cepas | Temperaturas oC | ||||
|---|---|---|---|---|---|
| 20 | 25 | 30 | 35 | ||
| pH 5,2 | 1 | GV | GV | GV | |
| 12 | GV | G | GV | GVL | |
| 25 | G | V | GVL | GV | |
| 85 | GV | GLP | GLP | GVLP | |
| pH 6 | 20 | 25 | 30 | 35 | |
| 1 | GVL | GV | GV | V | |
| 12 | GV | GV | GVL | G | |
| 25 | GVL | G | GVL | GV | |
| 85 | GVL | GV | GVLP | GVLP | |
| pH 7 | Cepas | 20 | 25 | 30 | 35 |
| 1 | GV | G | |||
| 12 | GV | G | G | GV | |
| 25 | G | V | G | GV | |
| 85 | GV | GL | GV | GV | |
Leyenda: G: Granulación, V: Vacuolización, L: Lisis, P: Parasitismo
CONCLUSIONES
Las cepas de T. asperellum presentaron, en mayor o menor medida, capacidad de inhibir el crecimiento de A. solani mediante metabolitos volátiles y no volátiles.
Las cepas de T. asperellum manifestaron diferencias en su antagonismo a diferentes valores de pH y temperatura.
Se evidenció, en las interacciones hifales, que hubo presencia de enzimas extracelulares del antagonista con actividad lítica sobre las hifas del patógeno, donde predominaron la granulación, la lisis y la vacuolización.
Existe especificidad en la capacidad inhibitoria de las cepas de T. asperellum frente al patógeno; la más promisoria es la Ta. 85.














