Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor v.16 n.1 Ciudad de la Habana ene.-abr. 2007
Cuantificación de lipopolisacárido en un proteoliposoma obtenido a partir de la superficie externa de Vibrio cholerae O1
José Luis Pérez, Yovania Fernández, Yisabel Aranguren, Maylín Alvarez, Reynaldo Acevedo, Oliver Pérez y Luis García.
Instituto Finlay, Centro de Investigación- Producción de Vacunas. Ave. 27 No. 19805,
Ciudad de
El lipopolisacárido (LPS) de Vibrio cholerae O1, a diferencia de la mayoría de las bacterias gramnegativas, no es reactivo en el ensayo del KDO, un método ampliamente utilizado para la cuantificación de LPS. Este LPS puede ser cuantificado por peso seco cuando se trata del antígeno en estado puro, pero cuando se necesita cuantificarlo, por ejemplo en un proteoliposoma, se requieren métodos de hidrólisis fuerte para que la molécula de KDO se exponga y sea reactiva en el ensayo antes mencionado. En este trabajo describimos un método rápido, sencillo y reproducible que nos permite cuantificar el LPS en un proteoliposoma obtenido a partir de la superficie externa de V. cholerae O1, El Tor Ogawa, mediante el uso de un anticuerpo monoclonal anti-LPS Ogawa en Western blot y la posterior evaluación del perfil reactivo en un densitómetro, utilizando LPS Ogawa purificado y cuantificado por peso seco como patrón de referencia. Este método puede ser aplicado a cualquier otra preparación que contenga LPS y que no pueda ser evaluada por KDO.
Palabras clave: Vibrio cholerae O1, LPS, immunoblot, densitómetro.
Introducción
El cólera es una de las infecciones entéricas que más drásticamente ha incidido en la salud de la población mundial (1, 2) y continúa siendo un serio problema en muchos países del mundo (3). El agente causal de esta enfermedad es Vibrio cholerae, de los serogrupos O1 y O139. El serogrupo O1 se divide en dos biotipos fundamentales: Clásico y El Tor, este último es el más ampliamente distribuido a nivel mundial y el principal responsable de la actual pandemia de la enfermedad (3).
En la actualidad se trabaja intensamente para obtener una vacuna efectiva de administración oral contra el cólera. Existen dos principales variantes de vacunas: las obtenidas mediante cepas vivas atenuadas genéticamente y las obtenidas mediante una combinación de cepas inactivadas por métodos físicos o químicos. Con cada variante se han logrado obtener preparados vacunales seguros, inmunogénicos y eficaces, ejemplo: OrocholTM, Berna Biotech, Switzerland (4, 5) y DukoralTM, licenciada por SBL Vaccine, Sweden (6, 7), que han sido licenciados en algunos países y son principalmente utilizados por viajeros desde países industrializados a áreas endémicas (8).
Existen otros candidatos vacunales en desarrollo: la cepa atenuada 638 V. cholerae O1 El Tor Ogawa, desarrollada en el Instituto Finlay en Cuba (9, 10), la cual fue capaz de conferir protección contra la cepa salvaje 3008 V. cholerae O1, El Tor Ogawa en un reto experimental en humanos (11) y recientemente fue evaluada en ensayos de fase I-II en Mozambique (en vías de publicación). También en Cuba se ha desarrollado una cepa inactivada formulada en tabletas (12), la cual se encuentra en ensayos preclínicos y próximamente será evaluada en voluntarios. La cepa atenuada Perú 15 (13), lista para ser evaluada en ensayos de fase II (8). Una vacuna inyectable antígeno O-conjugada (14), en desarrollo preclínico en el Instituto Pasteur (8) y una vacuna de DNA desnudo de administración intramuscular, que se encuentra en desarrollo preclínico en Malasia (8).
En el Instituto Finlay en Cuba, también estamos trabajando en la obtención de un candidato a vacuna por subunidades, como una variante alternativa para proteger contra cólera pero en una formulación combinada contra enfermedades entéricas. Se ha trabajado en la purificación parcial y caracterización preliminar de extractos de proteínas de membrana externa-lipopolisacárido (PME-LPS) obtenidos a partir de la superficie externa de V. cholerae O1, utilizando diferentes detergentes (15), con el objetivo de seleccionar un proteoliposoma que posteriormente será transformado en un cocleato para hacer factible su uso por vía oral en humanos. El cocleato, sería la plataforma de inclusión de otros antígenos no relacionados, que pudieran ser obtenidos a partir de Shigella, Salmonella, E. coli, Rotavirus o Helicobacter pilori, etc).
Para caracterizar un proteoliposoma, entre otras cosas, se hace necesario determinar su contenido de LPS. La determinación de KDO (keto–3-deoxy-d-manose-octulosonico acid) ha sido ampliamente utilizada para la cuantificación de LPS (16), pero este método no es aconsejable para la cuantificación del LPS de V. cholerae, debido a que en su estructura nativa, la molécula de KDO se encuentra muy interna y no es reactiva, por tanto se hace necesario aplicar métodos de hidrólisis fuertes que destruyan la molécula y permitan la exposición del KDO (17). Otro método para la cuantificación del LPS en extractos de membrana externa, es el uso del ensayo del Limulus Amebocytes Lised (LAL) (15, 18), pero este ensayo es costoso y consideramos que pudiera subestimar el contenido de LPS en un proteoliposoma, pues las moléculas de LPS que quedan atrapadas en el interior de la estructura del proteoliposoma no son reactivas. El mismo fenómeno ocurriría si intentamos cuantificar el LPS de un proteoliposoma mediante un ELISA de inhibición utilizando un anticuerpo monoclonal anti-LPS.
En este trabajo describimos un método de cuantificación del LPS en un proteoliposoma, que es menos costoso que el LAL, es sencillo, rápido y reproducible y consideramos que ofrece un resultado más exacto que aquel que ofrece el ensayo del LAL y el ELISA de inhibición. Este método puede ser aplicado para otras preparaciones similares de otros microorganismos, cuyos LPS no sean reactivos por el método del KDO o cuyas determinaciones sean interferidas por otros componentes estructurales o tampones.
Materiales y Métodos
Cepa y condiciones de cultivo
La cepa C7258, V. cholerae O1 El Tor Ogawa (19), fue cultivada en medio Caldo-Triptona-Soya (TSB), durante 8 h a
Purificación del LPS de V. cholerae O1
Se procedió básicamente según el método descrito por Westphal y colaboradores en 1965 (20). La biomasa celular, obtenida como resultado de la centrifugación del cultivo a 17 700 x g durante 1 h a 4 oC, se resuspendió en agua a 60 mg/mL. Posteriormente se añadió igual volumen de fenol al 90% y se incubó durante 30 min a 68 oC. Luego esta mezcla se enfrió en baño de agua con hielo y se colocó a 4 oC durante toda la noche hasta la formación de fases, se colectó la fase superior o acuosa, se centrifugó a 33 300 x g durante 30 min, el sobrenadante se dializó contra abundante agua destilada y se ultracentrifugó repetidas veces a 65 000 x g durante 5 h a 4 oC. Los sedimentos obtenidos como resultado de cada ultracentrifugación, se resuspendieron en agua y se sometieron a tratamiento con Dnasa y Rnasa (Sigma) (0,1 mg/ 20 mL, en agitación y a 37 oC durante 2 h) y posteriormente con Pronasa (Sigma) (0,2 mg/ 20 mL, a temperatura ambiente durante 48 h). La muestra tratada se colocó durante 10 min a 100 oC, se centrifugó a 33 300 x g durante 15 min y el sobrenadante se volvió a ultracentrifugar repetidas veces bajo las mismas condiciones antes descritas. Finalmente el sedimento obtenido se resuspendió en agua, se rotó, evaporó y se colocó en cámara de secado al vacío hasta la sequedad para su cuantificación por peso. En esta preparación se evaluó la ausencia de proteínas, utilizando el método de Lowry (21) y el SDS-PAGE (15% de acrilamida) (22) seguido de una tinción con plata (23). La ausencia de ácidos nucleicos como contaminantes fue evaluada mediante un barrido espectrofoto-métrico desde
Obtención del proteoliposoma
Se utilizó el método descrito por Pérez y colaboradores (15). Las células fueron resuspendidas en solución tampón
Cuantificación del LPS en el crudo de proteoliposoma y fracciones
El proteoliposoma total y sus fracciones, así como diferentes diluciones del LPS purificado, fueron aplicados en gel de poliacrylamida (12,5%) en presencia de SDS (SDS-PAGE (22). Posterior al desarrollo de la electroforesis, los antígenos fueron transferidos desde el gel (gel 1) a un papel de nitrocelulosa de 0,45 mm (Sartorius AG W-3400, Goettingen. Germany). Como control y ajuste de la transferencia (realizada en un Multiphor II, Pharmacia, a 20V, 300mA y durante 2 h a temperatura ambiente) se colocó otro gel de poliacrylamida (gel 2) detrás del papel de nitrocelulosa. Al concluir la transferencia, los geles 1 y 2, se sometieron a tinción con plata (23), para comprobar que los antígenos habían sido totalmente transferidos al papel de nitrocelulosa, el cual fue sometido a un immunoblot, siguiendo el procedimiento descrito por Burnette (24). Brevemente, el papel de nitrocelulosa se colocó en leche descremada al 3% y luego de 1 h a 37 oC en agitación, se procedió a realizar tres pasos de lavado con PBS-tween 20 al 0,5%, a continuación se añadió un anticuerpo monoclonal anti-LPS Ogawa (2B4G5, 10mg/mL) (25), suministrado por el Departamento de Anticuerpos Monoclonales del Instituto Finlay de C. de
Resultados y Discusión
El LPS de V. cholerae O1, como el de la mayoría de las bacterias gramnegativas, es la molécula más abundante en la superficie de la célula, formando parte de la barrera protectora frente a agentes hidrofóbicos y detergentes. La estructura química del LPS consta de tres regiones químicamente definidas: el lípido A, el núcleo y el antígeno O. El lípido A forma parte de la bicapa lipídica de la membrana externa y el núcleo se une al lípido A a través de la molécula conocida como KDO. La región más externa es el antígeno O el cual se une al núcleo (26).
Investigaciones iniciales no detectaron la presencia de KDO en el núcleo del LPS de V. cholerae. Esto puede ser explicado debido a que hoy se conoce que el KDO se libera del LPS, solamente bajo condiciones de hidrólisis fuertes (17) lo que no ocurre así con el KDO de muchas otras especies como Salmonella, E. coli, Shigella, Pseudomona, etc.
El LPS de V. cholerae es el antígeno responsable de la mayor parte de la respuesta inmune protectora contra la bacteria, aunque también se ha encontrado respuesta inmune protectora contra otros componentes, como Proteínas de Membrana Externa (PME) y fimbrias (27, 28).
Por tanto, si se diseña una preparación antigénica (proteoliposoma), para inducir respuesta inmune contra cólera, el LPS debe ser inevitablemente incluido. En un estudio previo (15), caracterizamos diferentes extractos de membrana externa con el objetivo de seleccionar un candidato vacunal atendiendo a su capacidad para generar una elevada respuesta vibriocida. Durante el proceso de caracterización nos enfrentamos a una dificultad práctica: la cuantificación del LPS en cada preparación. Como el LPS de V. cholerae no puede ser cuantificado por el método del KDO, diferentes autores han utilizado el peso seco (15) o el ensayo del LAL (15, 29, 30). Cuando se trata del antígeno en estado puro, la cuantificación por peso seco es una variante aceptada, dependiendo de la sensibilidad de los métodos utilizados para evaluar la pureza y para realizar la pesada. Sin embargo, cuando el LPS forma parte de una preparación multiantigénica (proteoliposoma), el peso seco no es eficaz y por tanto se requiere de la alternativa, el ensayo del LAL, que es un ensayo descrito para evaluar unidades endotóxicas, pero puede ser utilizado para cuantificar LPS en una preparación dada, siempre y cuando se utilice el antígeno puro y cuantificado como referencia. El LAL, puede ser un ensayo más o menos exacto en los resultados que ofrece, dependiendo del tipo de preparación, es costoso y no disponible en todos los laboratorios.
En un proteoliposoma, el LPS generalmente se distribuye tanto en la superficie como en el interior de la estructura. El LPS en la superficie puede ser detectado sin problemas en ensayos como el LAL o el ELISA de inhibición utilizando un anticuerpo monoclonal anti-LPS, pero estos métodos no son eficaces para detectar el LPS que se distribuye hacia el interior de la estructura, por tanto se convierten en métodos que ofrecen resultados inexactos. El SDS-PAGE seguido de una tinción con plata específica para LPS y posteriormente el análisis en el densitómetro, pudiera ser un método eficaz, pero en la práctica ocurre con mucha frecuencia que este método de tinción revela, además del LPS, determinadas glicoproteínas presentes en la muestra, las cuales hacen la lectura del densitómetro inespecífica para LPS. Sin embargo, si un proteoliposoma se somete a un SDS-PAGE en condiciones reductoras, conjuntamente con diferentes concentraciones del LPS purificado como referencia, seguido de un Western blot con un anticuerpo monoclonal específico para el LPS y posteriormente se evalúa el perfil reactivo en el densitómetro, entonces la determinación realizada sería mucho más exacta.

En
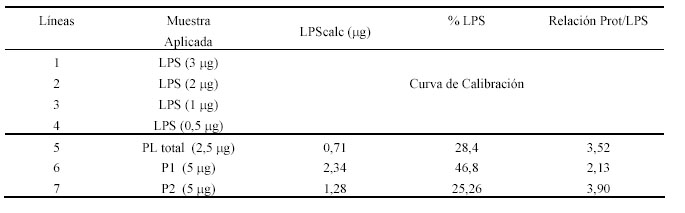
obtenidos indicaron una proporción proteínas: LPS equivalente a 4.61:1, es decir según este ensayo, el proteoliposoma total obtenido con SDS preparado al 15% contenía aproximadamente un 20% de LPS. En cambio se puede observar que los resultados obtenidos utilizando el método Western blot-densitometría, indican que en esa preparación el contenido de LPS es de aproximadamente el 30%, lo cual confirma que efectivamente, existe determinada cantidad de LPS en el proteoliposoma, que no es detectada con el ensayo del LAL y sí con el método propuesto, por tanto es más exacto, además es sencillo, no es costoso y puede realizarse en cualquier laboratorio de bioquímica.
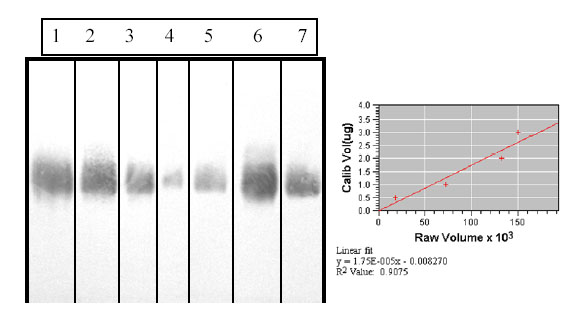
Figura 2. Perfil reactivo en Western blot utilizando un anticuerpo monoclonal anti-LPS Ogawa (2B4G5). Líneas 1, 2, 3 y 4: LPS Ogawa (3, 2, 1 y 0,5 mg respectivamente), Línea 5: PL total (2,5 mg de proteínas), Línea 6: P1 (5 mg de proteínas) y Línea 7: P2 (5 mg de proteínas).
Tabla 1. Resultados de la cuantificación de LPS por densitometría.
Finalmente, consideramos que el método propuesto puede ser aplicado para otras preparaciones similares de otros microorganismos, cuyos LPS no sean reactivos por el método del KDO o cuyas determinaciones sean interferidas por otros componentes estructurales o tampones.
Agradecimientos
Queremos expresar nuestro agradecimiento a Gustavo Falero Díaz, Jefe del Departamento de Anticuerpos Monoclonales del Instituto Finlay, por su gentileza en suministrarnos el anticuerpo monoclonal anti-LPS Ogawa (2B4G5) utilizado en este estudio.
Referencias
1. Mintz ED, Tauxe RV and Levine MM. The global resurgence of cholera. In Noah N, and O`Mahony M. (ed), Communicable disease: epidemiology and control. John wiley & Sons, Chichester, England;1998:63-104.
2. Tacket CO, Cohen MB, Wasserman SS, Losonsky G, Livio S, kotloff K, Edelman R, Kaper JB, Cryz SJ, Giannella RA, Schiff G, and Levine MM. Randomized, double-blind, placebo-controlled, multicentered trial of the efficacy, of a single dose of live oral cholera vaccine CVD103-HgR in preventing cholera following challenge with Vibrio cholerae O1 El Tor Inaba three months after vaccination. Infect. Immun 1999; 67:6341-6345.
3. Sack D, Sack RB, Nair GB, Nair AK, and Siddique AK. Cholera. Lancet 2004;363:223–233.
4. Levine MM, Kaper JB, Herrington D, Ketley J, Losonsky G, Tacket CO, et al. Safety, immunogenicity, and efficacy of recombinant live oral cholera vaccines, CVD 103 and CVD 103-HgR. Lancet 1988;2(8609):467–70.
5. Tacket CO, Cohen MB, Wasserman SS, Losonsky G, Livio S, Kotloff K, et al. Randomized, double-blind, placebo-controlled, multicentered trial of the efficacy of a single dose of live oral cholera vaccine CVD 103-HgR in preventing cholera following challenge with Vibrio cholerae 01 El tor Inaba three months after vaccination. Infect Immun 1999. 67(12):6341–5.
6. Clemens JD, Sack DA, Harris JR, Van Loon F, Chakraborty J, Ahmed F, et al. Field trial of oral cholera vaccines in Bangladesh: results from 3-year follow-up. Lancet 1990; 335 (8684): 270–3.
7. Sánchez JL, Vásquez B, Begue RE, Meza R, Castellares G, Cabezas C, et al. Protective efficacy of oral whole-cell/recombinant-B-subunit cholera vaccine in Peruvian military recruits. Lancet 1994; 344 (8932):1273–6.
8. Marc P. Girard, Duncan Steele, Claire-Lise Chaignat, Marie Paule Kieny. A review of vaccine research and development: human enteric infections. Vaccine 2006; 24:2732–2750.
9. Robert A, Silva A, Benítez JA, Rodríguez BL, Fando R, Campo J, Sengupta DK, Boesman-Finkelstein M and Finkelstein RA. Tagging a Vibrio cholerae El Tor candidate vaccine strain disruption of its hemagglutinin / protease gen using a novel reporter enzyme: Clostridium thermocellum endoglucanase A. Vaccine 1996;14:1517-1522.
10. Benítez J, García L, Silva A, Garcia H, Fando R, Cedré B, Pérez A, Campo J, Rodriguez BL, Pérez JL, Valmaseda T, Pérez O, Pérez A, Ramirez M, Ledón T, Díaz M, Lastre M, Bravo L and Sierra G. Preliminary assessment of the safety and immunogenicity of a new CTX F - negative, hemagglutinin/protease–defective El Tor strain as a cholera vaccine candidate. Infect. Immun 1999; 67:539-545.
11. García L, Díaz Jidy M, García H, Rodríguez B L, Fernández R, Año G, Cedré B, Valmaseda T, Suzarte E, Ramirez M, Pino Y, Campos J, Menéndez J, Varela R., González D, Pérez O, Serrano T, Lastre M., Miralles F, del Campo J, Maestre J. L, Pérez JL, Talavera A, Pérez A, Marrero K, Ledón T and Fando R. The Vaccine Candidate V. cholerae 638 is protective against cholera in healthy volunteers. Infection and Immunity 2005; 73 (5):3018 – 3024.
12. Talavera A, Año G, Pino Y, Castaño J, Uribarri E, Riverón L, Gil S, Fernández S, Cedré B, Valmaseda T, Pérez JL, Infante JF, García L and Sierra G. Formulation in tablets of a cholera Whole cells inactivated vaccine candidate Vaccine 2006;24: 3381-3387.
13. Qadri F, Chowdhury MI, Faruque SM, Salam MA, Ahmed T, Begum YA, et al. Randomized, controlled study of the safety and immunogenicity of Peru-15, a live attenuated oral vaccine candidate for cholera, in adult volunteers in Bangladesh. J Infect Dis 2005;192 (4): 573–9.
14. Boutonnier A, Villeneuve S, Nato F, Dassy B, Fournier JM. Preparation, immunogenicity, and protective efficacy, in a murine model, of a conjugate vaccine composed of the polysaccharide moiety of the lipopolysaccharide of Vibrio cholerae 0139 bound to tetanus toxoid. Infect. Immun 2001; 69 (5):3488–93.
15. Pérez JL, González Y, Año G, Cedré B, Valmaseda T, Alvarez M., Serrano D, Millián E, Fariñas M, Talavera A y García L. Obtención de extractos de membrana externa de Vibrio cholerae O1, mediante el uso de diferentes detergentes. VacciMonitor 2006;15 (1):1-7.
16. Karhanis YD, Zeltner JY, Jackson JJ and Carlo DJ. A new and improved microassay to determine 2-keto-3-deoxyoctonate in lipopolysaccharide of Gram negative bacteria. Anal. Biochem 1978; 85:595-601.
17. Brade H. Ocurrence of 2-keto-deoxyoctanoic acid 5-phosphate in lipopolysaccharides of Vibrio cholerae Ogawa and Inaba. J. Bacteriol 1985; 161:795-798.
18. Cooper JF and Pearson SM. Detection of endotoxin in Biological products by the Limulus test. Develop Biol Standard 1977; 34:7-13.
19. Hase CC, Thai LS, Boesman-Finkelstein M, Mar VL, Burnette WN, Kaslow HR, Stevens LA, Moss J, and Finkelstein RA. Construction and characterization of recombinant Vibrio cholerae strains producing inactive cholera toxin analogs. Infect. Immun 1994. 62: 3051-3055.
20. Westphal O., and K. Jam. Bacterial lipopolisaccharides. In R. L. Whistter (ed). Methods in carbohydrate chemestry. Academic Press. Inc. New York, 1965; 5:83 -91.
21. Lowry OH, et al. A protein measurement with the folin - phenol reagent. Biol. Chem 1951;193:265-275.
22. Lammli NK. Cleareage of strutural proteins during the assembly of the head of bacterio phage T4. Nature 1970; 227: 680-685.
23. Tsai, C. M., and S. E. Frash. Silver stain a method to proteins detection after polyacrilamide gel electrophoresis. Anal. Biochem 1982; 199:115 -119.
24. Burnette WN. Western Blotting electrophoretic transfer of protein from sodium dodecyl suphate polyacrilamide get to a modified nitrocelulose and radiographic detection with antibodies and radiodinated protein A. Anal. Biochem 1980; 112: 192-200.
25. Año G, García H., Balmaceda T, Cedre B, Pino Y, Ancheta O, Pérez JL, García L y Talavera A. Antigenicidad e inmunogenicidad de una cepa de Vibrio cholerae inactivada. Biotecnología Aplicada 2003; 20 (1): 9-13.
26. Bennish ML. Cholera: pathophysiology, clinical features, and treatment. En I. K. Wachsmuth, P. A. Blake (ed), Vibrio cholerae and cholera: molecular to global perspectives. ASM Press, Washington, D. C. 1994: 229-255.
27. Attridge SR. and D. Rowley. Prophylactic significance of the non-lipopolysaccharide antigens of Vibrio cholerae. J. Infect. Dis 1983; 148:864-872.
28. Jacob A, VB. Sinha, MK. Sahib, R Srivastava, JB. Kaper, and BS Srivastava. Identification of a 33 kDa antigens associated with an adhesive and colonizing strain of Vibrio cholerae El Tor and its role in protection. Vaccine 1993; 11:179-188.
29. Gupta RK, Szu SC, Finkelstein RA and Robbins JB. Synthesis, characterization, and some immunological properties of conjugates composed of the detoxified lipopolysaccharide of Vibrio cholerae O1 serotype Inaba bound to cholera toxin. Infect. Immun 1992; 60:3201-3208.
30. Hochstein HD. Role of FDA in regulating the Limulus amoebocyte lysate test. In: Prior RB. editor. Clinical applications of the Limulus amoebocyte lysate test. Boca Raton, FL, USA: CRC Press. 1990.
31. Martínez I., Muñoz Y., Iglesias N., Fajardo E., Balboa J., Riveron L., Talavera A., Cremata J., Sierra G., García L. and Jones C. Aportes Analíticos al Control de Calidad de la Vacuna Cubana VA-MENGOC BC® y de una Nueva Vacuna Antitifoidea. Acta Farm. Bonaerense 2006;25 (2):231-8.
Lipopolysaccharide quantification in a proteoliposome obtained from external surface of Vibrio cholerae O1
Abstract
Unlike most of the Gram-negative bacteria, Vibrio cholerae O1 lipopolysacharide (LPS), does not react in KDO assay, a widely used method for the quantification of these mole
Keywords: Vibrio cholerae 01, LPS, Immunoblot, densitometry.
Recibido: Marzo de 2007 Aprobado: Abril de 2007
Cuantificación de lipopolisacárido en un proteoliposoma obtenido a partir de la superficie externa de Vibrio cholerae O1
José Luis Pérez, Yovania Fernández, Yisabel Aranguren, Maylín Alvarez, Reynaldo Acevedo, Oliver Pérez y Luis García.
Instituto Finlay, Centro de Investigación- Producción de Vacunas. Ave. 27 No. 19805,
Ciudad de
El lipopolisacárido (LPS) de Vibrio cholerae O1, a diferencia de la mayoría de las bacterias gramnegativas, no es reactivo en el ensayo del KDO, un método ampliamente utilizado para la cuantificación de LPS. Este LPS puede ser cuantificado por peso seco cuando se trata del antígeno en estado puro, pero cuando se necesita cuantificarlo, por ejemplo en un proteoliposoma, se requieren métodos de hidrólisis fuerte para que la molécula de KDO se exponga y sea reactiva en el ensayo antes mencionado. En este trabajo describimos un método rápido, sencillo y reproducible que nos permite cuantificar el LPS en un proteoliposoma obtenido a partir de la superficie externa de V. cholerae O1, El Tor Ogawa, mediante el uso de un anticuerpo monoclonal anti-LPS Ogawa en Western blot y la posterior evaluación del perfil reactivo en un densitómetro, utilizando LPS Ogawa purificado y cuantificado por peso seco como patrón de referencia. Este método puede ser aplicado a cualquier otra preparación que contenga LPS y que no pueda ser evaluada por KDO.
Palabras clave: Vibrio cholerae O1, LPS, immunoblot, densitómetro.
Introducción
El cólera es una de las infecciones entéricas que más drásticamente ha incidido en la salud de la población mundial (1, 2) y continúa siendo un serio problema en muchos países del mundo (3). El agente causal de esta enfermedad es Vibrio cholerae, de los serogrupos O1 y O139. El serogrupo O1 se divide en dos biotipos fundamentales: Clásico y El Tor, este último es el más ampliamente distribuido a nivel mundial y el principal responsable de la actual pandemia de la enfermedad (3).
En la actualidad se trabaja intensamente para obtener una vacuna efectiva de administración oral contra el cólera. Existen dos principales variantes de vacunas: las obtenidas mediante cepas vivas atenuadas genéticamente y las obtenidas mediante una combinación de cepas inactivadas por métodos físicos o químicos. Con cada variante se han logrado obtener preparados vacunales seguros, inmunogénicos y eficaces, ejemplo: OrocholTM, Berna Biotech, Switzerland (4, 5) y DukoralTM, licenciada por SBL Vaccine, Sweden (6, 7), que han sido licenciados en algunos países y son principalmente utilizados por viajeros desde países industrializados a áreas endémicas (8).
Existen otros candidatos vacunales en desarrollo: la cepa atenuada 638 V. cholerae O1 El Tor Ogawa, desarrollada en el Instituto Finlay en Cuba (9, 10), la cual fue capaz de conferir protección contra la cepa salvaje 3008 V. cholerae O1, El Tor Ogawa en un reto experimental en humanos (11) y recientemente fue evaluada en ensayos de fase I-II en Mozambique (en vías de publicación). También en Cuba se ha desarrollado una cepa inactivada formulada en tabletas (12), la cual se encuentra en ensayos preclínicos y próximamente será evaluada en voluntarios. La cepa atenuada Perú 15 (13), lista para ser evaluada en ensayos de fase II (8). Una vacuna inyectable antígeno O-conjugada (14), en desarrollo preclínico en el Instituto Pasteur (8) y una vacuna de DNA desnudo de administración intramuscular, que se encuentra en desarrollo preclínico en Malasia (8).
En el Instituto Finlay en Cuba, también estamos trabajando en la obtención de un candidato a vacuna por subunidades, como una variante alternativa para proteger contra cólera pero en una formulación combinada contra enfermedades entéricas. Se ha trabajado en la purificación parcial y caracterización preliminar de extractos de proteínas de membrana externa-lipopolisacárido (PME-LPS) obtenidos a partir de la superficie externa de V. cholerae O1, utilizando diferentes detergentes (15), con el objetivo de seleccionar un proteoliposoma que posteriormente será transformado en un cocleato para hacer factible su uso por vía oral en humanos. El cocleato, sería la plataforma de inclusión de otros antígenos no relacionados, que pudieran ser obtenidos a partir de Shigella, Salmonella, E. coli, Rotavirus o Helicobacter pilori, etc).
Para caracterizar un proteoliposoma, entre otras cosas, se hace necesario determinar su contenido de LPS. La determinación de KDO (keto–3-deoxy-d-manose-octulosonico acid) ha sido ampliamente utilizada para la cuantificación de LPS (16), pero este método no es aconsejable para la cuantificación del LPS de V. cholerae, debido a que en su estructura nativa, la molécula de KDO se encuentra muy interna y no es reactiva, por tanto se hace necesario aplicar métodos de hidrólisis fuertes que destruyan la molécula y permitan la exposición del KDO (17). Otro método para la cuantificación del LPS en extractos de membrana externa, es el uso del ensayo del Limulus Amebocytes Lised (LAL) (15, 18), pero este ensayo es costoso y consideramos que pudiera subestimar el contenido de LPS en un proteoliposoma, pues las moléculas de LPS que quedan atrapadas en el interior de la estructura del proteoliposoma no son reactivas. El mismo fenómeno ocurriría si intentamos cuantificar el LPS de un proteoliposoma mediante un ELISA de inhibición utilizando un anticuerpo monoclonal anti-LPS.
En este trabajo describimos un método de cuantificación del LPS en un proteoliposoma, que es menos costoso que el LAL, es sencillo, rápido y reproducible y consideramos que ofrece un resultado más exacto que aquel que ofrece el ensayo del LAL y el ELISA de inhibición. Este método puede ser aplicado para otras preparaciones similares de otros microorganismos, cuyos LPS no sean reactivos por el método del KDO o cuyas determinaciones sean interferidas por otros componentes estructurales o tampones.
Materiales y Métodos
Cepa y condiciones de cultivo
La cepa C7258, V. cholerae O1 El Tor Ogawa (19), fue cultivada en medio Caldo-Triptona-Soya (TSB), durante 8 h a
Purificación del LPS de V. cholerae O1
Se procedió básicamente según el método descrito por Westphal y colaboradores en 1965 (20). La biomasa celular, obtenida como resultado de la centrifugación del cultivo a 17 700 x g durante 1 h a 4 oC, se resuspendió en agua a 60 mg/mL. Posteriormente se añadió igual volumen de fenol al 90% y se incubó durante 30 min a 68 oC. Luego esta mezcla se enfrió en baño de agua con hielo y se colocó a 4 oC durante toda la noche hasta la formación de fases, se colectó la fase superior o acuosa, se centrifugó a 33 300 x g durante 30 min, el sobrenadante se dializó contra abundante agua destilada y se ultracentrifugó repetidas veces a 65 000 x g durante 5 h a 4 oC. Los sedimentos obtenidos como resultado de cada ultracentrifugación, se resuspendieron en agua y se sometieron a tratamiento con Dnasa y Rnasa (Sigma) (0,1 mg/ 20 mL, en agitación y a 37 oC durante 2 h) y posteriormente con Pronasa (Sigma) (0,2 mg/ 20 mL, a temperatura ambiente durante 48 h). La muestra tratada se colocó durante 10 min a 100 oC, se centrifugó a 33 300 x g durante 15 min y el sobrenadante se volvió a ultracentrifugar repetidas veces bajo las mismas condiciones antes descritas. Finalmente el sedimento obtenido se resuspendió en agua, se rotó, evaporó y se colocó en cámara de secado al vacío hasta la sequedad para su cuantificación por peso. En esta preparación se evaluó la ausencia de proteínas, utilizando el método de Lowry (21) y el SDS-PAGE (15% de acrilamida) (22) seguido de una tinción con plata (23). La ausencia de ácidos nucleicos como contaminantes fue evaluada mediante un barrido espectrofoto-métrico desde
Obtención del proteoliposoma
Se utilizó el método descrito por Pérez y colaboradores (15). Las células fueron resuspendidas en solución tampón
Cuantificación del LPS en el crudo de proteoliposoma y fracciones
El proteoliposoma total y sus fracciones, así como diferentes diluciones del LPS purificado, fueron aplicados en gel de poliacrylamida (12,5%) en presencia de SDS (SDS-PAGE (22). Posterior al desarrollo de la electroforesis, los antígenos fueron transferidos desde el gel (gel 1) a un papel de nitrocelulosa de 0,45 mm (Sartorius AG W-3400, Goettingen. Germany). Como control y ajuste de la transferencia (realizada en un Multiphor II, Pharmacia, a 20V, 300mA y durante 2 h a temperatura ambiente) se colocó otro gel de poliacrylamida (gel 2) detrás del papel de nitrocelulosa. Al concluir la transferencia, los geles 1 y 2, se sometieron a tinción con plata (23), para comprobar que los antígenos habían sido totalmente transferidos al papel de nitrocelulosa, el cual fue sometido a un immunoblot, siguiendo el procedimiento descrito por Burnette (24). Brevemente, el papel de nitrocelulosa se colocó en leche descremada al 3% y luego de 1 h a 37 oC en agitación, se procedió a realizar tres pasos de lavado con PBS-tween 20 al 0,5%, a continuación se añadió un anticuerpo monoclonal anti-LPS Ogawa (2B4G5, 10mg/mL) (25), suministrado por el Departamento de Anticuerpos Monoclonales del Instituto Finlay de C. de
Resultados y Discusión
El LPS de V. cholerae O1, como el de la mayoría de las bacterias gramnegativas, es la molécula más abundante en la superficie de la célula, formando parte de la barrera protectora frente a agentes hidrofóbicos y detergentes. La estructura química del LPS consta de tres regiones químicamente definidas: el lípido A, el núcleo y el antígeno O. El lípido A forma parte de la bicapa lipídica de la membrana externa y el núcleo se une al lípido A a través de la molécula conocida como KDO. La región más externa es el antígeno O el cual se une al núcleo (26).
Investigaciones iniciales no detectaron la presencia de KDO en el núcleo del LPS de V. cholerae. Esto puede ser explicado debido a que hoy se conoce que el KDO se libera del LPS, solamente bajo condiciones de hidrólisis fuertes (17) lo que no ocurre así con el KDO de muchas otras especies como Salmonella, E. coli, Shigella, Pseudomona, etc.
El LPS de V. cholerae es el antígeno responsable de la mayor parte de la respuesta inmune protectora contra la bacteria, aunque también se ha encontrado respuesta inmune protectora contra otros componentes, como Proteínas de Membrana Externa (PME) y fimbrias (27, 28).
Por tanto, si se diseña una preparación antigénica (proteoliposoma), para inducir respuesta inmune contra cólera, el LPS debe ser inevitablemente incluido. En un estudio previo (15), caracterizamos diferentes extractos de membrana externa con el objetivo de seleccionar un candidato vacunal atendiendo a su capacidad para generar una elevada respuesta vibriocida. Durante el proceso de caracterización nos enfrentamos a una dificultad práctica: la cuantificación del LPS en cada preparación. Como el LPS de V. cholerae no puede ser cuantificado por el método del KDO, diferentes autores han utilizado el peso seco (15) o el ensayo del LAL (15, 29, 30). Cuando se trata del antígeno en estado puro, la cuantificación por peso seco es una variante aceptada, dependiendo de la sensibilidad de los métodos utilizados para evaluar la pureza y para realizar la pesada. Sin embargo, cuando el LPS forma parte de una preparación multiantigénica (proteoliposoma), el peso seco no es eficaz y por tanto se requiere de la alternativa, el ensayo del LAL, que es un ensayo descrito para evaluar unidades endotóxicas, pero puede ser utilizado para cuantificar LPS en una preparación dada, siempre y cuando se utilice el antígeno puro y cuantificado como referencia. El LAL, puede ser un ensayo más o menos exacto en los resultados que ofrece, dependiendo del tipo de preparación, es costoso y no disponible en todos los laboratorios.
En un proteoliposoma, el LPS generalmente se distribuye tanto en la superficie como en el interior de la estructura. El LPS en la superficie puede ser detectado sin problemas en ensayos como el LAL o el ELISA de inhibición utilizando un anticuerpo monoclonal anti-LPS, pero estos métodos no son eficaces para detectar el LPS que se distribuye hacia el interior de la estructura, por tanto se convierten en métodos que ofrecen resultados inexactos. El SDS-PAGE seguido de una tinción con plata específica para LPS y posteriormente el análisis en el densitómetro, pudiera ser un método eficaz, pero en la práctica ocurre con mucha frecuencia que este método de tinción revela, además del LPS, determinadas glicoproteínas presentes en la muestra, las cuales hacen la lectura del densitómetro inespecífica para LPS. Sin embargo, si un proteoliposoma se somete a un SDS-PAGE en condiciones reductoras, conjuntamente con diferentes concentraciones del LPS purificado como referencia, seguido de un Western blot con un anticuerpo monoclonal específico para el LPS y posteriormente se evalúa el perfil reactivo en el densitómetro, entonces la determinación realizada sería mucho más exacta.

En
obtenidos indicaron una proporción proteínas: LPS equivalente a 4.61:1, es decir según este ensayo, el proteoliposoma total obtenido con SDS preparado al 15% contenía aproximadamente un 20% de LPS. En cambio se puede observar que los resultados obtenidos utilizando el método Western blot-densitometría, indican que en esa preparación el contenido de LPS es de aproximadamente el 30%, lo cual confirma que efectivamente, existe determinada cantidad de LPS en el proteoliposoma, que no es detectada con el ensayo del LAL y sí con el método propuesto, por tanto es más exacto, además es sencillo, no es costoso y puede realizarse en cualquier laboratorio de bioquímica.

Figura 2. Perfil reactivo en Western blot utilizando un anticuerpo monoclonal anti-LPS Ogawa (2B4G5). Líneas 1, 2, 3 y 4: LPS Ogawa (3, 2, 1 y 0,5 mg respectivamente), Línea 5: PL total (2,5 mg de proteínas), Línea 6: P1 (5 mg de proteínas) y Línea 7: P2 (5 mg de proteínas).
Tabla 1. Resultados de la cuantificación de LPS por densitometría.

Finalmente, consideramos que el método propuesto puede ser aplicado para otras preparaciones similares de otros microorganismos, cuyos LPS no sean reactivos por el método del KDO o cuyas determinaciones sean interferidas por otros componentes estructurales o tampones.
Agradecimientos
Queremos expresar nuestro agradecimiento a Gustavo Falero Díaz, Jefe del Departamento de Anticuerpos Monoclonales del Instituto Finlay, por su gentileza en suministrarnos el anticuerpo monoclonal anti-LPS Ogawa (2B4G5) utilizado en este estudio.
Referencias
1. Mintz ED, Tauxe RV and Levine MM. The global resurgence of cholera. In Noah N, and O`Mahony M. (ed), Communicable disease: epidemiology and control. John wiley & Sons, Chichester, England;1998:63-104.
2. Tacket CO, Cohen MB, Wasserman SS, Losonsky G, Livio S, kotloff K, Edelman R, Kaper JB, Cryz SJ, Giannella RA, Schiff G, and Levine MM. Randomized, double-blind, placebo-controlled, multicentered trial of the efficacy, of a single dose of live oral cholera vaccine CVD103-HgR in preventing cholera following challenge with Vibrio cholerae O1 El Tor Inaba three months after vaccination. Infect. Immun 1999; 67:6341-6345.
3. Sack D, Sack RB, Nair GB, Nair AK, and Siddique AK. Cholera. Lancet 2004;363:223–233.
4. Levine MM, Kaper JB, Herrington D, Ketley J, Losonsky G, Tacket CO, et al. Safety, immunogenicity, and efficacy of recombinant live oral cholera vaccines, CVD 103 and CVD 103-HgR. Lancet 1988;2(8609):467–70.
5. Tacket CO, Cohen MB, Wasserman SS, Losonsky G, Livio S, Kotloff K, et al. Randomized, double-blind, placebo-controlled, multicentered trial of the efficacy of a single dose of live oral cholera vaccine CVD 103-HgR in preventing cholera following challenge with Vibrio cholerae 01 El tor Inaba three months after vaccination. Infect Immun 1999. 67(12):6341–5.
6. Clemens JD, Sack DA, Harris JR, Van Loon F, Chakraborty J, Ahmed F, et al. Field trial of oral cholera vaccines in Bangladesh: results from 3-year follow-up. Lancet 1990; 335 (8684): 270–3.
7. Sánchez JL, Vásquez B, Begue RE, Meza R, Castellares G, Cabezas C, et al. Protective efficacy of oral whole-cell/recombinant-B-subunit cholera vaccine in Peruvian military recruits. Lancet 1994; 344 (8932):1273–6.
8. Marc P. Girard, Duncan Steele, Claire-Lise Chaignat, Marie Paule Kieny. A review of vaccine research and development: human enteric infections. Vaccine 2006; 24:2732–2750.
9. Robert A, Silva A, Benítez JA, Rodríguez BL, Fando R, Campo J, Sengupta DK, Boesman-Finkelstein M and Finkelstein RA. Tagging a Vibrio cholerae El Tor candidate vaccine strain disruption of its hemagglutinin / protease gen using a novel reporter enzyme: Clostridium thermocellum endoglucanase A. Vaccine 1996;14:1517-1522.
10. Benítez J, García L, Silva A, Garcia H, Fando R, Cedré B, Pérez A, Campo J, Rodriguez BL, Pérez JL, Valmaseda T, Pérez O, Pérez A, Ramirez M, Ledón T, Díaz M, Lastre M, Bravo L and Sierra G. Preliminary assessment of the safety and immunogenicity of a new CTX F - negative, hemagglutinin/protease–defective El Tor strain as a cholera vaccine candidate. Infect. Immun 1999; 67:539-545.
11. García L, Díaz Jidy M, García H, Rodríguez B L, Fernández R, Año G, Cedré B, Valmaseda T, Suzarte E, Ramirez M, Pino Y, Campos J, Menéndez J, Varela R., González D, Pérez O, Serrano T, Lastre M., Miralles F, del Campo J, Maestre J. L, Pérez JL, Talavera A, Pérez A, Marrero K, Ledón T and Fando R. The Vaccine Candidate V. cholerae 638 is protective against cholera in healthy volunteers. Infection and Immunity 2005; 73 (5):3018 – 3024.
12. Talavera A, Año G, Pino Y, Castaño J, Uribarri E, Riverón L, Gil S, Fernández S, Cedré B, Valmaseda T, Pérez JL, Infante JF, García L and Sierra G. Formulation in tablets of a cholera Whole cells inactivated vaccine candidate Vaccine 2006;24: 3381-3387.
13. Qadri F, Chowdhury MI, Faruque SM, Salam MA, Ahmed T, Begum YA, et al. Randomized, controlled study of the safety and immunogenicity of Peru-15, a live attenuated oral vaccine candidate for cholera, in adult volunteers in Bangladesh. J Infect Dis 2005;192 (4): 573–9.
14. Boutonnier A, Villeneuve S, Nato F, Dassy B, Fournier JM. Preparation, immunogenicity, and protective efficacy, in a murine model, of a conjugate vaccine composed of the polysaccharide moiety of the lipopolysaccharide of Vibrio cholerae 0139 bound to tetanus toxoid. Infect. Immun 2001; 69 (5):3488–93.
15. Pérez JL, González Y, Año G, Cedré B, Valmaseda T, Alvarez M., Serrano D, Millián E, Fariñas M, Talavera A y García L. Obtención de extractos de membrana externa de Vibrio cholerae O1, mediante el uso de diferentes detergentes. VacciMonitor 2006;15 (1):1-7.
16. Karhanis YD, Zeltner JY, Jackson JJ and Carlo DJ. A new and improved microassay to determine 2-keto-3-deoxyoctonate in lipopolysaccharide of Gram negative bacteria. Anal. Biochem 1978; 85:595-601.
17. Brade H. Ocurrence of 2-keto-deoxyoctanoic acid 5-phosphate in lipopolysaccharides of Vibrio cholerae Ogawa and Inaba. J. Bacteriol 1985; 161:795-798.
18. Cooper JF and Pearson SM. Detection of endotoxin in Biological products by the Limulus test. Develop Biol Standard 1977; 34:7-13.
19. Hase CC, Thai LS, Boesman-Finkelstein M, Mar VL, Burnette WN, Kaslow HR, Stevens LA, Moss J, and Finkelstein RA. Construction and characterization of recombinant Vibrio cholerae strains producing inactive cholera toxin analogs. Infect. Immun 1994. 62: 3051-3055.
20. Westphal O., and K. Jam. Bacterial lipopolisaccharides. In R. L. Whistter (ed). Methods in carbohydrate chemestry. Academic Press. Inc. New York, 1965; 5:83 -91.
21. Lowry OH, et al. A protein measurement with the folin - phenol reagent. Biol. Chem 1951;193:265-275.
22. Lammli NK. Cleareage of strutural proteins during the assembly of the head of bacterio phage T4. Nature 1970; 227: 680-685.
23. Tsai, C. M., and S. E. Frash. Silver stain a method to proteins detection after polyacrilamide gel electrophoresis. Anal. Biochem 1982; 199:115 -119.
24. Burnette WN. Western Blotting electrophoretic transfer of protein from sodium dodecyl suphate polyacrilamide get to a modified nitrocelulose and radiographic detection with antibodies and radiodinated protein A. Anal. Biochem 1980; 112: 192-200.
25. Año G, García H., Balmaceda T, Cedre B, Pino Y, Ancheta O, Pérez JL, García L y Talavera A. Antigenicidad e inmunogenicidad de una cepa de Vibrio cholerae inactivada. Biotecnología Aplicada 2003; 20 (1): 9-13.
26. Bennish ML. Cholera: pathophysiology, clinical features, and treatment. En I. K. Wachsmuth, P. A. Blake (ed), Vibrio cholerae and cholera: molecular to global perspectives. ASM Press, Washington, D. C. 1994: 229-255.
27. Attridge SR. and D. Rowley. Prophylactic significance of the non-lipopolysaccharide antigens of Vibrio cholerae. J. Infect. Dis 1983; 148:864-872.
28. Jacob A, VB. Sinha, MK. Sahib, R Srivastava, JB. Kaper, and BS Srivastava. Identification of a 33 kDa antigens associated with an adhesive and colonizing strain of Vibrio cholerae El Tor and its role in protection. Vaccine 1993; 11:179-188.
29. Gupta RK, Szu SC, Finkelstein RA and Robbins JB. Synthesis, characterization, and some immunological properties of conjugates composed of the detoxified lipopolysaccharide of Vibrio cholerae O1 serotype Inaba bound to cholera toxin. Infect. Immun 1992; 60:3201-3208.
30. Hochstein HD. Role of FDA in regulating the Limulus amoebocyte lysate test. In: Prior RB. editor. Clinical applications of the Limulus amoebocyte lysate test. Boca Raton, FL, USA: CRC Press. 1990.
31. Martínez I., Muñoz Y., Iglesias N., Fajardo E., Balboa J., Riveron L., Talavera A., Cremata J., Sierra G., García L. and Jones C. Aportes Analíticos al Control de Calidad de la Vacuna Cubana VA-MENGOC BC® y de una Nueva Vacuna Antitifoidea. Acta Farm. Bonaerense 2006;25 (2):231-8.
Lipopolysaccharide quantification in a proteoliposome obtained from external surface of Vibrio cholerae O1
Abstract
Unlike most of the Gram-negative bacteria, Vibrio cholerae O1 lipopolysacharide (LPS), does not react in KDO assay, a widely used method for the quantification of these mole
Keywords: Vibrio cholerae 01, LPS, Immunoblot, densitometry.
Recibido: Marzo de 2007 Aprobado: Abril de 2007














