Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión On-line ISSN 1025-0298
Vaccimonitor vol.27 no.3 Ciudad de la Habana set.-dic. 2018
ARTÍCULO ORIGINAL
Metodología para la obtención y evaluación de un extracto proteínico de una cepa autóctona de Helicobacter pylori
Methodology to obtain and evaluate a protein extract of an autochthonous Helicobacter pylori strain
Onelkis Feliciano-Sarmiento,1* Osmel Fleitas-Martínez2**, Rosabel Falcón-Márquez,3 Tatiana Almaguer-Rodríguez,3 Cecia Torres-Rodríguez,4 Glenda Silega-Coma,5 Yuliet Ramírez-Cintra,6 Oderay Gutierrez-Gonzalez,1 Rafael Llanes-Caballero1
1 Laboratorio Nacional de Referencia de Neisserias-Helicobacter. Centro de Investigación, Diagnóstico y Referencia (CIDR), Instituto de Medicina Tropical Pedro Kouri (IPK). La Habana, Cuba.
2 Centro de Análisis Proteómico, Bioquímico e Inmunoproteómico; Universidad Católica de Brasilia. Brasilia, Brasil.
3 Laboratorio de Proteínas e Inmunoproteómica. Centro de Investigación, Diagnóstico y Referencia (CIDR), Instituto de Medicina Tropical “Pedro Kouri” (IPK). La Habana, Cuba.
4 Laboratorio de Investigación y Desarrollo. Departamento de Biotecnología. Centro Nacional para la Producción de Animales de Laboratorio, CENPALAB. La Habana, Cuba.
5 Laboratorio Ensayos Biológicos II. Departamento de Biológicos. Centro de Ingeniería Genética y Biotecnología, CIGB. La Habana, Cuba.
6 Laboratorio de Inmunología y Virología. Universidad Autónoma de Nuevo León. Monterrey, México.
email: onelkisfs@infomed.sld.cu
* Licenciada en Bioquímica. Máster en Bacteriología-Micología. Investigador Agregado, Profesor Asistente.
** Licenciado en Bioquímica. Máster en Bacteriología-Micología.
RESUMEN
Helicobacter pylori es una bacteria gram negativa que posee numerosos antígenos que juegan un importante papel en la patogénesis de las enfermedades gastroduodenales. Debido a la necesidad de métodos de diagnóstico estandarizados con antígenos locales u autóctonos nos propusimos el diseño de una estrategia para la obtención de extractos de antígenos con reactividad frente a sueros de pacientes infectados por H. pylori. Dos cepas de H. pylori, una autóctona (IPK196A) y una de referencia ATCC 43504, se cultivaron en un medio líquido modificado. Se sometieron a los protocolos de ruptura por ultrasonido aplicándose tres variantes de precipitación y al fraccionamiento celular mediante ultracentrifugación diferencial. Los extractos proteínicos se visualizaron mediante electroforesis en gel de poliacrilamida y se transfirieron para la detección de antígenos inmunorreactivos a sueros de pacientes con infección por H. pylori e individuos sanos. La variante de ultrasonido y precipitación con Coomasie fue la más efectiva para concentrar las muestras. El método de ultracentrifugación mejoró la resolución de las proteínas reactivas y permitió separarlas según su localización subcelular. El sistema de transferencia húmedo fue ideal para la inmunodetección de los antígenos obtenidos por ultrasonido mientras que el sistema semiseco permitió detectar las proteínas de membrana obtenidas por ultracentrifugación diferencial. La introducción de una metodología en el laboratorio para la obtención y evaluación de extractos proteínicos antigénicos a partir de cepas autóctonas de H. pylori, constituye la antesala para el diseño de futuros diagnosticadores y candidatos vacunales.
Palabras clave: Helicobacter pylori, extracción de proteínas, antígenos inmunorreactivos.
ABSTRACT
Helicobacter pylori is a gram-negative spiral-shaped bacterium, which has many antigens that play an important role in the pathogenesis of gastroduodenal diseases. Due to the lack of standardized methods from native or autochthonous antigens, we proposed in this study, the design of a strategy for extracting and obtaining immunoreactive antigens against H. pylori infected-patient sera. Two H. pylori strains, one autochthonous (IPK196A) and one reference ATCC 43504, were cultured in a modified liquid medium. Both strains were subjected to the ultrasound rupture protocols applying three precipitation variants and cell fractionation by differential ultracentrifugation. Protein extracts were visualized by polyacrylamide gel electrophoresis and transferred for the detection of immunoreactive antigens to sera from patients with H. pylori infection and healthy individuals. The precipitation with Coomasie was the most effective variant. The ultracentrifugation extraction method optimized the resolution of the proteins, which could be separated according to their subcellular location. The wet transfer system was ideal for the immunodetection of the antigens obtained by ultrasound, while the semi-dry system allowed detecting the membrane proteins by differential ultracentrifugation. The introduction of a methodology in the laboratory for obtaining and evaluating antigenic antibodies from autochthonous strains of H. pylori, is the prelude to the design for future diagnostics and vaccine candidates.
Keywords: Helicobacter pylori, extraction of proteins, immunoreactive antigens.
INTRODUCCIÓN
En la última década, Helicobacter pylori se ha convertido en uno de los agentes infecciosos de mayor prevalencia reportado a nivel mundial, con cifras en países desarrollados que alcanzan un 30%, mientras que en países en desarrollo puede llegar al 90% de la población en general (1).
El microorganismo ha sido implicado en la patogenia de disímiles enfermedades gastroduodenales como la gastritis, la úlcera péptica y el adenocarcinoma gástrico. Incluso se estima que la colonización por H. pylori incrementa 10 veces el riesgo de cáncer gástrico, motivo por el cual esta bacteria se ha designado por la OMS como agente carcinogénico clase I (2).
En la actualidad diversos métodos serológicos para el diagnóstico se han desarrollado basados en la población antigénica de H. pylori, ya sea de una población total o de un antígeno purificado en particular. Para la selección de dichos antígenos debe tenerse en cuenta factores inherentes a las cepas circulantes (distribución geográfica, variabilidad), la respuesta humoral en diferentes individuos (sanos, enfermos, niños, adultos) y la relación con diferentes tipos de enfermedades gastroduodenales. Por lo que la eficacia de un método diagnóstico cuyos antígenos provienen de cepas que circulan en países donde la prevalencia de H. pylori es baja, puede estar comprometida cuando el sistema se aplica en países subdesarrollados (3).
Además, diversos investigadores coinciden en la necesidad de identificar una mezcla de antígenos protectores o cepas bacterianas recombinantes que expresen tales antígenos, los cuales podrían ser administrados mediante un régimen que origine una respuesta inmune efectiva en humanos. En este afán, diferentes grupos de trabajo se han enfocado en el desarrollo de un candidato vacunal debido a la alta resistencia de H. pylori frente a los antimicrobianos empleados en el tratamiento de la infección (4).
Este candidato debe constituir prioridad en los países en desarrollo en donde el peso de la enfermedad por cáncer gástrico es mayor (4, 5).
Las investigaciones en Cuba que abordan esta temática son escasas y evalúan antígenos obtenidos a partir de cepas de referencia, sin considerarse las cepas autóctonas (6, 7). Por lo que el objetivo principal que persigue este trabajo es el establecimiento de una metodología para la obtención de un extracto proteínico de una cepa cubana de H. pylori y la evaluación de su reactividad frente a sueros de pacientes con infección por la bacteria. Esto permitirá evaluar su utilidad en un método de diagnóstico serológico y en el desarrollo de candidatos vacunales.
MATERIALES Y MÉTODOS
Cepas bacterianas, medio y condiciones de cultivo: Se utilizaron las cepas de H. pylori ATCC 43504 e IPK196A del Laboratorio Nacional de Referencia de Neisseria-Helicobacter (LNRNH) conservadas a -80ºC en triptona soya más glicerol al 20%. Los cultivos en medio sólido se realizaron según lo descrito por Llanes y colaboradores (8). La re-identificación de las colonias de H. pylori se realizó por las pruebas de oxidasa, catalasa, ureasa y coloración de Gram. El cultivo bacteriano puro se resuspendió con una turbidez equivalente a 3 en la escala de MacFarland (9x108 ufc/mL) en medio líquido modificado que consistió en caldo cerebro-corazón suplementado con Vitox al 1% e inhibidor VCNT (Biolife, Italia). Luego se colocó en condiciones de microaerofilia (5% de O2, 10% de CO2, 85% de N2) en un agitador orbital a una velocidad de 120 rpm (Infors AG CH-4103 Bottmingen, Alemania), con un diámetro de 30 mm y se incubó a 37ºC durante 24 h. La cepa de referencia se utilizó como control.
Preparación de las células bacterianas para los protocolos de extracción de proteínas: Las suspensiones celulares obtenidas del cultivo en medio líquido, se centrifugaron a 3000 rpm (Jouan GR 4,11, Francia) durante 30 min a 4ºC. El sobrenadante se descartó y el precipitado se lavó con agua estéril, se centrifugó nuevamente en las mismas condiciones y se almacenó a -80°C. Luego se procedió a la obtención del extracto proteínico empleando los protocolos de ruptura celular por ultrasonido y 3 variantes de precipitación química y el fraccionamiento a través de la ultracentrifugación diferencial.
Ruptura celular por ultrasonido: El precipitado obtenido a partir de la centrifugación, se resuspendió en 3 mL de tampón lisis compuesto por tampón fosfato salino, de sus siglas en inglés PBS (pH 7,3), ADNasa (50 µg/mL) (Sigma, Alemania) y coctel de inhibidores de proteasas (dilución 1:200) (Sigma) y se incubó a 4°C durante 10 min. Posteriormente se adicionó lisozima (0,2 mg/mL) (Sigma) y se incubó durante 10 min a 4°C. Finalmente las muestras mantenidas en hielo se sometieron a 10 ciclos de 24 Hz de ultrasonicación, a intervalos de10 seg de encendido/10 seg de apagados usando el desintegrador celular Soniprep 150 con sonda de 3 mm (Gallenkamp, Inglaterra) y se verificó que el sobrenadante se tornara traslúcido (9). Después de la centrifugación a 10000 rpm durante 30 min (Eppendorff 5417R, FA 45-24-11, Alemania) se colectó el sobrenadante. Luego se procedió a la precipitación utilizando tres reactivos químicos, según lo descrito previamente (10, 11). La variante 1 consistió en la precipitación con azul de Coomasiee G-250 (CBB), la variante 2 (V2) con estreptomicina y la variante 3 (V3) empleando ambos agentes químicos.
Ultracentrifugación diferencial: Para el fraccionamiento por ultracentrifugación se siguió el protocolo descrito por Thein y colaboradores (12). En cada fase de centrifugación se obtuvieron las fracciones periplasmática, citoplasmática, de membrana interna y de membrana externa. Las fracciones se sometieron al proceso de concentración de proteínas mediante la utilización de dispositivos filtración por centrifugación (Centricon, Amicon YM10, EE.UU). Los pasos esenciales en la obtención de los extractos proteicos mediante ultrasonido y ultracentrifugación diferencial se detallan en el flujograma de la Figura 1.
Estimación de la cantidad de proteínas: La cuantificación de proteínas de los extractos proteicos correspondiente a cada protocolo de extracción se realizó mediante el ensayo del ácido bicinconínico (BCA siglas en inglés), siguiendo las recomendaciones del fabricante (BCA Protein Assay Kit Pearson, EE.UU).
Electroforesis SDS-PAGE: Los extractos proteínicos obtenidos previamente calentados a 100ºC y centrifugados a 12000 x g durante 5 min se disolvieron en tampón muestra (tris-glicina 0,5 M, glicerol 99%, bromofenol azul 0,05%, SDS 2%; pH 6,8) y se aplicaron en gel de poliacrilamida 10% con dimensiones de 5 cm x 10 cm x 0,75 mm (Mini-Protean® II Cell system, Bio-Rad, EE.UU) y condiciones desnaturalizantes, no reductoras. Se utilizó en cada corrida el marcador de Color BurstTM, Color Brust Electrophoresis Marker y SDS Molecular Weight Standard (Sigma, Alemania), con un rango de 10-220 kDa, 10-260 kDa y 10-160 kDa de peso molecular, respectivamente. La tinción de los geles se realizó con plata (13).
Sueros en estudio: Se seleccionaron 14 sueros provenientes de pacientes con síntomas gastroduodenales conservados a -20ºC en el LNRNH. Los sueros positivos se seleccionaron en base al criterio de clasificación del sistema comercial ELISA semicuantitativo (Virotech, Alemania) siguiendo las instrucciones del fabricante.
Inmunotranferencia sistema húmedo: La transferencia a membranas de nitrocelulosa (HybondTM ECL, Amersham, Suecia), se realizó en el sistema Mini Trans-Blot® Cell (Bio-Rad, EE.UU) con tampón de transferencia (Tris 25 mM glicina 190 mM pH 8,3 y metanol 20%) y se sometió a 100 V durante una hora a 4ºC. La efectividad de la transferencia se confirmó mediante la tinción de las membranas con rojo Ponceau (Merck, Alemania). Las membranas, luego de sucesivos lavados, se bloquearon mediante la incubación en solución de bloqueo (leche descremada al 4%, PBS-Tween 20 al 0,05%) durante una hora. Posteriormente se trataron con los sueros (diluidos 1:50 en solución de bloqueo), durante 2, 4 y 18 horas a 4ºC. El suero se decantó y las membranas se lavaron con PBS-Tween al 0,05% durante tres ciclos de 5 min. Por último, se incubaron durante una hora con un anticuerpo monoclonal anti-IgG humano conjugado a peroxidasa (Amershan, EE.UU) diluido 1:3000 en solución de bloqueo (20-25°C) y se culminó con lavados sucesivos con PBS-Tween 20 al 0,05%, como se describió anteriormente.
Inmunotransferencia sistema semiseco: La transferencia a membranas de nitrocelulosa (HybondTM ECL, Amersham, Suecia), se realizó en el sistema Mini Trans-Blot® Cell (Bio-Rad, EE.UU) con tampón de transferencia (Tris 48 mM glicina 39 mM, 0.037% SDS pH 8,3 y metanol 20%) y se sometió a 15 V durante una hora y media a 20-25°C. Las membranas, luego de sucesivos lavados, se bloquearon mediante la incubación durante una hora en solución de bloqueo (leche descremada al 4%, TBS-Tween 20 al 0,05%, del inglés: Tris Buffer Saline). Luego se incubaron los sueros (diluidos 1:50 en solución de bloqueo) durante 12 h a 4ºC. Se realizaron lavados sucesivos con TBS-Tween 20 durante 5 min a 20-25°C. El suero se decantó y las membranas se lavaron con TBS-Tween 20 al 0,05% durante tres ciclos de 5 min. Por último, se incubaron durante una hora con un anticuerpo monoclonal anti-IgG humano conjugado a peroxidasa (Amershan) diluido 1:3000 en solución de bloqueo (20-25°C) y se culminó con lavados sucesivos con TBS-Tween al 0,05%, como se describió anteriormente.
Revelado de las membranas: La presencia de antígenos en las membranas se detectó mediante la tinción con solución sustrato Tetrahidrocloruro de 3,3-diaminobencidina, en PBS 1X para el sistema húmedo y en TBS 1X para el sistema semiseco ambos con H2O2 al 30%. Ante la aparición de las bandas, la reacción se detuvo con la adición de agua corriente. Como control de la inmunotransferencia se utilizó la proteína purificada VacA con un peso aproximado de 90 kDa, obtenida de forma recombinante en el Instituto de Mombusho, Japón.
RESULTADOS Y DISCUSIÓN
La presente investigación aborda la estrategia de obtención de proteínas específicas de cepas de H. pylori autóctonas para evaluar su utilidad como antígenos y su potencial para el serodiagnóstico. Los métodos de extracción de proteínas como el ultrasonido propician la ruptura mecánica de la célula bacteriana liberándose al medio todo el contenido intracelular. La eliminación de detritos celulares complejos moleculares y moléculas de gran tamaño se realiza a través de la centrifugación, la cual en ocasiones no es eficiente en un medio con alta fuerza iónica ya que no permite la eliminación de fragmentos de ácidos nucleicos y polisacáridos de baja densidad (14).
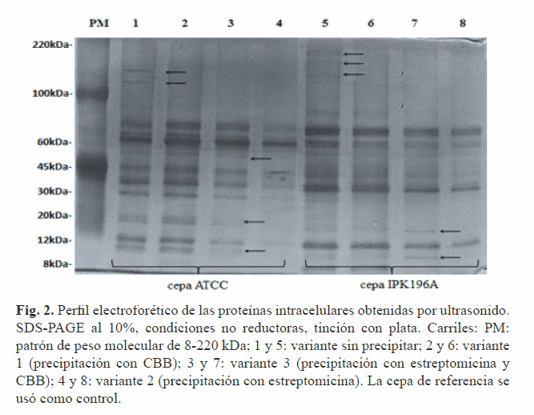
Por lo tanto, resulta necesario la introducción de técnicas complementarias que permitan obtener un extracto proteínico libre de contaminantes y es en este sentido que las técnicas de precipitación con agentes químicos son de gran utilidad, económicas, sencillas y rápidas. La aplicación del método de ultrasonido mostró un perfil proteico similar al de las muestras sin precipitar en el rango de peso molecular entre los 100 y 220 kDa, señaladas en la Figura 2, en los carriles 1 y 5.
El patrón electroforético de mayor resolución se evidenció en las muestras precipitadas con la variante 3 (estreptomicina y CBB); además, se identificaron nuevas proteínas de bajo peso molecular que no estuvieron presentes en las muestras precipitadas con estreptomicina (variante 2), señaladas en la Figura 2, carriles 3 y 7. También se demostró que el perfil electroforético de las muestras tratadas con la variante 1 y las muestras precipitadas con la variante 3 es semejante (Fig. 2: carriles 2, 3, 6 y 7).
Estos resultados indican que la precipitación con la variante 1 resulta el método de concentración ideal, pues el empleo del reactivo CBB minimiza el riesgo de pérdida por hidrólisis del enlace peptídico de las proteínas. Por otro lado, el método de fraccionamiento celular mediante ultracentrifugación diferencial descrito por Thein y colaboradores (12) resulta un método útil en el estudio de diferentes fracciones celulares de bacterias Gram negativas.
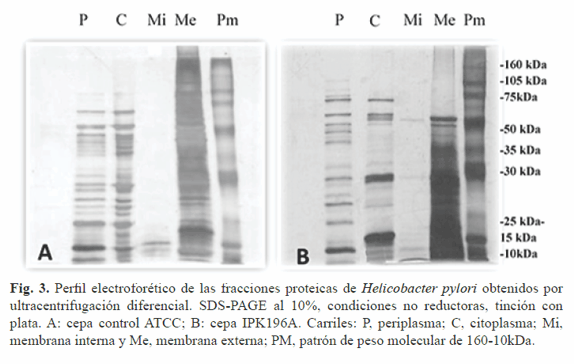
La implementación de este método en el laboratorio es de gran importancia, pues se establece un protocolo de fraccionamiento celular que facilita el estudio de los diferentes subproteomas celulares. Como se muestra en la Figura 3, el perfil proteico obtenido por ultracentifugación fue complejo y heterogéneo, pues se observó la presencia de múltiples bandas de proteínas en casi todas las fracciones estudiadas, siendo mayoritario en periplasma, citoplasma y membrana externa de ambas cepas.
Las masas moleculares de estas se encontraron principalmente en el intervalo de 10-105 kDa, excepto para la fracción de membrana externa. La cepa IPK196A que mostró bandas en los pesos moleculares de 10-50 kDa (Fig. 3B, carril Me) se diferenció de la ATCC 43504 cuyas bandas se encontraron en el intervalo de 10-160 kDa (Fig. 3A, carril Me). En los perfiles de membrana interna se observó una disminución considerable de proteínas para ambas cepas.
La cepa IPK196A mostró bandas por debajo de los 75 kDa, mientras que la cepa de referencia sólo presenta bandas de bajo peso molecular (<15 kDa). Esto puede deberse a que en esta localización parte de las proteínas se encuentran de manera transitoria pues son trasladadas a periplasma para luego formar parte de la membrana extracelular o ser secretadas al ambiente extracelular (15). Otro elemento a tener en cuenta en la resolución de la electroforesis es la utilización de detergentes (SDS, tritón X-100) y su relación de concentración que en nuestro estudio es uno. Schägguer (16) describe la ocurrencia de distorsiones en el perfil electroforético cuando la relación de SDS/detergente no iónico es menor que 10. Esto pudiera explicar el comportamiento electroforético limitado de las fracciones de membrana interna.
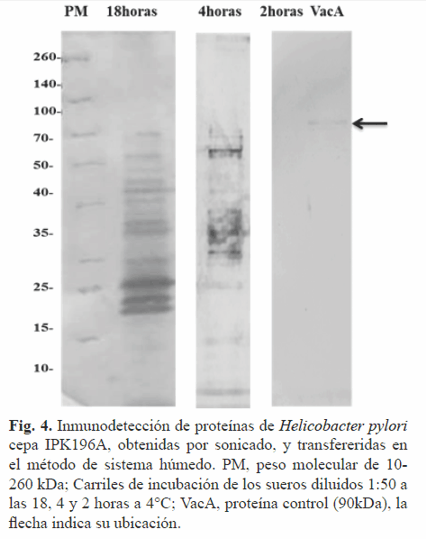
En la inmunotransferencia (Fig. 4), la incubación de los antígenos transferidos con las diferentes diluciones de los sueros durante 2 h a 4°C resultó insuficiente, pues no hubo reconocimiento de antígenos ni de control positivo proteína VacA. Al prolongar la incubación (4 y 18 h) utilizando similar régimen de temperatura, se evidenció el reconocimiento de múltiples proteínas y del control positivo, no así para las presentes en el medio de cultivo. La transferencia húmeda de las proteínas a la membrana de nitrocelulosa obtenidas por ultrasonido fue exitosa utilizando un régimen de18 h de incubación con los sueros de pacientes. La velocidad de unión inicial de los anticuerpos a los antígenos inmovilizados está limitada por la difusión de los anticuerpos de la solución hasta la interfase donde están los antígenos inmovilizados, constituyendo el tiempo de incubación un aspecto crítico en la inmunodetección (17).
La difusión incompleta a las 2 h explicaría el reconocimiento antigénico exitoso al prolongar el tiempo de incubación. Otros aspectos a valorar para mejorar la inmunotransferencia serían determinar el rango dinámico de linealidad así como las concentraciones óptimas del anticuerpo.
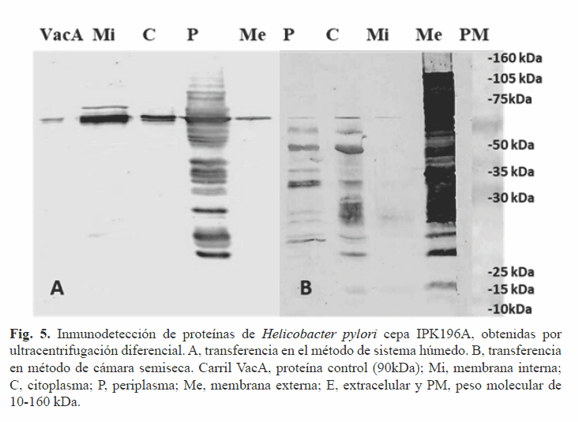
La transferencia semiseca en cámara de las proteínas obtenidas por ultracentrifugacion diferencial fue más eficiente que la del sistema húmedo como se muestra en la Figura 5. Se observó en las cuatro fracciones una banda a la altura de la proteína control VacA. El reconocimiento de las fracciones de membrana externa, periplasma y citoplasma fue mayoritario. La transferencia en sistema semiseco es particularmente ventajosa pues utiliza menores cantidades de sustancias tóxicas (metanol), además resulta eficiente cuando de proteínas de menos de 20 kDa se trata. Si bien casi la totalidad de las proteínas son transferidas de la SDS-PAGE a la membrana de nitrocelulosa empleando el sistema húmedo, este no resultó del todo eficiente con proteínas de membrana. Estas proteínas, contienen regiones transmembranales y una gran cantidad de aminoácidos hidrofóbicos lo que provoca grandes agregados proteicos en el gel que pudieran imposibilitar su paso a la membrana de nitrocelulosa. Según diversos autores el empleo de SDS en la transferencia favorece el paso de proteínas con estas características (17, 18).
El sistema semiseco en cámara empleado en la presente investigación contempló el uso de este detergente en la transferencia lo cual pudo influir en la mayor representatividad en perfil de proteínas de membrana observado. El reconocimiento exitoso de la proteína VacA en las cuatro fracciones celulares confirma su producción en el citoplasma y su posterior asociación a membrana interna, periplasma y membrana externa para luego ejercer su función a nivel de la célula epitelial gástrica. Es reconocida como la proteína de membrana externa más notable y clasificada como autotransportadora. Los autotranspotadores son proteínas pertenecientes a la familia de bacterias Gram negativas que contienen prácticamente toda la maquinaria para ser secretadas (19).
En Helicobacter pylori, la membrana externa alberga factores de virulencia como las adhesinas BabA, SabA entre otras, que establecen el primer contacto con la célula epitelial gástrica. En periplasma estas proteínas sufren modificaciones post-traduccionales para luego ser ubicadas a nivel de membrana externa. Otros factores de virulencia cuya síntesis se produce en el citoplasma, se sitúan en esta región con la ayuda de las chaperonas asociadas a membrana interna (20).
Al comparar ambas metodologías de extracción de proteínas constatamos diferencias notables. El método de extracción por ultracentrifugación mejoró la resolución de las proteínas y permitió separarlas según su localización subcelular. Este último es ostensiblemente más ventajoso pues permite, obtener proteínas de membrana que se pierden al aplicar el método de ultrasonido y evaluar la antigenicidad de las fracciones en función de su localización celular. No obstante, resulta laborioso si lo comparamos con el ultrasonido, cuyo rendimiento en el perfil de proteínas se potencializa con el uso de agentes químicos que permiten la concentración de la muestra.
En resumen, la presente investigación ofrece dos alternativas de algoritmo de trabajo que resultan factibles, según disponibilidad en los laboratorios, para la obtención de antígenos autóctonos bacterianos que pudieran ser de utilidad para el diseño de sistemas de diagnóstico serológico y en los estudios de evaluación de candidatos vacunales futuros.
REFERENCIAS
1. Mentis A, Lehours P, Mégraud F. Epidemiology and Diagnosis of Helicobacter pylori infection. Helicobacter 2015;20(l):1-7.
2. Park JY, Forman D, Waskito LA, Yamaoka Y, Crabtree JE. Epidemiology of Helicobacter pylori and CagA-positive infections and global variations in gastric cancer. Toxins 2018;10(4).pii: E163.doi: 10.3390/toxins10040163.
3. Formichella L, Romberg L, Bolz C, Vieth M, Geppert M, Gottner G, et al. A novel line immunoassay based on recombinant virulence factors enables highly specific and sensitive serologic diagnosis of Helicobacter pylori infection. Clin Vaccine Immunol 2013;20:1703-10.
4. Svennerholm AM, Lundgren A. Progress in vaccine development against Helicobacter pylori. FEMS Immunol Med Microbiol. 2007;50(2):146-56.
5. Sutton P, Boag JM. Status of vaccine research and development for Helicobacter pylori. Vaccine 2018. pii: S0264-410X(18)30017-3. doi: 10.1016/j.vaccine.2018.01.001.
6. Roblejo Y, Samada M, Cansino J, Alfonso C, Martínez M, Marrero A. Comparación de métodos diagnósticos de la infección por Helicobacter pylori en pacientes con desórdenes gastroduodenales. Rev CNIC Ciencias Biológicas 2005;36:191-97.
7. Torres LE, Bermúdez L, Roblejo Y, Moreno A, Samada M, Cansino J, et al. Desarrollo de un método serológico propio para el diagnóstico de la infección por Helicobacter pylori y su comparación con dos juegos comerciales. Rev CENIC Ciencias Biológicas 2008;39:100-6.
8. Llanes R, Feliciano O, Guzmán D, Gutiérrez O, Valdés L, Llop A, et al. Use of a single biopsy specimen for diagnosing Helicobacter pylori infection by culture and two different PCR methods: report from Cuba. Trop Gastroenterol 2010;31:111-2.
9. Rosenberg OS, Deindl S, Sung RJ, Nairn AC, Kuriyan J. Structure of the autoinhibited kinase domain of CaMKII and SAXS analysis of the holoenzyme. Cell 2005;123:849-60.
10. Liang J, Niu Q, Xu X, Luo Y, Zhou X, Deng Z, Wang Z. Effective elimination of nucleic acids from bacterial protein samples for optimized blue native polyacrylamide gel electrophoresis. Electrophoresis 2009;30:2454-9.
11. Rabilloud T. Solubilization of proteins in 2DE: an outline. Methods Mol Biol 2009;519:19-30.
12. Thein M, Sauer G, Paramasivam N, Grin I, Linke D. Efficient subfractionation of gram-negative bacteria for proteomics studies. J Proteome Res 2010;9:6135-47.
13. Chevallet M, Luche S, Rabilloud T. Silver staining of proteins in polyacrylamide gels. Nat Protoc 2006;1:1852–58.
14. Rabilloud T. Solubilization of proteins for electrophoretic analyses. Electrophoresis. 1996;17:813-29.
15. Slusky JS, Dunbrack RL. Charge asymmetry in the proteins of the outer membrane. Bioinformatics 2013;29:2122-8.
16. Schägger H. Tricine-SDS-PAGE. Nat Protoc 2006;1(1):16-22.
17. Bass JJ, Wilkinson DJ, Rankin D, Phillips BE, Szewczyk NJ, Smith K, Atherton PJ. An overview of technical considerations for Western blotting applications to physiological research. Scand J Med Sci Sports 2017;27(1):4-25.
18. Abeyrathne PD, Lam JS. Conditions that allow for effective transfer of membrane proteins onto nitrocellulose membrane in Western blots. Can J Microbiol 2007;53:526-32.
19. Nicolay T, Vanderleyden J, Spaepen S. Autotransporter-based cell surface display in Gram-negative bacteria. Crit Rev Microbiol 2015;41:109-23.
20. Liechti G, Goldberg JB. Helicobacter pylori relies primarily on the purine salvage pathway for purine nucleotide biosynthesis. J Bacteriol 2012;194:839-54.
Recibido: Junio de 2018 Aceptado: Septiembre de 2018