Introducción
Las sales de aluminio, tales como el hidróxido de aluminio y el fosfato de aluminio, se aplican rutinariamente para mejorar la inmunogenicidad de antígenos en las formulaciones vacunales. La adsorción de los antígenos en estos adyuvantes, depende de las características físicas y químicas del antígeno, del tipo de adyuvante y de las condiciones de adsorción.1 Este proceso tiene como principal mecanismo las interacciones electrostáticas, aunque los efectos hidrofóbicos, los puentes de hidrógenos y las interacciones de van der Waals también juegan un papel importante.2
A pesar de que el aluminio es ampliamente usado, la vía por el cual potencia la respuesta inmune no es completamente conocida. Estudios realizados han propuesto algunos mecanismos entre los que se incluye un efecto de depósito, asegurando una lenta y prolongada liberación del antígeno en el sitio de inoculación, para estimular el reclutamiento de células presentadoras de antígenos en estos sitios.3
Las sales de aluminio también tienen efecto inmunopolarizador, direccionando la respuesta preferentemente hacia un patrón de tipo Th2. Estos fenómenos se han relacionado con la activación del inflamasoma,4 pero en gran medida dependen de la adsorción del antígeno en el gel de aluminio, por lo que ha sido generalmente aceptado que los antígenos deben adsorberse en porcentajes elevados para lograr la mejor eficiencia de la vacuna. A pesar del largo historial de éxito en la mejora de la inmunogenicidad de las vacunas, el proceso de formulación con estos adyuvantes se basa en gran medida en ensayo y error. La importancia de la adsorción y las fuerzas de adsorción, recientemente se han convertido en temas a considerar en la elaboración de las nuevas formulaciones vacunales.3
La enfermedad causada por las especies de Salmonella en la actualidad constituye un tema importante para la salud a nivel mundial. La fiebre tifoidea es causada por la subespecie Salmonella enterica sevorar Typhi (S. Typhi), mientras que la fiebre paratifoidea tiene como principal agente etiológico a Salmonella enterica sevorar Paratyphi A, B y C (S. Paratyphi A/B/C). En conjunto conocida como fiebre entérica, la fiebre tifoidea y paratifoidea prevalecen mayormente en países subdesarrollados,5 siendo más representativa en regiones como África y Asia.6
En la última década los casos producidos por S. Paratyphi A se han incrementado hasta aproximadamente 5,4 millones de casos anuales.7 Con el aumento de los casos provocados por S. Paratyphi A y la resistencia a antibióticos de los serovares de Salmonella enterica responsables de la enfermedad invasiva, se hace cada vez más importante el control y prevención de la enfermedad a través de las vacunas, como una solución efectiva de este problema de salud mundial.8 Hasta la actualidad no existen vacunas licenciadas contra S. Paratyphi A.9
Las vacunas contra S. Paratyphi A que se encuentran actualmente en desarrollo, están basadas principalmente en células enteras vivas atenuadas y en el antígeno-O del lipopolisacárido conjugado a proteínas.10 El Instituto Finlay de Vacunas tras 25 años de haber desarrollado la vacuna anti-meningócoccica VA-MENGOC-BC® posee una plataforma de investigación basada en el desarrollo de vacunas proteicas a partir de la obtención de vesículas derivadas de la membrana de los microorganismos.
El objetivo de este trabajo fue determinar las condiciones de adsorción de las vesículas de membrana externa de S. Paratyphi A (VME-SPA), en dos adyuvantes: hidróxido de aluminio y fosfato de aluminio.
Materiales y Métodos
Materiales y reactivos
Todos los reactivos que se utilizaron en los ensayos físico-químicos son comerciales y de calidad puro para análisis, de los proveedores Sigma (EUA) y Merck (RFA).
Las VME-SPA (Lote experimental 16.04) se obtuvieron mediante el método de extracción con detergentes descrito por Pérez JL y colaboradores,11 en la Dirección de Investigaciones del Instituto Finlay de Vacunas. Se emplearon adyuvantes basados en aluminio para el estudio de formulación: AlPO4 (sintetizado en el Instituto Finlay de Vacunas) y Al(OH)3 (Alhydrogel®) del proveedor Brenntag Biosector (RFA).
Tamaño de partícula e índice de polidispersión
Para determinar el tamaño de partícula y el índice de polidispersión de las VME-SPA, se empleó un analizador de partículas Zetasiszer (Malvern Panalytical). La determinación se realizó con una fuente de laser fija y un ángulo de luz desviada de 173°. Las muestras se trabajaron a una concentración de proteínas entre 1-0,5 mg/mL. Se analizaron 10 réplicas de la muestra y se determinó la media aritmética de la talla con su correspondiente desviación estándar.
Barrido de pH
Se definió el pH al cual precipitaban las VME-SPA, en ausencia de adyuvante. Para ello se evaluó un rango de pH de 4,5 a 8,0 eliminando de los experimentos aquel pH en el cual se observara turbidez en la muestra.
Para determinar el pH de máxima adsorción se fijaron los valores de concentración para las VME-SPA (0,2 mg/mL) y los adyuvantes basados en aluminio (1mg/mL de Al 3+), este sistema se evaluó en un rango de pH de 5,0 a 7,5. Las muestras se dejaron en agitación con balas magnéticas a 150 rpm (agitador magnético, IKAMAN® REO) durante 1 h a temperatura y presión constantes (25°C, 1 atm). Posteriormente las muestras se centrifugaron a 800 g x 5 min a 4°C. El sobrenadante fue colectado para la posterior evaluación del porcentaje de adsorción. Se realizaron tres réplicas del experimento.
Cinética de adsorción
Se evaluó la cinética de adsorción en los geles de aluminio con valores fijos de concentración para las VME-SPA (0,2mg/mL) y de Al3+ (1mg/mL). Se trabajó en un rango de pH de 6,5 a 7,0. Las VME-SPA se mezclaron con cada uno de los geles y se mantuvieron en agitación con balas magnéticas a 150 rpm (agitador magnético, IKAMAN® REO) durante 7 h a temperatura y presión constantes (25°C, 1 atm). Se tomaron muestras cada 1 h, que posteriormente fueron centrifugadas a 800 g x 5 min a 4°C. El sobrenadante fue colectado para la posterior evaluación del porcentaje de adsorción. Se realizaron tres réplicas del experimento.
Isoterma de Langmuir
Para la construcción de las isotermas se realizaron pruebas de adsorción variando las concentraciones iniciales de las VME-SPA, desde 0,1 mg/mL hasta 1 mg/mL manteniendo constantes el volumen de adsorbato y la cantidad de adsorbente (1mg/mL de Al3+). El ensayo se realizó en un rango de pH de 6,5 a 7,0 en agitación continua con balas magnéticas a 150 rpm (agitador magnético, IKAMAN® REO) durante 4 h. Posteriormente se cuantificó la concentración de proteína incorporada al gel de aluminio. Partiendo de estos datos, con la finalidad de estudiar la naturaleza de la adsorción, se realizaron ajustes a los parámetros del modelo Langmuir. La capacidad adsortiva (qm) y coeficiente de adsorción (Kd), se estimaron a partir de la regresión linear de la isoterma.12 Cuando el R2 de la regresión lineal alcanzó valores ≥0,99, se asumió que la isoterma de adsorción cumplía con el modelo de Langmuir. Se realizaron tres réplicas del experimento.
Tratamiento de las muestras. Cálculo del porciento de adsorción
La cantidad de proteína libre en el sobrenadante se determinó mediante ensayo descrito por Lowry y colaboradores. 13) El porcentaje de adsorción refleja el equilibrio entre las VME-SPA libres en solución y la adsorbida. La cantidad adsorbida se calculó restando la cantidad de VMA-SPA presente en el sobrenadante del total de antígeno usado, el porcentaje de adsorción se calculó como se muestra en la siguiente ecuación:
% adsorción = C ads x 100 / C T
C ads : Concentración de proteína adsorbida
C T : Concentración total de proteína
Resultados
El análisis por difractometría láser del lote experimental 16.04 de VME-SPA obtenido en el departamento de Biomoléculas Bacterianas del Instituto Finlay de Vacunas, mostró que las vesículas que componen estos extractos poseen una talla media de 79 ± 21,88 nm, con un índice de polidispersión de 0,3.
La determinación del rango de pH de equilibrio de la formulación se realizó mezclando las VME-SPA y los adyuvantes (AlPO4 o Al(OH)3) en un rango de pH de 5,0 a 7,5 (Fig. 1). En los resultados mostrados en la Figura 1A se observó un elevado nivel de adsorción cuando las vesículas se formularon con AlPO4, con valores promedios superiores al 90% en el rango de pH estudiado. La adsorción en Al(OH)3 mostró porcentajes de adsorción por encima del 90% a partir de pH 6,0; alcanzando el máximo valor a pH 7,0 (99,29%) (Fig. 1B).
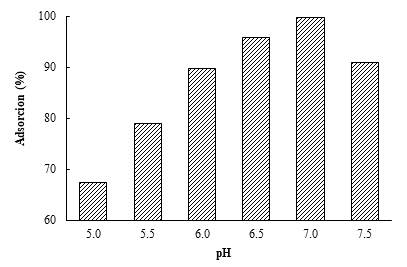

Fig. 1 Grado de adsorción de las vesículas de membrana externa de S. Paratyphi A (VME-SPA) en adyuvantes que contiene aluminio, bajo diferentes pH. Se realizaron tres repeticiones de cada ensayo, el gráfico muestra la media de los valores obtenidos. A VME-SPA adsorbidas en AlPO4. B VME-SPA adsorbidas en Al(OH)3.
La Figura 2 muestra el estudio de cinética de las VME-SPA empleando ambos adyuvantes. Como se observa en la Figura 2A, pasados los primeros 30 min las VME-SPA alcanzaron valores de adsorción cercanos al 100% en presencia de AlPO4. Estos valores se mantuvieron estables (≥95%) en las siguientes 7 h. Por otro lado las VME-SPA adyuvadas en Al(OH)3 se adsorbieron en un 95% a partir de las 3 h (Fig. 2B).


Fig. 2 Cinética de adsorción de las vesículas de membrana externa de S. Paratyphi A (VME-SPA) en adyuvantes que contienen aluminio. Se realizaron tres repeticiones de cada ensayo, el gráfico muestra la media de los valores obtenidos. A VME-SPA adsorbidas en AlPO4. B VME-SPA adsorbidas en Al(OH)3.
El desarrollo de la adsorción de cada sistema fue estudiado mediante la construcción de una isoterma, la cual siguió la ecuación de Langmuir. Los datos de la adsorción fueron analizados utilizando la ecuación de linealización de Langmuir, que permitió calcular la capacidad adsortiva (qm) y el coeficiente de adsorción (Kd); los resultados obtenidos se muestran en la Tabla 1.
Tabla 1 Isoterma de Langmuir
| Al3+ (mg/mL) | qm (mg/mg Al3+ ) | Kd (mL/mg) | R2 | |
|---|---|---|---|---|
| VME-SPA/ AlPO4 | 1 | 0,312 | 10 | 0,990 |
| VME-SPA/ Al(OH)3 | 1 | 0,165 | 193 | 0,989 |
|
|
|
Los dos sistemas cumplieron con el modelo descrito por Langmuir (R2 ≥0,99). La capacidad adsortiva obtenida a partir de la formulación de las VME-SPA en AlPO4 fue mayor a la obtenida cuando es mezclada con Al(OH)3 (Tabla 1). Se observó diferencias significativas entre los coeficientes de adsorción obtenidos (Kd (Al(OH)3) >Kd (AlPO4)), lo que pudiera estar asociado a la diferencia de carga de ambos geles a pH neutro.
Discusión
Los adyuvantes basados en hidrogeles de aluminio continúan siendo una importante estrategia para el desarrollo y formulación de la mayoría de las vacunas en investigación y las aprobadas para uso en humanos. La adsorción de un antígeno en una vacuna que contiene aluminio es aceptada comúnmente como un importante factor para mejorar la respuesta inmune y el grado de adsorción del antígeno puede afectar esta respuesta.14 Actualmente se ha determinado que en vacunas diseñadas para humanos, el límite máximo aprobado de Al+ por dosis debe oscilar entre 0,85 y 1,25 mg.15
En este estudio se determinaron las condiciones óptimas de adsorción de las VME-SPA en dos adyuvantes que contienen aluminio (AlPO4 y Al(OH)3). Los resultados obtenidos mostraron porcentajes de adsorción superiores al 85% cuando la VME-SPA fueron formuladas tanto con Al(OH)3 como con AlPO4. La adsorción puede tomar lugar generalmente por uno o dos mecanismos: las interacciones electrostáticas o intercambio de ligando. Mientras las interacciones electrostáticas requieren la presencia de cargas opuestas entre los antígenos y el adyuvante bajo una solución en particular, el intercambio de ligando requiere la presencia de fósforo en el antígeno de manera que pueda ser intercambiado por los grupos hidroxilos en los adyuvantes que contienen aluminio.16
Otros mecanismos de adsorción han sido propuestos como las interacciones hidrofóbicas e interacciones de superficie no asociadas con la carga y todos estos mecanismos pueden coexistir para un solo antígeno,17 especialmente para antígenos complejos como las VME que representan una combinación de proteínas y lípidos.
Otro aspecto importante a tener en cuenta en el desarrollo de nuevas formulaciones adyuvadas en geles de aluminio, es el tamaño de partícula del antígeno de interés. Estudios realizados por Huang y colaboradores,15 empleando diferentes modelos de proteínas, mostraron que la qm en los sistemas que contenían Al(OH)3 era inversamente proporcional al tamaño del antígeno, sin embargo en los sistemas que contenían AlPO4 los valores de qm eran independiente al tamaño. Si bien el lote de VME-SPA estudiado presenta tamaños de partículas entre 60 y 100 nm, es importante señalar que los geles de Al(OH)3 y AlPO4 están compuestos por partículas que oscilan entre 10 y 50 nm, que al agregarse forman poros irregulares con diámetros de 1 a 20 µm,18 donde pueden quedar retenidas las VME-SPA.
Los sistemas de VME-SPA/AlPO4 y VME-SPA/Al(OH)3 se analizaron mediante la construcción de isotermas de Langmuir. Las propiedades adsortivas pueden ser descritas mediante dos parámetros calculados a partir del modelo de Langmuir; la capacidad adsortiva (qm) que es la cantidad de antígeno adsorbido en una fase solida (asumiendo que es una monocapa) y el coeficiente de adsorción (Kd) que describe la fuerza de adsorción del antígeno en la fase sólida.12 Como resultado se obtuvieron valores diferentes qm y Kd, siendo VME-SPA /AlPO4 el sistema con mayor qm y menor Kd. El Kd es frecuentemente ignorado debido a los altos grados de variación (varios ordenes de magnitud) que han sido reportados para diferentes proteínas unidas al mismo adyuvante y con similar mecanismo de adsorción. Sin embargo, este parámetro puede emplearse como predictor del tipo de mecanismo de adsorción que interviene en el sistema.
Estudios previos sobre la adsorción de diferentes proteínas en adyuvantes que contiene aluminio (Tabla 2) han revelado, que los valores de Kd tienden a ser bajos en proteínas tales como la Lisozima, mioglobulina, seroalbúmina bovina; que son adsorbidas mediante fuerzas de atracción electrostáticas o hidrofóbicas.16,19 Proteínas como la α-Caseína desfosforilada y la ovalbúmina (OVA), que contienen de 0-2 grupos fosfatos presentan valores intermedios de Kd. Estas proteínas se pueden adsorber mediante intercambio de ligando, aunque se ha comprobado que también intervienen fuerzas electrostáticas.19 Se ha demostrado que las proteínas β-caseína (5 grupos fosfato),14 α-caseína (8 grupos fosfato),20 y el antígeno de superficie del virus de la Hepatitis B,21 presentan como mecanismo predominante de adsorción el intercambio de ligando, lo que coincide a su vez con los valores más altos de Kd.
Tabla 2 Coeficiente de adsorción de diferentes proteínas en adyuvantes que contienen aluminio
| Proteína | Adyuvante | Kd (mL/mg) | Referencia |
|---|---|---|---|
| Mioglobina | Al(OH)3 | 2 | (21) |
| Lisozima | AlPO4 | 6 | (21) |
| BSA | Al(OH)3 | 12 | (21) |
| α-Caseína desfosforilada | Al(OH)3 | 59 | (20) |
| ovalbúmina | Al(OH)3 | 86 | (21) |
| β-Caseína | AlPO4 | 115 | (14) |
| α-Caseína | Al(OH)3 | 2409 | (20) |
| Antígeno de hepatitis B | Al(OH)3 | 3660 | (21) |
Los resultados observados en la isoterma de Langmuir (Tabla 1), sugieren que la adsorción de las VME-SPA en Al(OH)3 puede estar mediada por intercambio de ligando. Sin embargo, los valores de Kd en el sistema VME-SPA/AlPO4 (<12), sugieren que los mecanismos que median la adsorción en AlPO4 pudieran ser electrostáticos o hidrofóbicos. Tanto el Al(OH)3 como el AlPO4 presentan grupos hidroxilos superficiales, por lo que pueden intercambiar ligados con antígenos fosforilados; sin embargo, el Al(OH)3 es el que presenta mayor cantidad de sitios potenciales para la adsorción.18 Los antígenos más propensos a adsorberse mediante intercambio de ligando son aquellos que contienen grupos libres de fosfato o grupos fosfatos generados por la hidrolisis de fosfolípidos asociados a la membrana celular, como ocurre con el antígeno de superficie de hepatitis B.21
Conclusiones
Los resultados obtenidos en el estudio de las condiciones de adsorción de las VME-SPA mostraron que en presencia de AlPO4 y Al(OH)3 se logran formulaciones con buenos porcentajes de adsorción. Las diferencias en los valores de coeficientes de adsorción sugirió que el proceso de adsorción de las VME-SPA en cada adyuvante está mediado por mecanismos diferentes. A pesar de estas diferencias se definieron las condiciones de adsorción de dos candidatos vacunales basados en VME-SPA. Solo los estudios de inmunogenicidad en animales permitirá discriminar cuál de estos candidatos resulte más eficiente en el desarrollo de una adecuada respuesta inmunológica contra S. Paratyphi A.














