Introducción
La enfermedad meningocócica (EM) era una enfermedad muy temida desde el siglo XIX y aún sigue siendo un problema de salud global.1 Su causa es la infección con Neisseria meningitidis (Nm),2 y sus variantes fundamentales son la meningitis y la septicemia, ambas graves, y causas principales de infección bacteriana invasiva.
La incidencia mundial varía entre 1x100.000 y 27,5 x100.000 habitantes. Durante las epidemias, en el denominado “Cinturón de la Meningitis” (países africanos del Sahara desde Gambia hasta Sudán), puede enfermar hasta el 1% de la población.3,4 La letalidad mundial fluctúa entre 5,3%-26,2%, con una media de 14,4%. Durante una epidemia en África la letalidad puede superar el 30%.5 A pesar del subregistro en muchas regiones, se estima que ocurren más de 500.000 casos y más de 85.000 fallecidos anualmente. El 20% de los sobrevivientes presenta secuelas, con un riesgo tres veces más alto en África que en Estados Unidos o Europa.6
En el mundo existen millones de portadores nasofaríngeos asintomáticos de Nm que pueden transmitir la enfermedad a otras personas. La frecuencia mayor se reporta en adultos jóvenes (10%-35%).7 En los años 60 del pasado siglo, la EM se consideró un problema de salud solo en países tropicales, pero en los años 70 ese criterio cambió, al aparecer brotes en Europa y América del Norte. Desde la Segunda Guerra Mundial, las principales epidemias se producen en los países del Sahara, incluido el “Cinturón de la Meningitis” donde entre un 60% y un 65% de las meningitis son meningocócicas. Hoy la EM está presente en todos los continentes. Los meningococos del serogrupo B causan EM principalmente en países de América del Norte, centro y sur de Europa, sur y nordeste de África, Medio Oriente, Rusia, China, Japón, Australia y Nueva Zelanda.3
En 1980, cuando comenzaron las etapas para la obtención de la vacuna y para realizar sus evaluaciones preclínicas y clínicas hasta los ensayos de eficacia, e iniciar su producción y uso, Cuba era un territorio “en rojo” en el mapa de la carga mundial de la EM, con una incidencia absoluta de 14,4 casos por 100.000 habitantes para todas las edades. Después de aplicar la vacuna, la EM dejó de ser un problema de salud y el país ya no está en ese mapa, en el que aún otras regiones del mundo siguen marcadas “en rojo”.
En este artículo se evalúan la importancia y la vigencia de la EM en el mundo, su situación en Cuba y los resultados obtenidos con la vacuna cubana anti-meningocócica BC, VA-MENGOC-BC®, desde su obtención. Se analizan, entre otras cuestiones, el impacto de su empleo, la vigencia de su utilidad y la de su tecnología; pionera en Cuba y el mundo y su contribución al desarrollo científico cubano y mundial.
Enfermedad meningocócica en Cuba. Desarrollo de VA-MENGOC-BC®
Enfermedad meningocócica, características y carga en Cuba. Enfrentamiento y solución del problema
Desde 1916 hasta mediados de los años 70 del pasado siglo, en Cuba solo ocurrían casos esporádicos de EM. A partir de 1976 comenzaron brotes que adquirieron magnitud de epidemias. En 1978 la incidencia era 1,5 por 100.000 habitantes y en 1979 llegó a 5,6 por 100.000 habitantes. Más del 50% de los casos los provocó el serogrupo C y cerca del 35% el serogrupo B. Los más afectados fueron niños entre 10 y 14 años, seguidos por los menores de 1 año.8
Para controlar la enfermedad, en 1979 se vacunaron 3.245.046 personas entre 3 meses y 19 años con la vacuna anti-meningocócica AC de Merieux, Francia, con una cobertura superior al 80%. Disminuyó la incidencia por el serogrupo C, pero la EM continuó en aumento y en 1980 llegó a 5,9 por 100.000 habitantes, la letalidad estuvo entre 10 y 25%,8,9 y cerca del 80% de los casos los provocó el serogrupo B. Ese año la EM fue declarada el principal problema de salud del país y en 1984 la incidencia se elevó a 14,4 por 100.000 habitantes para todas las edades. En niños menores de 1 año se reportaron más de 120 casos por 100.000 habitantes en algunas provincias del país 8
En esos momentos no existían en el mundo vacunas con eficacia probada contra Nm del serogrupo B o un candidato vacunal que pudiera ser exitoso a corto plazo. El máximo nivel de desarrollo al que habían llegado los grupos más avanzados, era una vacuna de Antígeno de Serotipo Específica (STA en inglés) cuyas características se resumen en el Recuadro 1 y se comparan con la vacuna cubana.9,10,11,12
Entre 1980 y 1986 se obtuvo el candidato vacunal cubano basado en vesículas de membrana externa (VME) o proteoliposomas (PLS,) y se probó su eficacia clínica en el terreno entre 1987 y 89. Para obtener este candidato vacunal se creó un sistema productivo escalable e integrado, con un complejo “Know How” para el cultivo inicial, la fermentación, el proceso de extracción, la purificación, la formulación, la adyuvación, el llenado y el envase. Se obtuvieron VME estables, con la composición adecuada del lipopolisacárido para administrarlo a humanos sin toxicidad y conservar su contribución a la inmunogenicidad (Recuadro 1).
Con las novedades tecnológicas en el desarrollo de VA-MENGOC-BC®, se registraron patentes que obtuvieron concesiones en Cuba,13,14,18 y mediante el Tratado de Cooperación de Patentes (PCT-Sistema Internacional de Patentes), se registraron en países de América, Europa, Asia, África y Australia. En 1989, la Organización Mundial de la Propiedad Intelectual (OMPI) otorgó a los autores principales de la patente de VA-MENGOC-BC®, la medalla de oro de esa organización. El logro científico más importante fue obtener las VME o PLS del meningococo del serogrupo B, inmunogénicas y estables, el proceso de obtención y el producto con una composición, formulación y eficacia diferentes a las de los candidatos vacunales que existían. Los PLS o VME constituyen la estructura fundamental que garantiza la inmunogenicidad y capacidad protectora de la vacuna. La vacuna obtuvo la patente iniciadora de una familia de vacunas y a partir de ella se originaron nuevas investigaciones de desarrollo para otras vacunas y adyuvantes.13 Las características de las vesículas de membrana externa se muestran en la Figura 1 y en el Recuadro 2 aparece la formulación de la vacuna, las funciones de la mezcla y de algunas de las estructuras formadas.
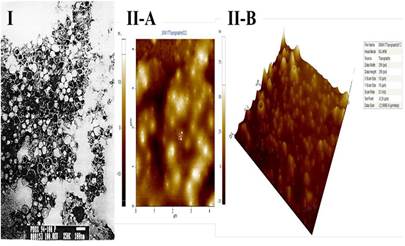
Fig. 1 Características de VA-MENGOC-BC®. Vesículas de membrana externa (VME) de la cepa CU-B385/83 de Neisseria meningitidis serogrupo B; núcleo activo de VA-MENGOC-BC®. Microfotografías electrónicas de proteoliposomas (PLS) o VME. Las VME bien definidas de 50 a 80 Nm de diámetro y estables química y físicamente constituyen el corazón de VA-MENGOC-BC® y su inmunogenicidad. I. Microscopía electrónica de Transmisión. II-A. Microscopía de Fuerza Atómica en dos dimensiones y II-B en tres dimensiones. Digital Nanoscope III AFM (Santa Bárbara CA) acoplado a J-Scanner de 125 μm, Software usado UTHSCSA Image Trial (EE.UU.).
Estudios de la vacuna en Cuba previos a su registro médico y aplicación masiva
Entre 1987 y 1989, se realizó un estudio de eficacia, prospectivo, aleatorizado con placebo y grupo control, que incluyó a 106.251 voluntarios entre 10-16 años de edad en siete provincias del país. En la discusión del protocolo final del ensayo y en su evaluación, participaron investigadores del Instituto Finlay, del Ministerio de Salud Pública de Cuba, del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos de Cuba, de la OMS y la OPS, y del Centro para el Control de Enfermedades de los Estados Unidos de América.
El estudio de campo se siguió por 1 año y 4 meses y durante ese tiempo ocurrieron 25 casos de EM. Se decodificó el sistema de doble ciego y se asignaron los casos al grupo placebo o vacunado. En los 52.966 voluntarios (distribuidos en 99 escuelas) que recibieron la vacuna se reportaron 4 casos y en los 53.285 (distribuidos en 98 escuelas) que recibieron placebo 21 casos. La eficacia estimada fue 83% (p=0,0019) (cálculo por conglomerados o escuelas).16 VA-MENGOC-BC® fue la primera vacuna en el mundo efectiva contra el meningococo del serogrupo B, evaluada en un ensayo de campo, prospectivo, controlado, a doble ciegas con vacuna y placebo.
En 1989 se completaron los ensayos preclínicos y clínicos de Fase I, II y III exigidos por las autoridades regulatorias nacionales e internacionales y el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos de Cuba - entidad regulatoria cubana- otorgó el Registro Médico Sanitario a VA-MENGOC-BC®.18
Resultados de la vacunación de 1989 a 2019
Con la vacuna registrada comenzó la Fase IV pos-licenciamiento. Entre 1989 y 1990 se realizó una campaña nacional de vacunación, en la que se inmunizaron más de 3 millones de personas entre 3 meses y 24 años de edad y se logró una cobertura superior al 95%. Incluyó además grupos de alto riesgo, principalmente trabajadores y estudiantes con dormitorios colectivos, reclusos, personal sanitario, etc, sin considerar la edad, con un orden de prioridad por provincias de acuerdo con la incidencia de la enfermedad.8,16
En 1991 se incorporó VA-MENGOC-BC® al Programa Nacional de Inmunización y se mantiene desde entonces sin interrupciones ni cambios esenciales, con un esquema de 2 dosis, la primera a los 3 meses de edad y la segunda a los 5 meses. Esta inmunización universal y sistemática en la infancia mantuvo la cobertura para los que nacieron después de la campaña de vacunación masiva.
La tasa de incidencia de la EM en Cuba antes de la vacunación alcanzó un valor de 14,4 x 100.000 habitantes. Después de la vacunación la tasa disminuyó a ≤1 x 100.000 habitantes en 1993 y a partir del 2008 se mantiene por debajo de 0,1 por 100.000 habitantes. En niños ≤6 años de edad la tasa de incidencia antes de la vacunación estaba entre 38-120 x100.000 habitantes y bajó a 0,01-1,8 x 100.000 habitantes. La reducción se estimó en 95% [93%-98%] y se eliminó la EM como problema de salud.8,16,21,22,23
Efecto de la vacunación masiva sobre el patrón de cepas de portadores y enfermos
En la etapa epidémica pre-vacunación, el 96,8% de las cepas de los enfermos era del serogrupo B, 1,4% del C y 1,8% de los no agrupables. En los portadores el 67,3% era del serogrupo B, y el 32,7% no agrupables. La campaña de vacunación cambió el patrón de distribución de las cepas. En los enfermos el 100% fueron del serogrupo B. En los portadores sanos la distribución de las cepas cambió a 26,7% del serogrupo B y 70,8% los no agrupables y apareció el serogrupo W-135 en el 2,5% de los casos.24
La presión selectiva de la vacuna efectiva contra el grupo B en más del 95% medido por la disminución de la incidencia de casos de enfermos y la disminución de la expresión de cápsula B en los portadores sanos desde 67,3% hasta 26,7%, no se había descrito antes para ninguna vacuna anti-meningocócica B.
Los cambios en los serotipos y subtipos en los enfermos y portadores posteriores a la vacunación pueden interpretarse como expresión del amplio espectro de la respuesta inmune inducida por la vacuna, pues se eliminaron o disminuyeron los serotipos y subtipos epidémicos y aumentaron los no-tipables, no-subtipables en los enfermos y portadores. Los serotipos y subtipos distintos a la cepa vacunal no aumentaron en los enfermos ni en los portadores. La vacuna fue eficaz contra cepas homólogas y heterólogas a la vacunal.24 La frecuencia y diversidad de los complejos clonales hipervirulentos (ST-32 y ST-41/44) en los enfermos y portadores disminuyeron después de la vacunación y han sido reemplazados por el complejo ST-53, lo cual representa un cambio positivo.25 Después de 2008 aparecieron cuatro cepas del serotipo B:17 nunca antes reportado en Cuba. Ya entre octubre del 2004 y marzo del 2005 se habían reportado en Canadá cepas B:17:P1.19 pertenecientes a un nuevo clon circulante (ST-69).26
Estos cambios son favorables pues se eliminaron dos de los clones hipervirulentos más importantes en la generación y expansión de la epidemia cubana y de otras en el mundo, además del cambio de fenotipos en portadores hacia variantes no virulentas y de la transformación provocada por la vacuna en las cepas epidémicas en los enfermos. Sin embargo, hay que evaluar cuidadosamente la posible relevancia de la aparición, aunque muy limitada, del clon ST-53 y si las cepas B:17 encontradas son ST-269 como las de Canadá, así como los niveles de protección conferidos por nuestra vacuna contra dichas cepas.
Importancia del esquema de inmunización y la cobertura en la efectividad de VA-MENGOC-BC®
A pesar del efecto de la inmunidad poblacional y la protección lograda por las altas coberturas del Programa Nacional de Inmunización, como se ha demostrado en los 30 años transcurridos, hay indicios de la disminución con el tiempo de la protección post-inmunización con el esquema de dos dosis de VA-MENGOC-BC® que se emplea en el programa de inmunización cubano, particularmente en niños de hasta 1 año de vida, aunque este esquema logra buena protección contra la forma clínica meningococcémica, que es la más grave y letal.27 La disminución de la protección en el tiempo con el esquema utilizado en el programa, podría explicarse por la menor inmunogenicidad de las vacunas bacterianas, que requieren de esquemas primarios de más de dos dosis, con refuerzos en el esquema inicial,27 e incluso dosis de refuerzo después de transcurrido cierto tiempo o frente a estados de estrés del Sistema Inmune. Para VA-MENGOC-BC® se demostró la superioridad del esquema de tres dosis en estudios realizados en Cuba y en otros países.16,28,29,30
Si se aplicara un esquema de inmunización inicial con tres dosis o más, y con refuerzo, que madure mejor la respuesta inmune sistémica, la vacuna podría ofrecer una protección superior en lactantes y contra la forma clínica meníngea y debe por tanto valorarse. Sin embargo, aunque se aumentara el número de dosis, es conveniente mantener las altas coberturas que han demostrado efectividad e impacto sostenido.
Aplicación de la Gamma Globulina Hiperinmune Anti-meningocócica en niños graves
Los voluntarios que participaron en los ensayos clínicos para el registro de la vacuna, aceptaron donar sangre para obtener el plasma donde estaban los anticuerpos inducidos por la vacuna en altas concentraciones. Se purificaron las globulinas,31,32 se caracterizó su composición y concentración y se realizaron los estudios preclínicos y toxicológicos fundamentales.32,33 Se produjeron varios lotes de gammaglobulina específica antimeningocócica (GGHAM), que la autoridad regulatoria nacional liberó para su uso experimental en niños enfermos con alto riesgo para la vida.
Con la GGHAM se realizó un ensayo clínico que incluyó 123 niños con el diagnóstico de EM en 21 unidades de cuidados intensivos de nueve provincias del país.31,32 Los niños se incorporaron en el ensayo una vez obtenido el consentimiento de los padres o tutores legales para que sus hijos recibieran el tratamiento, explicándoles las ventajas y posibles riesgos de la administración de la GGHAM y que firmaran el consentimiento informado. Por razones éticas se usaron como comparación los resultados de la serie histórica y no quedaron niños sin que se les administrara la GGHAM.
Los casos se estratificaron de acuerdo con los factores de mal pronóstico (FMP) que presentaban. Los FMP se establecieron por el cuadro clínico y la evolución de los pacientes registrados en la serie histórica de la epidemia. Para evaluar la efectividad de la administración de la GGHAM se contrastaron los resultados de la supervivencia de los niños en el ensayo clínico con los reportados en la serie histórica con iguales FMP.
Se empleó el tratamiento establecido según las normas para estos enfermos, considerando los FMP y se adicionó la GGHAM. En los niños que tuvieron hasta 2 FMP, el tratamiento convencional en la serie histórica y con la GGHAM logró 100% de sobrevida. Con 3 y 4 FMP, los porcentajes respectivos de sobrevida con el tratamiento convencional fueron 86% y 78,5%, mientras que en ambos casos la sobrevida con la GGHAM fue de 100%. Los enfermos con 5 FMP se consideran muy graves y con el tratamiento que había demostrado ser el más efectivo se lograba 53% de sobrevida. Cuando se adicionó la GGHAM la supervivencia llegó al 88,9%. Los niños con 6 FMP se clasifican como graves críticos, y con el tratamiento convencional lograban una sobrevida del 21,4%. Se alcanzó una sobrevida del 62,5% cuando se utilizó la GGHAM. Con 7 y 8 FMP la administración de la GGHAM no mejoró la sobrevida.
Encontramos combinaciones de FMP con alta letalidad y muy baja sobrevida (20%) con el tratamiento convencional, como fueron los casos con conteo plaquetario <150.000, + shock, + acidosis (pH<7,3). Al administrarles la GGHAM la sobrevida se elevó hasta un 62,5%. Estos resultados aportaron nuevas evidencias a favor de la capacidad protectora de los anticuerpos inducidos por la vacuna.31,32
Potencialidad de VA-MENGOC-BC® en la prevención de la enfermedad gonocócica
Dos especies bacterianas del género Neisseria; Neisseria meningitidis y Neisseria gonorrhoeae están relacionadas antigénicamente, y causan enfermedades en humanos: la primera provoca la EM y la segunda enfermedad gonocócica o gonorrea (EG). Ambas son comensales y patógenos exclusivos del humano. La gonorrea es una enfermedad de transmisión sexual. Los gonococos se han convertido en super-bacterias resistentes y constituyen un problema en expansión, sin que exista aún una vacuna para su prevención.34,35
Estudios de laboratorio realizados en el Instituto Finlay y el Instituto de Medicina Tropical (IPK) “Pedro Kourí”, demostraron reacciones cruzadas in vitro entre anticuerpos séricos y en secreciones inducidos por la administración de VA-MENGOC-BC® en ratones. También se identificaron elementos de una respuesta de tipo celular inducida por esta vacuna contra gonococos, lo que explicaría el comportamiento epidemiológico observado en la reducción de la incidencia de la EG después de las campañas de vacunación masiva con VA-MENGOC-BC®.36
En un estudio de casos y controles realizado en Nueva Zelanda, los que recibieron una vacuna antimeningocócica de VME tuvieron un riesgo significativamente menor de enfermar de gonorrea que los no vacunados (OR 0,69; p<0,001).37
Otro estudio en el mismo país, con la misma vacuna, reportó una efectividad general de 31% y una efectividad de 47% para una de las cohortes en la reducción de la hospitalización causada por EG.38
Avances en el campo de los adyuvantes para vacunas humanas. Paquete tecnológico y patentes
La plataforma tecnológica de adyuvantes para vacunas humanas más utilizada en Cuba se basa en la tecnología proteoliposómica por la que se obtienen las VME a partir de la cepa CU-B385/83 de Nm. Esta tecnología, que se empleó para producir más de 70 millones de dosis de la vacuna antimeningocócica, generó una familia de patentes, nuevas vacunas y oportunidades de desarrollo biomédico y biotecnológico.
Una nueva vacuna terapéutica antialérgica, actualmente en ensayo clínico, usa la tecnología proteoliposómica como adyuvante vacunal. Vacunas terapéuticas en desarrollo contra diferentes tipos de cáncer emplean también variantes de la tecnología vesicular proteoliposómica como adyuvante. Las nuevas generaciones de vacunas experimentales anti-meningocócicas, anti-leptospirósicas, anti-colérica y anti-pertúsica, también emplean la tecnología de VME en su producción.39 La Figura 2 y la Tabla 1 resumen estos aspectos.

Fig. 2 Plataforma desarrollada a partir de la tecnología vesicular o proteoliposómica. La Figura está compuesta por un conjunto de imágenes y representa, por medio de microfotografías electrónicas, la plataforma de formulaciones adyuvantes, de estructura proteoliposómica y coclear, desarrollada a partir de la tecnología del Instituto Finlay de Cuba, para la obtención de VME de Neisseria meningitidis B. El bloque superior con tres líneas diferentes; 1) A, A1, A2 representa nuevas VME y cocleatos a partir directamente de las originales. 2) A, A3, A4, a3, a4 representa una nueva generación de nano-VME y nano-cocleatos y 3) Directamente de las VME originales se obtienen PLS muy pequeños (VSSP) con gangliósidos. Las 4 fotos del bloque inferior representan la aplicación de la tecnología vesicular a vacunas de cólera (B1, B2) y de leptospira (C1, C2).
Tabla 1 Paquete tecnológico: “know how” de nuevos adyuvantes y vacunas basadas en la tecnología vesicular de VA-MENGOC-BC®.
| Documento | Pat. | PI | Producto biotecnológico | Referencia |
|---|---|---|---|---|
| CU 21888 A1 | X | - | Vacuna contra |
(13) |
| EP 0301992 B1 | X | - | Vacuna, gamma y FT, |
(14) |
| WO 2004/047805A1 | X | - | Vacunas y adyuvantes basados en cocleatos | (40) |
| WO 2003/094964A1 | X | - | Vacunas y tratamientos antialérgicos | (41) |
| WO2010/057447A1 | X | - | Vacunas y formas de aplicación | (42) |
| WO2011/137876A2 | X | - | Vacunas contra antígenos tolerogénicos. Vacunas contra Malaria | (43) |
| WO02/45746A2 | X | - | Adyuvante para antígenos poco inmunogénicos (cáncer) | (44) |
| Vaccine (1999) | - | X | Adyuvante para antígenos poco inmunogénicos (cáncer) | (45) |
| VacciMonitor (2012) | - | X | Nanococleatos y proteoliposomas de Leptospira | (46) |
| BMC Immunol. (2013) | - | X | Nuevas vacunas de |
(17) |
| J Sci Tot Env (2019) | - | X | Nanococleatos y nanoproteoliposomas anti-meningocócicos | (19) |
| Rev Chim (2019) | - | X | Evaluación inmuno-toxicológica de vacunas sin Al(OH)3 | (20) |
| Methods (2009) | - | X | Proteoliposomas y cocleatos de |
(47) |
| BMV Immunol (2013) | - | X | Vacuna acelular de |
(48) |
Pat: Patentes P.I.: Publicación Índice.
Otros avances científico-tecnológicos obtenidos en el macro-proyecto meningo. Paquete científico tecnológico, selección de patentes y publicaciones
Mediante tecnologías de ingeniería genética se clonaron y obtuvieron proteínas importantes para las nuevas generaciones de vacunas anti-meningocócicas del serogrupo B: PorA, PorB, OpcA, NadA, Tbp, NspA, NlpB, lpdA, y otras, y variantes de algunas de ellas.49,50
Se obtuvieron y caracterizaron los mimotopos peptídicos del polisacárido del serogrupo B por tecnología de fagos filamentosos, que abren nuevas potencialidades vacunales basadas en el polisacárido B y evitan el posible desarrollo de autoinmunidad.51
Se produjeron anticuerpos monoclonales contra Nm que se emplean con fines diagnósticos, en técnicas analíticas y en procesos de purificación. Con el uso de la proteómica, se estudió la cepa CU-B385/83 que contiene en sus vesículas de membrana externa todas las proteínas esenciales para la protección contra Nm con poder inmunomodulador.15,52,53
Se desarrollaron ensayos ultramicroanalíticos tipo ELISA (que emplean cantidades pequeñas de reactivos y muestras biológicas), para el diagnóstico serológico de la respuesta inmune inducida por VA-MENGOC-BC® en los estudios de campo, para evaluar inmunidad poblacional y para cuantificar las concentraciones de inmunoglobulina G anti-meningocócica de los plasmas hiperinmunes empleados en la producción de la GGHAM.32
La proteína recombinante de Nm P64K, obtenida por ingeniería genética se empleó como portadora para vacunas y su N-terminal forma parte de construcciones genéticas que permiten un alto nivel de expresión de las proteínas de fusión. Está incorporada en la estructura de candidatos vacunales en desarrollo contra el dengue, en vacunas terapéuticas contra el cáncer y contra enfermedades autoinmunes. Es la proteína portadora de la vacuna terapéutica CIMAvax-EGF, usada en el tratamiento de pacientes con cáncer de pulmón.54 En la Tabla 2 se resumen las patentes y publicaciones de este paquete tecnológico.
Tabla 2 Paquete Científico Tecnológico, selección de Patentes y Publicaciones-Índice sobre resultados obtenidos en el macro-proyecto meningo.
| Documento | Pat. | PI | Producto biotecnológico | Referencias |
|---|---|---|---|---|
| EP 0474313 A2 | X | - | Proteína-r P64K, portadora (cáncer, enfermedades infecciosas) | (55) |
| WO2009/003425Al | X | - | CIMAvax- EGF (vacuna terapéutica contra el cáncer) | (56) |
| CU 2006/0020 | X | - | Péptidos miméticos del polisacárido B de |
(57) |
| USP 5,747,653 | X | - | Gammaglobulina hiperinmune y su método. | (58) |
| Int J of Med Micr (2011) | - | X | Péptidos miméticos del polisacárido B de |
(51) |
| Exp Rev Vaccines (2015) | - | X | CIMAvaxEGF-P64K (vacuna terapéutica contra cáncer de pulmón) | (59) |
| BBRC 308 (2003) | - | X | Dengue virus-P64k proteína-r | (60) |
| Tesis Doctoral (2006) | - | X | Obtención de inmunoglobulina humana antimeningocócica | (32) |
| Proteomics (2006) | - | X | Caracterización de vesículas de VA-MENGOC-BC® | (52) |
| Hum Vaccine (2009) | - | X | Caracterización de vesículas de VA-MENGOC-BC® | (53) |
| Microb Pathogen (1997) | - | X | Obtención de proteínas reguladoras del hierro de |
(49) |
| Biotecnología Aplicada (2008) | - | X | Propiedades genéticas e inmunológicas del antígeno NlpB | (50) |
Pat: Patentes P.I.: Publicación Índice.
Aplicación de VA-MENGOC-BC® en otros países
En varios países de América Latina circulan cepas, diferentes a la vacunal y contra todas ellas VA-MENGOC-BC® ha tenido un porcentaje alto de efectividad, en el rango de 55%-98% en menores de 4 años y de 73%-100% en mayores de 4 años. La Tabla 3 muestra los resultados de la evaluación de eficacia y efectividad en varios países, incluida Cuba.
Tabla 3 Eficacia/efectividad de la vacuna evaluada en poblaciones y grupos de edades de diferentes países.
| Lugar | Fecha | Grupo de edad | Efectividad por grupo de edad (%) | ≤ 4 años | > 4 años | Referencias |
|---|---|---|---|---|---|---|
| Cuba (7 Provincias) | 1987-1989 | 10 a 16 años | - | 83* | (16) | |
| Cuba (12 Provincias) | 1988-1990 | 3 meses a 4 años | 93 | - | (61,62) | |
| Cuba (14 Provincias) | 1989-1994 | 3 meses a 4 años | 81 | - | (62) | |
| Cuba | 1997-2008 | > de 1 año | 84 | - | (27) | |
| Brasil (Santa Catarina) | 1990-1992 | 3 meses a 7 años | 66 | 88 | (63) | |
| Brasil (Rio de Janeiro) | 1990-1992 | 6 meses a 9 años | 64 | 82 | (64) | |
| Brasil (Sao Paulo) | 1990-1991 | 3 meses a 6 años | (55%)** | 73 | (65,66) | |
| Colombia (Antioquia) | 1991-1994 | 3 meses a 4 años | 98 | - | (67) | |
| Uruguay (Canelones) | 2002-2003 | 4 a 19 años | - | 100 | (68) | |
| Uruguay (Montevideo) | 2002-2003 | 4 a 19 años | - | 88 | (68) |
*Eficacia con placebo y vacuna en diseño prospectivo aleatorizado a doble ciegas. **Efectividad en la rama prospectiva del estudio.
En 1989-90 se administraron dos dosis de VA-MENGOC-BC® a 2,4 millones de niños en el estado de Sao Paulo, Brasil. La efectividad fue menor que en las evaluaciones cubanas, debido probablemente a que se realizaron intervenciones aisladas sin el rigor ni las coberturas de una campaña o programa, en un estado con más de 40 millones de habitantes. Después se incorporaron otros países y regiones dentro de países que aplicaron esquemas de vacunación de dos dosis, restringidos a algunos grupos de edad, con coberturas inferiores a las de Cuba y con una mayor heterogeneidad en las cepas circulantes. Por lo general, se vacunaron niños de estados, provincias o localidades con altas tasas de incidencia, en intervenciones únicas no insertadas en un programa nacional de inmunización, que dejaban sin vacunar a niños de localidades vecinas y pertenecientes a grupos de edad en riesgo.
Varias revisiones que incluyen estudios de VA-MENGOC-BC® frente a cepas heterólogas de Nm en niños menores de 2 y 4 años demuestran la efectividad de la vacuna en esas condiciones.69,70,71
Conclusiones
La EM ya no es un problema de salud pública en Cuba después de la introducción de la vacuna VA-MENGOC-BC®, debido a su estructura (basada en la presencia, estabilidad y consistencia de PLS que confieren inmunogenicidad y capacidad protectora) y la estrategia de administración. VA-MENGOC-BC® es la primera vacuna de probada eficacia contra el serogrupo B de N. meningitidis y también es efectiva contra el serogrupo C y un amplio espectro de cepas heterólogas del serogrupo B. Tiene reactividad cruzada contra N. gonorrheae, que amplía el posible espectro de prevención de esta infección. La aplicación sistemática de la vacuna con una amplia cobertura en el Programa Nacional de Inmunización de Cuba mantiene baja la incidencia de la EM. La vacunación cambia los patrones de las cepas en los portadores asintomáticos y cepas circulantes, lo cual es importante para la epidemiología de la enfermedad. Una mayor supervivencia en niños con EM severa tratados con gammaglobulina hiperinmune meningocócica, evidencia la capacidad protectora de los anticuerpos inducidos por la vacuna. La tecnología de producción de VA-MENGOC-BC® contribuye al desarrollo de la industria farmacéutica y biotecnológica cubana, obteniendo importantes avances tecnológicos, respaldados por una familia de patentes y publicaciones primarias en el campo de las vacunas y adyuvantes, para beneficio actual y futuro.














