Introducción
La uveítis anterior no infecciosa (UANI) es definida como una inflamación de la úvea y estructuras subyacentes. Esta enfermedad se ubica en el espectro de enfermedades autoinmunes e inflamatorias (EAI). Es considerada, además, un problema de salud mundial, por ser causa importante de ceguera total y otras discapacidades visuales. Cuba no está exenta de esta heterogénea enfermedad y sus complicaciones.1,2
En la actualidad se detectan, cada vez con mayor frecuencia, cuadros clínicos de desregulación inmune, que incluyen: autoinmunidad, inflamación, linfoproliferación o malignidad; que se relacionan con alteraciones cualitativas o cuantitativas de la respuesta inmune. A su vez, procesos autoinmunes se han identificado en pacientes con inmunodeficiencias; sin embargo, estos cuadros no siempre se tienen en cuenta para la evaluación inicial de EAI, en detrimento del diagnóstico y tratamiento temprano de estas alteraciones inmunológicas.3
El estudio de los niveles de anticuerpos frente a antígenos vacunales es necesario para la evaluación de programas de vacunación y la detección de los niveles de protección a escala individual y poblacional. También contribuye a la evaluación inmunitaria del paciente; por otra parte, la vacunación en pacientes con EAI es segura, eficaz y de bajo costo, lo que contribuye a disminuir la morbilidad y mortalidad por infecciones inmunoprevenibles en este grupo de pacientes.4,5,6,7
Se han descrito varios alelos de las moléculas HLA y diferentes genes relacionados con la magnitud de la respuesta a las vacunas;8 también se han vinculado con autoinmunidad. Hasta la mitad de los casos con UANI se han asociados a la presencia del alelo HLA-B27. Varias teorías relacionan la presencia de este antígeno con la inmunopatogenia y diagnóstico de esta enfermedad.2
Las EAI se caracterizan por presentar desregulación inmune y en muchos casos existe una asociación paradójica entre inmunodeficiencias y estas enfermedades. Existen reportes en otras EAI de posibles afectaciones de la inmunidad contra inmunógenos vacunales,3 pero en la UANI está menos estudiada, por lo que el objetivo de este estudio fue evaluar la inmunidad frente al toxoide tetánico y diftérico y su relación con el alelo-HLA-B27 en pacientes cubanos con uveítis anterior no infecciosa.
Materiales y Métodos
Diseño
Se llevó a cabo un estudio observacional, analítico, de casos y controles en el periodo de enero 2013 a marzo 2018.
Pacientes
El universo estuvo constituido por todos los pacientes que asistieron a consultas de inflamaciones oculares del Instituto Cubano de Oftalmología “Pando Ferrer” (La Habana, Cuba) en el periodo definido. La muestra del estudio quedó representada por 197 pacientes con diagnóstico de UANI evaluados en consulta de inmunogenética por un especialista de esta área procedente del Centro Nacional de Genética Médica (La Habana, Cuba), teniendo en cuenta los criterios de selección en el periodo de enero 2013 a marzo 2018.
Criterios de exclusión
Padecer alguna enfermedad infecciosa en el momento de la extracción de sangre.
Recibir tratamientos orales, intramusculares o endovenosos con inmunosupresores a las dosis máximas establecidas para cada medicamento una semana antes de la extracción de sangre.
Haber recibido transfusiones de sangre u otros hemoderivados en 3 meses anteriores a la extracción de sangre.
Pacientes con enfermedades crónicas descompensadas en el momento de la extracción.
Pacientes con antecedentes de padecer de cáncer.
Tratamientos con inmunoterapias dos meses previos a la extracción.
Criterios de salida
Los grupos de edad se definieron según lo establecido en el Esquema Nacional de Inmunización (ENI),7 que define que la vacunación de refuerzo con toxoide tetánico es cada 10 años después de los 14 y hasta los 65 años de edad, luego cada 5 años para los mayores e iguales de 65. Teniendo en cuenta que la edad de los individuos incluidos es mayor e igual a 18 años, los grupos analizados fueron: 18-24, 25-34, 35-44, 45-54, 55-64 y 65 años o más.
Esta investigación fue aprobada por el comité de ética del Centro Nacional de Genética Médica (La Habana, Cuba) y se obtuvo el consentimiento informado de todos los participantes. Se tuvieron en cuenta los principios éticos enunciados en la Declaración de Helsinki de la Asociación Médica Mundial para las investigaciones médicas en seres humanos.8 Se excluyeron cuatro pacientes por llevar tratamiento 7 días antes de la extracción de sangre con altas dosis de inmunosupresores por agudización de la UANI. Tres pacientes abandonaron voluntariamente el estudio por cambio de domicilio de la Habana. La muestra quedó conformada finalmente por 190 pacientes con UANI.
Controles
Los controles supuestamente sanos, bajo los criterios establecidos para donantes de sangre, fueron incluidos de manera aleatoria en una proporción 1:1 según el número de pacientes incluidos, con distribución semejante según sexo, edad y color de la piel. Estos individuos procedieron del banco de sangre provincial de La Habana.
Técnicas
Se realizó la determinación de anticuerpos antitoxina diftérica (ATD) y tetánica (ATT) mediante ensayos inmunoenzimáticos en fase sólida (ELISA) (SUMA PR-521, Cuba).9,10 Los resultados fueron clasificados según el nivel de antitoxina: <0,1 UI/mL: niveles de antitoxina no adecuados para conferir protección; ≥0,1 UI/mL: niveles protectores. Los niveles protectores se subdividen en: 0,1-1,0 UI/mL: niveles de antitoxina para una protección confiable; y >1,0 UI/mL: niveles de antitoxina para una protección confiable de larga duración.5
Se obtuvo suero a partir de la extracción de 5 mL de sangre por punción venosa. Se vertió la sangre en un tubo de ensayo de cristal seco y se mantuvo a temperatura de laboratorio (22-25°C) hasta que se logró la retracción espontánea del coágulo. Las muestras se centrifugaron a 1.000 g y se decantó el suero en viales Eppendorf de 1,5 mL, previamente identificados. Se conservaron a -20ºC hasta el momento de realizar las determinaciones.
Se realizó la extracción del ácido desoxirribonucleico mediante la técnica de precipitación salina,11) a partir de 10 mL de sangre humana, y posteriormente se realizó el esudio molecular del alelo HLA-B27 mediante la técnica de la reacción en cadena de la polimerasa (PCR).12
Análisis estadístico
Las variables cualitativas se expresaron como frecuencias y porcentajes. La normalidad de las variables se verificó mediante la prueba de Kolmogorov-Smirnov. La media geométrica y los intervalos de confianza (IC) al 95% fueron calculados para cada una de las distribuciones de ATT y ATD. Se realizó el análisis de comparación de proporciones entre los enfermos y supuestamente sanos para comparar los niveles de protección entre ambos grupos de estudio y también se calculó el intervalo de confianza de proporciones. La comparación de los Títulos Medios Geométricos (TMG) de los pacientes con UANI y los controles se realizó a través del test no paramétrico U de Mann-Whitney. La asociación entre los niveles de protección y la presencia del alelo HLA-B27 se identificó mediante el estadígrafo Chi-cuadrado. Se utilizó la razón de disparidades (OR, del inglés: Odd Ratio) como medida de asociación y su IC al 95%. El análisis estadístico de los resultados se realizó con los programas Statistica 7.0 (Statistica Inc., New York, EE.UU.) y EPIDAT versión 3.1 (OPS; Galicia, España). Se empleó un nivel de significación estadística de 0,05.
Resultados
En los pacientes con UANI se observó una frecuencia ligeramente mayor del sexo femenino (59,47%). La mediana de la edad fue de 45 años con un rango de 33 a 55.
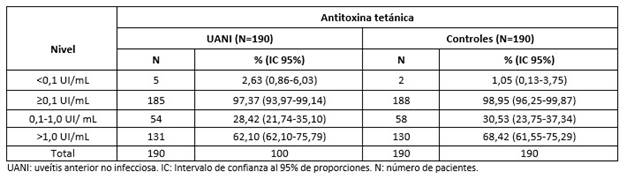
El 97,37% de los pacientes con UANI presentaron niveles protectores (≥0,1 UI/mL) de ATT. En el 62,10% de los pacientes se observaron niveles de ATT para una protección confiable de larga duración (>1 UI/mL). Similares resultados se observaron en los controles en los mismos niveles de protección (p=0,2525 y p= 0,1964, respectivamente) (Tabla 1).
Tabla 1 Niveles de antitoxina tetánica en pacientes cubanos con uveítis anterior no infecciosa y en individuos supuestamente sanos.
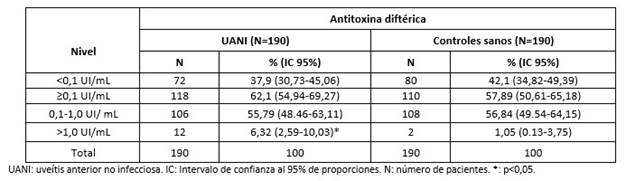
Se detectaron similares niveles protectores de ATD (>0,1 UI/mL), así como no protectores (<0,1 UI/mL), entre los pacientes con UANI y sus controles (p=0,8517 y p=0,4040, respectivamente). Sin embargo, los porcentajes de pacientes con niveles de ATD para una protección confiable de larga duración (>1,0 UI/mL) fueron mayores en los pacientes con UANI comparados con los del grupo control (p=0,0065) (Tabla 2).
Tabla 2 Niveles de antitoxina diftérica en pacientes cubanos con uveítis anterior no infecciosa y en individuos supuestamente sanos.
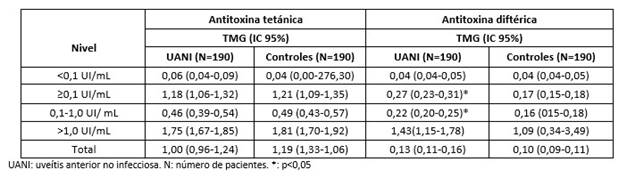
Los TMG de ATT en los pacientes con UANI son similares respecto a los detectados en los individuos supuestamente sanos (p=0,2907). Los TMG totales de ATD en el grupo general de pacientes con UANI no mostraron diferencias estadísticas con los individuos controles (p=0,1265); sin embargo, los TMG de los niveles protectores (≥0,1 UI/mL) en los pacientes con UANI fueron mayores respecto a los controles sanos (p< 0,0001) (Tabla 3).
Tabla 3 Media geométrica e intervalos de confianza a 95% de antitoxina tetánica y antitoxina diftérica en pacientes cubanos con uveítis anterior no infecciosa y en individuos sanos.
Los niveles de protección de ATT por grupos de edades (Tabla 4) fueron similares entre los pacientes con UANI e individuos supuestamente sanos en todos los grupos de edad (p>0,05) (Tabla 4). Sin embargo, respecto a los niveles de ATD, se observó que los individuos de 65 o más años con UANI se encontraban más protegidos contra la difteria que los individuos sanos (p=0,0212) (Tabla 5).
Tabla 4 Niveles de protección de antitoxina tetánica en pacientes cubanos con uveítis anterior no infecciosa y en individuos sanos, según grupos de edades.
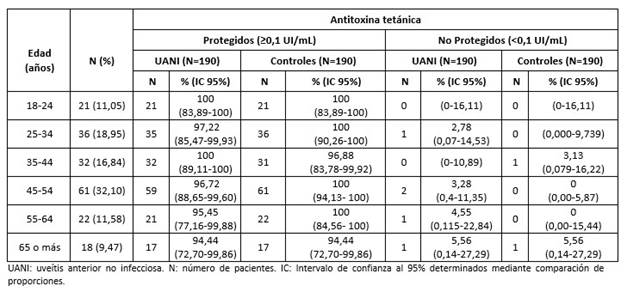
Tabla 5 Niveles de protección según grupos de edad de antitoxina diftérica en pacientes cubanos con uveítis anterior no infecciosa y en individuos sanos según grupos de edades.
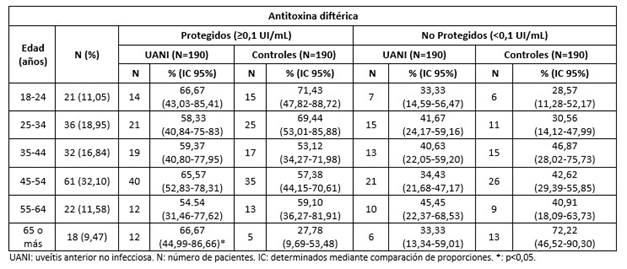
Respecto a los TMG de ATT, el rango de edad de 18 a 24 años fue el único que mostró diferencias estadísticas entre los enfermos (0,97 UI/mL, IC 95%: 0,72-1,32 UI/mL) y controles estudiados (1,48 UI/mL, IC 95%: 1,12-1,97 UI/mL) (p=0,0215).
El TMG de ATD en pacientes de 45-54 años de edad con UANI (0,18 UI/mL, IC 95%: 0,13-0,24) fue superior respecto al grupo control (0,10 UI/mL; IC 95%: 0,08-0,13) (p=0,0222); sin embargo, no se encontraron diferencias entre la comparación de proporciones en ese mismo grupo, según los niveles de protección (p=0,4568). El grupo de edad de 65 o más años con UANI presentó TMG de ATD de 0,14 UI/mL con IC 95% entre 0,08 y 0,25 UI/mL, los cuales fueron estadísticamente superiores (p=0,0480) respecto a los detectados en individuos supuestamente sanos (0,06 UI/mL, IC 95%: 0,03-0,13 UI/mL).
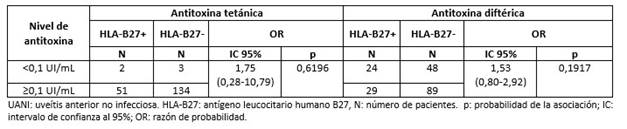
En los pacientes con UANI no se observó asociación entre la presencia del alelo HLA-B27 y los niveles de protección frente al toxoide tetánico y diftérico (Tabla 6).
Discusión
La UANI es un problema de salud global por ser causa importante de ceguera total.1,2,3 Los pacientes con EAI como la UANI, se caracterizan por presentar desregulación inmune, por lo que identificar alteraciones en los niveles de protección frente a inmunógenos vacunales es útil para trazar estrategias preventivas y terapéuticas en estos individuos.
En un estudio nacional que se realizó en pacientes con UANI también prevaleció el sexo femenino.1 De igual forma, el comportamiento de la edad es similar a lo descrito en este y otros estudios realizados.1,2,3
Las toxinas tetánicas y diftéricas son inactivadas y convertidas en toxoide tetánico y diftérico respectivamente. La administración de estos toxoides genera la producción de anticuerpos denominados ATT y ATD, los cuales desempeñan un papel importante en la protección contra el tétano y la difteria.5,13
Los buenos títulos de ATT detectados en los pacientes con UANI y en los controles sanos apoyan el cumplimiento y eficacia del ENI en Cuba y las excelentes propiedades inmunogénicas del toxoide tetánico reportado en Cuba y otros países.5,7,13,14 La Organización Mundial de la Salud recomienda que siempre que sea posible se utilicen vacunas combinadas con el toxoide tetánico aprovechando las características de este inmunógeno.13
Csuka y cols., observaron resultados semejantes respecto a los diferentes niveles de protección de ATT en pacientes con enfermedades mediadas por el sistema inmune, como el lupus eritematoso sistémico (LES), comparado con controles sanos.15
Aunque se detectaron TMG ligeramente menores de ATT en los pacientes con UANI en el grupo de edad de 18 a 24 años, todos ellos se encontraban protegidos contra el tétanos, al presentar valores superiores a 0,1 UI/mL, no difiriendo en este aspecto del grupo control.7,14
Csuka y cols., también observaron títulos de ATT variables por grupos de edades en enfermedades mediadas por el sistema inmune. Estos autores reportaron que en pacientes con LES de 30 a 69 años se observaron menores títulos de esta antitoxina respecto a los controles sanos; sin embargo, en los menores de 30 años y mayores o iguales a 70, los títulos de ATT fueron mayores en los pacientes con LES que en sus controles.15
La Liga Europea contra las Enfermedades Reumáticas plantea que se ha observado una respuesta inmune ATT satisfactoria en estas enfermedades y que estos pacientes deben vacunarse según las recomendaciones nacionales para la población general.4,16
Los niveles protectores de ATD fueron menores en ambos grupos de estudio respecto a los de ATT, lo que coincide con otras investigaciones, las cuales también han sugerido la importancia y necesidad de sustituir la vacuna monovalente de toxoide tetánico por una vacuna bivalente contra el tétanos y la difteria para adultos.5,14,15,17,18
Sin embargo, otros estudios en adultos y ancianos, reportaron que los títulos de ATD después de la reactivación con toxoide diftérico no se modificaron o lo hacen muy poco comparado con el toxoide tetánico.17,19
Aunque el TMG de ATD en el grupo de 45 a 54 años fue mayor en los pacientes con UANI, los niveles de protección entre ambos fueron similares. Otro estudio controlado, encontró diferencias estadísticas en los niveles de esta antitoxina en pacientes con enfermedades mediadas por el sistema inmune.15)
No encontramos una explicación plausible para los mayores títulos de ATD encontrados en el grupo con UANI, específicamente en los mayores de 65 años. No puede descartarse la influencia del pequeño tamaño de la muestra en este grupo de edad, por lo que sugerimos realizar otras investigaciones que corroboren o no este comportamiento. No obstante, llama la atención que otras investigaciones reportaron niveles de protección de ATD muy inferiores a las del presente estudio.17,19
Se describen implicaciones genéticas con relevancias en el diseño de vacunas y su efectividad.6 Un estudio de asociación a nivel de todo el genoma describió cuatro alelos clásicos (HLA-DRB1*0301, HLA-DQB1*0201, HLA-DQB1*0602 y HLA-DRB1*1501) asociados con la duración de la protección específica contra el tétano.6
En 1200 sujetos sanos, van Tok y cols., encontraron asociación entre el alelo HLA-B*2705 y bajos títulos de anticuerpos frente a la vacuna contra la Rubeola.20)
Aunque en nuestra investigación no se encontró asociación entre la presencia del alelo HLA-B27 y los títulos de ATT y ATD, se sugiere realizar estudios futuros, empleando la tipificación de la molécula HLA-B27 mediante alta resolución. Variantes alélicas de esta molécula pudieran influir sobre la respuesta a vacunas como el toxoide tetánico y diftérico.
Esta anterior recomendación se sustenta en que Ovsyannikova y cols., demostraron en ratas transgénicas con la expresión de HLA-B27, que la activación de la respuesta inmune innata, después de la estimulación con Mycobacterium tuberculosis inactivo, incrementó la expresión y producción de citocinas proinflamatorias, lo cual se asoció con el desencadenamiento de espondiloartropatías y con la severidad de la espondilitis y artritis, respecto a ratas sin la expresión de HLA-B27.21
No se encontraron diferencias en cuanto a la respuesta contra toxoide tetánico y diftérico en la mayor parte de los pacientes con UANI y sus controles supuestamente sanos. Los adultos cubanos requieren refuerzos con toxoide diftérico.