Introducción
En el desarrollo de vacunas son obligatorios los estudios preclínicos que incluyen una evaluación preliminar de la seguridad en modelos animales, los mismos son altamente regulados y consumen tiempo.1 El uso de Primates No Humanos (PNH), posteriormente a la conducción de estudios en especies roedoras, ha permitido confirmar la seguridad y eficacia de vacunas contra la COVID-19, teniendo en cuenta su cercanía filogenética al ser humano, lo que implica similitudes biológicas en su desarrollo, composición sanguínea, dentición y los sistemas endocrino, nervioso y reproductor.2,3
En el Instituto Finlay de Vacunas (IFV) de La Habana, Cuba, ante la situación de la pandemia de la COVID-19, se comenzó rápidamente el desarrollo de tres candidatos vacunales contra el virus SARS-CoV-2;4,5,6,7,8) el primero de ellos fue SOBERANA 01 (FINLAY-FR-01) que tiene como ingrediente activo el RBD (del inglés, receptor binding domain) dimérico con vesícula de membrana externa de Neisseria meningitidis, adyuvado en hidróxido de aluminio y que en estudios preclínicos indujo una respuesta inmune potente y neutralizante en ratones.4
El mono verde Cercopithecus aethiops es una especie ampliamente utilizada en estudios preclínicos de fármacos y vacunas que se ha establecido como un biomodelo para la investigación biomédica, en particular para los estudios toxicológicos.9) Estos estudios preclínicos en PNH se llevan a cabo teniendo en cuenta las guías internacionales pertinentes para los mismos.1,10,11,12).
Este trabajo tuvo como objetivo evaluar la inmunogenicidad y posibles efectos toxicológicos del candidato vacunal SOBERANA 01 (FINLAY-FR-01) en Cercopithecus aethiops.
Materiales y Métodos
Consideraciones generales
Los ensayos de toxicidad a dosis repetida y de inmunogenicidad se realizaron teniendo en cuenta lo establecido en las guías de la Organización Mundial de la Salud (OMS)1 y la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) para la evaluación de vacunas,10 teniendo en cuenta, además, lo establecido por la EMA para los estudios a dosis repetidas.11
Candidato vacunal a evaluar
El candidato vacunal a evaluar fue SOBERANA 01 (FINLAY-FR-01) cuyo ingrediente activo es el RBD dimérico con vesícula de membrana externa de Neisseria meningitidis, adyuvado en hidróxido de aluminio. El candidato vacunal fue producido según las Buenas Prácticas de Fabricación por el IFV y el Centro de Inmunología Molecular de La Habana, Cuba. Esta sustancia de ensayo utilizada para la realización de los estudios de toxicidad por dosis repetidas e inmunogenicidad fue recibida y registrada en el laboratorio de Química Analítica del Centro de Toxicología Experimental del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) con su correspondiente Certificado de Calidad emitido por el IFV.
Animales
Animales de la especie Cercopithecus aethiops, hembras, se distribuyeron en dos grupos: un grupo Tratado (n=3) y un grupo Control (n=2). La selección del tamaño de la muestra se realizó tomando en consideración la especie animal empleada, ya que en este caso las guías internacionales permiten el uso de un número reducido de animales, teniendo en cuenta las características de los PNH y la necesidad de aplicar el principio de las 3R.1,12,13 En este contexto, la utilización de animales del mismo sexo se justifica por la similitud en los parámetros bioquímicos, hematológicos, respiratorios, cardiovasculares y electroneurofisiológicos entre hembras y machos de Cercopithecus aethiops.9
Todos los protocolos en los que se emplearon los animales se realizaron con la aprobación del Comité Institucional para el Cuidado y Uso de los Animales de Laboratorio (CICUAL) del CENPALAB.
Condiciones de mantenimiento de los animales
Los parámetros ambientales se monitorearon diariamente mediante un medidor de temperatura y humedad relativa RH 600 (EQ-06.168). La temperatura de la sala durante la fase experimental fue de 27,46 ± 0,46 oC; la humedad relativa de 77,20 ± 4,43 % y el fotoperiodo de 7 h de luz y 17 h de oscuridad. Estas variables se registraron diariamente (en horas de la mañana). Los animales se alojaron durante el estudio en jaulas de socialización. El agua clorada se ofreció ad libitum a través de un sistema de tetinas. El alimento con Certificado de Calidad, fórmula de pienso CMO:1600 AlycoR, se les suministró de forma restringida en tolvas acorde los requerimientos de la especie, excepto los días que precedieron a las extracciones de sangre, en los cuales los animales se sometieron a ayuno nocturno. Esta alimentación se suplementó con frutas y vegetales.
Grupos experimentales, dosis, frecuencia y duración
Los animales seleccionados se distribuyeron al azar para formar dos grupos experimentales, empleando el programa de números aleatorios LABTOOLS y se les realizó el siguiente esquema de inmunización:
Grupo Tratado (Finlay-FR-01): inmunizaciones los días 0, 28, 56 y 70. Este esquema se realizó teniendo en cuenta el esquema terapéutico previsto de los candidatos vacunales. La cuarta administración de la dosis, que excede las tres inmunizaciones previstas para el producto, se realizó cumpliendo con lo recomendado por la OMS para los estudios de toxicidad por dosis repetida para vacunas (N+1).1,14,15,16 Los animales recibieron en cada administración la dosis propuesta para humanos en un volumen de 0,5 mL. La duración de la fase experimental del ensayo fue de 84 días.
Grupo Control: se administraron con la misma frecuencia que los animales tratados, pero recibieron Solución Salina Fisiológica.
Preparación de los animales para la administración
Se realizó el rasurado del sitio de administración (zona muscular externa de la extremidad inferior izquierda) y de la zona torácico-abdominal de cada animal, con el objetivo de facilitar la observación de estos sitios y detectar cualquier manifestación clínica. El rasurado se realizó empleando una máquina de rasurar Andis RS1. La frecuencia del rasurado se estableció en dependencia de la administración de las sustancias.
La sedación de los animales se realizó con clorhidrato de ketamina de 50 mg, en una dosis de 5-10 mg/kg de peso corporal previo a las inmunizaciones y el estudio electrocardiográfico.
Extracción de sangre
Las extracciones de sangre para hematología y bioquímica sanguínea se realizaron antes de comenzar el estudio y 7 días después de la tercera y cuarta inmunizaciones.
Para los estudios inmunológicos, las extracciones de sangre se realizaron al tiempo cero y cada 14 días a partir de la primera inmunización.
La sangre se obtuvo de las venas femorales utilizando jeringuillas de 5 y 10 mL y agujas 21G x 1 pulgada. Los animales se sometieron a ayuno previo de 12 h. La sangre para hematología se colectó en viales que contenían EDTA (40 µL/mL de sangre). Para bioquímica sanguínea y estudios inmunológicos, se usaron viales de 2 mL, donde se dejó coagular y posteriormente se centrifugó a 12.000 rpm en una centrífuga Eppendorf (IT EQ-06.120) durante 10 min. Para los estudios inmunológicos, los sueros obtenidos fueron conservados a -20oC hasta su procesamiento en el IFV.
Ensayo de toxicidad por dosis repetidas
Observaciones clínicas, signos y peso corporal
Se realizaron observaciones clínicas diarias mediante el método de inspección visual dirigidas a detectar posibles cambios en la piel y el pelaje (especialmente el sitio de administración), ojos, membranas mucosas, sistemas respiratorio, circulatorio, sistema nervioso central y autónomo, así como actividad somatomotora y patrones de comportamiento.
Se realizó la determinación del peso corporal y la toma de los signos vitales previo a la administración de las sustancias. Ante cualquier traumatismo o proceso patológico de naturaleza general que afectara la salud de los animales, se aplicaron técnicas de reanimación.
El peso corporal se determinó en una balanza técnica de 30 kg antes de la administración de las sustancias de ensayo y luego semanalmente hasta el día 84 del ensayo.
Para la evaluación de los signos vitales se tomó la temperatura corporal, utilizando un termómetro clínico infrarrojo AXD 515 sin contacto en la región torácica, antes de cada administración de la dosis de cada sustancia de ensayo y a las 4, 8, 24, 48 y 72 h posteriores a cada inmunización.
La medición de la frecuencia respiratoria y la frecuencia cardíaca se realizaron empleando un estetoscopio SMIC. Esta evaluación se realizó antes de cada inmunización, aproximadamente 4 h después, y semanalmente.
Se realizó un electrocardiograma antes de comenzar el estudio y se repitió una vez finalizado el período de administración. Para su ejecución se utilizó un electrocardiógrafo BB Cardiocid H Serie 51BB 100324.
Tolerancia local de la sustancia en ensayo
Para la evaluación de la tolerancia local se tuvo en cuenta la toma de la temperatura del sitio de inyección en un cronograma igual al empleado para la temperatura corporal. Además, se realizó musculometría para la evaluación de la inflamación local con una cinta métrica, para medir la circunferencia de la extremidad inoculada antes y después de realizar la administración. Esta operación se realizó en los tiempos 0, 4, 8, 24, 48 y 72 h después de cada inmunización.
La irritabilidad dérmica se evaluó en el sitio de administración de las sustancias de ensayo mediante el método de Draize diseñado para aplicaciones tópicas, a través de la presencia de eritema, edemas y escaras, en los mismos tiempos que la temperatura del sitio y la musculometría.
Hematología y bioquímica sanguínea
Se determinaron los siguientes parámetros hematológicos: hemoglobina (HB), hematocrito (HTC), eritrocitos (ERI), constantes corpusculares (volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM) y concentración de hemoglobina corpuscular media (CHCM)), conteo de plaquetas (PLT), conteo total y diferencial de leucocitos (LEU), neutrófilos (N), linfocitos (L), eosinófilos (E), monocitos (M) y basófilos (B)). Todos los parámetros se determinaron en un Contador de Células MICROS ABX (Roche Diagnostic Systems), exceptuando el conteo diferencial de células que se realizó mediante la observación en un microscopio Carl Zeiss.
A los sueros obtenidos se les realizaron las determinaciones de los siguientes parámetros de la bioquímica sanguínea, proteínas totales (PT), alaninoaminotransferasa (ALAT), aspartatoaminotransferasa (ASAT), gamma glutamiltranspeptidasa (GGT), albúmina (ALB), fosfatasa alcalina (ALP), creatinina (CREA), bilirrubina total (Bil-T), colesterol (CHOL-T), triglicéridos (TG), ácido úrico (AU), urea nitrogenada (BUN), calcio (Ca), fósforo (PHOS), glucosa (GLUC) e índice albúmina/globulina (A/G), mediante un Analizador Automático Cobas Integra 400 PLUS (Roche Diagnostic Systems). Además, se determinó el balance electrolítico mediante la medición de sodio y potasio en el Espectrofotómetro de Absorción Atómica Hitachi ZA 3000.
Estudios inmunológicos
Se realizaron las determinaciones de los anticuerpos específicos anti-RBD IgG en suero e inhibición de la unión RBD-ACE2 por anticuerpos mediante ELISA.
Técnica ELISA indirecto para determinar el título de anticuerpos IgG anti-RBD
Las placas de microtitulación de 96 pocillos NUNC Maxisorp se recubrieron con 50 µL de RBD a una concentración de 3 µg/mL en disolución reguladora carbonato-bicarbonato pH 9,6 y se incubaron 1 h a 37ºC, posteriormente se lavaron tres veces con disolución de lavado y se bloquearon los sitios no recubiertos empleando 100 µL de una disolución de bloqueo de suero albúmina bovina (SAB) al 5% durante 1 h a 37ºC. Luego de otro paso de lavado como se describió previamente, se adicionaron los sueros de los animales incluidos en el ensayo, disueltos en disolución reguladora de fosfatos pH 7,2 + SAB al 1% en diluciones seriadas (1:3), generalmente partiendo de 1/50 y en un volumen de 50 µL/pozo. Las placas se incubaron 1 h a 37ºC y fueron lavadas nuevamente. A continuación, se adicionaron 50 µL de una dilución de anti-IgG de mono conjugada a peroxidasa en disolución reguladora de fosfatos pH 7,2 + SAB al 1% (1:10.000) durante 1 h. Luego de un último paso de lavado, se aplicó 50 µL/pozo de la disolución sustrato para enzima peroxidasa. Se incubó en la oscuridad durante 20-25 minutos y se detuvo la reacción con disolución de H2SO4 2N 50 µL/pozo. Se leyó la absorbancia a 450 nm en un lector de ELISA Multiskan EX (Thermo Scientific). El título de IgG se definió como el inverso de la dilución del suero de cada animal individual donde se alcanza cuatro veces el valor de la media de la absorbancia de los sueros pre-inmunes (T0) diluido 1/50. Para una mejor presentación y análisis de los resultados se calcula el Log del título para cada animal individual. Para definir los animales respondedores, se consideró como valor de corte un Log del título > 1,70, lo que se corresponde con una dilución del suero superior a 1/50. Para los animales cuyo título fue inferior al límite de detección del ensayo, se consideró un valor de título igual a 25 y de Log de 1,4.
Técnica ELISA de inhibición de la interacción RBD-hACE2
Se realizó un ELISA de inhibición de la interacción RBD-ACE2 por los anticuerpos anti-RBD inducidos en los animales. Para ello se recubrieron las placas de microtitulación de 96-pocillos con 50 µL de ACE2 a una concentración de 5 µg/mL en solución tamponada carbonato-bicarbonato a pH 9,6 y se incubaron toda la noche a 4°C, posteriormente se lavaron 3 veces con solución de lavado. Seguidamente, los sitios no recubiertos se bloquearon usando 200 µL de solución de bloqueo con leche descremada al 2% por 1 h a 37°C. Luego, el RBD unido a Fc humano (RBD-hFc) se preparó a 40 ng/mL en tampón fosfato a pH 7,2 + leche descremada al 0,2%. El suero de PNH inmunizados o preinmunizados se preparó en diferentes diluciones, en rangos de 1:100 a 1:100.000. Como control negativo se utilizó otra proteína irrelevante (PDL1-hFc). El suero diluido fue preincubado con RBD-hFc en una proporción 1:1, a 37ºC por 1 h y luego 50 µL/pocillo de la mezcla, se añadió a la placa y se incubó 1 h y 30 min a 37ºC. Después de un nuevo paso de lavado, se adicionaron 50 µL/pocillo de IgG anti-humana conjugada a la enzima fosfatasa alcalina en tampón fosfato a pH 7,2 + leche descremada al 0,2% (1:1000), por 1 h a 37ºC. Luego de un último paso de lavado, se aplicaron 50 µL/pocillo de p-nitrofenilfosfato (1mg/mL) en tampón dietanolamina. Se incubó en la oscuridad por 20 min y se detuvo la reacción con 50 µL/pocillo de solución NaOH 3M. La absorbancia se leyó a 405 nm en un lector de ELISA. El porciento de inhibición se calculó según la siguiente fórmula:
(1- Abs 405nm RBD-hFc + suero de PNH/Abs 405nm RBD-hFc) * 100.
Análisis estadístico
El análisis estadístico de todos los datos obtenidos se realizó utilizando el paquete estadístico SPSS 11.5.115. Se determinó la media de los valores (X) y desviación estándar (DE) para cada grupo. La normalidad se determinó por el test de Kolmogorov-Smirnov. Para las comparaciones entre grupos, se usó la prueba t de Student, y cuando no fue posible por la ausencia de normalidad, la prueba U de Mann-Whitney, ambos para muestras independientes. Se usó además la prueba t de Student para muestras relacionadas. En cuanto a los datos de inmunología, para encontrar diferencias significativas entre los grupos en cada tiempo, se realizó un ANOVA de clasificación doble y a continuación la prueba de comparación múltiple de Sidak, mediante el paquete estadístico para Windows GraphPad Prism 9 (Versión 9.0, GraphPad Software, Inc. 2020). Los valores probabilísticos (p) menores de 0,05 se consideraron estadísticamente significativos.
Resultados
Estudio de toxicidad por dosis repetida
El ensayo tuvo una supervivencia del 100%. Los animales mostraron buen estado de salud durante el estudio, con adecuado consumo de agua y alimentos, así como patrones de comportamiento normales. No se presentaron signos clínicos de interés que pudieran asociarse a la exposición a la sustancia de ensayo.
En cuanto al peso corporal, todos los animales manifestaron discreta ganancia de peso al final de la fase experimental respecto al inicio. El análisis estadístico no mostró diferencias significativas entre grupos en ninguno de los días (Fig. 1).
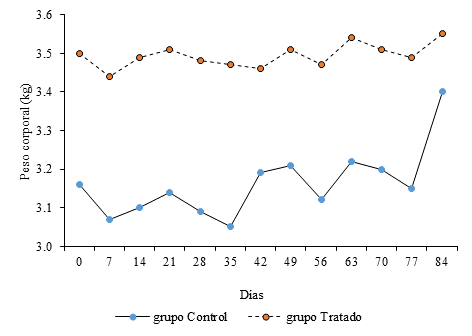
Fig. 1 Comportamiento del peso corporal durante el estudio. Los valores se corresponden con la media.
Con relación a los signos vitales, la frecuencia respiratoria no mostró diferencias significativas entre grupos durante el ensayo (Fig. 2).
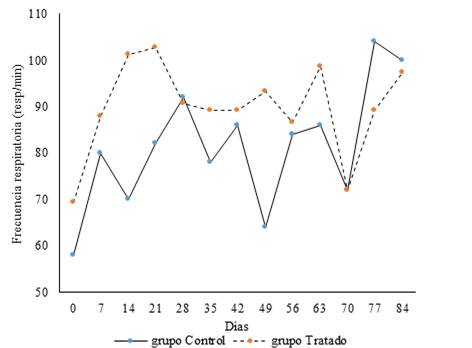
Fig. 2 Comportamiento de la frecuencia respiratoria durante el estudio. Los valores se corresponden con la media.
La comparación estadística entre la medición realizada antes de cada inmunización y la realizada aproximadamente 4 h después mostró diferencias significativas solo en el grupo Control, en el cual se produjo un aumento significativo del tiempo 0 al 4; mientras que el comportamiento de esta variable antes y después de cada inmunización no mostró diferencias por grupo.
Por otra parte, la frecuencia cardíaca no evidenció diferencias significativas entre grupos en ninguno de los días. Durante el estudio, el comportamiento de esta variable entre la medición realizada antes de cada inmunización y 4 h después, por grupo, mostró diferencias significativas sólo en el día 56 para el grupo Tratado, en el cual se produjo una disminución significativa (Fig. 3).
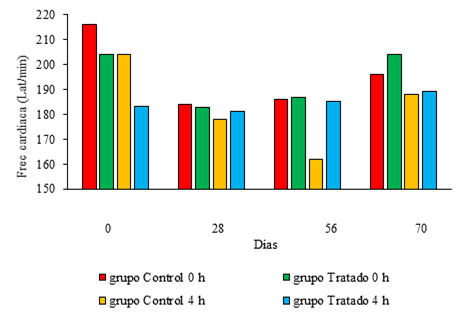
Fig. 3 Comportamiento de la frecuencia cardíaca antes y después de cada inmunización. Los valores se corresponden con la media.
La temperatura corporal no arrojó diferencias significativas entre los grupos en ninguna de las evaluaciones realizadas. La comparación estadística entre la medición realizada antes de cada inmunización y 4 h después no mostró diferencias significativas en ninguna de las observaciones.
En cuanto a la tolerancia local, no se observó edema ni eritema en el sitio de administración, aunque pudo apreciarse una tendencia al aumento de la temperatura en el sitio de inyección durante las primeras 4 h posteriores a la administración de la sustancia de ensayo.
Los resultados de la evaluación de la musculometría no mostraron diferencias entre grupos, ni entre los tiempos analizados.
En los análisis hematológicos, los resultados estadísticos entre grupos no mostraron diferencias significativas; a pesar de que antes de la administración y al día 63 se apreciaron diferencias significativas con respecto a HB, ERI, HTC y VCM, no se observaron alteraciones cualitativas en la morfología de la serie blanca, todas las células observadas al microscopio durante el conteo diferencial se presentaron en fases maduras de su desarrollo.
En la evaluación de la bioquímica sanguínea antes de la administración, el grupo Control mostró valores superiores significativamente en la ALP con respecto al grupo Tratado. Antes de la administración y al día 63 se observó disminución significativa en el grupo Tratado en relación a ASAT, ALAT, ALB, GGT, calcio y el índice A/G. Por otra parte, al día 63 y 77, la GLUC disminuyó significativamente en el grupo Tratado.
En el balance electrolítico, los parámetros sodio y potasio mostraron que al día 63 los valores de potasio en el grupo Tratado fueron diferentes significativamente al grupo Control, no se encontraron otras diferencias para ninguna de las dos variables.
En el caso del sodio, ambos grupos mostraron una disminución significativa antes de la administración y al día 63. En relación al potasio, se observó que el grupo Tratado mostró una diferencia estadística antes de la administración hasta el día 77 y del día 63 al 77.
Los estudios electrocardiográficos mostraron que el ritmo cardíaco se mantuvo sinusal. La frecuencia cardíaca promedio inicial fue de 229,33 ± 15,83 y la final 230,2 ± 26,74 latidos/minuto, lo cual no arrojó diferencias significativas desde el punto vista estadístico. La morfología de las ondas P, QRS y T se mantuvo sin variación.
Estudios inmunológicos
La Figura 4 muestra los títulos de anticuerpos anti-RBD para cada tiempo de extracción. El análisis reveló que luego de la primera dosis no se observa inducción de anticuerpos específicos anti-RBD en el grupo Tratado con el candidato vacunal. Sin embargo, después de la segunda y tercera dosis se observó un incremento significativo del título de anticuerpos inducidos que se mantienen durante el periodo evaluado.

Fig. 4 Títulos de anticuerpos IgG anti-RBD inducidos en primates no humanos. Las determinaciones de los títulos de anticuerpos se realizaron por un ELISA indirecto. Las flechas indican los momentos en los que se aplicaron las dosis (T0, T28, T56 y T70).
La evaluación de la funcionalidad de los anticuerpos inducidos por el esquema primario se realizó mediante el ensayo de inhibición de la unión RBD-ACE2. En relación a estos valores en las diluciones de suero evaluadas 14 días después de cada inmunización y la inhibición ID50 mostró que los anticuerpos inducidos a los 42 días (14 días después de la segunda dosis) eran capaces de inhibir la interacción RBD-ACE2 con valores superiores al 60% y una media de ID50 de 291. Estos valores se incrementaron después de la tercera y cuarta dosis, siendo superiores al 90% y una media de ID50 de 4.948 para el T84.
Discusión
La selección de la especie más adecuada para los estudios toxicológicos es una consideración importante que se toma en una fase temprana del descubrimiento de un fármaco basándose en factores científicos, éticos y prácticos.17 La guía de la OMS de 2013 indica que son suficientes los estudios de toxicidad en una sola especie relevante para las vacunas.18 En este estudio se seleccionaron PNH teniendo en cuenta resultados previos con candidatos vacunales similares.2,3 La detección de títulos elevados de IgG anti-RBD en los monos vacunados, después de la segunda dosis, validan la relevancia del uso de esta especie en nuestro estudio.
El peso corporal es uno de los parámetros que brinda mayor información acerca de la toxicidad de una sustancia; la pérdida significativa de peso corporal puede ser uno de los indicadores más sensibles del deterioro animal y se interpreta en la mayoría de los casos como un signo inequívoco de toxicidad.19 Desde el inicio hasta el final del estudio todos los animales ganaron peso, si bien las ganancias fueron discretas. El comportamiento de este parámetro no refleja que hayan existido efectos adversos sobre este indicador por la administración repetida del candidato vacunal.
Los valores de temperatura corporal, frecuencia cardíaca y frecuencia respiratoria se corresponden con lo observado en estudios anteriores,20,21 estando dentro de lo reportado para la especie.9 Estos signos vitales no mostraron variaciones biológicamente significativas entre la medición tomada antes de la administración y 4 h después, por lo que se considera que el candidato vacunal no afectó estos parámetros. Los valores reportados para esta especie y específicamente para los animales obtenidos en este estudio, son de 80 ± 17 para la frecuencia respiratoria y 170 ± 40 para la frecuencia cardíaca, con ligeras variaciones entre sexos.9 Las frecuencias respiratoria y cardíaca mostraron valores puntuales por encima del rango mencionado, pero al encontrarse tanto en animales tratados como controles, y teniendo en cuenta que los valores de referencia se obtuvieron a partir de animales alojados de forma individual y no grupal como sucedió en nuestro estudio, consideramos que no estuvieron relacionados con la administración del candidato vacunal, ni reflejan una afectación patológica en los animales inmunizados.
Si bien el aumento de la temperatura se considera un efecto adverso común después de una inmunización, ya que forma parte de la respuesta de defensa del organismo ante la exposición a un agente extraño,20,22 esto no se observó en nuestro estudio. De manera similar, en el análisis de los resultados de la tolerancia local, no se observó irritación dérmica, ni aumento del volumen del sitio de administración, a pesar de los incrementos puntuales en ambos grupos.
Las cifras del conteo de las variables hematológicas estuvieron comprendidas en los rangos establecidos para la especie.9 Aunque se observó una tendencia a la disminución en la HB y los ERI entre el muestreo antes de la administración y al día 77, que alcanzó significación estadística entre el muestreo realizado antes de la administración del candidato vacunal y 7 días después de la tercera administración, estas se observaron tanto en animales controles como tratados, manteniéndose dentro de los valores normales para la especie.9 Estos hallazgos pudieran considerarse asociadas al uso del sedante ketamina.23
Las diferencias estadísticas observadas entre grupos y muestreos en los parámetros de la bioquímica sanguínea carecen de significación biológica al estar acordes a lo reportado para esta especie.9,24
En cuanto al balance electrolítico del sodio, las diferencias significativas encontradas antes de la administración y al día 63 no se relacionan con la sustancia de ensayo, ya que en el grupo Control también hubo disminución, la cual puede deberse a varios factores, entre ellos a la variabilidad de concentraciones en que oscilan estas variables analíticas (rangos), la dieta, el consumo de líquidos y el estrés, los cuales influyen en las variaciones analíticas de los electrolitos.
El rango de variación del sodio ha sido reportado en diferentes especies de primates. En Cercopithecus aethiops los valores oscilan entre 142-151 mmol/L para animales menores de 4 años, y entre 142-150 mmol/L para los de 4 a 12 años.25 Los valores encontrados en nuestros animales resultaron ligeramente superiores a lo reportado, pero fueron similares en animales controles y tratados.
El balance electrolítico del potasio fue la variable de mayor significación, encontrándose diferencias entre grupos a los 63 días, donde el Tratado fue mayor que el Control, mientras que entre muestreos el grupo Tratado mostró disminución significativa antes de la administración y a los 77 días. Esta variable analítica, al igual que para el sodio, tiene un rango de variabilidad alto; lo que resulta común en los estudios de evaluación de seguridad en monos, mayormente debido al pequeño tamaño de los grupos experimentales. Debido a esto, varias compañías farmacéuticas prescinden del análisis estadístico en sus diseños experimentales en PNH,26 por lo que la observación individualizada de los datos adquiere gran relevancia. Según ha sido reportado el rango del potasio en Cercopithecus aethiops, oscila de 3,4-4,4 mmol/L en animales menores de 4 años, y de 3,1-4,5 mmol/L, de 4-12 años.25 En esta especie Casacó y colaboradores reportaron valores de 3,69 a 4,17 mmol/L,9 similares a los obtenidos en el presente estudio.
Los anticuerpos inducidos a los 42 días fueron capaces de inhibir la interacción RBD-ACE2 con valores de media superiores al 77%, estos valores se incrementaron después de la tercera y cuarta dosis con valores superiores al 90% constituyendo una fuerte evidencia de la calidad y funcionalidad de los anticuerpos inducidos por la vacunación.
Por todo lo antes mencionado, el candidato vacunal SOBERANA 01 (FINLAY-FR-01) contra el coronavirus de tipo 2 causante del síndrome respiratorio agudo severo, indujo una elevada respuesta de anticuerpos, siendo bien tolerado, lo cual ofrece seguridad para su uso en humanos.














