Introducción
La Organización Mundial de la Salud (OMS) declaró el 30 de enero de 2020 la epidemia de COVID-19 (evento iniciado en China de “enfermedad por coronavirus 2019” o COVID-19) como una emergencia de salud pública de importancia internacional.1)
Para el 11 de marzo del 2020, el director general de la OMS pronunció que esta enfermedad era una pandemia que se había extendido por varios países de todo el mundo, afectando a un gran número de personas. Ese mismo día, Cuba detectó los tres primeros casos importados, con el consiguiente contagio de sus contactos, lo que marcó la entrada en el país del coronavirus de tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2, por sus siglas en inglés). Desde esta alerta, el Ministerio de Salud Pública (Minsap) elaboró un plan de acción para enfrentar esta contingencia.2
La comunidad científica y médica a nivel mundial acometió grandes esfuerzos para limitar esta pandemia y las subsecuentes olas epidémicas producto de la aparición de nuevas variantes, para lo cual se enfocó en el desarrollo de vacunas y búsqueda de potenciales terapias antivirales.3 Cuba elaboró su Plan Nacional de Prevención y Control de la COVID-19 y acordó conformar el Comité de innovación para lograr candidatos vacunales cubanos.4
La ciencia cubana junto a la industria biofarmacéutica (BioCubaFarma) se movilizaron para desarrollar una vacuna contra la enfermedad COVID-19; para marzo del 2021, en tiempo récord, CUBA tenía cinco candidatos vacunales.2,4
Una de las aristas de esta nueva realidad (la COVID-19) es la salud laboral. La salud de los trabajadores es un requisito esencial para los ingresos familiares, la productividad y el desarrollo económico de una nación.5) El sector salud ha sido grandemente impactado por la pandemia, especialmente, los trabajadores que se encuentran en la primera línea de enfrentamiento a la enfermedad: cientos de médicos y enfermeras. Dentro de este sector, la susceptibilidad a enfermarse se incrementa, y la morbimortalidad puede causar crisis severas, al producirse ausencias al trabajo, además, de ser el personal, en sí mismo, un riesgo para infectar a otros por el contacto con los enfermos.6
De igual forma, son reconocidos por el riesgo laboral de contraer COVID-19 otros sectores como el productivo, que conducen operaciones y servicios esenciales. La industria farmacéutica se enfrascó entonces en lograr vacunas y medicinas para la cura de la COVID-19, y sus trabajadores desarrollaban las actividades, que implicaban exposición a riesgos biológicos,7 por lo que fue de vital importancia implementar medidas de prevención para garantizar la protección de los trabajadores durante la pandemia.7 Entre las medidas de protección fundamentales establecidas en lugares con un riesgo importante de contraer la enfermedad, como por ejemplo las plantas de producción, se destacan: ajustes de nóminas con las modalidades de trabajo a distancia y teletrabajo, garantizar el distanciamiento físico, prohibición de la entrada de trabajadores con síntomas respiratorios a los centros de trabajo y remisión a los centros de salud con inmediatez, uso obligatorio de nasobuco, obligatoriedad de la desinfección de las manos al entrar a las instituciones, así como la desinfección sistémica de las superficies con hipoclorito de sodio o solución hidroalcohólica.2
La tasa de infección autóctona en la población cubana estaba en incremento al cierre del 6 de marzo de 2021, con un total de 55.693 casos positivos a la COVID-19, ocurriendo los mayores reportes de casos positivos en las provincias de La Habana, Pinar del Río, Santiago de Cuba y Guantánamo.8 En este mismo periodo ya se tenían resultados satisfactorios de las vacunas cubanas Abdala®, SOBERANA®02 y SOBERANA®Plus, con elevados niveles de seguridad e inmunogenicidad y estaba en inicio la ejecución de un ensayo clínico Fase 3 multicéntrico, para evaluar la eficacia.2) Para detener la propagación de la enfermedad, en el contexto de la situación epidemiológica en que ese encontraba el país, y tomando en consideración los datos presentados, resultaba justificado evaluar estas vacunas en poblaciones de riesgo, incluyendo el sector biofarmacéutico cubano, representado por el grupo BioCubaFarma.
En el periodo de marzo a junio de 2021, se desarrolló una intervención sanitaria en trabajadores aplicando el esquema heterólogo: dos dosis de SOBERANA®02 y una tercera de SOBERANA®Plus, en las áreas del Instituto Finlay de Vacunas (IFV), en La Habana, Cuba. Los objetivos fueron: revertir la situación epidemiológica ocasionada por la epidemia de la COVID-19 en las organizaciones, documentar el perfil de seguridad de estas vacunas y evaluar el comportamiento de la enfermedad COVID-19 a partir de la aplicación del esquema de vacunación.
Materiales y Métodos
Diseño del estudio, participantes y procederes
Se realizó un ensayo comunitario tipo intervención al estrato o cohorte identificado como grupo 1 dentro del “Ensayo de intervención para evaluar los efectos directos e indirectos de la vacunación anti SARS-CoV-2 en cohortes poblacionales de riesgo de infección, enfermedad y dispersión de la epidemia COVID-19”. El IFV funcionó como centro promotor siendo responsable del desarrollo del mismo.
La cohorte se estableció en marzo 2021 en las áreas del consultorio médico del IFV, que cuenta con las condiciones necesarias para la atención adecuada a los participantes del estudio. El sitio clínico estuvo conformado por dos vacunatorios previamente certificados por el Programa Nacional de Inmunización (PNI) del Minsap.
La intervención consistió en la vacunación anti SARS-CoV-2 con esquema de dos dosis de SOBERANA®02 y una dosis de SOBERANA®Plus, a una cohorte de trabajadores de BioCubaFarma, que incluye: IFV, Empresa Empleadora de BioCubaFarma: CAPITAL, BioCubaFarma S.A, SolMed. El estudio incluyó, además, trabajadores del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos y del Centro Nacional Coordinador de Ensayos Clínicos. La población de trabajadores fue incluida entre el 22 de marzo del 2021 y el 11 de junio del 2021.
El promotor escogió un equipo de investigadores constituido principalmente por personal del grupo de Salud Ocupacional de la Dirección de Capital humano y del Grupo de Ensayos Clínicos de la Dirección de Investigaciones del IFV, Grupo de Ensayos Clínicos del Centro Nacional de Toxicología (CENATOX), así como personal de apoyo de otras áreas del IFV. Todos con la información y dominio necesario del protocolo del estudio y sobre vacunación.
Los participantes fueron de ambos sexos, con edades comprendidas entre los 19 y 80 años, y nacionalidad cubana. Los investigadores clínicos ofrecieron a los voluntarios toda la información relativa al estudio. Los individuos fueron evaluados clínicamente mediante interrogatorio y examen físico para definir su posible inclusión para la vacunación. Se incluyeron todos los sujetos que otorgaron su consentimiento para participar en la investigación, plasmado mediante firma en el registro de consentimiento informado.
Se excluyeron aquellos individuos previamente vacunados con un candidato vacunal o vacuna anti SARS-CoV-2; con antecedentes documentados de infección previa por COVID-19 como resultado del interrogatorio médico; alérgicos a alguno de los componentes de la vacuna (tiomersal, toxoide tetánico); a los que se les administró inmunomoduladores en los 30 días previos a la vacunación; con enfermedades crónicas descompensadas; enfermedad aguda que contraindicara la vacunación; VIH positivos con carga viral detectable, enfermedad oportunista o CD4+ menor de 200 copias, según último chequeo de seguimiento del paciente y embarazo y lactancia.
La información generada de la evaluación y seguimiento de cada sujeto se recogió en el registro individual diseñado específicamente para el estudio de intervención. Una vez incluido, se realizó la indicación de la vacunación que fue administrada por una enfermera vacunadora.
Todos los participantes recibieron un esquema heterólogo de dos dosis de SOBERANA®02 y como tercera dosis, SOBERANA®Plus. La administración de cada dosis se realizó con intervalo de cero, 28 y 56 días. Ambas vacunas fueron producidas en el IFV y en el Centro de Inmunología Molecular en La Habana, Cuba, acorde a las Buenas Prácticas de Fabricación.
Se administró 0,5 mL de cada vacuna en el tercio superior del brazo no dominante, a la altura del músculo deltoides, por vía intramuscular, siguiendo las especificaciones de la técnica de administración de vacunas establecida por el PNI. Las jeringuillas utilizadas fueron de 1,0 mL y agujas 23 G x 1.
Los sujetos fueron considerados completamente vacunados si habían recibido el esquema completo de vacunación.
Consideraciones éticas
El Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos, autoridad reguladora de Cuba, aprobó el estudio y fue registrado con el Código de Registro Público RPCEC00000360.
El estudio se realizó siguiendo las guías de las Buenas prácticas clínicas emitidas por el Minsap en la Resolución Ministerial No 165 del año 2000.9
Seguridad
El personal médico responsable realizó la vigilancia activa de los eventos adversos (EA) durante la primera hora posterior a cada dosis administrada a los sujetos. Se continuó la vigilancia pasiva de los EA desde el día cero hasta 28 días después de cada dosis. Se le indicó al sujeto que, ante la aparición de algún EA, acudiera al consultorio del médico de familia o cuerpo de guardia de su área de salud, presentando la constancia de vacunación.
Los EA referidos por cada sujeto fueron escritos en la sección, diseñada para estos, del modelo de recolección de datos individuales, y se incluyeron posteriormente en la base de datos. Además, se informaron, como parte del proceso, en el formato 84-30-2 del Minsap,10 por un miembro designado en el equipo de trabajo. Cada evento adverso fue presentado según la definición de casos de la Brighton Collaboration11 y los Criterios Comunes de Toxicidad de EA versión 5.0 (CTCAE, Common Terminology Criteria for Adverse Events, por sus siglas en inglés).12
Los EA solicitados de tipo locales fueron: dolor en el sitio de inyección, calor, enrojecimiento, aumento de volumen e induración en el sitio de la inyección; y los sistémicos: fiebre (≥38°C) y malestar general durante los 7 días, todos posteriores a cada dosis. Otros EA fueron evaluados hasta 28 días posteriores a la última inmunización.
La intensidad de los EA fue clasificada como leve o ligera, moderada y severa. Todos los EA reportados fueron evaluados por una comisión de expertos clínicos y se asignó una relación de causalidad a cada uno según la clasificación de la OMS: A1-A2: “evento relacionado con la calidad de la vacuna”; A3: “evento relacionado con error en la inmunización (error programático)”; A4: “evento relacionado con la ansiedad por la vacunación”; B1: “la asociación temporal es consistente, pero no hay evidencias suficientes que permitan establecer una relación causal entre el evento y la inmunización”; B2: “los factores de revisión dan como resultado tendencias contradictorias de coherencia e inconsistencia con asociación causal a la inmunización”; C: “asociación causal inconsistente con la vacunación (coincidental)”.13
Evaluación de la incidencia de COVID-19
La aparición de casos de COVID-19 entre los participantes se evaluó a partir de los 14 días después de la última dosis recibida o en aquellos que estaban completamente vacunados.
Los participantes fueron instruidos para informar o contactar, a través de un teléfono móvil, con el investigador principal o el coordinador del estudio ante la aparición de un síntoma o signos de sospecha de enfermedad COVID-19. A cada participante sospechoso se le indicó una muestra de exudado nasofaríngeo tan pronto fuera posible.
Las muestras fueron procesadas mediante RT-PCR, según las recomendaciones de la OMS14 en los laboratorios de Microbiología del Centro Provincial de Higiene y Epidemiología de La Habana.
Aquellos participantes contactos cercanos de un caso positivo a SARS-CoV-2 (laboral, familiar u otro tipo) se notificarían al coordinador por vía telefónica.
El seguimiento se realizó diariamente a los participantes enfermos de COVID-19 que estaban en la modalidad de ingreso en el hogar, en centros de aislamientos o en hospitales. Ante un fallecido asociado con COVID-19, se informaría por un familiar directamente al coordinador del estudio.
Todos los datos informados por cada participante del estudio (síntomas, resultados de laboratorio o esquema de vacunación) se verificaron y consultaron rápidamente con las bases de datos del Minsap; la habilitada para la gestión de la epidemia fue la plataforma en línea HIGIA ANDARIEGO (GEOCUBA, Cuba, http://higia.andariego.cu). Esta plataforma se creó para la geo-localización de los sujetos con RT-PCR positivo a SARS-CoV-2 a nivel nacional.
La definición de caso de COVID-19 se realizó según el Protocolo de Actuación Nacional para la COVID-19 del Minsap15 y la muerte por causa directamente atribuible a COVID-19 por los criterios de la OMS.16
Toda la información generada durante este tiempo fue recogida en un registro y en modelos diseñados para el estudio. Los modelos estaban en formato impreso y electrónico. La introducción de los datos de cada sujeto fue completada en un sistema electrónico para la gestión de datos, confeccionado para este fin por el IFV.
Análisis
Los valores de las características demográficas y los EA se presentan en números y frecuencias en tablas y figuras.
Cada EA se evaluó acorde al protocolo del estudio respecto a duración y momento de aparición posterior a la administración de cada dosis, intensidad, resultado y asociación de causalidad.
Resultados y Discusión
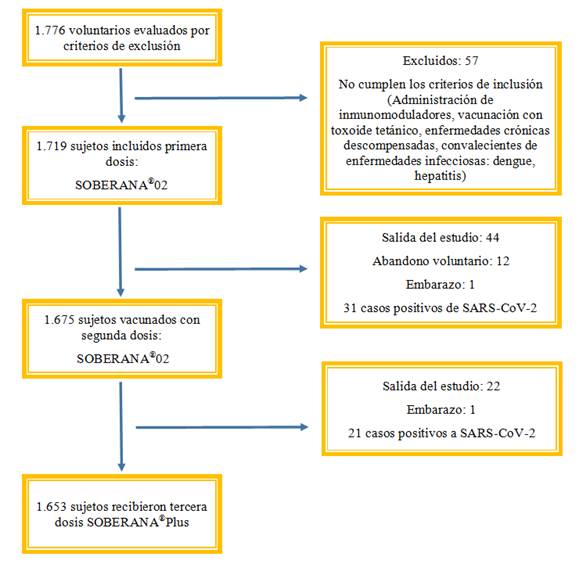
Los dos vacunatorios habilitados y certificados fueron considerados unidad experimental del estudio. La Figura 1 muestra el diagrama del estudio. Fueron evaluados 1.776 trabajadores posibles a vacunar. La cobertura vacunal de la primera y segunda dosis con SOBERANA®02 fue 96,79% (1.719 vacunados) y 95,58% (1.675 vacunados), respectivamente y 97,87% (1.653 vacunados) con tercera dosis de SOBERANA®Plus. El tiempo operacionalmente necesario para lograr una cobertura de vacunación ≥ 90% del universo fue estimado entre 3 a 8 meses. Entre el 22 de marzo al 11 de junio se ejecutó el estudio de intervención, tiempo razonable de aproximadamente 4 meses.
En la Tabla 1 se presentan las características demográficas, edad y sexo de los sujetos que se incluyeron en el estudio.
Tabla 1 Características demográficas de la población vacunada con esquema heterólogo de tres dosis de SOBERANA® en el sitio clínico IFV.
| Variables | Categoría | Frecuencia (%) |
|---|---|---|
| 19 | 18 (1,05) | |
| 20-29 | 389 (22,63) | |
| Edad (años) | 30-39 | 273 (15,88) |
| 40-49 | 350 (20,36) | |
| 50-59 | 427 (24,84) | |
| ≥ 60 | 262 (15,24) | |
| Sexo | F | 934 (54,33) |
| M | 785 (45,67) | |
| Total | 1.719 (100) |
Fuente: registro individual del sujeto en intervención.
La muestra poblacional perteneciente a BioCubaFarma y otros centros laborales fue diversa y heterogénea. Cada centro realizaba distintas funciones, desde el tipo administrativo o en la fabricación de medicamentos y/o vacunas. Las principales causas por las cuales los sujetos no completaron el estudio fueron similares, entre ellas: abandono voluntario, traslado de la zona del estudio por viaje al exterior o a provincia, embarazo o inicio de un criterio de exclusión.
Dentro de los criterios de exclusión reportados estuvieron antecedentes documentados de infección por COVID-19 y embarazo.
Seguridad
De manera global, se registraron 175 individuos con EA: 74 con la primera dosis, 40 con la segunda y 79 con la tercera. El mayor número de EA se observó una hora posterior a la administración de cada dosis de vacuna, constatada durante la vigilancia activa estricta en ambos vacunatorios (Tabla 2).
Tabla 2 Características de los eventos adversos siguiendo a la vacunación del esquema heterólogo de SOBERANA®02 y SOBERANA®Plus.
| Eventos adversos | Número (%) | ||
|---|---|---|---|
| Gravedad | No-grave | 183 (98,91) | |
| Grave | 2 (1,08) | ||
| Tipo | Local | 140 (75,68) | |
| Sistémico | 45 (24,32) | ||
| Intensidad | Leve | 103 (55,68) | |
| Moderada | 43 (23,24) | ||
| Severa | 39 (21,08) | ||
| Resolución | Recuperado | 184 (99,45) | |
| Recuperado con secuelas | 1 (0,54) | ||
| Persiste | 0 | ||
| Muerte | 0 | ||
| Solicitado | Solicitado | 127 (68,65) | |
| No solicitado | 58 (31,35) | ||
| Tiempo de aparición | ≤ 60 min | 108 (58,37) | |
| 24-72 horas | 70 (37,83) | ||
| >7 días | 1 (0,54) | ||
| ≤7 días | 6 (3,24) | ||
| Eventos adversos | Número (%) | ||
| Gravedad | No-grave | 183 (98,91) | |
| Grave | 2 (1,08) | ||
| Tipo | Local | 140 (75,68) | |
| Sistémico | 45 (24,32) | ||
| Intensidad | Leve | 103 (55,68) | |
| Moderada | 43 (23,24) | ||
| Severa | 39 (21,08) | ||
| Resolución | Recuperado | 184 (99,45) | |
| Recuperado con secuelas | 1 (0,54) | ||
| Persiste | 0 | ||
| Muerte | 0 | ||
| Solicitado | Solicitado | 127 (68,65) | |
| No solicitado | 58 (31,35) | ||
| Tiempo de aparición | ≤ 60 min | 108 (58,37) | |
| 24-72 horas | 70 (37,83) | ||
| >7 días | 1 (0,54) | ||
| ≤7 días | 6 (3,24) | ||
La mayoría de los EA ocurridos en las primeras 12 a 24 horas fueron locales y de ligera intensidad. La mayor proporción (44,29%) se observó en sujetos que recibieron la tercera dosis, con remisión de los síntomas y signos antes de los 7 días de aparición.
Los EA que empezaron durante los 7 días posteriores a cada dosis fueron clasificados como eventos del tipo no solicitado. En la Tabla 3 se muestra la frecuencia de EA locales y generales.
Tabla 3 Número y porciento de voluntarios con eventos adversos locales y sistémicos posteriores a la administración de cada dosis (SOBERANA®02 y SOBERANA®Plus).
| Número (%) | ||||
|---|---|---|---|---|
| Dosis 1 | Dosis 2 | Dosis 3 | Total | |
| Individuos con EA sistémicos | 22 (48,89) | 15 (33,33) | 8 (17,78) | 45(24,32) |
| Individuos con EA locales | 53 (37,86) | 25(17,86) | 62 (44,29) | 140 (75,68) |
Fuente: modelos de recolección de datos. EA: eventos adversos.
De los EA locales, el dolor en el sitio de inyección fue el más reportado (59,28%), Figura 2A. Otros eventos locales fueron, enrojecimiento, inflamación y calor local. La frecuencia fue similar comenzando en las primeras 12 horas posterior a la administración de cada dosis. La resolución ocurrió a los 4 a 5 días posteriores a la vacunación. De manera general, los eventos locales fueron de intensidad moderada y, principalmente, siguiendo la primera y segunda dosis. Otros eventos de tipos locales y no solicitados ocurrieron menos comúnmente como prurito, calambres y sensibilidad en el sitio de la inyección.
La cefalea, aunque no es un EA solicitado se consideró el más notificado de los EA generales, comenzando dentro de los primeros 60 minutos para ambos productos vacunales (Fig. 2 B). La fiebre, a pesar de ser uno de los eventos solicitados por protocolo como EA sistémico, presentó baja frecuencia de reporte. En los individuos que refirieron la fiebre como evento, esta estuvo relacionada con la aparición de casos de COVID-19 virológicamente confirmados.
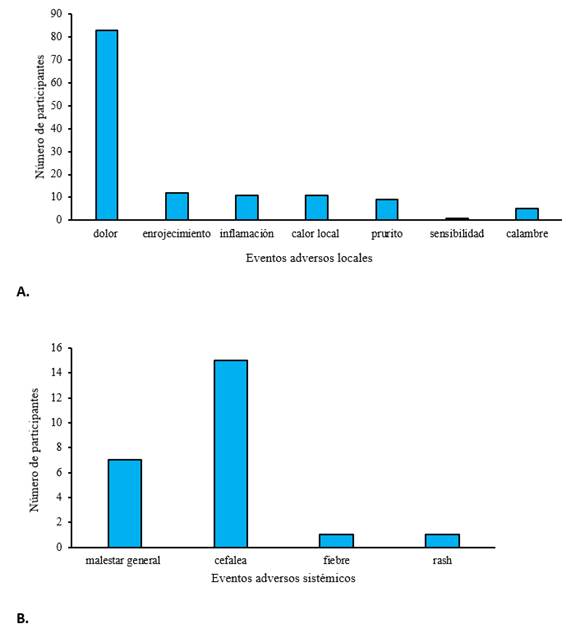
Fig 2 Número de participantes con eventos adversos posteriores a la administración del esquema completo. A. Frecuencia de eventos adversos locales. B. Frecuencia de eventos adversos sistémicos.
La mayoría de los EA de intensidad severa ocurrieron principalmente después de la dosis de SOBERANA®Plus (tercera dosis). Los sujetos declararon en mayor proporción el dolor espontáneo, que impedía la realización de las actividades cotidianas, seguidos por el eritema y un incremento del volumen (inflamación) abarcando un área de ≥5 cm que circundaba la zona de la vacunación, típico de una respuesta severa. Aunque ambos eventos (eritema e inflamación) representaron el 34%, todos fueron transitorios y desaparecieron a los 3 días sin secuelas. El prurito y el calor local se clasificaron como leves o moderados, aparecieron acompañando a los antes descritos y resolvieron durante el periodo de seguimiento.
Trece sujetos presentaron dos o más signos y síntomas en el sitio de inyección posterior a la dosis con SOBERANA®Plus; como consenso de los investigadores clínicos se decidió reportar los eventos por separado en cada vacunado y no como un diagnóstico único.
En la Tabla 4 se resume el análisis de la causalidad de los EA, el 91,2% de los EA solicitados fueron A1, con consistente asociación de causalidad con la vacunación (86,8% y 82,5% después de la primera y segunda dosis de SOBERANA®02, respectivamente y 100% después de SOBERANA®Plus). Los EA locales, en su totalidad, se relacionaron con la administración del producto vacunal, clasificándose como A1. El dolor local fue el más frecuente y se clasificó como relacionado con ambos productos SOBERANA®02 y con SOBERANA®Plus.
Tabla 4 Clasificación según la asociación de causalidad de los eventos adversos registrados.
| Número (%) | ||||
|---|---|---|---|---|
| Causalidad | Dosis 1 | Dosis 2 | Dosis 3 | Total |
| A1 | 66 (86,84) | 33 (82,5) | 79 (100) | 178 |
| A4 | 2 (2,63) | 2 (5) | 0 (0) | 4 |
| B1 | 1 (1,32) | 0 (0) | 0 (0) | 1 |
| C | 7 (9,21) | 5 (12,5) | 0 (0) | 12 |
| Total | 76 (100) | 40 (100) | 79 (100) | 195 |
Individuos con enfermedades crónicas como la diabetes mellitus y la hipertensión arterial (HTA) fueron incluidos en el estudio siempre que se constatara, durante el proceso de reclutamiento, que ambas enfermedades estaban controladas. En dos sujetos se describió HTA después de la segunda dosis, clasificado como categoría A4, relacionado (en ambos) con las condiciones inherentes al vacunado.
Otros dos eventos registrados se clasificaron como A4, fueron eventos de tipo sistémicos, cosquilleo en la región de la orofaringe y sensación de mareo, ambos ocurrieron en la primera hora y después de la primera dosis del esquema.
Un sujeto presentó dolor en el sitio de vacunación que apareció en las primeras 24 horas con la primera dosis; este EA se clasificó como B1, ya que persistió durante los 28 días después de haber sido administrado el producto. El mismo sujeto continuó en el estudio y completó el esquema de vacunación, al no lograr evidencias suficientes para correlacionarlo con el evento de la vacunación.
Se presentaron pocos EA no solicitados. No ocurrieron EA graves relacionados con la vacunación. Entre los eventos co-incidentales se reportó un voluntario que posterior a la primera dosis tuvo un accidente automovilístico que conllevó a ingreso, se clasificó como categoría C no relacionado con el producto vacunal. El sujeto evolucionó a mejoría durante el tiempo del estudio.
La reacción de hipersensibilidad ocurrió en un sujeto, consistió en erupción y prurito generalizado y apareció a los 7 días después de la primera dosis. En un principio fue valorado como relacionado, pero al completar el análisis por el equipo de investigadores, el sujeto declaró tener antecedentes de alergia a algunos alimentos, y se calificó como inconsistente. No fue admitido en un hospital, recibió tratamiento con esteroides y causó baja del estudio.
La vigilancia activa y pasiva de todas las personas vacunadas dentro del estudio de intervención permitió computar los EA ocurridos por dosis, clasificarlos por intensidad, analizar las posibles causas que produjeron estos eventos; los resultados coincidieron con lo descrito en términos de seguridad en los ensayos clínicos de ambas vacunas SOBERANAS®.17,18
Evaluación de la enfermedad COVID-19
Los sujetos del estudio de intervención se siguieron por intervalos entre los 14 días posteriores a cada dosis hasta los 28 días de cumplir con el esquema heterólogo de tres dosis. El seguimiento permitió recoger la ocurrencia de la enfermedad COVID-19 en los vacunados (con síntomas y confirmados virológicamente).
El seguimiento fue posible con el sistema implementado para la consulta y reporte de enfermedad por COVID-19, empleando medios de comunicación telefónica (móvil), a partir de los coordinadores de salud ocupacional de cada institución.
En la Tabla 5 se muestra la ocurrencia de la enfermedad COVID-19 según cada dosis del esquema y la forma de presentación de los casos diagnosticados.
Tabla 5 Sujetos con diagnóstico de enfermedad COVID-19 posterior a cada dosis del esquema heterólogo de tres dosis.
| Definición de caso de COVID-19, OMS | Primera dosis (N=1.719) | Segunda dosis (N=1.675) | Tercera dosis (N=1.653) | Total |
|---|---|---|---|---|
| Enfermedad confirmada virológicamente de COVID-19 | 22 | 13 | 6 | 41 |
| Enfermedad sistémica severa de COVID-19 | 3 | 1 | 0 | 4 |
| Infección confirmada de SARS-CoV-2 (a partir de la vigilancia de rutina)* | 5 | 2 | 0 | 7 |
| Muerte por causa directamente atribuible a una complicación de COVID-19 | 0 | 0 | 0 | 0 |
| Total | 30 | 16 | 6 | 52 |
*Confirmados virológicamente por RT-PCR o detección de antígeno.
Los adultos mayores de ≥ 60 años de edad tienen una condición médica que los predispone al riesgo de padecer la forma severa de la enfermedad COVID-19. En el estudio, encontramos un número relativamente pequeño de casos con la forma severa en este grupo etario, cuando comparamos con el resto de los grupos (Tabla 5). El mayor porciento de individuos que enfermaron de COVID-19 perteneció al grupo etario de 50 a 59 años con un 25%, que representa la fuerza laboral activa dentro de las empresas de BioCubaFarma, en el momento del estudio (Tabla 6).
Tabla 6 Rango de edad de los sujetos que tuvieron enfermedad COVID-19.
| Grupo de edades | Frecuencia (%) |
|---|---|
| 19 | 1(1,92) |
| 20-29 | 10 (19,23) |
| 30-39 | 10 (19,23) |
| 40-49 | 8 (15,38) |
| 50-59 | 13 (25,00 |
| 60 y más | 10 (19,23) |
| TOTAL | 52(100) |
Fuente: modelos de recolección de datos.
El grupo de 20-29 años estuvo compuesto principalmente por estudiantes universitarios, que trabajaban en las diferentes áreas de salud de la provincia de La Habana, en el apoyo al control y atención de la pandemia. En ellos, la vacunación fue una medida para protegerlos contra la infección por COVID-19.
Una gran mayoría de los sujetos presentaron la forma leve o asintomática de la enfermedad COVID-19, predominando síntomas y signos menores como cefalea, fiebre, dolor de garganta/odinofagia, tos, malestar general, congestión, secreción nasal y alteraciones del gusto y del olfato.
Uno de los participantes requirió ser ingresado en la sala de cuidados del centro donde estaba en aislamiento por sospecha de la enfermedad. El trabajador presentó síntomas digestivos: diarreas y vómitos durante 5 días, necesitando terapia de hidratación parenteral. La aparición de los síntomas ocurrió después de la primera dosis (21 días post vacunación). La evolución clínica fue satisfactoria y el examen de COVID- 19 fue positivo.
Las manifestaciones extrapulmonares de COVID-19 han sido descritas desde el comienzo de la pandemia, entre ellas, las del tipo gastrointestinales: diarreas y vómitos.19,20) Singh S et al., en 2022, describieron un total de 20 pacientes de COVID-19 (9,9%) que tenían un cuadro a predominio gastrointestinal, sin síntomas respiratorios. Este tipo de paciente no tiene necesidad de ventilación mecánica, con una estadía corta y baja mortalidad, similar a lo descrito en el trabajo. No obstante, resulta fundamental tomar precauciones en términos de trasmisión fecal.
Tras la primera dosis del candidato, tres sujetos del estudio cursaron con neumonía caracterizada por síntomas respiratorios típicos y diagnóstico imagenológico (condensación característica confirmatoria). Dos de estos pacientes cursaron con COVID-19 grave con una saturación de oxígeno menor de 90%, requiriendo hospitalización con una estadía de más de 14 días; tenían una edad de 60 años y más y presentaban antecedentes patológicos personales de HTA y diabetes mellitus tipo 2. Las comorbilidades se han relacionado con mayor riesgo de contraer COVID-19, de tener mala evolución y de mortalidad.21,22 A pesar de la notificación de comorbilidades en los pacientes, no se presentó un desenlace fatal con la totalidad de los pacientes recuperados.
Posterior a los 28 días de la aplicación del esquema completo (totalmente vacunados con esquema heterólogo de SOBERANA®02 y SOBERANA®Plus), solamente seis sujetos fueron confirmados virológicamente de COVID-19. Ninguno presentó o progresó a la forma grave de la enfermedad y evolucionaron rápidamente a la mejoría del cuadro.
Durante el estudio de intervención, no ocurrieron muertes directamente atribuibles a una complicación de COVID-19, a partir de 14 días posteriores a la última dosis del esquema completo o en los intervalos entre los 14 días posteriores a cada dosis del candidato y hasta los 28 días (Tabla 5).
Alcanzar una respuesta inmune que impacte en la desaceleración de la pandemia por COVID-19, podía lograrse mediante la diseminación natural de la infección o la vacunación a gran escala. Se estima que el número mínimo de personas que deben estar totalmente vacunadas para lograr esta inmunidad corresponde entre el 70% y el 85% de la población.2 Con intervenciones de tipo comunitarias se persigue como objetivo principal lograr estas coberturas de vacunación altas (≥ 90% del universo) en un período corto entre 3 a 8 meses.
La intervención de salud con las vacunas SOBERANA®02 y SOBERANA®Plus es un estudio que se propuso vacunar cohortes poblacionales con elevado riesgo de infección, enfermedad y dispersión de la epidemia de COVID-19.14) Se diseñó como un estudio multicéntrico,23,24) al cual pertenecen los resultados expuestos en el manuscrito. El esquema de tres dosis permitió la reducción de la gravedad y el número de enfermos entre los vacunados después de administrada la segunda dosis, o al concluir el esquema, como se observa en la Tabla 5.
La pandemia de COVID-19 afecta a toda la sociedad, y de manera especial, a los trabajadores sanitarios que han estado atendiendo a las personas enfermas, dando frente al sufrimiento y a la muerte. El sector empresarial productivo, y dentro de este sector, las fábricas de producción de medicamentos o vacunas de la industria farmacéutica, es igualmente reconocido por su riesgo laboral.5,6,7 A nivel mundial, la industria farmacéutica continuó investigando y fabricando para el bienestar de la humanidad. Con este objetivo se impulsó esta intervención comunitaria para tomar todas las precauciones necesarias para cuidar de sí mismos y de los demás.
BioCubaFarma agrupa un grupo importante de empresas biofarmacéuticas que permitieron, durante la pandemia, obtener el 85% de los productos empleados en el protocolo de tratamiento de la COVID-19, los que, casi en su totalidad, fueron de factura nacional, incluidas las vacunas: SOBERANA®02 y SOBERANA®Plus. Ambas vacunas demostraron ser seguras y eficaces en la reducción de la enfermedad durante su desarrollo clínico.18) Una de las mejores formas de prevención de las enfermedades transmisibles es la vacunación y esta ha sido una de las políticas de salud del gobierno cubano para alcanzar el control de esta enfermedad. El estudio de intervención en estos trabajadores vacunados con el esquema heterólogo de SOBERANA® mostró elevado perfil de seguridad, reducción de la enfermedad sintomática, la gravedad y la muerte por COVID-19.