Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.20 no.1 Ciudad de la Habana ene.-mar. 2015
ARTÍCULO ORIGINAL
Determinación de saponinas y otros metabolitos secundarios en extractos acuosos de Sapindus saponaria L. (jaboncillo)
Determination of saponins and others secondary metabolites in aqueous extracts of Sapindus saponaria L. (jaboncillo)
Lic. Licet Mena Valdés,I Dra. Beatriz Tamargo Santos,I MSc. Eva Salas Olivet,I Dr. Luis Enrique Plaza Paredes,II Lic. Yisel Blanco Hernández,III DrCs. Anselmo Otero González,IV Dr. Gustavo Sierra GonzálezV
I Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
II Universidad de Ciencias Médicas. Guayaquil, Ecuador.
III Laboratorio Central de Farmacología. Facultad de Ciencias Médicas Dr. Salvador Allende. La Habana, Cuba.
IV Facultad de Biología. Universidad de la Habana. La Habana, Cuba.
V BioCubaFarma. Grupo de las Industrias Biotecnológicas y Farmacéuticas de Cuba. La Habana, Cuba.
RESUMEN
Introducción: la especie Sapindus saponaria L. se encuentra ampliamente distribuida en el continente americano. La abundante presencia de saponinas que la caracteriza, le confiere un elevado valor farmacológico, por lo que determinar la concentración de este metabolito y la presencia de otros en las diferentes partes de la planta, permitirá desarrollar futuras evaluaciones biológicas.
Objetivos: determinar cualitativa y cuantitativamente saponinas en los extractos acuosos de las semillas, tallo y frutos de Sapindus saponaria L., así como identificar la presencia de otros metabolitos secundarios de la planta.
Métodos: los extractos (infusión y decocción) se prepararon con los frutos, semillas y tallos de la planta. Se utilizó el método de extracción mediante solventes, y se aplicó las técnicas de infusión y decocción. Para identificar la presencia de metabolitos secundarios se realizó el tamizaje fitoquímico a todos los extractos acuosos. Se realizó el ensayo de hemólisis de eritrocitos para determinar las concentraciones de saponinas en los extractos. Los carbohidratos y las proteínas detectadas se cuantificaron por los métodos de Orcinol Sulfúrico y Lowry, al respecto.
Resultados: el tamizaje fitoquímico sugirió la presencia de saponinas, taninos, azúcares reductores y flavonoides en los tres extractos. La mayor concentración de saponinas se encontró en el extracto del pericarpio del fruto, seguido por el de las semillas y el del tallo. La concentración de carbohidratos y proteínas fue mayor en el extracto del fruto que en el resto de los extractos evaluados.
Conclusiones: los extractos acuosos obtenidos contienen metabolitos secundarios de elevado interés farmacológico. Las saponinas se encuentran a elevadas concentraciones en el fruto, mientras que, carbohidratos y proteínas están presentes a bajas concentraciones en los tres extractos.
Palabras clave: Sapindus saponaria L, saponinas, hemólisis de eritrocitos, carbohidratos, proteínas.
ABSTRACT
Introduction: the species Sapindus saponaria L. is widely distributed in America. The abundant presence of saponins is characteristic of this specie and it offers a high pharmacological value. Determine the concentration of these metabolites in various plant parts; allow the development of biological assessments.
Objectives: to determine qualitatively and quantitatively the presence of saponins in aqueous extracts of seeds, stems and fruit of Sapindus saponaria L. and identify other metabolites that may be present in the plant.
Methods: the extracts of the plant, with the fruits, seeds and stem was prepare. The extraction by solvent method and the infusion and decoction techniques was used. To identify the presence of secondary metabolites a phytochemical screening was performed on all extracts. Erythrocyte hemolysis assay was used to determine the concentration of saponins in the extracts. The carbohydrates and proteins were quantitatively determinate by Orcinol Sulphuric method and Lowry method respectively.
Results: the phytochemical analysis suggested the presence of saponins, tannins, reducing sugars and flavonoids in the three extracts. The extract of the pericarp had higher concentration of saponins, followed by the seeds and stem. The concentration of carbohydrates and protein was higher in fruit extract than in the rest.
Conclusions: the aqueous extracts obtained by conventional methods, contain secondary metabolites of high pharmacological value. The saponins are found in high concentrations in fruit; however, the carbohydrates and proteins are present at low concentrations in the three evaluated extracts.
Key words: Sapindus saponaria L, saponins, erythrocyte hemolysis, carbohydrates, proteins.
INTRODUCCIÓN
La especie Sapindus saponaria L. originaria de América tropical, se distribuye desde el sur de Estados Unidos, Centroamérica, Venezuela, Ecuador, Perú, Colombia y Brasil.1 Pertenece al género Sapindus L. (Sapindaceae) formado por unas 12 especies de árboles o arbustos, distribuidos por los trópicos y subtrópicos del mundo. Las conocidas propiedades detersivas de las especies pertenecientes a este género, se las confieren las saponinas.2
Las saponinas son glicósidos hidrosolubles, con propiedades tensoactivas y hemolíticas, ambas atribuidas a sus características estructurales de naturaleza anfifílica. Estos metabolitos también pueden ejercer una amplia actividad biológica y farmacológica, destacándose su efecto piscida, insecticida, anti-protozoos, anti-inflamatorio, leishmanicida, anti-trichomonas, anti-agregante plaquetario, broncolítico, hipo-colesterolémico,2,3 así como su actividad citotóxica frente a varias neoplasias.4-7 Estos informes sitúan a las saponinas del género Sapindus L. entre los metabolitos secundarios con elevado valor farmacológico. No obstante, resulta necesario para realizar evaluaciones de actividad biológica de esta planta, determinar a priori las concentraciones a las que se encuentran sus metabolitos, a fin de establecer las partes de la planta a emplear para la obtención de los extractos, así como la posible composición de los mismos.
El ensayo de formación de espuma, así como la técnica de hemólisis de eritrocitos constituyen métodos sencillos y rápidos para detectar la presencia de saponinas en un extracto.8 La técnica de hemólisis es además, un método espectrofotométrico convencional que permite no sólo cuantificar las saponinas sino también determinar su actividad hemolítica.9-12
Sobre la base de lo antes planteado el presente estudio tiene como objetivos, determinar cualitativa y cuantitativamente saponinas en extractos acuosos de semillas, tallo y frutos de Sapindus saponaria L; así como identificar otros metabolitos secundarios que pudieran estar presentes.
MÉTODOS
Material vegetal
El material vegetal (frutos y tallo) de Sapindus Saponaria L. fue colectado en el Bosque Politécnico ubicado a 2 ½ Km de la ciudad de Calceta, Cantón: Bolívar, en la provincia de Manabí (Latitud: 0o 50´51,36” S; Longitud: 80o 9´49,79” W; a una altitud media de 86 metros sobre el nivel del mar), Ecuador. Se realizó la recolección en el horario de la mañana entre las 10:30 a.m. y las 11:00 a.m. a una temperatura de 23 0C, durante el mes de enero del 2013, luego de la época de floración de la planta. Los frutos y el tallo fueron identificados taxonómicamente por el analista e Ing. Servio Pachard Vera y el técnico agrícola Alfredo Pinargote Zambrano ambos profesionales de la Escuela Superior Politécnica Agropecuaria de Manabí “Manuel Félix López”. (ESPAM-MFL). El código de registro para frutos y tallo es (2013XII15 Ss01/F) y (2013XII15 Ss01/T) respectivamente.
Las partes afectadas por insectos o con signos de daño se desecharon y el resto se fraccionó con ayuda de una tijera y una prensa en el caso de las semillas, por su mayor dureza. El material vegetal se separó en fruto, semilla y corteza del tallo; se lavó con abundante agua corriente para eliminar los restos de tierra y después se realizó un último lavado con agua destilada. Detrás se secó sobre papel de filtro a temperatura ambiente, por último se determinó la masa utilizando una balanza analítica (Sartorius AG, China).
Extracción
En la preparación de los extractos se utilizó el método: extracción mediante solventes, mediante las técnicas de extracción sólido–líquido: infusión y decocción.8 Para ello, se utilizó el material vegetal fresco, del cual se pesaron 29,93 g en los casos del fruto y la semilla y 34,39 g de corteza del tallo para obtener extractos acuosos en proporción 1:1 masa/volumen (m/v), procediendo a realizar la infusión con el fruto y la corteza del tallo, y una decocción con las semillas. Después los extractos se filtraron utilizando papel de filtro y se liofilizaron en bulbos de cristal 10 R los cuales una vez rotulados se almacenaron de 4 a 8 0C hasta su uso.
Determinación de pH e Índice de Refracción
El pH de cada extracto fue determinado en un equipo medidor de pH (PHSJ-4A, China). Por su parte el índice de refracción se determinó en un Refractómetro (ABBE, China).
Tamizaje fitoquímico de los extractos acuosos
En la tabla 1 se muestran los ensayos realizados a los extractos acuosos de S. saponaria L.
Cuantificación de Saponinas
Ensayo de hemólisis de eritrocitos
La determinación cuantitativa de saponinas en los extractos se realizó modificando la técnica descrita en el protocolo “Red Blood Cell Test System”.11
Obtención y preparación de la sangre
La sangre fue colectada de carneros saludables procedentes del CENPALAB, se utilizó tubos plásticos de centrífuga (Corning, EUA) que contenían 5 mL de tampón citrato en los cuales se adicionaron 45 mL de sangre por cada uno, se homogeneizó suave, para obtener a última hora una concentración 1:10 citrato: sangre.
Aislamiento de los eritrocitos y obtención de la suspensión
Se centrifugaron 2 mL de sangre a 1500 x g por 15 minutos a temperatura ambiente, se aplicó una centrífuga para viales Eppendorf (Heraesus, Alemania). Se extrajo el sobrenadante de la superficie al cuidado y el precipitado se lavó 4 veces con Tampón Fosfato Salino isotónico, pH 7,4 (TFSi).
La determinación del número de eritrocitos en suspensión se realizó mediante conteo en cámara de Neubauer, para lo cual se tomó un alícuota de la suspensión de eritrocitos, se realizaron diluciones seriadas hasta 1/100 000 en TFSi, se calculó el número total de células para 1mL de la suspensión y finalmente el volumen necesario para obtener 8 x 109 células en suspensión.
Preparación de las muestras
Se disolvió cada una de las muestras liofilizadas de los extractos de tallo, semilla y fruto en el volumen de TFSi necesario para obtener disoluciones a concentraciones de 1mg/mL en cada caso. Paralelo se preparó una disolución de saponina patrón (SIGMA, EUA) Quillaja saponaria Molina a una concentración de 0,5 mg/mL en TFSi.
Procedimiento del ensayo
En viales independientes Eppendorf de 1,5 mL se pipetearon los volúmenes siguientes de cada muestra de extracto y de la saponina patrón al respecto: 0, 10, 20, 30, 40, 50, 60, 70 y 80 µL. Detrás se completó cada vial con TFSi hasta alcanzar un volumen final de 975 µL. En otros dos viales independientes se añadieron 975 µL de agua destilada y 975 µL de TFSi, para obtener el 100 % y el 0 % de hemólisis, respectivamente.
A continuación se añadió una alícuota de 25 µL de la suspensión de eritrocitos que contenía un aproximado de 8 × 10 9 células/mL a cada vial y se incubaron por 10 minutos a temperatura ambiente, se agitó suave, en una zaranda (Stuart Scientific, Inglaterra). De seguida, se centrifugaron a 1500 x g durante un minuto, 300 µL del sobrenadante, se depositaron en una placa de 96 pozos de fondo plano (Costar) y en conclusión se determinó la absorbancia de las muestras y el patrón a 540 nm, en un lector de placas (Amersham, EUA).
Cuantificación de Carbohidratos y proteínas
La concentración de carbohidratos fue determinada en los extractos según la técnica Orcinol-Sulfúrico descrita por Bruckner en 199513 y la concentración de proteínas en los extractos fue determinada por el método espectrofotométrico referido por Lowry en 1951.14
Procesamiento de los datos
La actividad hemolítica del patrón Quillaja saponaria M. dada en unidades de Densidad Óptica (D.O) se ploteó contra los valores de concentración ensayados, para obtener una curva de calibración correcta ajustada, al utilizar el método de los mínimos cuadrados (Microsoft Excel, versión 97-2003). A la postre se interpolaron los valores de D.O de los extractos en la curva de Q. saponaria M, y se calculó así la concentración de saponinas de cada una de las muestras. En el análisis de los ejemplos, así como, el procesamiento de los datos para la obtención de la curva de saponina patrón, se tomaron en cuenta tres réplicas del ensayo. El análisis estadístico se realizó mediante el test U Mann Witney utilizando el paquete comercial Statistic para Windows (Release 4.2, Stat Soft, Inc USA). Se consideraron los niveles de significación: p< 0,05.
RESULTADOS
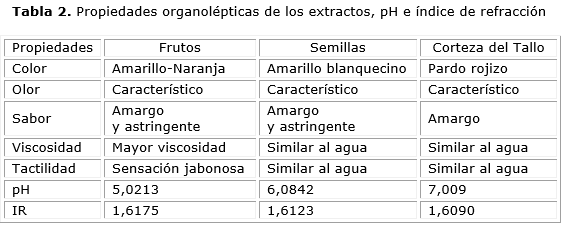
La tabla 2 resume las propiedades organolépticas de los extractos acuosos del pericarpio del fruto, semillas y tallo de S. saponaria L , donde se observan las principales diferencias en cuanto a color, sabor y tactilidad. Además, se indican los valores de pH e índice de refracción calculados para los extractos, previo a la liofilización.
Análisis fitoquímico
En la tabla 3 se muestran las clases de metabolitos secundarios detectados, mediante el tamizaje fitoquímico y las principales observaciones referentes a cada ensayo.
Cuantificación de Saponinas
Las concentraciones de saponinas de los extractos determinadas mediante la curva de calibración de Q. saponaria M. (y= 0,371x-0,44; r= 0,9388) se muestran en la tabla 4. Como se puede observar, la concentración de saponinas en el extracto del fruto es mayor que en los extractos de semillas y tallo, en los cuales estos metabolitos se encuentran a bajas concentraciones.
Cuantificación de Carbohidratos y Proteínas
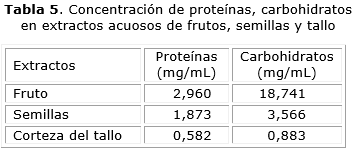
Las concentraciones detectadas en cada extracto quedan reflejadas en la tabla 5, donde se puede observar la baja concentración de estos compuestos en los tres extractos, no obstante, la mayor concentración de proteínas y carbohidratos se determinó en el pericarpio del fruto.
DISCUSIÓN
Una gran diversidad de usos medicinales se refieren para diversas especies del género Sapindus y es posible agruparlos de acuerdo, a sus efectos sobre los sistemas: genitourinario (estimulante uterino, abortivo, antiandrogénico), nervioso (Epilepsia), respiratorio (expectorante, asma bronquial) y sobre la piel (antifúngico, antiinflamatorio). Las saponinas son glicósidos con elevado potencial farmacológico en la terapia del cáncer;4-6 y están presentes con gran abundancia en las especies pertenecientes a este género. Por su marcada solubilidad en agua las técnicas de extracción: infusión y decocción, fueron seleccionadas para obtener los extractos de Sapindus saponaria L, utilizan el agua como menstruo o disolvente. Además, las infusiones o decocciones son las formas más comunes de preparación tradicional de los extractos, que también son utilizados como: antiulcerosos, espasmolíticos, insecticidas, nematicidas.2
Según lo que se observó, los metabolitos secundarios de mayor abundancia fueron: saponinas, flavonoides, azúcares reductores y taninos. Otros autores han descrito la presencia de algunos de estos metabolitos en esta especie y otras del mismo género.2,15,16 Estas coincidencias se deben a la estrecha relación quimiotaxonómica que presentan las especies del género Sapindus, por lo cual se refieren actividades biológicas similares.
En un estudio fitoquímico que realizó Sosa en 1998,15 a la especie Sapindus saponaria L. que crece en Cuba, se informa la ausencia de alcaloides y taninos en todas las partes de la planta. Estos datos son contradictorios a los resultados mostrados en el presente trabajo, para esta misma especie procedente de Ecuador, pues el ensayo de cloruro férrico sugirió la presencia de taninos en los tres extractos evaluados. Por otra parte, el ensayo de Dragendorff supone la presencia alcaloides en semillas y en menor medida en el pericarpio del fruto. Estas diferencias están asociadas a factores extrínsecos e intrínsecos que influyen directamente en la composición química de las plantas como son: la edad de la planta, el clima, la temperatura, la luz, la humedad, la altitud e incluso factores de origen biológico.8
Las propiedades detersivas de las saponinas favorecen el uso popular de las especies que las contienen, pero también les confieren una actividad biológica muy peculiar asociada a su toxicidad,17 denominada actividad hemolítica. Algunos autores plantean, que las saponinas son capaces de formar complejos con los esteroles de la membrana celular de los eritrocitos, en consecuencia ocurre un aumento de la permeabilidad celular, continuo de la ruptura de la membrana del eritrocito y la pérdida o liberación de la hemoglobina.18-20 Sobre la base de este mecanismo fue posible detectar y cuantificar las saponinas en los extractos acuosos de Sapindus saponaria L. Las saponinas presentes en esta planta demostraron un efecto directo sobre los eritrocitos, lo cual posibilitó su cuantificación mediante el ensayo de hemólisis cumplido, se utilizó como referencia concentraciones conocidas de una saponina comercial.11 La actividad hemolítica asociada a la presencia de saponinas ya sean de origen esferoidal o triterpénicas ha sido observada por otros investigadores, no sólo para los extractos de S. saponaria L. sino también, para extractos de otras especies que de igual forma presentan elevadas concentraciones de estos metabolitos secundarios.18,21-23
Los carbohidratos son componentes universales de los organismos vivos; se forman como resultado de la fotosíntesis, constituyen el punto de partida para todo estudio que se realice en las drogas vegetales, pues a partir de ellos y por reacciones orgánicas subsiguientes, las plantas sintetizan una gran diversidad de metabolitos.8,24
En los extractos evaluados las concentraciones de carbohidratos determinadas, avalan los resultados del ensayo cualitativo para la determinación de estructuras del tipo polisacarídicas, donde la mayor consistencia gelatinosa fue observada en el extracto del pericarpio seguido por el de las semillas y por último el del tallo, lo cual coincide con el orden decreciente de concentraciones de carbohidratos calculadas, pues son estructuras que en las plantas pueden actuar como vehículos de retención de agua (mucílagos).25
A su vez, se deberá tener en cuenta para futuros estudios, las proteínas cuantificadas en los extractos, si se deseara purificar las saponinas contenidas en ellos. Además, las proteínas pueden influir en la formación de espuma26 e interferir en el ensayo cualitativo para detectar saponinas en los extractos, se puede dar respuesta a las diferencias mostradas entre el resultado del ensayo de espuma y las concentraciones reales de saponinas calculadas mediante el ensayo de hemólisis. Pues tanto para el extracto del pericarpio del fruto como para el de las semillas este ensayo fue positivo, sin embargo, la concentración de saponinas en las semillas no es notable.
El género Sapindus y dentro de éste, la especie S. saponaria L. constituye una de las plantas cuyo uso tradicional es un legado ancestral, avalado por trabajos científicos que lo corroboran.2-4,27 Sobre la base de este estudio se puede concluir que los extractos acuosos de esta especie, obtenidos por métodos convencionales, contienen metabolitos secundarios de elevado interés farmacológico, lo cual justifica el uso popular. Las saponinas, como quedó descrito, se encuentran a elevadas concentraciones en el fruto por lo cual se sugiere realizar ensayos de actividad biológica, sobre la base de los usos medicinales consultados en diferentes fuentes bibliográficas.
REFERENCIAS BIBLIOGRÁFICAS
1. Roig J. Plantas medicinales aromáticas o venenosas de Cuba. Segunda Edición. La Habana: Ciencia y Técnica, Instituto Cubano del Libro; 1989.
2. Orlando A, Guirado A. Potencial medicinal del género Sapindus L. (Sapindaceae) y de la especie Sapindus saponaria L. Rev Cubana Plant Med 2005;10(3-4).
3. Suhagia B, Rathod I, Sindhu S. Sapindus mukorossi (Areetha): an overview. IJPSR. 2011;2(8):1905-913.
4. Man S, Gao W, Zhang Y, Huang L, Liu Ch. Chemical study and medical application of saponins as anti-cancer agents. Fitoterapia. 2010;81(1):703-14.
5. Labrada K. Síntesis y caracterización de análogos y miméticos de saponinas espirostánicas [tesis]. Universidad de la Habana; 2012.
6. Alhosin M, Sharif T, Mousli M, Etienne-Selloum N, Fuhrmann G, Schini-Kerth V. Down-regulation of UHRF1, associated with re-expression of tumor suppressor genes, is a common feature of natural compounds exhibiting anti-cancer properties. J Exp Clin Cancer Res. 2011;30(41):2-10.
7. Ospina L, Álvarez A, Cortés F, Cadavid A, Cardona W. Effects of spermicidal extracts of Ananas comosus (pineapple) and Sapindus saponaria (jaboncillo) on cell viability, cytotoxicity and apoptosis. Rev Cubana Plant Med. 2013;18(4):534-42.
8. Miranda M, Cuéllar A. Farmacognosia y Productos Naturales. La Habana: “Félix Varela”; 2001.
9. Cheok Ch, Salman H, Sulaiman R. Extraction and quantification of saponins: A review. Food Res Int. 2014,59:16-40.
10. Pape W. Red blood cell test system. The ERGATT/FRAME databank of in vitro techniques (INVITTOX). Hum Exper Toxicol 1992; IP-37:1-14.
11. Barve KH, Laddha KS, Jayakumar B. Extraction of saponins from Safed Musli. Phcog J. 2010;2(13):561-4.
12. Habicht SD, Kind V, Rudloff S, Borsch C, Mueller AS, Pallauf J. Quantification of antidiabetic extracts and compounds in bitter gourd varieties. Food Chem. 2011;126(1):172-176
13. Bruckner J. Estimation of Monosaccharides by the Orcinol Sulphuric Acid Reaction. J Bio Chem. 1995;60(2):200-5.
14. Lowry O, Rosebrough N, Farr A, Randall R. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951;193(1):265-5.
15. Kanchanapoom T, Kasai R, Yamasaki K. Acetylated triterpene saponins from the Thai medicinal plant, Sapindus emarginatus. Chem. Pharm. Bull. 2001;49(9):1195-7.
16. Sosa I. Evaluación de la actividad acaricida de Sapindus saponaria L. (Sapindaceae) frente a Boophylus microplus (Acari: Ixodidadae) [tesis].Universidad de Camagüey; 1998.
17. Glauert AM, Dingle JT, Lucy JA. Action of Saponin on Biological Cell Membranes. Nature. 1962;196(3):952-5.
18. Gauthier C, Legault J, Pichette A. Haemolytic activity, cytotoxicity and membrane cell permeabilization of semi-synthetic and natural lupane-and oleanane-type saponins. Bioorg. Med. Chem. 2009;17(2):2002-8.
19. Carvajal R, Hata Y, Sierra N, Rueda D. Análisis fitoquímico preliminar de hojas, tallos y semillas de Cupatá (Strychnos schultesiana krukoff). Colombia Forestal [En línea]. 2009 [citado 18 sep 2014];12:161-70. Web. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-07392009000100011
20. Melzig M, Hebestreit P, Gaidi G. Structureactivity relationship of saponins to enhance toxic effects of agrostin. Rev Planta Med. 2005;71(11):1088-90.
21. Inalegwu B, Sodipo O. Phytochemical screening and haemolytic activities of crude and purified saponins of aqueous and methanolic extracts of leaves of Tephrosia vogelii Hook. F. Asian J. Plant Sci Res. 2013;3(5):7-11.
22. Baumann E, Stoya G, Volkne A, Richter W, Lemke C, Werner L. Hemolysis of human erythrocytes with saponin affects the membrane structure. Acta Histochem. 2000;10(2):21-35.
23. Serrano M. ¿Constituye la nuez de Sapindus mukorossi una alternativa eficaz y ecológica a los detergentes sintéticos?[tesis]. Universidad de Santiago de Compostela, España; 2010.
24. Keunen E, Peshev D, Vangronsveld J, Van Den Ende W, Cuypers A. Plant sugars are crucial players in the oxidative challenge during abiotic stress: extending the traditional concept. Plant Cell Environ. 2013;36(7):1242-55.
25. Majmudar H, Mourya V, Devdhe S, Chandak R. Pharmaceutical Applications of Ispaghula Husk: Mucilage. Int J Pharm Sci Rev Res. 2013;18(1):49-55.
26. Blasco L, Viñas M, Villa G. Proteins influencing foam formation in wine and beer: the role of yeast. Int Microbiol. 2011;14(1):61-71.
27. Newman D, Cragg G, Snader K. Natural products as sources of new drugs over the period 1981-2002. J Nat Prod. 2003;2(66):1022-37.
Recibido: 15 de mayo de 2014.
Aprobado: 16 de enero de 2015.
Dra. Beatriz Tamargo Santos. Instituto de Farmacia y Alimentos. Universidad de la Habana. La Habana, Cuba.
Correo electrónico: beatrizts@ifal.uh.cu