Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.15 no.11 Santiago de Cuba nov. 2011
REFLEXIÓN Y DEBATE
Bases morfofisiopatológicas de la respuesta inflamatoria aguda pulpar
Morphophysiopathological bases of pulpar acute inflammatory response
MsC. Lizet García Cabrera, 1 MsC. Oscar Rodríguez Reyes 2 y MsC. Milagros Calzado de Silva 3
1Especialista de I Grado en Fisiología Normal y Patológica. Máster en Atención de Urgencias Estomatológicas. Profesora Asistente. Universidad de Ciencias Médicas, Facultad de Estomatología, Santiago de Cuba, Cuba.
2Especialista de I Grado en Fisiología Normal y Patológica. Máster en Atención de Urgencias Estomatológicas. Instructor. Universidad de Ciencias Médicas, Facultad de Estomatología, Santiago de Cuba, Cuba.
3Especialista de II Grado en Estomatología General Integral. Máster en Medicina Tradicional y Natural y en Atención de Urgencias Estomatológicas. Profesora Auxiliar. Universidad de Ciencias Médicas, Facultad de Estomatología, Santiago de Cuba, Cuba.
RESUMEN
Teniendo en cuenta el desconocimiento existente sobre las bases morfofisiopatológicas que caracterizan la respuesta inflamatoria aguda pulpar; conocimiento este que resulta imprescindible para tomar decisiones según se trate de enfermedades pulpares reversibles o irreversibles, tratables o intratables, tejidos para el recubrimiento y su conservación o pulpas que deben ser extraídas, se decidió describir las mencionadas bases en el presente artículo, con la finalidad de que se reflexione acerca de ello y se debatan los aspectos de mayor interés en relación con el tema.
Palabras clave: Respuesta inflamatoria aguda pulpar, enfermedad pulpar, morfofisiopatología.
ABSTRACT
Given the lack of knowledge on morphophysiopathological bases characterizing pulpar acute inflammatory response, which becomes essential knowledge to make decisions depending on reversible or irreversible and treatable or untreatable pulpar diseases, tissues for covering and preservation or pulps to be extracted, it was decided to describe the bases mentioned in this article in order to reflect on this and to discuss the aspects of greatest significance in relation to the topic.
Key words: Pulpar acute inflammatory response, pulpar disease, morphophysiopathology.
INTRODUCCIÓN
La pulpa dental, aunque posee muchas propiedades similares a las de otros tejidos conectivos del organismo, por su peculiar localización está dotada de importantes características especiales, a saber:
- Una irrigación muy rica que, gracias al intercambio dinámico de líquidos entre los capilares y los tejidos, genera y mantiene una presión hidrostática extravascular en el interior de esta cámara rígida.
- La presión intrapulpar puede verse aumentada en una zona aislada y sobrepasar el umbral de las estructuras sensitivas periféricas de la zona; de esta manera se generaría el dolor.
- Su fuente principal de irrigación se encuentra a una distancia considerable de la masa principal de tejido coronario.
- La inexistencia de una circulación colateral eficaz que permita contrarrestar una irritación intensa, fenómeno fundamental para la supervivencia de cualquier órgano (no pueden ser llevadas nutrición adicional ni defensas a la zona).
Cuando se lesiona la pulpa dental se produce una inflamación conocida como pulpitis y como parte de esta reacción, habrá un aumento de la permeabilidad vascular y una filtración de líquidos hacia los tejidos circundantes. A diferencia de la mayoría de los tejidos blandos, la pulpa carece de espacio para edematizarse.
Debido a una serie de características y restricciones en su entorno, las lesiones pulpares son a menudo irreversibles y dolorosas:
- Un entorno bastante rígido
- Un tejido conjuntivo elástico
- Una circulación colateral ineficaz
La pulpitis es similar a la inflamación de otros tejidos del cuerpo, lo que varía es la intensidad, duración y extensión. Basándose en síntomas clínicos y descripciones histopatológicas, se pueden distinguir 2 fases: aguda (exudativa) y crónica (proliferativa). 1
BASES MORFOFISIOPATOLÓGICAS DE LA RESPUESTA INFLAMATORIA AGUDA PULPAR
- Génesis de los procesos inflamatorios pulpares
Pulpitis es la inflamación de la pulpa dentaria provocada por estímulos nocivos de variada índole; dentro de los cuales están: los agentes bacterianos que pueden tener una vía de acceso coronario (caries, anomalías dentarias como dens in dente, evaginación e invaginación) y una vía de acceso radicular (lesiones endoperiodontales, caries radicular); traumáticos: trauma agudo (fractura coronaria y radicular, luxación) y crónico (atrición, abrasión, erosión); químicos a través del uso de materiales de obturación (resinas - cementos), antisépticos, desecantes (alcohol - cloroformo) y desmineralizantes; iatrogénicos: calor de fresado, pulido y de fraguado, exposición pulpar y finalmente, idiopáticos. 1
- ¿Qué elementos componen la respuesta inflamatoria pulpar? 2
La respuesta inflamatoria pulpar evoluciona en el tejido conjuntivo vascularizado y los componentes de dicha respuesta pueden ser agrupados como se expone a continuación:
1. Plasma (aporta los anticuerpos y las proteínas de los sistemas de activación):
a) Sistema del complemento activado
b) Sistema de las cininas activados (bradicinina)
c) Sistema de coagulación y fibrinólisis
2. Elementos formes de la sangre:
a) Leucocitos polimorfonucleares (neutrófilos, basófilos y eosinófilos)
b) Monocitos
c) Linfocitos B y T y células plasmáticas
d) Plaquetas
3. Vasos sanguíneos (red de la microcirculación):
a) Arteriolas con fibras musculares lisas
b) Metaarteriolas con fibras musculares a modo de esfínter
c) Capilares y vénulas-zonas más activas del proceso inflamatorio
d) Endotelio vascular-órgano versátil multifuncional con propiedades de síntesis y metabólicas
4. Células del tejido conjuntivo:
a) Mastocitos (contienen histamina en sus granulaciones, se sitúan alrededor de los vasos sanguíneos).
b) Fibroblastos (formadores del propio tejido conjuntivo).
c) Macrófagos.
5. Matriz extracelular:
a) Proteínas fibrilares: colágenas y elásticas
b) Proteínas de adhesión: fibronectina, laminina, colágeno no fibrilar, tenascina
c) Gel de proteoglucanos e hialuronidato
- Pulpitis aguda: ¿Cuáles son sus características morfofisiopatológicas? 3
La fase aguda de la inflamación pulpar es sinónimo de reacción inmune innata. En este proceso se distinguen 3 fases claves: cambios hemodinámicos, alteración de la permeabilidad vascular y modificaciones leucocitarias.
- ¿Cuáles son estos cambios hemodinámicos?
En primer lugar, ocurre una respuesta vascular inmediatamente debajo del sitio de la lesión, evidenciado por un aumento en la permeabilidad vascular y extravasación de fluido (edema), que en dependencia de su intensidad, puede causar alteraciones en la capa odontoblástica por la elevación de la presión. Esta vasodilatación permite el aumento de la velocidad de circulación de la sangre y la marginación de leucocitos.
Cuando la presión local en los tejidos sobrepasa la presión venosa, los vasos tienden a colapsar, la sangre se aleja de la zona de mayor presión hística hacia zonas de menor resistencia. La presión persistente obstaculiza la circulación, cuya consecuencia es mínima en los tejidos normales, pero grave en los tejidos inflamados; al obstruirse esta, se facilita la acumulación de factores irritantes como las toxinas bacterianas, las enzimas nocivas, los factores quimiotóxicos, entre otros. Dicha congestión venosa en la región apical, con control del posible drenaje de la pulpa, constituye el factor decisivo para la manifestación regresiva o progresiva de la reacción inicial.
De manera didáctica, los cambios hemodinámicos que acontecen en la respuesta inflamatoria aguda pulpar pueden resumirse, paso a paso, de la siguiente manera:
1. Vasoconstricción: Período inconstante y transitorio, su duración dependerá de la intensidad del agente inflamatorio.
2. Vasodilatación arteriolar y capilar: Provoca la apertura de capilares y vénulas, inducida por la acción de diferentes mediadores sobre el músculo liso vascular, principalmente histamina y óxido nítrico.
3. Aumento de la velocidad del flujo sanguíneo (hiperemia) por las arteriolas: Es la causa de la aparición de eritema (rojez) en el sitio de la inflamación.
4. Aumento de la permeabilidad de la microvasculatura: Salida de un exudado inflamatorio hacia los tejidos extravasculares y aparición de edema inflamatorio.
5. Acumulación anormal y excesiva de sangre: La salida de líquido provoca un aumento de la viscosidad de la sangre, lo cual aumenta la concentración de los glóbulos rojos (congestión venosa).
6. Disminución de la velocidad de la sangre en pequeños vasos (estasis sanguínea).
7. Acumulación periférica de los leucocitos: Marginación y pavimentación leucocitaria.
8. Al mismo tiempo, las células endoteliales son activadas por los mediadores de la inflamación, expresando moléculas en sus membranas que favorecen la adhesión de los leucocitos, fundamentalmente los polimorfonucleares neutrófilos (PMN).
9. Paso de leucocitos (PMN en primer lugar, seguidos por macrófagos) desde los vasos al intersticio: Migración celular con formación del infiltrado inflamatorio.
- Alteraciones de la permeabilidad vascular 4
En condiciones normales el endotelio de los vasos sanguíneos pulpares no permite la salida de proteínas y el intercambio se produce por pinocitosis. Durante la inflamación aguda pulpar, se alteran las bases morfofisiológicas del endotelio por acción de mediadores químicos, con la consecuente alteración de las uniones celulares y las cargas negativas de la membrana basal. Según Abbas y Lichtman, 3 Majno y Palade observaron aperturas entre las células que no se encontraban rotas. Generalmente, este efecto se produce en las vénulas, pero si es muy intenso se alcanza a los capilares y se produce extravasación por rotura.
La salida de líquidos, proteínas y células a partir de la sangre se denomina exudación. Es importante distinguir los siguientes conceptos:
- Exudado: Es un líquido extracelular que contiene alta concentración de proteínas y restos celulares, muy denso; su presencia implica una reacción inflamatoria.
- Trasudado: Constituye un fluido con bajo contenido en proteínas (contiene sobre todo albúminas); es un ultrafiltrado del plasma debido a la existencia de una diferencia de presión osmótica o hidrostática a través de la pared de un vaso, sin aumento de la permeabilidad vascular ni proceso inflamatorio.
- Edema: Es un exceso de líquido en el tejido intersticial, que puede ser un exudado o un trasudado.
- Pus: Es un exudado purulento, un exudado inflamatorio rico en leucocitos (sobre todo PMN), restos de células muertas y en muchos casos microorganismos.
El aumento de la permeabilidad vascular se genera por varios mecanismos que pueden producirse simultáneamente:
- Contracción de las células endoteliales.
Es el mecanismo más común, desencadenado por diferentes mediadores, como la histamina, la bradicinina, los leucotrienos y la sustancia P, entre otros. Estas sustancias provocan la contracción brusca de los filamentos de actina y miosina de las células endoteliales que se retraen, de forma que los espacios interendoteliales aumentan. Después el citoesqueleto se reorganiza para mantener la contracción durante más tiempo. Las sustancias inflamatorias deben disolver la membrana basal de estas aperturas.
- Daño endotelial
La necrosis de las células endoteliales provoca su separación de la pared del vaso, con la creación de una apertura en este. Puede producirse en lesiones graves, o por la acción tóxica de agentes patógenos que afectan directamente al endotelio. Los PMN que se adhieren a las células endoteliales también pueden dañarlas. En este caso, la pérdida de líquido continúa hasta que se forma un trombo o se repara el daño.
- Aumento de la transcitosis
El transporte de fluidos y proteínas a través de las propias células endoteliales (y no entre ellas) puede realizarse mediante canales que se forman a partir de vacuolas y vesículas no recubiertas interconectadas (denominado orgánulo vesículo-vacuolar).
- ¿Cuáles son las modificaciones leucocitarias que acontecen en la respuesta inflamatoria aguda pulpar? 5
Los leucocitos fagocitan a los patógenos, destruyen a las bacterias, a otros microorganismos y degradan el tejido necrótico, pero pueden prolongar, también, la lesión tisular al liberar enzimas, mediadores químicos y especies reactivas del oxígeno (ERO), estas últimas también denominadas radicales libres de oxígeno (RLO). El grupo de leucocitos más importantes en una inflamación aguda son los leucocitos polimorfonucleares neutrófilos (PMN).
El tejido conjuntivo contiene macrófagos y mastocitos, células centinelas capaces de reconocer la presencia de microorganismos, células muertas o cuerpos extraños. Los macrófagos son los elementos principales en el inicio del proceso de inflamación, pues poseen receptores específicos capaces de reconocer agentes extraños y células muertas. Cuando advierten estos elementos, los macrófagos producen las citoquinas interleuquina-1 (IL-1) y factor de necrosis tumoral (TNF-á), que desencadenan la inflamación propiamente dicha y, de esa manera, actúan sobre las células endoteliales de los vasos sanguíneos cercanos (principalmente vénulas postcapilares), para permitir la migración transendotelial de los leucocitos.
Por otra parte, los mastocitos reaccionan al estrés físico que se detecta en el tejido pulpar (calor, frío, presión) y producen los mediadores: serotonina e histamina, potentes agentes vasoactivos que actúan sobre la contracción y la permeabilidad de los vasos, tanto arteriales como venosos.
Como consecuencia de la activación de macrófagos y mastocitos, se produce la liberación de mediadores químicos de la inflamación. Estos mediadores inducen vasodilatación en la zona afectada, provocan la salida de líquido de la sangre hacia los tejidos generando un edema. Por esta razón, la viscosidad de la sangre aumenta, debido al aumento de concentración de los glóbulos rojos, lo que provoca un descenso en el flujo sanguíneo (estasis). En estas condiciones hemodinámicas, los leucocitos se redistribuyen en posición periférica, un fenómeno denominado marginación. A continuación, ruedan sobre la superficie del endotelio, estableciendo contactos transitorios con las células endoteliales, soltándose y volviéndose a unir. Finalmente, se adhieren firmemente al endotelio, antes de iniciar la migración a través de los capilares.
Los leucocitos que han atravesado los capilares se dirigen hacia la zona afectada por un proceso de quimiotaxis. Una vez allí, fagocitan los agentes extraños y los destruyen, lo cual producirá pus, que será eliminado hacia el exterior o generará un absceso, si la zona donde se ha formado está en el interior (cámara pulpar cerrada).
Una vez eliminado el pus (bien de manera natural o por intervención quirúrgica en caso de absceso), los macrófagos y los linfocitos proceden a la reparación del tejido dañado por la inflamación aguda. El daño tisular está producido generalmente por los PMN, que son muy numerosos y liberan enzimas hidrolíticas y radicales libres que lesionan los tejidos. La reparación se produce gracias a los macrófagos, que estimulan a los fibroblastos a sintetizar colágeno y a las células endoteliales a generar nuevos vasos, mediante la secreción de factores de crecimiento. Sin embargo, la reparación casi siempre es bastante incompleta.
La naturaleza de los leucocitos infiltrados varía según el momento de la respuesta inflamatoria y el tipo de estímulo. En la mayor parte de los casos de inflamación aguda, los neutrófilos (PMN) predominan durante las primeras 6-24 horas, luego son reemplazados por monocitos en 24-48 horas. La rápida aparición de los PMN se debe a que son más abundantes en la sangre, responden más rápido a las quimioquinas y se adhieren más fuertemente a las moléculas de adhesión que aparecen en las células endoteliales activadas, como las selectinas E y P. No obstante, después de entrar en los tejidos, los PMN tienen una vida media corta: apoptosis y desaparición después de 24-48 h. Los monocitos responden más despacio, pero no solo sobreviven en los tejidos, sino que, además, proliferan y dan lugar a los macrófagos, de modo que se convierten en la población dominante en las reacciones inflamatorias crónicas.
- ¿Quiénes son los protagonistas principales de las respuestas que se suscitan en la inflamación aguda pulpar? 4
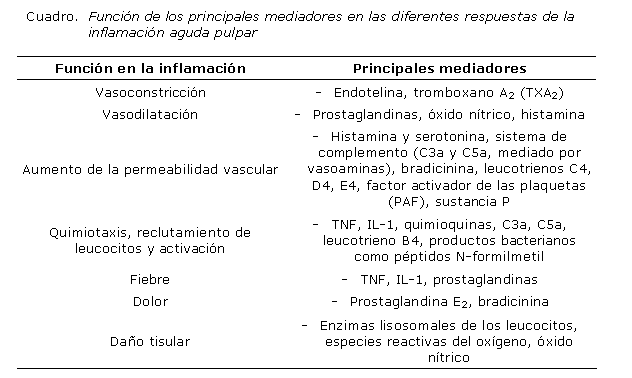
Son los mediadores químicos, pequeñas moléculas que consisten en lípidos (prostaglandinas, leucotrienos y tromboxanos), aminoácidos modificados (histamina, serotonina) y pequeñas proteínas (citoquinas, factores de crecimiento, interleuquinas), que representan información específica destinada a las células capaces de utilizar esta información gracias a la presencia de receptores específicos en su membrana plasmática. Los mediadores de la inflamación son de origen plasmático (sintetizados la mayoría por el hígado) o celular (cuadro).
Vínculo básico-clínico en los procesos inflamatorios agudos pulpares 6-9
Al revisar la bibliografía médica, se encuentran disímiles criterios sobre la clasificación de los procesos inflamatorios pulpares; sin embargo, se coincide con la clasificación de Villasana del 2002, por ser la más cercana a la relación morfofuncional de la inflamación como entidad clínica y sus características:
1. Inflamación aguda (pulpitis incipiente): Vasodilatación, estasis circulatoria, hemorragia intersticial, edema, movilización intravascular de leucocitos.
2. Inflamación aguda (pulpitis aguda propiamente dicha): Diapédesis localizada de neutrófilos y eosinófilos, exudación serosa, microabscesos, fagocitosis.
3. Inflamación por abscesos (pulpitis supurada): Microabsceso, encapsulación fibrosa, múltiples abscesos con necrosis por licuefacción, edema generalizado y exudación serosa, trombosis.
4. Necrobiosis aguda: Inflamación flemonosa difusa total, infección total, infección secundaria, gangrena pulpar.
5. Inflamación crónica (pulpitis crónica): Infiltración difusa de linfocitos y plasmocitos, movilización de histiocitos y macrófagos, degeneración cálcica y fibrosa, formación de úlcera en el lugar de la exposición.
6. Necrobiosis crónica: Infiltración plasmocitaria general, lisis hística con necrosis por licuefacción, vacuolas.
Se considera que a pesar de ser más objetivo correlacionar la evolución del estado pulpar con los hallazgos clínicos, sí existe una vinculación estrecha entre todas las etapas del proceso inflamatorio agudo pulpar, como respuesta inespecífica ante el daño o la lesión tisular, con el sustento teórico del diagnóstico y tratamiento de esta afección.
Puede indicarse que la muerte pulpar no es un fenómeno repentino, sino el resultado de la evolución paulatina del proceso inflamatorio y su remisión, lo que condiciona la clasificación en los siguientes estados pulpares:
1. Pulpa sana
2. Pulpitis reversible
3. Pulpitis transicional
4. Pulpitis irreversible
5. Pulpa necrótica
Pulpa sana: No existe proceso inflamatorio, la pulpa reacciona normalmente a estímulos como un mecanismo propio de activación de receptores nerviosos pulpares (nociceptores), el dolor desaparece cuando se retira el estímulo.
Pulpitis reversible: Lo que caracteriza este estado es la vasodilatación ocasionada por la presencia de mediadores químicos en el tejido pulpar, que provoca hiperemia y determina la aparición del dolor frente a estímulos como frío, calor, dulce, pero tan pronto se retira el estímulo, el dolor desaparece. Esta respuesta vascular condiciona la ingurgitación de los vasos sanguíneos pulpares y ocasiona sensibilidad de la pulpa.
Pulpitis transicional: Se caracteriza, además de la vasodilatación y la hiperemia, por un aumento de la permeabilidad vascular en los capilares que provoca la aparición de un exudado líquido que contiene mediadores químicos como la prostaglandina E1 (PGE2) y la bradicinina, y origina presión en la cavidad pulpar, inextensible con la aparición del dolor.
Pulpitis irreversible: Además de todo lo planteado anteriormente sobre la transicional, se adicionan la presencia de microabscesos diseminados, hallazgo morfofisiopatológico de gran interés que denota la presencia de un exudado de polimorfonucleares neutrófilos, junto con el incremento de la presión hidrostática, la viscosidad sanguínea y el bloqueo del drenaje linfático, lo que ocasiona un dolor espontáneo, insoportable, continuo e irradiado, que se exacerba con la ingestión de alimentos calientes y que solo es aliviado con líquidos fríos.
Pulpa necrótica: En este estado, sumado a todo lo anterior, se produce la descomposición celular, y la producción de pus se extiende a todo el tejido pulpar, generalmente desaparece el dolor y la estructura dentaria no presentará ningún signo de vitalidad, aunque puede encontrarse una extrema sensibilidad, que denota síntomas de dolor periapical y se inicia una dolencia de origen periodontal, sobre todo a la percusión vertical. 2
CONCLUSIONES
La causa de los procesos inflamatorios pulpares es variada y su fase aguda es sinónimo de respuesta inmune inespecífica, la cual tiene origen vascular y exudativo, con predominio de polimorfonucleares neutrófilos.
En la respuesta inflamatoria aguda pulpar se identifican 3 fases esenciales: cambios hemodinámicos, alteración de la permeabilidad vascular y modificaciones leucocitarias, que tienen lugar en un tejido contenido dentro de una cavidad rígida e inextensible. Los mediadores químicos constituyen los protagonistas por excelencia de todos los cambios morfofisiopatológicos que se suscitan en la inflamación aguda pulpar, con la existencia de una estrecha relación entre las bases morfofisiopatológicas de la respuesta de dicho proceso inflamatorio y los estadios pulpares.
REFERENCIAS BIBLIOGRÁFICAS
1. Queralt R, Durán Sindreu F, Ribot J, Roig M. Manual de Endodoncia. Parte 4. Patología pulpo-periapical. Rev Oper Dent Endod 2006; 5:24.
2. Pérez Ruiz AO. El estomatólogo: su relación con el dolor y la sangre. La Habana: Editorial Ciencias Médicas, 2008:122.
3. Abbas AB, Lichtman AH. Ch 2 Innate immunity. Basic immunology. Functions and disorders of the immune system. 3 ed. Philadelphia: Saunders-Elsevier, 2009.
4. JOE Editorial Board. Pulpal and periradicular diagnosis: an online study guide. J Endod 2008; 34(5 Suppl):45-52.
5. Fragoso Rodríguez DI, García Pérez EE, Montes Meneses D, Rojas Fragoso A. Diagnóstico histopatológico contra diagnóstico clínico en padecimientos pulpares. <http://scholar.googleusercontent.com/scholar?q=cache:kmnWMKkJvzoJ:scholar.google.com /&hl=es&as_sdt=0> [consulta: 21 febrero 2011].
6. López Marcos JF. Etiología, clasificación y patogenia de la patología pulpar y periapical. Med Oral Patol Oral Cir Bucal 2004; 9(Suppl):52-62. <http://www.medicinaoral.com/medoralfree01/v9Suppli/medoralv9supplip58.pdf> [consulta: 2 marzo 2011].
7. Cohen S, Burns RC. Pathways of the pulp. Saint Louis: Mosby, 2002:1031.
8. Ingle JI. Endodoncia. México DF: McGraw Hill-Interamericana, 2004:981.
9. Shafer WE et al. A textbook of oral pathology. 4 ed. Philadelphia: Saunders-Elsevier, 1983:479.
Recibido: 4 de Julio de 2011.
Aprobado: 16 de agosto de 2011.
MsC. Lizet García Cabrera. Universidad de Ciencias Médicas, Facultad de Estomatología, avenida de las Américas, entre calles I y E, reparto Sueño, Santiago de Cuba, Cuba.
Dirección electrónica:lisgarcia@medired.scu.sld.cu