Introducción
En Cuba la tendencia creciente del cáncer de pulmón se expresa a través de 2 indicadores básicos: tasa de incidencia y tasa de mortalidad. Según el Anuario Estadístico de Salud 20151 de este país, en el año 2012 se registraron 5 mil 603 casos nuevos, de los cuales 63,5 % correspondió al sexo masculino. Ese mismo año fueron notificados en el mundo 14,1 millones de nuevos casos de cáncer y 8,2 millones de muertes por esta causa.2
Cabe referir que en esta nación caribeña el cáncer de pulmón es más frecuente en hombres (65 %) que en mujeres (35 %) y su causa más común es el tabaquismo, puesto que 95 % de los pacientes son fumadores o exfumadores, mientras que en el porcentaje restante de no fumadores coexisten la combinación de factores genéticos, la exposición al gas radón, al asbesto, y la contaminación atmosférica, incluido el humo secundario (ser fumadores pasivos).1,2
El diagnóstico se establece de manera temprana en cerca de 20 % de las personas afectadas, en quienes el tratamiento con resección quirúrgica resulta exitoso, con altas tasas de curación; sin embargo, la neoplasia maligna mayormente es detectada cuando ya existe metástasis, por lo que los pronósticos son peores, con una esperanza de vida promedio de aproximadamente 8 meses.3
Por otra parte, la vacuna terapéutica CIMAvax-EGF® está compuesta por el factor de crecimiento epidérmico humano (hEGF, siglas del inglés human epidermal growth factor) conjugado a la proteína P64K de la Neisseria meningitidis. Este antígeno (hEGF-P64K) se administra unido al adyuvante Montanide ISA-51 vegetal para incrementar su inmunogenicidad. La conjugación de esta proteína propia del ser humano con una proteína de un microorganismo hace que sea reconocida como extraña por el sistema inmunitario y que se produzcan anticuerpos anti-EGF que se unen al EGF circulante e impiden la interacción de este al ligarse con su receptor (EGFR).4
Cuando un paciente es tratado con esta vacuna, se produce un incremento en los títulos de anticuerpos neutralizantes contra el EGF y una reducción proporcional del EGF circulante en el suero. El nivel de los títulos de anticuerpos desarrollados en cada paciente se relaciona directamente con el incremento de la supervivencia global.5
Resulta oportuno destacar que en Cuba el cáncer de pulmón es un problema de salud importante, donde el diagnóstico temprano y el seguimiento médico de los pacientes constituyen una prioridad, que es muy discutida en diferentes niveles de asistencia. A escala mundial se ha observado que la población afectada por dicha neoplasia posee un alto riesgo de muerte, tanto por causas respiratorias como no respiratorias, debido a que pueden aparecer múltiples morbilidades asociadas. En esta investigación se pretendió contrastar los hallazgos de diferentes estudios con la actualidad en este país.
Métodos
Se realizó un estudio descriptivo y longitudinal de 58 pacientes, mayores de 50 años, con diagnóstico de cáncer de pulmón, atendidos en la consulta de Sombras Pulmonares del Servicio de Neumología en el Hospital General Docente Dr. Juan Bruno Zayas Alfonso de Santiago de Cuba, de enero del 2013 a igual mes del 2018, quienes eran tratados con la vacuna CIMAvax-EGF®, a fin de determinar las características clínicas y epidemiológicas de estos como grupo poblacional del territorio.
Los datos demográficos y clínicos se obtuvieron de las historias clínicas del Servicio de Oncología y a través del examen físico, y luego fueron recogidos en una planilla elaborada a los efectos. La respuesta al tratamiento fue evaluada teniendo en cuenta los criterios internacionales propuestos por el Comité de Criterios de Evaluación de Respuesta en Pacientes con Tumores Sólidos (RECIST, siglas en inglés de Response Evaluation Criteria In Solid Tumors versión 1.1, 2009).
Una vez recogida la información, se creó una base de datos en el paquete estadístico SPSS, versión 11.5, para procesarla y ofrecerla en porcentaje como medida de resumen.
Resultados
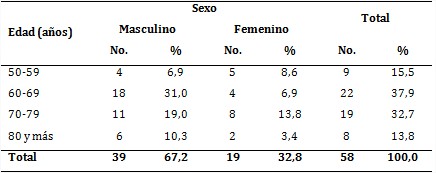
De un total de 58 pacientes, 39 eran del sexo masculino (67,2 %) y 19 del femenino (32,8 %). El grupo etario de 60-69 años fue el más frecuente, con 22 pacientes, para 37,9 %, seguido del grupo de 70-79 años, con 19, para 32,7 % (tabla 1).
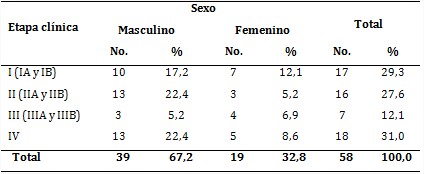
En la serie se comprobó que la etapa IV fue la predominante, con 18 pacientes (31,0 %); no obstante, existió homogeneidad numérica en cuanto a las etapas clínicas, a excepción de la etapa III, que fue la de menor cuantía, con 7 pacientes, para 12,1 % (tabla 2).
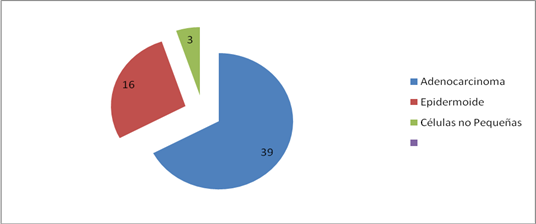
Las características histológicas se determinaron por las diferentes vías de acceso (fig. 1), tanto en el caso de los tumores periféricos como de los centrales, y el medio diagnóstico más utilizado fue el broncoscopio. Las pruebas citológicas dieron positivo en 39 pacientes (67,2 %) con la variedad adenocarcinoma, en 16 con carcinoma epidermoide (27,5 %) y en 3 con carcinoma de pulmón de células no pequeñas (5,17 %).
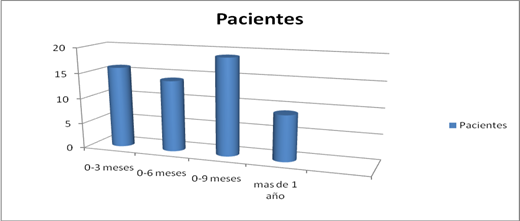
Varios parámetros sirven de referencia para determinar si el uso del producto es adecuado, uno de ellos es el tiempo de supervivencia mientras se aplica el producto y se mide en el tiempo trascurrido desde que comenzó la inmunización hasta la fecha de fallecimiento del paciente, con independencia de la causa del fallecimiento. En el caso de no haber fallecido, se calculará en relación con la fecha de última vacunación. En la figura 2 se muestra que la mayoría de los pacientes (18) sobrevivieron en un intervalo de 0 a 9 meses.
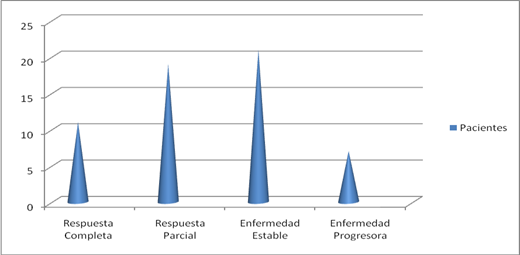
Luego de concluir el tratamiento de primera línea, se realizaron los estudios para identificar la respuesta a este, clasificada como enfermedad no progresora (respuesta completa, respuesta parcial y enfermedad estable) y enfermedad en progresión. De la serie, 51 presentaron enfermedad no progresora, para 87,9 %, y los 7 restantes enfermedad progresora; de estos últimos, 2 se encontraban en etapas iniciales de la neoplasia, para 3,4 %, y recibían además tratamiento oncoespecífico de segunda línea, y los otros 5 pacientes (8,6 %) recibieron segunda línea luego de posteriores evaluaciones (fig. 3).
Discusión
En Cuba el cáncer es una de las principales causas de incidencia y mortalidad desde la década de los 70 del pasado siglo. El panorama epidemiológico del cáncer, una vez que pasó a ser la primera causa de mortalidad general en el 2012, representa el mayor obstáculo para lograr sostener la “esperanza de vida de 80 años con mejor calidad”, puesto que, aunque afecta a personas en todas las edades, constituye también la primera causa de años de vida potencialmente perdidos hasta los 74 años.6
Particularmente el cáncer de pulmón constituye un importante problema de salud a escala mundial, con el primer lugar en incidencia y mortalidad en el sexo masculino y el cuarto en incidencia y segundo en mortalidad en el sexo femenino.7
Dicha neoplasia maligna afecta sobre todo a personas entre los 60 y 65 años de edad como promedio. Al respecto, en España, en el 2012, se estimó8 que hubo 26 715 afectados por cáncer pulmonar, con una incidencia ajustada a la población mundial de 52,5 por cada 100 000 en el caso de los varones y de 11,3 en el de las féminas, con lo cual se confirmaba la propensión levemente descendente en los primeros y ascendente en las segundas, observada en esa nación desde 1990.9,10
En consonancia con lo anterior, en Cuba se presenta de manera similar, pues al finalizar el 2015 resultó ser la primera causa de muerte para ambos sexos, situación que, según un estudio de pronóstico, se mantendrá para el 2030.11
Cabe destacar que sobre todo en las provincias occidentales cubanas, incluido el municipio especial de la Isla de La Juventud, se informan las tasas de incidencia más altas. De igual modo, 64 % de los pacientes notificados al Registro Nacional de Cáncer presentaban confirmación microscópica de la enfermedad y la variedad histológica más frecuente en ellos era el carcinoma de células escamosas. De los pacientes incluidos en el Registro, solo en 38 % se determinó el estadio al momento del diagnóstico, y de ellos 54 % correspondió a la etapa IV.12
El cáncer de pulmón de células no pequeñas localmente avanzado, o en la etapa III, se presenta en 30 % de los pacientes. El tratamiento en esta etapa continúa siendo muy difícil y polémico, principalmente debido a la gran heterogeneidad de condiciones patológicas. Así mismo, durante muchos años, se ha sido dividido este estadio en IIIA, con 24 % de supervivencia a los 5 años, y IIIB, con un peor pronóstico y una supervivencia de 9 % a los 5 años.13
Se calcula una incidencia para el cáncer de pulmón de células no pequeñas en la etapa IIIB de 17,6 %. La supervivencia a los 5 años que se anticipa para la mayoría de los pacientes en este estadio es de 3 a 7 %. En una serie pequeña se encontró que determinados pacientes con T4 y N0-1, debido exclusivamente a un nódulo o a nódulos tumorales satélites dentro del lóbulo primario, mostraron tasas de supervivencia a los 5 años de 20 %.14
Igualmente, se estima que 40 % de los pacientes recién diagnosticados con cáncer de pulmón de células no pequeñas se encuentran en la etapa IV de la enfermedad. En las estrategias terapéuticas se deben considerar las características histológicas, la biología molecular, la edad, el estado general, las morbilidades asociadas y las preferencias del paciente; también deben discutirse las decisiones al respecto en el grupo multidisciplinario. La terapia sistémica se debe ofrecer a todos los pacientes que presenten el estadio IV, con una escala funcional de 0-3.15
A juicio de Amorín Kajjat,3 la broncoscopia como técnica de visualización permite un pronto diagnóstico; es muy útil cuando existen signos directos de neoplasia en el canal endobronquial, y a través de ella pueden obtenerse una biopsia dirigida transbronquial y otra del tumor visible con fórceps, con lo cual se facilita la evaluación bajo visión directa de la extensión de la enfermedad. Los resultados de este estudio coincidieron con el planteamiento anterior.
El algoritmo de tratamiento en los pacientes en estadio IV depende de la localización de la metástasis. El diagnóstico de la enfermedad metastásica se logra con la mediastinoscopia, broncoscopia, resonancia magnética nuclear de cerebro y tomografía de emisión de positrones (si existe la posibilidad). Si este último examen da positivo de metástasis a otros órganos distantes, se necesita la confirmación histológica u otro estudio radiológico, puesto que por la sensibilidad de este método se pueden identificar otras metástasis y prevenir el uso de cirugías innecesarias en los pacientes.16
Un importante logro de la medicina cubana es el empleo del CIMAvax-EGF® humano recombinante, que es una vacuna terapéutica contra el cáncer, enteramente desarrollada en Cuba y licenciada en el país para su uso en pacientes adultos con neoplasia de pulmón de células no pequeñas en las etapas IIIB y IV. El producto se basa en la inmunoterapia activa; o sea, condiciona la respuesta inmunitaria de un individuo para que genere sus propios anticuerpos efectores contra el factor de crecimiento epidérmico (EGF).17
Numerosos ensayos clínicos han demostrado la inmunogenicidad y la seguridad de esta vacuna en el tratamiento de pacientes con cáncer avanzado. Los pacientes son seleccionados de manera aleatoria para recibir CIMAvax-EGF® o mejor tratamiento de soporte, después de la primera línea de tratamiento oncoespecífico.18
En esta serie figuraron diferentes etapas clínicas de la enfermedad, y a los pacientes se les proporcionó inmunoterapia como opción de continuidad terapéutica o como única opción contra el cáncer de pulmón. En alrededor de 70 % se pudo, al menos, controlar la enfermedad al terminar dicho tratamiento.
El esquema de inmunización cuenta con una fase de inducción, donde se administran 4 dosis de CIMAvax-EGF® cada 2 semanas, y una fase de mantenimiento con reinmunizaciones cada 4 semanas. La vacuna se administró por vía intramuscular y 3 días previos a la primera dosis de la fase de inducción los pacientes recibieron una dosis de ciclofosfamida (200 mg/m2).17,18
El tratamiento con CIMAvax-EGF® fue seguro y se registraron efectos adversos en menos de 25 % de los pacientes vacunados, todos ellos de intensidad leve o moderada (grado 1-2 según la escala de Criterios Comunes de Terminología para Eventos Adversos). Aquellos pacientes con una buena respuesta de anticuerpos mostraron una supervivencia significativamente superior que los que reaccionaron pobremente a la terapia. Se ha planteado que la supervivencia global de los pacientes menores de 60 años vacunados es significativamente superior.17
Posteriormente se han diseñado ensayos clínicos tomando en cuenta diferentes situaciones que se pueden presentar al momento del diagnóstico en el paciente con cáncer de pulmón que presenten criterio de tratamiento oncoespecífico, en etapas avanzadas o no, y con enfermedad no progresora en sus variantes (respuesta completa, respuesta parcial, enfermedad estable).4,14
La vacunación indujo a títulos de anticuerpos anti-EGF y disminuyó la concentración sérica de EGF. En el análisis por intención del tratamiento con CIMAvax-EGF® se incrementó significativamente la supervivencia global. El mayor beneficio en supervivencia fue visto en los pacientes que completaron la fase de inducción.16,17