Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.13 n.2 Ciudad de la Habana Mayo-ago. 2002
Instituto Nacional de Endocrinología
Desarrollo de un método inmunoenzimático para determinar progesterona
Dr. Roberto M. González Suárez,1 Lic. María Celeste Arranz Calzado 2 y Lic Gema García Dafonte3
Resumen
Se desarrolló un método inmunoenzimático, competitivo, en fase líquida, con separación por anticuerpos acoplados a partículas magnetizables, para determinar progesterona en plasma; se basa en la competencia por los sitios de unión de un anticuerpo monoclonal, entre la hormona presente en la muestra y un conjugado hormona-enzima, en presencia de agentes bloqueadores de las proteínas de transporte de esteroides del plasma. El complejo antígeno-anticuerpo es atrapado por un segundo anticuerpo antiglobulina de ratón acoplado a partículas magnetizables que permite separarlo de los componentes no reaccionantes del sistema y desarrollar en su superficie la reacción de color con la que se cuantifica el analito. Este sistema no requiere extracción de los esteroides del plasma con solventes orgánicos, ni centrifugación y el producto final de la reacción puede ser leído en un colorímetro convencional. Todo lo anterior lo hace accesible al equipamiento de un laboratorio de bioquímica clínica convencional. Se estudiaron los parámetros de calibración y de calidad de ambos métodos, se compararon con 2 sistemas analíticos comerciales similares y con los resultados de la determinación de progesterona en 200 muestras y se comprobó que no existían diferencias estadísticas entre ellos. Se concluyó que este sistema cuenta con los requisitos necesarios para ser incorporado como método de rutina en los laboratorios del Sistema Nacional de Salud.
DeCS: TECNICAS PARA INMUNOENZIMAS/métodos; PROGESTERONA/análisis; ANTICUERPOS MONOCLONALES/inmunología; OVULACION/inmunología.
La progesterona es una hormona que se produce en el cuerpo lúteo de los ovarios, en el período posterior a la ovulación. La cuantificación de progesterona se emplea en la clínica para diagnosticar la ovulación, para evaluar defectos en la fase lútea y efectividad de los procedimientos de inducción de la ovulación. Más recientemente, en la Clínica de Fertilización In Vitro y Trasplante Embrionario, la determinación de los niveles plasmáticos de progesterona entre las 24 y 48 h antes del pico preovulatorio de LH se ha empleado como un índice predictor del mismo.1 Su uso es imprescindible en los servicios de Ginecología, Endocrinología, y en las clínicas de fertilidad.2
El objetivo de este trabajo es desarrollar y validar un método inmunoenzimático, competitivo, en fase líquida, con separación por partículas magnetizables, que no requiere el uso de placas desechables, centrifugación ni equipos complejos de conteo o de lecturas espectrofotométricas, que pudiera ser utilizado en laboratorios con escasos recursos instrumentales.
Métodos
Componentes del ensayo
Se empleó un anticuerpo monoclonal anti-3-carboximetil oxima-progesterona (donado por el Laboratorio de Hormonas del Centro Médico Quirúrgico de Buenos Aires, directora Dr. S. Quiroga) con una dilución 1/80 000 del líquido ascítico y como trazador, un conjugado de fosfatasa alcalina de intestino bovino con 3-carboximetil-oxima-progesterona preparado en este laboratorio, según la técnica descrita por Erlanger 3 y como bloqueador de las proteínas transportadoras de esteroides del plasma, 4 mg/mL de danazol en solución tampón Tris 0,05 mol/L pH 7,5 que contenía suero humano libre de esteroides al 1,5 %.4
El reactivo de separación fue magnetita acoplada a inmunoglobulinas de carnero antiglobulinas de ratón. Para ello se purificaron inmunoglobulinas de ratón por precipitación salina y cromatografía de intercambio iónico, las que se emplearon para inmunizar carneros. Las inmunoglobulinas de carnero antirratón se purificaron de la misma manera y fueron acopladas a magnetita por medio de la reacción de periodato de sodio. Los detalles de los métodos empleados han sido publicados previamente.5-7
Se preparó una curva de calibración entre 0 y 80 nmol/L de progesterona (Sigma No. P-0130) en suero humano libre de esteroides (SHL).
La solución de sustrato para la reacción enzimática estuvo compuesta por dinitrofenil fosfato en dietanolamina al 10 %, a un pH 9,8 y 1mmol/L de MgCl2. La solución tampón fue Tris 0,05 mol/L; 1mmol/L de MgCl2 e igual de ZnCl2; gelatina y albúmina sérica bovina, ambas al 0,1 % y la solución de lavado fue la misma sin gelatina.
Protocolo del ensayo
Se incuban 50 mL de la muestra, patrón o SHL para los blancos con 100 mL de la dilución del anticuerpo e igual cantidad de la solución bloqueadora y de la dilución del reactivo de separación, a 4 oC, hasta el día siguiente. Se precipitan las partículas en la gradilla magnética y se lava 2 veces el precipitado con 0,5 mL de solución de lavado, se mezcla con agitación y se precipita en gradilla magnética por 2 min. A continuación, al pellet se le añaden 200 mL de la dilución del conjugado, se incuba por 2 h a 4 oC, se precipita y se lava, otras 2 veces, en la forma descrita. Para realizar la reacción de color, se le añaden 500 mL de la solución de sustrato. Se incuba 1 h a 37 oC, y se detiene la reacción con 1 mL de NaOH frío 5N. Se lee la densidad óptica a 405 nM.
La calidad de este método fue validada mediante la comparación de sus parámetros de calibración con los del juego de reactivos producidos por el Matched Reagent Program del Programa de Reproducción Humana de la OMS,8 que se basa en la misma metodología, se ha empleado durante los últimos años en el Instituto Nacional de Endocrinología y cuenta con una amplia aceptación y prestigio en todo el mundo. Adicionalmente, se compararon los resultados obtenidos con nuestro método en 200 muestras con los que brinda el método radioisotópico PROG-CTRIA (CIS bio International), que actualmente se distribuye en Cuba.
Se estudió la especificidad del ensayo por el desplazamiento de la unión del conjugado al anticuerpo por soluciones de esteroides relacionados estructuralmente con la progesterona. La potencia relativa se calculó como la relación, expresada en porcentaje, del ED-50 (concentración necesaria del producto para desplazar el 50 % del trazador unido al anticuerpo) de la sustancia evaluada y el de la progesterona.
Resultados
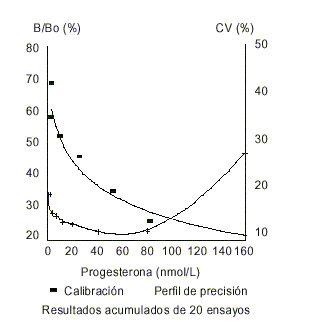
La figura 1 muestra la curva de calibración del método. El rango útil de la curva calculado entre el ED-20 y el ED-80 es de 0,71 a 255 nmol/L, mucho más amplio que el del método del MRP/HRP que es de 3,3 a 72. El punto medio de la curva es de 12,8 y 15,7 nmol/L, respectivamente.8 El error intraensayo evaluado por el perfil de precisión muestra que, a lo largo de la curva de calibración, es menor del 15 %, con un mínimo en el rango de los 60 nmol/L. El error entre ensayos, calculado por la reproducibilidad de los sueros de control de calidad a 3 niveles de concentración, se encuentra en alrededor del 30 % (tabla 1).
FIG.1. Curva de calibración del método inmunoenzimático para determinar progesterona.
Resultados acumulados de 20 ensayos.
TABLA 1. Evaluación de la reproducibilidad de la determinación de progesterona en sueros de control de calidad
| Control de calidad | Media/DE(*) | CV (%) | Rango |
| Bajo | 1,57/0,51 | 32,4 | 0,55-2,58 |
| Medio | 8,43/2,4 | 29,3 | 3,5-13,4 |
| Alto | 42,2/14,3 | 33,9 | 27,7-56,9 |
* Concentración de progesterona (nmol/L) en sueros de control de calidad, determinada en 20 ensayos independientes.
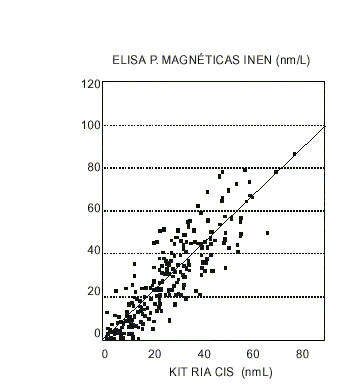
El análisis de regresión entre los valores de progesterona determinados en 200 muestras con nuestro método y con el kit PROG-CTRIA se muestra en la figura 2. Se encontró que la recta de regresión tiene una pendiente de 1,05 (intervalo para el 95 % de confianza; 0,96 a 1,18) y un intercepto de 2,30 (IC para 95 % -0,31 a 1,92), por lo que no se diferencian estadísticamente de 1 y 0, respectivamente.
FIG.2. Análisis de regresión de los resultados de la determinación de progesterona por 2 métodos analíticos.
De las 200 muestras estudiadas, 143 presentaban concentraciones de progesterona correspondientes a la fase lútea (más de 7,9 nmol/L) de acuerdo con el método de referencia y los criterios diagnósticos recomendados en el mismo. El método propuesto detectó 136 y solamente 7 falsos positivos, utilizando los mismos criterios, por lo que cuenta con una sensibilidad del 95 % y una especificidad del 88 % en el diagnóstico de la ovulación, con respecto al método en uso.
Se comprobó que la reacción cruzada con las moléculas relacionadas con la progesterona, que se puede encontrar más frecuentemente en el plasma, se halla en un rango menor del 0,001% (tabla 2), salvo con la androstenediona (0,09 %) y la 17- hidroxiprogesterona (0,013 %).
TABLA 2. Estudio de la especificidad del ensayo: potencia relativa de la unión al anticuerpo de esteroides con estructura similar a la progesterona
| Producto | Potencia relativa |
| Progesterona | 100 |
| Testosterona | < 0,001 |
| 5a androstane-3,17 diona | 0,001 |
| 5a androstane-3ß-17ß-diol | < 0,001 |
| Androsterona | 0,009 |
| Hidrocortisona | < 0,001 |
| 5a androstan 17ß ol-3-one | < 0,001 |
| ß-estradiol | < 0,001 |
| Estrona | < 0,001 |
| Ethisterona | < 0,001 |
| 9(11)-dihydro-17a metil T | <0,001 |
| Norethindrona | < 0,001 |
| 17 hidroxi-progesterona | 0,013 |
Discusión
Este trabajo se originó por la necesidad de producir un método propio que nos permitiera asegurar el gran número de determinaciones de progesterona que requiere la actividad asistencial e investigativa del Instituto Nacional de Endocrinología (INEN), sin depender de la importación de juegos de reactivos comerciales de alto costo. Se escogió como referencia para su diseño el método que se había empleado hasta el momento, y que había mostrado un alto nivel de calidad.8 Para evaluar la exactitud de sus resultados se usó el método isotópico que actualmente se distribuye en Cuba y se usa en el Instituto Nacional de Endocrinología.
Los resultados muestran que se logró reproducir, con reactivos propios, el método de referencia, con una curva de calibración que cubre los valores habituales en los períodos preovulatorios y posovulatorios. Las diferencias en la amplitud del rango útil son atribuibles a las diferencias de las características de los anticuerpos monoclonales que se emplean en ambos métodos, no afectan la utilidad del ensayo y plantean la posibilidad de extender en ambas direcciones el rango de la concentración de los patrones de calibración.
La evaluación de la exactitud mediante la comparación de los resultados con los de otro método aceptado como referencia muestra que este método es una alternativa válida en el rango de valores de utilidad clínica1,2 y, en particular, para diagnosticar la ovulación, alcanza resultados prácticamente idénticos. Según el análisis de la especificidad, la reacción cruzada con moléculas relacionadas estructuralmente se encuentra en un rango de valores que permite ignorarla en la interpretación de los resultados del ensayo.
Este sistema solo requiere el uso de tubos convencionales y de gradillas con base magnética. El resultado final se puede leer en un colorímetro convencional y no requiere centrifugación ni extracción con solventes orgánicos. Sus parámetros de calidad se encuentran dentro del rango establecido para este tipo de determinación,9 a pesar de encontrar valores de CV cercanos al 30 %.
En un estudio previo en el que se evaluó un prototipo preliminar del presente método y se comparó con el kit de progesterona del MRP de HRP/WHO,10 el error entre ensayo, evaluado por perfil de precisión en este laboratorio, se encontraba entre un 16 % para los valores entre 25 y 50 nm/L y 30 % para los valores puntos de la curva de calibración (González-Suárez RM, Arranz C, García G, Parets L. Desarrollo de métodos inmunoquímicos para la determinación de progesterona y testosterona. Resúmenes de la Jornada de temas terminados, Instituto Nacional de Endocrinología, 1999). Estos valores relativamente altos en lo que respecta a la precisión en este tipo de ensayo, obligan a extremar las medidas de manipulación y a elaborar sueros controles de calidad frescos y con algún preservo que asegure la conservación, y por tanto la estabilidad de los mismos, por largos períodos, especialmente en el contenido de proteínas transportadoras de esteroides, y que permita evitar falsos estimados de la precisión del ensayo.
En conclusión, hemos comprobado que el método propuesto cuenta con parámetros de calibración y de calidad similares a los de los juegos de reactivos comerciales de referencia. Su incorporación al trabajo de rutina de la institución, después del necesario proceso de validación en condiciones de trabajo, que se encuentra en curso, significará un incremento en nuestras potencialidades asistenciales e investigativas así como un importante ahorro de recursos.
Agradecimientos
Los autores expresan su gratitud a la compañera Lucía Parets Águila, técnica de laboratorio, por su colaboración en la realización de este estudio.
Summary
An immunoenzimatic, competitive liquid stage method , with separation by antibodies coupled to magnetizable particles was developed to determine progesterone in plasma, It is based on the competence for the binding sites of a monoclonal antibody between the hormone present in the sample and a hormone-enzime conjugate in the presence of blocking agents of the proteins transporting steroids from plasma. The antigen-antibody complex is trapped by a second mouse antiglobulin antibody coupled to magnetizable particles that allow to separate it from the non reacting components of the system and to develop in its surface the color reaction with which the analyte is quantified. This system does not require either extraction of the steroids from plasma with organic solvents or centrifugation and the final product of the reaction may be read in a conventional colorimeter. All this make it accessible to the equipment of a laboratory of conventional clinical biochemistry. The parameters of calibration and quality of both methods were studied and compared with 2 similar commercial analytic systems and with the results of progesterone determination in 200 samples. It was proved that there were no statistical differences between them. It was concluded that this system has all the necessary requirements to be incorporated as a routine method in the laboratories of the National Health System.
Subject headings: IMMUNOENZIME TECHNIQUES/methods; PROGESTERONE/analysis; MONOCLONAL ANTIBODIES/immunology; OVULATION/immunology.
Referencias bibliográficas
1. Padrón R. Infertilidad femenina. Diagnóstico de la ovulación. La Habana: Editorial Científico Técnica;1998:64.
2. Padrón R, Mateo de Acosta O, eds. Manual de diagnóstico y tratamiento en Endocrinología y Metabolismo. Reproducción, exploración funcional del ovario. La Habana: Editorial Científico Técnica;1985:108.
3. Erlanger B, Borek F, Beiser SM, Lieberman S. Preparation and characterization of conjugates of bovine serum albumin with testosterone and with cortisone. J Biol Chem 1957;228:713-27.
4. Nisembaum A, Machado A, Santander M, Andino N. Dos radioinmunoanálisis (extractivo y directo) para cuantificar progesterona plasmática. Rev Cubana Invest Biomed 1996:7;77-89.
5. Díaz E, Arranz C, Deás M, González-Suárez RM. Metodología preparativa y analítica para estandarizar y validar un sistema ELISA para cuantificar IgG de ratón. Rev Cubana Endocrinol 1997;8:184-92[ STANDARDIZEDENDPARAG]
6. Arranz C, González-Suarez RM, Robaina R. Producción de anticuerpo anticuriel en conejos para su uso como anticuerpo precipitante en el radioinmunoensayo. Rev Cubana Invest Biomed 1987;6:88-93.
7. Tijssen P. Preparation of enzyme-antibody or other enzyme-macromolecule conjugates. Practice and theory of enzyme immunoassays. Amsterdam, Netherland: Elsevier Science Publishers BV; 1993:221.
8. WHO. Special programme of research. Development and research training in human reproduction programme for the provision of matched assay reagents for the radioimmunoassay of hormone in reproductive physiology. Method Manual, 19 ed. Londres: HRP\WHO; 1995:36-45.
9. WHO. Special programme of research. Development and research training in human reproduction programme for the provision of matched assay reagents for the radioimmunoassay of hormone in reproductive physiology. WHO EQAS for reproductive hormones. Annual report, London, 1997.
Recibido: 11 de diciembre de 2001. Aprobado: 20 de junio de 2002.
Dr. Roberto M. González Suárez. Instituto Nacional de Endocrinología, Zapata y D, El Vedado, Ciudad de La Habana, Cuba.
1 Doctor en Ciencias Médicas. Investigador Titular
2 Licenciada en Bioquímica. Investigadora Auxiliar.
3 Licenciada en Bioquímica. Investigadora Agregada.