Introducción
En la hiperplasia suprarrenal congénita (HSC), el tratamiento sustitutivo con glucocorticoides (GC) constituye en nuestros días su terapéutica ideal.1 El mecanismo por el cual este grupo de medicamentos producen osteoporosis no está completamente dilucidado, pero es aceptada la teoría de que disminuyen la formación ósea e incrementan su reabsorción.2 Algunos de los efectos descritos sobre el hueso parecen ser indirectos, por ejemplo, el de interrumpir el crecimiento y la inhibición de la reabsorción tubular renal de calcio.3 Por otra parte, de manera directa, se conoce que incrementan la resorción osteoclástica y disminuyen la formación ósea mediada por osteoblastos.3
En numerosos pacientes que por diferentes condiciones, entre ellas la HSC, han sido tratados con terapia de reemplazo de GC (aun respetando el ritmo circadiano de secreción de cortisol), se ha encontrado disminución de la densidad mineral ósea (DMO).4,5,6,7 En investigación previa, Espinosa y otros, si bien encontraron valores inferiores de DMO y contenido mineral óseo (CMO) en columna y fémur en pacientes con HSC en comparación con sus controles, no hubo diferencias estadísticamente significativas.
El presente estudio tuvo como objetivo describir las variables relacionadas con la masa ósea en pacientes con HSC que reciben tratamiento esteroideo sustitutivo.
Métodos
Se realizó un estudio descriptivo transversal que exploró variables clínicas, bioquímicas, hormonales y de mineralización ósea en todos los pacientes con HSC por déficit de 21OHasa y tratamiento esteroideo sustitutivo que asistieron a la consulta de Endocrinología pediátrica del Instituto de endocrinología durante el período en el que se desarrolló la investigación. (20017-2019). Con una edad comprendida entre 5 años y 30 años y que presentaran 1 año de tratamiento esteroideo, como mínimo.
Como criterios de exclusión se establecieron:
Ausencia a consulta de seguimiento por 1 año o más para el grupo 1.
Presencia de condiciones que produzcan osteoporosis por desuso, 1 o 2 meses previo al reclutamiento.
Presencia de osteoporosis permanente por enfermedades óseas, endocrinas, neurometabólicas o síndromes genéticos.
Pacientes que utilicen drogas que afecten la masa ósea.
Desde la aprobación del protocolo, el reclutamiento hasta el procesamiento estadístico y escritura del informe final se consideraron todos los aspectos éticos. Se presentó el consentimiento informado a los adolescentes y a los padres o tutores, previo el inicio del estudio.
Se tuvo en cuenta la edad del paciente al diagnóstico, el tiempo de tratamiento, la forma clínica: (clásica perdedora de sal (PS), clásica virilizante simple (VS) y forma no clásica (FNC)). El tipo de esteroide utilizado (con las categorías: hidrocortisona, acetato de cortisona, prednisona), la dosis diaria de esteroide, en mg/día, y según mg por metros cuadrados de superficie corporal.
En una segunda etapa se tomó una muestra de sangre para estudio del metabolismo fosfocálcico, que incluyó fósforo (mmol/L), calcio (mmol/L), fosfatasa alcalina (U/L), proteínas totales (g/L) y creatinina (µmol/L). Como variable hormonal se midió la testosterona, expresada en nmol/l; para determinación de calcio y fósforo urinarios (mmol/24 h), además, se recogió la orina de 24 h, correspondiendo con el día previo a la extracción de sangre. En todos los casos se utilizó la metodología y los valores de referencia empleados en el Instituto de Endocrinología.8,9
En la tercera etapa se realizó la densitometría ósea en el Hospital Fructuoso Rodríguez, se exploró columna lumbar y cadera. Se determinó la DMO expresada en g/cm2, el contenido mineral óseo (CMO), expresado en gramos y el puntaje Z-score, este último se calculó automáticamente por el programa del equipo de densitometría y expresa la deficiencia existente en la DMO y el CMO del paciente y un estándar poblacional similar en edad, sexo y etnia.10
Análisis estadístico
Se hallaron distribuciones de frecuencia para las variables cualitativas y medias y desviación estándar para las cuantitativas. Se compararon las medias según formas clínicas, utilizando Test de Krusckal-Wallis. En todos los casos se consideró la significación estadística cuando p< 0,05.
Los autores consideran que el análisis estadístico ofrecería resultados más contundentes si se hubiera realizado por grupos de edades, sexo y estadio puberal. Sin embargo, el número pequeño de casos y las diferencias de edades, no permitían HSC realizar tales subdivisiones, elemento que es identificado por los autores, como una limitación.
Resultados
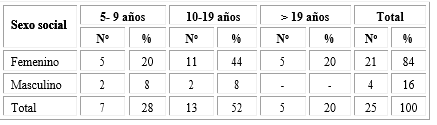
Los 25 pacientes estudiados se distribuyeron según grupos etáreos. Al sexo femenino correspondieron 21 (84,0 %) pacientes, el mayor grupo se ubicó en la etapa de la adolescencia‚ entre 10 y 19 años (52 %) (tabla 1).
Se comprobó un predominio de las formas clínicas clásicas 22 (88,0 %) pacientes, de ellas 13 (52 %) fueron formas PS, 9 (36,0 %) VS y solo 3 (12,0 %) FNC.
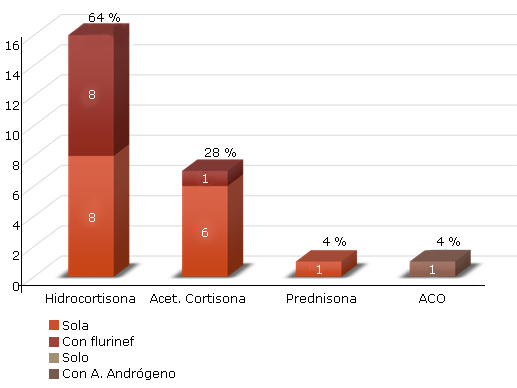
El tipo de tratamiento esteroideo que predominó en los pacientes fue la hidrocortisona sola o combinada con flurhidrocortisona, que representó 64 % de los pacientes, dato que corresponde con el mayor número de pacientes con diagnóstico de las formas clásicas PS, seguido del acetato de cortisona, en 7 (28 %) de los pacientes y por último, un solo paciente con prednisona para 4 %. El 4 % llevaba tratamiento con ACO combinado con acetato de ciproterona (fig. 1).
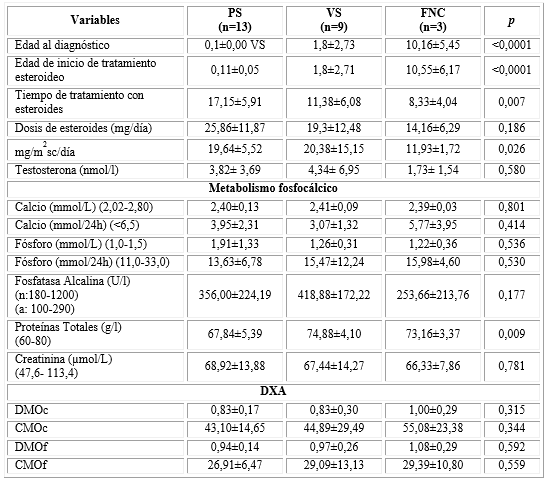
La dosis de esteroide utilizada estuvo entre 5 y 50 mg/día (22,10±12,00), una media de 17,09±5,71mg/m2sc/día; las que fueron calculadas según tabla de equivalencias de Pitarch Flors.11) Como promedio llevaban 14,02±6,57 años de terapéutica sustitutiva (tabla 2).
Al comparar las formas clínicas HSC según las variables relacionadas, se observaron diferencias con significación estadística en las medias de: la edad al diagnóstico (p< 0,0001), la edad de inicio del tratamiento esteroideo (p< 0,0001), el tiempo de tratamiento sustitutivo con esteroides (p=0,007) y la dosis en mg/m2sc/día (p= 0,026), no así‚ con los valores de testosterona, aunque clínicamente sí puede resultar en diferencias sustanciales (tabla 2).
En relación con el metabolismo fosfocálcico se observaron niveles similares de calcemia en los tres grupos. La calciuria fue más elevada en la forma no clásica, lo cual no tuvo significación estadística. Las medias más elevadas de fosfatemia se observaron en la forma PS, pero tampoco tuvo diferencias significativas. La fosfatasa alcalina fue superior en la forma VS, seguido de la PS y la FNC. De igual manera se comportó la creatinina, sin mostrar significación estadística. Las proteínas totales mostraron mayores valores en la VS, muy similar en la FNC y más bajos en la PS y estos resultados mostraron diferencias estadísticamente significativas (p=0,009).
Las medias de las variables relacionadas con la DEXA mostraron valores dentro de la normalidad en los grupos estudiados. Se encontró que la DMO y el CMO tanto en columna como en fémur mostraron valores superiores en las FNC de la enfermedad, seguidos de la VS y finalmente los pacientes con formas PS; aunque no se evidenció significación estadística.
La dosis de esteroides diaria se relacionó de manera positiva con la DMOc (0,428, p=0,033), con el CMOc (0,426, p=0,019) y el CMOf; (0,441, p=0,03).
Tabla 2 Tratamiento esteroideo, metabolismo fosfocálcico y variables relacionadas con el hueso según formas clínicas
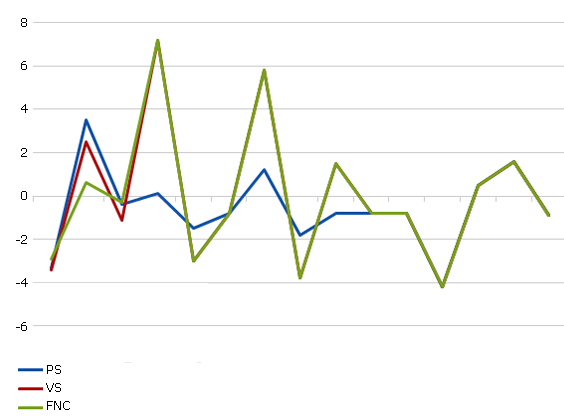
En ninguno de los casos hubo significación estadística en los puntajes de Z score, aunque puede tener importancia desde el punto de vista clínico. Solo 2 pacientes mostraron una baja masa ósea para la edad. Es importante señalar que un 1 paciente con la forma VS presentó un Z score mayor de 5 DE (fig 2 y 3).
Al revisar los valores de Z- score en cada uno de los pacientes fue llamativo el resultado en los sujetos 2 y 9 (Z-score para columna -4,20 y -3,30 respectivamente).
Discusión
El efecto del tratamiento esteroideo en la HSC ha sido motivo de controversia a lo largo de los años. En especial, por tratarse de una terapéutica establecida para la utilización de esquemas sustitutivos, a diferencia de lo descrito en afecciones donde el efecto que se busca es antiinflamatorio.
La edad del diagnóstico de la entidad en la mayoría de los pacientes fue en los primeros meses de vida, correspondiendo con el momento de aparición de las manifestaciones clínicas en la forma PS, que predominó en el presente estudio.
El inicio de tratamiento fue tan temprano como el periodo neonatal, lo que se corresponde con las formas clínicas de presentación de la enfermedad; por tanto, las medias del tiempo de tratamiento estuvieron en correspondencia con las formas clínicas. El mayor tiempo coincidió con aquellos casos cuyo diagnóstico fue precoz, durante la pesquisa, o por crisis suprarrenales neonatales presentadas por lo general en las formas más severas del déficit enzimático.
En el grupo de estudio, la hidrocortisona fue el tratamiento más utilizado por ser el más fisiológico, al tener una potencia superponible a la del cortisol endógeno, lo que coincide con los resultados encontrados. Además, por su corta vida biológica, minimiza la afectación sobre el crecimiento y sobre otros efectos adversos.11). Espinosa y otros12) en una investigación previa, donde se estudiaron 29 adolescentes y de ellos 19 (62,06 %) usaba hidrocortisona. Fleischman y otros13 en una muestra de 17 pacientes 8-20 años, encontró que 58,8 % recibían tratamiento con hidrocortisona, 3 (17,6 %) con dexametasona y 4 (23,5 %) con prednisona. Otros como Raizada y otros14 con pacientes femeninas de mayor edad (entre18-40años) reportó un mayor uso de dexametasona en 14 pacientes (93,3 %),seguido de prednisolona y solo 5 utilizaron hidrocortisona en periodos alternos.
Raizada reportó que la edad al diagnóstico y la edad al inicio del tratamiento mostraron una relación directa con la DMO y el CMO tanto en columna como en fémur; (p=0,039) y la DMOf (p=0,57). Este elemento pudiera ser la razón que justifique los valores obtenidos en las formas clínicas de déficit enzimático severo, en las cuales estas edades se corresponden con la primera etapa de la vida.14
Cuando se analizaron las variables clínicas, las relacionadas con la HSC y aquellas relacionadas con la masa ósea se obtuvo que a mayor edad de inicio del tratamiento, mayor DMO y CMO tanto en columna como en fémur. Este resultado pudiera explicarse porque fue a mayor edad que comenzó la exposición a tratamiento esteroideo, lo cual brinda la posibilidad de desarrollo de un pico de masa ósea sin influencia medicamentosa. Por otra parte, implica un período de tiempo mayor con niveles de andrógenos más elevados, lo que constituye‚ de alguna manera‚ una protección para el hueso.
La dosis de esteroides diaria se relacionó de manera positiva con la DMOc, con el CMOc y el CMOf; aspecto que pudiera resultar paradójico. Sin embargo, puede estar justificado por la utilización de dosis de esteroides en rango realmente sustitutivo.15,16
Aunque desde el punto de vista estadístico no se encontraron diferencias en las variables del DEXA y las formas clínicas, desde el punto de vista numérico‚ las cifras fueron más bajas en todos los casos en la forma PS, seguidos de la VS y finalmente la NC; relacionado en todos los casos con las dosis de esteroides empleados (a mayor dosis de esteroides mayor afectación de la masa ósea) y estos resultados sí pueden tener en un futuro una repercusión clínica importante.
En el análisis que se hace a continuación se identifican las posibles causas que pudieran justificar los resultados adversos en dos pacientes:
El sujeto 2 se corresponde con un varón, 8 años, con una forma clásica perdedora de sal, que requirió varios ingresos hospitalarios en sus primeros años de vida por descompensaciones. Todos los ingresos implicaron utilización de altas dosis de esteroides; las denominadas dosis de estrés, esquemas donde se duplica o triplica las dosis empleadas para mantenimiento. La edad en este caso es una ventaja, porque le permite ganar en masa ósea e incluso alcanzar un pico importante en la etapa puberal y mejorar su pronóstico óseo a largo plazo.
En el segundo caso se trata de una adulta de 26 años, igualmente con una forma clásica perdedora de sal, con diagnóstico desde la etapa de recién nacida (tratamiento prolongado), cuya dosis de mantenimiento oscila alrededor de los 32 mg/diarios de hidrocortisona, que se corresponde, en esta paciente, con una dosis media que no rebasa los 20 mg/m2sc/día, considerado adecuado como dosis de mantenimiento en las formas clásicas.
En ninguno de estos pacientes se identificó historia familiar de osteoporosis o baja masa ósea; la influencia de otros factores como los nutricionales, el ejercicio físico, el tabaquismo, entre otros, fue motivo de otra investigación.
Estos valores más bajos de masa ósea pueden constituir el escalón que antecede a la osteoporosis y con ello, acelerar o incrementar el riesgo posterior de fractura.
Uno de los sujetos de estudio mostró una masa ósea muy por encima de la curva para su edad y sexo. Los autores interpretan el valor como resultado de altos niveles de andrógenos a los que ha estado expuesta por descompensación, resultado de no cumplimiento del esquema terapéutico indicado.
Con los resultados encontrados los autores consideran que es importante el monitoreo de las dosis de esteroides empleadas, así como los niveles de plasmáticos de testosterona, con el propósito de asegurar a largo plazo una buena salud ósea en los pacientes con HSC; tema que es apoyado por otros autores.17,18