Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Higiene y Epidemiología
versión On-line ISSN 1561-3003
Rev Cubana Hig Epidemiol vol.49 no.1 Ciudad de la Habana ene.-abr. 2011
ARTÍCULOS ORIGINALES
Establecimiento de una técnica para la determinación de enteroparásitos en vegetales mediante inmunofluorescencia
Establishment of a technique to determination of entero-parasites in vegetables by immunofluorescence
Yamila Puig Peña,I José Carrera Vara,II Virginia Leyva Castillo,III Idalmis Hernández CastroIV
I Máster en Nutrición y en Enfermedades Infecciosas. Especialista de I Grado en Microbiología. Investigadora Agregada. Asistente. Instituto de Nutrición e Higiene de los Alimentos. La Habana. Cuba.
II Doctor en Ciencias Médicas, Profesor Titular. Investigador Auxiliar. Higienista de Alimentos. Instituto de Nutrición e Higiene de los Alimentos. La Habana. Cuba.
III Licenciada en Bioquímica. Investigadora Auxiliar. Asistente. Instituto de Nutrición e Higiene de los Alimentos. La Habana. Cuba.
IV Máster en Microbiología. Instructora. Instituto de Nutrición e Higiene de los Alimentos. La Habana. Cuba.
RESUMEN
Existen riesgos biológicos asociados a los vegetales, entre los que se encuentran los parásitos patógenos humanos, por lo que se hizo necesario establecer una técnica para la determinación de enteroparásitos en estos alimentos. Este procedimiento se realizó según el método descrito en el Manual de Análisis Bacteriológico FDA/CFSAN de 2001, y se investigaron diez muestras de vegetales procedentes de cinco áreas de cultivo pertenecientes a la provincia de Ciudad de La Habana, en el periodo de enero a marzo de 2009. Para esto se utilizó el examen directo con solución de lugol concentrado y la técnica de inmunofluoresecia para Giardia y Cryptosporidium mediante Kit de anticuerpos monoclonales (MERIFLUOR C/G). Para el control del proceso de extracción de parásitos se tomó una muestra de lechuga a la cual se le adicionó una suspensión de quistes de Giardia. Mediante examen directo se obtuvo 14,1 % de recuperación y por inmunofluorescencia 57,8 %. Los resultados obtenidos para los controles de la inmunofluorescencia fueron los esperados. En dos muestras de ensayo se observaron quistes de Giardia mediante inmunofluorescencia, pero no se encontraron quistes de Cryptosporidium.
Palabras clave: Parásito, vegetales, inmunofluorescencia, Giardia, Cryptosporidium.
ABSTRACT
There are biological risks associated with vegetables including the human pathogen parasites, thus it was necessary to establish a technique to assessment of entero-parasites in these foods. This procedure was applied according to the method described in the FDA Bacteriological Analysis Manual / CFSAN of 2001 where ten vegetable samples were investigated from five culture areas from the Ciudad de La Habana province from January to March, 2009. Authors used a direct examination with concentrated Lugol's solution and the immunofluorescence technique for Giardia and Cryptosporidium by monoclonal antibodies kit (MERIFLUOR C/G). For control of parasites extraction process we took a sample of lettuce adding a suspension based in Giardia cysts. By direct examination we achieved the 14,4% of recovery and by immunofluorescence the 57,8%. Results obtained for immunofluorescence control were the expected ones. In two assay samples there were Giardia cysts by immunofluoresence but not Cryptosporidium cysts.
Key words: Parasite, vegetables, immunofluorescence, Giardia, Cryptosporidium.
INTRODUCCIÓN
Las frutas y vegetales frescos constituyen un motivo de preocupación con respecto a la seguridad alimentaría. Existen riesgos biológicos asociados, como contaminantes que se establecen a través de malas prácticas de producción y manipulación, provenientes del suelo, de la aplicación de abono orgánico sin tratar, uso de agua de riego contaminada con materia fecal o la presencia de animales en el campo.1-3
Entre los patógenos humanos presentes en los vegetales se encuentran los parásitos, que por la baja dosis infectante y la alta resistencia de las formas quísticas al medio ambiente y a los desinfectantes en las concentraciones habituales que se utilizan para eliminar las bacterias, subrayan la importancia que este grupo de alimentos puede tener en la epidemiología de estos microorganismos,2-4 por lo que se hace necesario el establecimiento de procedimientos para su estudio.
Las técnicas empleadas para la determinación de parásitos en vegetales son costosas, por lo que se aplican generalmente en países desarrollados.5-7 Sin embargo, en la literatura revisada se reportan estudios en países latinoamericanos, como Costa Rica, Perú y Venezuela, realizados de forma puntual con el uso de métodos sencillos, como filtración de membrana para la determinación de Giardia, técnicas con sulfato de zinc, teleman modificado para Isospora sp. y coloración de Ziehl-Neelsen para Criptosporidium parvum.8-11
Los procedimientos publicados en los últimos años para recuperar parásitos de las frutas y hortalizas demuestran un aumento en la sensibilidad y especificidad, como el desarrollo de un método estándar para el lavado mediante la sonicación y observación de quistes de Giardia y Cryptosporidium mediante inmunofluorescencia (IFA) y el uso de anticuerpos monoclonales,5,6 lo que mejora la separación del parásito del vegetal y tiene el potencial de aumentar la eficacia de la recuperación, incluso en muestras de vegetales procesados en estudios de brotes. No obstante, autores como Robertson y otros consideran que aun estas técnicas no son las óptimas, y describen un método mejorado donde incluyen el proceder immunomagnético durante el lavado.6,7
Existen otros métodos para la determinación de parásitos en agua y vegetales mucho más sensibles, como la tecnología de PCR cuantitativa (TaqManTM PCR), que puede automatizarse, es rápida y acorta el tiempo de procesamiento de la muestra, con el inconveniente de que este tipo de estudio es muy costoso.5,12
En Cuba, a pesar de los esfuerzos realizados para el control de las enfermedades parasitarias, aun esto constituye un problema de salud. En estudios realizados en diferentes grupos de pacientes, se informa que la infección por Giardia lamblia es la de más alta prevalencia y varían entre 15 a 50 %. Los helmintos, que con mayor frecuencia afectan a la población, sobre todo a los pacientes pediátricos que viven en zonas rurales, son Trichuris trichura y Ascaris lumbricoides.13-15
Teniendo en cuenta lo antes expuesto, nos trazamos como objetivo establecer en el laboratorio de Microbiología de los Alimentos del Instituto de Nutrición e Higiene de los Alimentos (INHA), una técnica para la determinación de enteroparásitos en vegetales.
MÉTODOS
En el laboratorio de Microbiología de los Alimentos del INHA se adoptó el procedimiento para la determinación de enteroparásitos en vegetales descrito en el Manual de Análisis Bacteriológico FDA / CFSAN, 2001.5 Para el establecimiento de la técnica se analizaron diez muestras de vegetales, obtenidas de cinco áreas de cultivo, en el período de enero a marzo de 2009. Las muestras fueron de 1 kg de peso (hortalizas frescas que se consumen crudas o mínimamente procesadas), las que se trasladaron en bolsas de nylon de primer uso y se distribuyeron como sigue: tomate (2), col (1), lechuga (2), rábano (1), col china (1), zanahoria (1), acelga (1), espinaca (1).
PROCEDIMIENTO
- Control del proceso de extracción de parásitos. Se tomaron 250 g de lechuga previamente descontaminadas con solución de cloro al 3 % y lavada con abundate agua; se le adicionó 10 mL de una suspensión de quistes de Giardia (64 quistes por campo) y se dejó 2 h a temperatura ambiente.
- Preparación de muestras. Para el análisis las muestras se dividieron en submuestras de 250 g. Vegetales de hojas sueltas, como la lechuga, la acelga y la espinaca, se separaron por hojas individuales. Otros, como la col, se removieron en tres hojas por nivel. Vegetales como la zanahoria, el rábano y el tomate, se tomaron por unidad.
- Lavado de vegetales. Se realizó en baño ultrasónico durante cinco minutos con el uso de un litro de solución de detergente compuesta por tween 80 (0,1 %), formaldehído (2,5 %) y Duodecil sulfato de sodio (0,1 %). Al finalizar se removieron los vegetales y se repitió el procedimiento.
- Concentración. La solución de lavado se concentró por centrifugación en tubos plásticos de 50 mL con tapa de rosca, y el empleo de una centrifuga (TOMY LC- 200, Japón). El proceso se realizó a 1 200 x g durante 10 min. Se utilizó solución de detergente compuesta por Tween 80 (1%) y Duodecil sulfato de sodio (1%). Para el aclarado del sedimento, el concentrado fue transferido a un tubo con 25 mL de solución de Sheather y se centrifugó a 1 200 x g durante 30 min. Se removió 7 mL del fluido de la interfase y fue depositado en otro tubo. Seguidamente se completó el volumen con solución detergente Tween 80 (1%). Esta operación se repitió dos veces hasta obtener el concentrado final.
- Observación al microscopio. Se utilizó examen directo con solución de lugol concentrado. El examen mediante la técnica de inmunofluoresecia se realizó para Giardia y Cryptosporidium, con el uso de Kit de anticuerpos monoclonales para Giardia y Cryptosporidium (MERIFLUOR C/G). Las observaciones se realizaron en microscopio (Nikon ECLIPSE 80i, Japón). Las imágenes fueron tomadas mediante sistema de cámara DS-5M-L1.
RESULTADOS
Los controles de los reactivos, tanto negativos como positivos realizados en desarrollo de la técnica de inmunofluorescencia (IFA) para los estudios del proceso de control de extracción, como en cada una de las muestras de ensayo, fueron los esperados según lo indicado por el productor (Procedimiento de detección por inmunofluorescencia directa de Cryptosporidium y Giardia. Merifluor C/G, Biocience, Inc).
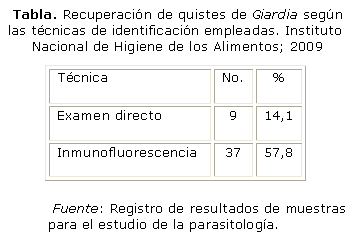
En el análisis del control de extracción en las muestras inoculadas se realizó examen directo mediante microscopia de contraste de fase, en el que se obtuvo una recuperación del 14,1 %, y por inmunofluorescencia el 57,8 % (tabla).
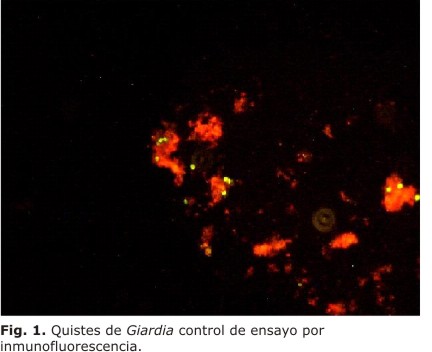
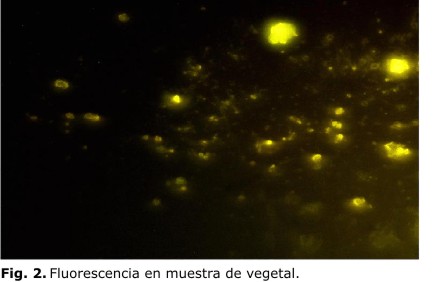
En este último procedimiento los quistes de Giardia y Cryptosporidium se observaron con una coloración fluorescente verde manzana (figura 1); sin embargo, se pudo apreciar que en algunas muestras que no presentaron parásitos se observó fluorescencia. En este aspecto se debe tener en cuenta que la diferencia es distinguible por la ausencia de la morfología característica de los quistes (figura 2), para lo que se recomienda la observación con aumento de 400x.
En las 10 muestras de ensayo analizadas, se observaron quistes de Giardia mediante inmunofluorescencia en dos tipos de vegetales: en col china y en zanahoria (figura 3). No se observaron quistes de Cryptosporidium.
DISCUSIÓN
En el estudio de parásitos patógenos para el hombre en vegetales se requieren procedimientos de alta sensibilidad y especificidad que permitan una correcta identificación en muestras que pueden tener una alta carga de contaminante, procedentes del medio ambiente de producción, así como la que puede adquirir durante el trasporte, la comercialización y el procesamiento.
Al realizar la comparación de los métodos empleados en este trabajo para la determinación de Cryptosporidium y Giardia en la lechuga inoculada, se pudo observar una mayor sensibilidad en la técnica de IFA, datos que se corresponden con otros estudios. Robertson y Gjerde informan en una investigación realizada en Noruega un recobrado de 67 % de quistes de Giardia inoculados en lechugas y fresas, analizadas mediante IFA.16 En una investigación realizada para la determinación de Cryptosporidium y Giardia en agua, por el método de sulfato de cinc, la recuperación de Giardia es de 5,9 % y por el método de IFA-Percoll-sacarosa la media de recuperación es de 74,1 %12
Es importante tener en cuenta que en las observaciones al microscopio de fluorescencia, las muestras en las que no existen quistes de Giardia y Cryptosporidium no deben exhibir fluorescencia verde manzana. Sin embargo, en algunas muestras de las estudiadas se observó esta coloración como resultado de componentes de algún tipo de vegetal; no obstante, es fácilmente distinguible de las formas parasitarias por la ausencia de la morfología característica de los quistes. Se han obtenido resultados similares en un estudio realizado para la determinación de parasito en agua en el que se emplea esta técnica y se observa que especies de algas muestran algún grado de fluorescencia.12
En dos de las muestras de ensayo analizadas se observaron quistes de Giardia mediante inmunofluorescencia. En la literatura se encuentra que los porcentajes de detección de este parásito son bajos. Robertson y otros detectaron quistes de Giardia en 10 muestras de 475 vegetales.16 En estudio realizado en Brasil, en 129 hortalizas se encontró 0,7 % de muestras con presencia de Giardia.17 T. Varela hace referencia en su trabajo a la determinación de 1,11 % de Giardia sp., en lechugas obtenidas en los campos de cultivo.9
El presente trabajo demuestra que el hallazgo de parásito en un número de muestras pequeña responde a la selección de las áreas de cultivo en zona rural, uso de agua no tratada, animales en el campo y factores relacionados con la presencia de parásitos en los vegetales.1-3
Se concluye que el procedimiento de inmunofluorescencia es más sensible que la observación directa y que existe presencia de quistes de Giardia en vegetales procedentes de aéreas de cultivo.
REFERENCIAS BIBLIOGRÁFICAS
1. Mejorando la seguridad y la calidad de frutas y hortalizas frescas: Manual de formación para instructores [Internet] Maryland: University of Maryland; 2002 [citado: 8 de Abril 2009]. Disponible en: http://groups.ucanr.org/UC_GAPs/documents /Other_Training_Resources2660.pdf
2. Rodríguez Jerez JJ. Contaminación de alimentos. La presencia de protozoos en los alimentos implica un riesgo para el consumidor. Observatorio de la Seguridad Alimentaria. Barcelona: Universidad Autónoma de Barcelona; 2002.
3. Depósito de documentos de la FAO. Departamento de Agricultura y Protección al consumidor. Capítulo 4: Aspectos higiénicos y sanitarios. En: López Camelo AF. Manual para la preparación y venta de frutas y hortalizas: Del campo al mercado [Internet]. Roma: FAO; 2003 [citado: 23 de abril de 2009]. Disponible en: http://www.fao.org/DOCREP/006/Y4893S/y4893s07.htm#bm07http://www.fao.org/DOCREP/006/Y4893S/y4893s07.htm#bm07
4. Centro de Estudios y Control de Contaminantes. Secretaría de recursos naturales y ambientales. Calidad microbiológica en productos Hortícola. Centro de Estudios y Control de Contaminantes [Internet]. Tegucigalpa M.D.C.: CESCCO/SERNA; 2009 [citado: 23 de abril de 2009]. Disponible en: http://www.cescco.gob.hn/informes/Calidad%20microbiologica%20de%20productos%20horticolas.pdf
5. Bier JW, Jackson GJ, Adams AM, Rude RA. Parasitic animals in foods. Chapter 19. In: Bacteriological Analytical Manual [Internet]. Maryland: EE.UU. Department of Health and Human Services. FDA U.S Food and Drug Adnministration; 2009 [consultado: 5 de junio de 2009; citado: 16 de junio de 2009]. Disponible en: http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/BacteriologicalAnalyticalManualBAM/UCM071468
6. Robertson LJ, Gjerde B. Factores que afectan la eficacia de la recuperación en el aislamiento de Cryptosporidium Oocysts y de los quistes de Giardia de los vehículos para el desarrollo estándar del método. Diario de la protección del alimento. 2001;64(11):1799-805.
7. Robertson LJ, Gjerde B, Campbell AT. Isolation of Cyclospora oocysts from fruits and vegetables using lecitin-coated paramagnetic beads. J Food Prot. 2000;63(10):1410-14.
8. Monge-Rojas R, Chinchilla-Carmona M, Reyes-Lizano L. Estacionalidad de parásitos y bacterias intestinales en hortalizas que se consumen crudas en Costa Rica. Revista de Biología tropical. 1996;44(2A):369-75.
9. Tananta Varela VI. Presencia de enteroparásitos en lechuga (Lactuca sativa) en establecimientos de consumo público de alimentos del distrito del Cercado de Lima [Tesis para optar por el título de Médico Veterinario]. Lima: Universidad Nacional Mayor de San Marco; 2002 [citado: 14 de marzo de 2005]. Disponible en: http://cnia.inta.gov.ar/helminto/Alimentos/tesis%20enteroparasitos%20en%20lechuga.pdf
10. Calvo M, Carazo M, Arias ML, Chaves C, Monge R, Chinchilla M. Prevalencia de Cyclospora sp., Cryptosporidium sp., microsporidos y determinación de coliformes fecales en frutas y vegetales frescos de consumo crudo en Costa Rica. ALAN. 2004;54(4):34-9.
11. Vilchez M, Scorza JV. Calidad sanitaria parasitológica de hortalizas cultivadas en La Puerta, municipio Valera, Estado de Trujillo, Venezuela. Bol Mal Salud Amb. 2007;47(2):56-9.
12. Butler BJ, Mayfield CI. Cryptosporidium sp. A review of the organism, the disease and implications for managing water resources. Waterloo, Canada: Centro para la Investigación de Groundwater Waterloo; 1996.
13. Mendoza D, Núñez FÁ, Escobedo Á, Pelayo L, Fernández M, Torres D, et al. Parasitosis intestinales en cuatro círculos infantiles de San Miguel del Padrón, Ciudad de La Habana, 1998. Rev Cubana Med Trop. 2001;53(3):189-93 [citado: 21 de febrero de 2011]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602001000300007&lng=es
14. Wördemann M, Polman K, Menocal HL, Junco DR, Collado MAM, Núñez FF, et al. Prevalence and risk factors of intestinal parasites in Cuban children. Tropical Medicine & International Health. 2006;11(12):1813-20.
15. Pelayo L, Nuñez FA, Rojas L, Furuseth HE, Gjerde B, Wilke H, et al. Giardia infections in Cuban children: the genotypes circulating in a rural population. Ann Trop Med Parasit. 2008;102(7):585-95.
16. Robertson LJ, Gjerde B. Occurrence of parasites on fruit and vegetables in Norway. J Food Prot. 2001;64(11):1793-8.
17. Takayanagui OM, Febronio LH, Bergamini AM, Okino MH, Silva A, Santiago R, et al. Fiscalização de hortas produtoras de verduras do município de Ribeirão Preto, SP. Rev Soc Bras Med Trop. 2000;33(2):169-74 [citado: 23 de febrero de 2011]. Disponible en: http://www.scielo.br/scielo.php?script=sci_isoref&pid=S003786822000000200002&lng=en&tlng=pt
Recibido: 26 de junio 2010.
Aprobado: 20 de octubre 2010.
Dra. Yamila Puig Peña. Instituto de Nutrición e Higiene de los Alimentos. Infanta 1158 e/ Clavel y Llinás, Centro Habana, CIP 10300. La Habana, Cuba. Correo electrónico: yamilapuig@infomed.sld.cu