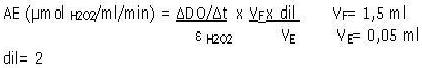Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica Electrónica
versión On-line ISSN 1684-1824
Rev. Med. Electrón. vol.35 no.2 Matanzas mar.-abr. 2013
ARTÍCULO ORIGINAL
Enzimas antioxidantes en la hiperglicemia e hiperlipidemia inducida por sacarosa en ratas Wistar
Antioxidant enzymes in saccharose-induced hyperglycemia and hyperlipidemia in Wistar rats
MsC Lic. Alcides González Gil I, MsC Yisel González Madariaga II, MsC Lic Danay Heredia Ruiz II,MsC Douglas Fernández Caraballo II, MsC Dra Marianela Ballesteros HernándezII
I Universidad de Ciencias Médicas de Matanzas. Matanzas, Cuba.
II Universidad de Ciencias Médicas de Villa Clara. Villa Clara, Cuba.
RESUMEN
El trabajo realizado evaluó la actividad de las enzimas antioxidantes catalasa y superóxido dismutasa en un modelo experimental de hiperlipidemia inducida por sacarosa en ratas Wistar, para lo cual se determinaron los niveles de glicemia y lípidos plasmáticos y los niveles de actividad enzimática específica de la superóxido dismutasa y la catalasa. Se produjeron incrementos significativos en los niveles de glicemia y triacilglicéridos relacionados con la dieta rica en sacarosa. Al cuarto mes del estudio se observó un incremento en la actividad de las enzimas en el grupo con dieta rica en sacarosa, solo con incrementos significativos para la catalasa. Se observó una fuerte correlación entre los niveles de triacilglicéridos del grupo estudio en el último mes de experimentación y los valores obtenidos en la actividad enzimática de la catalasa.
Palabras clave: estrés oxidativo, radicales libres, enzimas antioxidantes, catalasa, superóxido dismutasa.
ABSTRACT
The work we accomplished evaluated the activity of the catalase antioxidant and dismutase superoxide enzymes in the experimental model of saccharose induced hyperlipidemia in Wistar rats, for what we determined the glicemia and plasmatic fluids and the levels of dismutase superoxide and catalase specific enzymatic activity. There they were significant increases in glicemia and triacylglycerides related with a saccharose-rich diet. At the fourth month of the study we observed an increase of the enzymes in the group with a saccharose-rich diet, with significant increases only for the catalase. It was observed a strong correlation between the triacylglyceride levels of the studied group in the last month of experimentation and the values obtained in the catalase enzymatic activity.
Key words: oxidative stress, free radicals, antioxidant enzymes, catalase, dismutase superoxide.
INTRODUCCIÓN
El oxígeno que es imprescindible para la vida, puede ser también fuente de enfermedad a través de una producción incontrolada de radicales libres de oxígeno o especies reactivas de oxígeno (ERO) que dañan las macromoléculas y alteran los procesos celulares. (1,2)
La hiperglicemia sostenida favorece la autooxidación de la glucosa lo cual causa desbalance en los mecanismos de oxidación y antioxidación que conlleva a hiperproducción de radicales libres de oxígeno que en sus mecanismos de toxicidad oxidan lípidos proteínas, lo que causa disturbios en la mecánica metabólica del organismo, oxidación de lipoproteínas, inactividad enzimática y de vitaminas antioxidantes y cortes en la doble cadena del ácido desoxirribonucleico (DNA). (3,4)
Existe una relación entre los niveles de especies reactivas de oxígeno celulares y el incremento o descenso de las actividades de los mecanismos antioxidantes. El descontrol de todas estas especies reactivas de oxígeno puede, por lo tanto, afectar diferentes procesos esenciales del organismo, y constituirse en una de las piedras angulares en la génesis de distintas patologías donde la hiperglicemia constituye un signo distintivo y un detonante para el estrés oxidativo el cual puede ser evaluado mediante la utilización de marcadores biológicos. (4-6)
El sistema de defensa antioxidante de las células vivas, constituye un mecanismo adaptativo de gran relevancia, destacándose las actividades enzimáticas de la superóxido dismutasa (SOD), glutatión peroxidasa (GPx) y catalasa (CAT). (5,6)
Las enzimas antioxidantes son esenciales para las células aeróbicas, puesto que mantienen en niveles aceptables las concentraciones de especies químicas conocidas como radicales libres.
El uso de modelos resulta sumamente útil para discernir entre los posibles mecanismos fisiopatológicos involucrados en las alteraciones metabólicas presentes con la ingestión de dietas hiperglicemiantes, investigaciones realizadas demuestran que ratas normales alimentadas con dietas ricas en carbohidratos por un período de tiempo prolongado desarrollan hipertrigliceridemia e hiperglicemia con aumento del estrés oxidativo y ratas alimentadas por un corto período de tiempo con una dieta rica en sacarosa desarrollan dislipidemia, incremento de triglicéridos hepáticos y mayor secreción hepática de lipoproteínas de muy baja densidad (VLDL). (3)
Los eritrocitos están particularmente expuestos al estrés oxidativo debido a que son transportadores de oxígeno, tienen un elevado contenido de ácidos grasos y proteínas en sus membranas y poseen una elevada concentración de hemoglobina intracelular que puede actuar como promotora de procesos oxidativo, estando protegidos de las lesiones oxidativas a través de un sistema antioxidante bien desarrollado compuesto entre otros por las enzimas catalasa y superóxido dismutasa. Por esta razón, los eritrocitos constituyen un buen modelo experimental para el estudio de los mecanismos de lesión de los radicales libres y los mecanismos antioxidantes. (7-9)
Todos estos elementos nos permitieron realizar esta investigación con el objetivo de determinar la actividad de los sistemas antioxidantes enzimáticos compuestos por la catalasa y la superóxido dismutasa en un modelo experimental de hiperglicemia e hiperlipidemia inducida por sacarosa en ratas Wistar.
MÉTODOS
Se realizó un estudio experimental de casos y controles entre noviembre de 2010 y mayo de 2011 en un modelo experimental de hiperglicemia e hiperlipidemia inducida por sacarosa en ratas Wistar. El modelo fue establecido a partir de la administración de una dieta rica en sacarosa.
Se formaron dos grupos experimentales de 6 animales cada uno. Un grupo que solo consumió dieta convencional, el grupo dos consumió la dieta convencional más 35g de sacarosa disuelta en 100mL de agua de bebida durante un período de inducción de 4 meses.
Parámetros para evaluar daño oxidativo en eritrocitos
Toma de muestra de sangre: se realizó a la duodécima y décimo sexta semanas para cada uno de los animales tanto del grupo DRS como el grupo control.
Técnicas analíticas
Test de glicemia, triacilglicéridos y colesterol:
Para el procesamiento de las muestras se utilizo el equipo autoanalizador HITACHI 902 del Laboratorio Clínico del Hospital Universitario Arnaldo Milían Castro.
Evaluación Enzimas Antioxidantes.
Determinación de la actividad enzimática de Catalasa (CAT).
Reactivos: Hydrogen peroxide 30%. Disodium hydrogen phosphate anhydrous. Sodium dihydrogen phosphate monohydrate. Catalasa 20000 U. Código según catálogos Aldrich 2003-2004 y Espectrum 2002.
Procedimiento Ensayo blanco:
- Se añadió 1000 µL de buffer fosfato pH 7.0. + 500 mL de H2O2, tapamos la cubeta y homogenizamos invirtiendo la misma.
- Se tomó la D.O. a los 10 y 70 segundos de reacción a una longitud de onda de 240 nm
Ensayo muestra:
- Se añadió 950 µL de buffer fosfato pH 7.0 en la cubeta de cuarzo.
- Se adicionó 500 µL de H2O2 disuelto en buffer fosfato.
- Se vertió en la mezcla de reacción 50 µL de muestra (suero diluido ½), tapando la cubeta y homogenizamos invirtiendo la misma.
- Se tomó la D.O. a los 10 y 70 segundos de reacción a una longitud de onda de 240 nm.
Cálculo
Determinación de la actividad enzimática de Superóxido dismutasa (SOD)
Reactivos: Pirogalol 4mM, EDTA, Tris (hydroxymetyl) aminomethane 0.2 M, HCl 37 %. 0.2 M, Metanol, Cloroformo, Superoxide dismutase. Código según catálogos Aldrich 2003-2004 y SIGMA 2002-2003.
Procedimiento
Ensayo blanco de la reacción no inhibida:
- Se tomó en una cubeta de plástico 900 μL del buffer Tris-HCL y 50 µL de agua destilada, añadiendo entonces 50 µL de la solución de pyrogallol, dejando reaccionar por 10 segundos y seguimos el cambio en la absorbancia durante 1 minuto a 420 nm. Se repitió el procedimiento al menos tres veces; el valor resultante estuvo entre ΔD.O. = 0.020x0.025, este valor se tomó como D.O. del blanco.
Ensayo:
- Se mezcló en una cubeta de cuarzo 50 µL de suero, plasma, lisado de eritrocitos u homogenizado de tejido deslipidados.
- Se adicionó 900 μL de Tampón Tris - HCl pH 8.20.
- Se adicionó entonces 50 μL de la solución de pirogalol y después de 10 segundos de reacción determinamos la diferencia de D.O. en un minuto a 420nm.
Cálculo
La actividad enzimática se calculó mediante el empleo de la ecuación:


Procesamiento Estadístico de los Datos
El análisis estadístico de realizó aplicando la U de Mann Whitney y Wilconxon como estadístico de comparación. Se consideró significancia si p < 0.05 para ambos test. La correlación entre fue determinada aplicando el test de correlación de Pearson con un nivel de significación de p>0,05 y altamente significativo p>0,01.
RESULTADOS
En el experimento realizado al someter a las ratas Wistar a una dieta rica en sacarosa con el objetivo de inducir hiperlipidemia e hiperglicemia se constató que los valores de la glicemia, tomadas en cada uno de los tiempos del estudio, tuvo un incremento al comparar los valores de las ratas del grupo con dieta rica en sacarosa en relación a las ratas del grupo control, fundamentalmente al 4to mes de evaluar este parámetro cuando se produjeron variaciones significativas con una p=0,001. Tabla 1
Tabla 1. Resultados de los valores de glicemia de las ratas del grupo con dieta rica
en sacarosa (DRS) y las ratas del grupo control en t3 y t4
| Tiempo 3 | Tiempo 4 | ||
| Grupo | Glicemia 3 | Glicemia 4 | |
| DRS | Media | 3,992 | 6,917 |
| D.E. | 0,980 | 0,757 | |
| Control | Media | 3,675 | 5,350 |
| D.E. | 0,704 | 0,443 | |
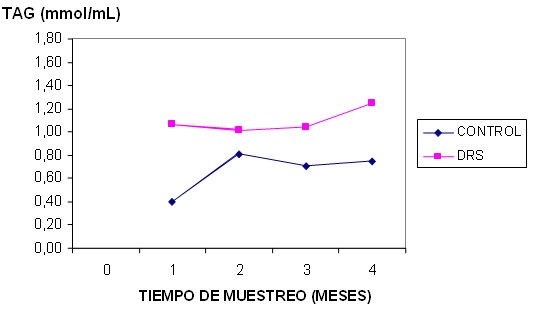
En los valores de colesterol y triacilglicéridos (gráficos 1 y 2) se presenta un aumento en el grupo de las ratas DRS en relación a las ratas del grupo control, en el análisis del colesterol al último mes los valores de significación del grupo DRS en relación al grupo control comienzan a acercarse a 0.05 (p=0.078). En el caso de los triacilglicéridos se constata al igual que la glicemia, que en el cuarto mes las diferencias entre ambos grupos se hacen significativas con una p=0.008.
Gráfico 1. Resultados de los valores de colesterol total en los grupos
estudiados durante el t1, t2, t3 y t4 del experimento
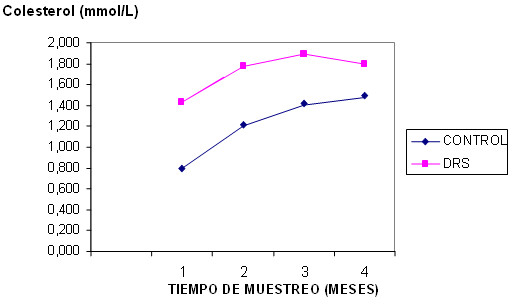
Gráfico 2. Resultados de los valores de triacilglicéridos en los grupos
estudiados durante el t1, t2, t3 y t4 del experimento
El efecto de las dosis de sacarosa en cada uno de los tiempos de estudio sobre las enzimas superóxido dismutasa y catalasa se presenta en la tabla 2.
En el tiempo 3 se produjo un aumento de la actividad de ambas enzimas en el grupo control en relación al grupo con dieta, sin embargo, en el tiempo 4 se observó un aumento en la actividad de ambas enzimas en el grupo con dieta rica en sacarosa, resultando solo en el caso de la Catalasa un incremento con significación estadística al cuarto mes del estudio p=0.019.
Tabla 2. Resultados de la actividad enzimática específica de las enzimas superóxido dismutasa
(SOD) y catalasa (CAT) de los grupos sometidos al experimento
|
| SOD | CAT | ||
|
| AEE t 3 AEE t 4 | AEE t 3 | AEE t 4 | |
| Dieta sacarosa | 0,058 0.033 | 0,197 | 0,958 | |
| Controles | 0,117 0,019 | 0,337 | 0,231 | |
AEE: Actividad enzimática específica.
El análisis estadístico para evaluar el grado de correlación entre las variables glicemia-lípidos plasmáticos y actividad enzimática mostraron que solo se observó una fuerte correlación con los valores de la catalasa al concluir el estudio y los TAG en este mismo período de tiempo (r=1).
DISCUSIÓN
Los sistemas antioxidantes son los que se encargan de revertir el daño oxidativo actuando a diferentes niveles: intracelular, a nivel de la membrana celular o extracelular.
La actividad de las enzimas del sistema antioxidante da una medida del mecanismo de protección, adaptación y recambio celular durante el daño oxidativo.(10) Si se tiene en cuenta que la hiperglicemia provoca daño a las diferentes células del organismo, y consecuentemente se genera gran cantidad de H2O2 por diferentes fuentes, es posible explicar las variaciones de la actividad de la SOD y de la CAT al cuarto mes de estar sometidas las ratas a la dieta rica en sacarosa.
En estudios realizados y que coinciden con los resultados que se presentan, en relación al comportamiento de la actividad de la catalasa, pueden apreciarse, bajo condiciones de daño oxidativo, cambios significativos en su actividad, lo que sugiere que los niveles de H2O2 se han elevado lo suficiente para activar a dicha enzima.(11) Bermúdez y colaboradores 12 observaron, que en el hígado de ratas sometido a un evento de isquemia/reperfusión, evento que produce un aumento en los radicales libres, un incremento en la actividad de esta enzima. La CAT tiene mayor afinidad por altas concentraciones de su sustrato, el H2O2 formado por dismutación del superóxido en presencia de la SOD. La alta concentración de H2O2 formado en las condiciones de hiperglicemia pueden conducir a un incremento en la actividad de la catalasa, lo que unido a un aumento de la síntesis de proteínas como mecanismo de adaptación de células de mamíferos frente al daño por H2O2, provocan un incremento en la expresión de la CAT, entre otras proteínas; mecanismo que bien pudiera explicar el por qué del aumento en la actividad de la enzima que protege contra el daño oxidativo producido en el modelo experimental de hiperlipidemia inducida por sacarosa. (11,12)
Mora y colaboradores (11) reportan en su estudio que las actividades de las enzimas SOD y CAT en ratas diabéticas por estreptozotocina están significativamente incrementadas comparadas frente al grupo control, en concordancia con los resultados encontrados en la investigación que se presenta al cuarto mes del estudio. La reducción de la actividad de SOD observada en este experimento en el mes cuatro del grupo DRS, también se ha reportado en otras investigaciones lo que puede asociarse a una inactivación debido a elevadas concentraciones de especies reactivas de oxígeno y a procesos de glicación no enzimática favorecidos por la hiperglicemia persistente en los cuadros de diabetes.(13)
En relación a los resultados encontrados en las ratas del grupo control resulta evidente una disminución de los valores de actividad enzimáticas al comparar los dos tiempos del estudio, en la actualidad se refiere que la senescencia normal se acompaña de un declinar de las defensas antioxidantes en sangre y en órganos de animales y humanos. La actividad de la CAT disminuyó con la edad al determinar alteraciones de los sistemas antioxidantes en ratas en correspondencia con lo observado en el presente estudio. (14,15)
La glucotoxicidad es responsable de manifestaciones tardías debido a la glicosilación no enzimática de proteínas y/o enzimas importantes en los procesos de eliminación de radicales libres tales como la catalasa, la superóxido dismutasa (SOD), la glutatión peroxidasa (GPx) y la glutatión reductasa. También se observa como consecuencia de la toxicidad glucídica, la generación exagerada de polioles y a la alteración del índice oxidación/antioxidación. (3)
Una exposición a elevadas concentraciones de glucosa sanguínea puede generar un incremento de las especies reactivas de oxígeno, provocando la activación de las primeras barreras antioxidantes de las células; dentro de las cuales se encuentran la SOD y la CAT. Sin embargo, cuando la exposición a altas concentraciones de glucosa es mantenida durante mucho tiempo, la situación parece cambiar. Esto pudiera deberse a que la hiperglicemia crónica mantiene también un estrés oxidativo crónico lo que pudiera llevar al agotamiento de estas enzimas, que se encontrarán completamente saturadas. Además este incremento persistente de especies reactivas de oxígeno, pudiera ser capaz de dañar múltiples moléculas de importancia biológica entre las que se pueden encontrar el ADN celular y las enzimas anteriormente señaladas. (5)
Los resultados obtenidos ofrecen evidencias que en el modelo experimental de hiperlipidemia y hiperglicemia inducida por sacarosa en ratas Wistar, al cuarto mes del estudio, se ha alcanzado un estado inicial de daño oxidativo, caracterizado por un moderado incremento de las ERO, que demuestran que existe un mayor ambiente oxidativo en los animales sometidos a la dieta rica en sacarosa, al observarse un incremento en la actividad de las enzimas antioxidantes.
Los autores arribaron a las conclusiones de que se produjo un aumento estadísticamente significativo de los niveles de glicemia y triacilglicéridos en las ratas sometidas a la dieta rica en sacarosa comparadas con las del grupo control, este comportamiento no fue observado en el caso del colesterol.
La actividad de las enzimas del grupo DRS aumentó en el cuarto mes del estudio, aunque solo se obtuvieron incrementos significativos para la catalasa.
Solo se observó una fuerte correlación entre los niveles de TAG del grupo DRS en el último mes de experimentación y la actividad enzimática de la catalasa.
REFERENCIAS BIBLIOGRÁFICAS
1. Romero Elías MJ, Figueroa Marin H, Morales Segura MÁ, Rojas Rubio A. El estrés oxidativo en la pared vascular y su potencialidad de manipulación terapéutica. Rev Cubana Invest Bioméd. [Internet]. 2009[citado 22 Oct 2012 ]; 28(3): 112-129. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03002009000300010&lng=es
2. Ugartondo Casadevall V. Caracterización de derivados polifenólicos obtenidos de fuentes naturales. Citotoxicidad y capacidad antioxidante frente a estrés oxidativo en modelos celulares [Tesis]. Barcelona; 2009[citado 22 Oct 2012].Disponible en: http://www.tesisenred.net/handle/10803/1837
3. Rosado Pérez J, Mendoza Núñez VM. Inflamación crónica y estrés oxidativo en la diabetes mellitas. Bioquimia [Internet]. 2007. 32(2): 58-69. [citado 22 Oct 2012 ]; Disponible en: http://www.medigraphic.com/pdfs/bioquimia/bq-2007/bq072d.pdf
4. Benítez Zequeira DE. Vitaminas y oxidorreductasas antioxidantes: defensa ante el estrés oxidativo. Rev Cubana Invest Bioméd [Internet]. Jun 2006[citado 19 Mar 2011]; 25(2): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_issuetoc&pid=0864-030020060002&lng=es&nrm=iso
5. Delgado-Roche L, Martínez-Sánchez G. Nuevos enfoques sobre la función de las lipoproteínas plasmáticas en las enfermedades de origen aterotrombótico. Rev Cubana Farm [Internet]. 2010; [citado 2012 Oct 22] 44(2): 245-258. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152010000200013&lng=es.
6. Fernández Hernández N, Martínez Sánchez IG, Cedeño Palenzuela ME. Función del peróxido de hidrógeno en el vitíligo. Rev Cubana Farm [Internet]. 2010 [citado 22 Oct 2012 ]; 44(3): 390-402. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152010000300014&lng=es.
7. González Madariaga Y, Boffill Cárdenas MA, Bermúdez Toledo D, Castillo Alfonso O, Martínez Montalbán CM, Martínez Bernal Y. Evaluación fotohemolítica in vitro de Cissus sicyoides L. y Achyranthes aspera L. Rev Cubana Plant Med [Internet]. 2010 Sep [itado 22 Oct 2012 ]; 15(3): 126-32. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962010000300004&lng=es.
8. González Madariaga Y, Boffill Cárdenas M, Bermúdez Toledo D, Castillo Alfonso O, Sánchez Álvarez C. Hemólisis producida por solanum melongena, cissus sicyoides, plantago major y achyranthes aspera. Medicentro [Internet]. 2009 [citado 18 Mar 2011]; 13(1). Disponible en: http://medicentro.vcl.sld.cu/paginas%20de%20acceso/Sumario/ano%202009/v13n1a09.php
9. González Madariaga Y, Boffill Cárdenas MA, Bermúdez Toledo D, Sánchez Álvarez C, Castillo Alfonso O. Evaluación del ensayo de fotohemólisis en el sistema de Clasificación ABO Rh+. Medicentro Electrónica [Internet]. 2007 [citado 20 Dic 2008]; 11(1). Disponible en:
http://medicentro.vcl.sld.cu/pdf/Sumario/Ano%202007/v11n1a07/evaluacion.pdf
10. Delgado Roche L, Martínez Sánchez G, Díaz Batista A. Determinación de marcadores de estrés oxidativo en pacientes con enfermedades cardiovasculares. Acta Bioquím Clín Latinoam [Internet ]. 2009 [citado 22 Dic 2012] ; 43(3): 307-13. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572009000300003&lng=es .
11. Mora AC, Aragòn DM, Ospina LF. Caracterización del estrés oxidativo en ratas Wistar diabéticas por estreptozotocina. Vitae [Internet]. 2009; [citado 22 Oct 2012 ]; 16(3): 311-19. Disponible en: http://scholar.google.com.cu/scholar?cluster=15925747513068027462&hl=es&as_sdt=0,5
12. Bermúdez A, Céspedes E, Romero A, Peña M, García JC. El estrés oxidativo en un modelo de isquemia y reperfusión en higado de ratas tratadas con aprotinina. Rev Latinoamer Tecnol Extracorp[Internet].2007[ citado 22 Oct 2012]; 14(4): 6-10. Disponible en: http://perfline.com/revista/volume14/v14n4/v14n4_01_art.pdf
13. Lu L, Lin Pu l, Jing Chen Q, Wang L, Peng W, Yan X, et al. Increased glycated albumin and decreased esRAGE concentrations are associated with in-stent restenosis in Chinese diabetic patients. Clin Chim Acta [Internet]. 2008; [citado 22 Oct 2012] 396(1): 33-7. Disponible en: http://www.sciencedirect.com/science/article/pii/S0009898108003227
14 . Muthuswamy AD, Vedagiri K, Ganesan M, Chinnakannu P. Oxidative stress-mediated macromolecular damage and dwindle in antioxidant status in aged rat brain regions: Role of l-carnitine and DL-alpha-lipoic acid. Clin Chim Acta. 2006; 368(1-2):84-92. Citado en PubMed; PMID:16480704.
15. McEwen JE, Zimniak P, Mehta JL, Reis RJ. Total antioxidant capacity is impaired in different structures from aged rat brain. Int J Dev Neurosci. 2005;23(8):663-71. Citado en PubMed;PMID:16298100.
Recibido: 4 de enero de 2013.
Aprobado: 21 de enero de 2013.
Alcides González Gil. Universidad de Ciencias Médicas de Matanzas. Carretera Central Km 101. Matanzas, Cuba. Correo Electrónico: alcidesgg@ucm.mtz.sld.cu
CÓMO CITAR ESTE ARTÍCULO
González Gil A, González Madariaga Y, Heredia Ruiz D, Fernández Caraballo D, Ballesteros Hernández M. Enzimas antioxidantes en la hiperglicemia e hiperlipidemia inducida por sacarosa en ratas Wistar. Rev Méd Electrón [Internet]. 2013 Mar-Abr [citado: fecha de acceso];35(2). Disponible en: http://www.revmatanzas.sld.cu/revista%20medica/ano%202013/vol2%202013/tema01.htm