INTRODUCCIÓN
A los tumores del estroma gastrointestinal (GIST, por sus siglas en inglés) le corresponde solo el 1 % de todas las neoplasias gastrointestinales; no obstante, son los tumores mesenquimatosos más frecuentes del tracto gastrointestinal. 1 La mayoría de los GIST son descubiertos de modo incidental, por lo que la verdadera prevalencia es desconocida. 2 Se plantea que solo de 3-5 % se identifican en localización duodenal, donde la segunda porción es la más común. (3
Los GIST se caracterizan por mutaciones del gen c-KIT o del receptor del factor de crecimiento derivado de plaquetas (PDGFR) y se originan en las llamadas “células de Cajal “, las cuales son el marcapaso del estroma gastrointestinal. (3
Con relación a su progresión hacia la malignidad, ocurre entre 10 % y 30 %, aquellos que se desarrollan en localizaciones diferentes al estómago son los de mayor potencial. 2 La malignidad también se relaciona con tres variables, como son tamaño de tumor (invasivo >10 cm), la probabilidad de metástasis, influida por el tamaño del tumor, y finalmente el índice mitótico (IM), con impacto sobre la supervivencia. (4
En los últimos años, mucho se ha progresado en el conocimiento de la biología y comportamiento clínico de los GIST y su manejo se ha modificado en concordancia con los avances alcanzados; sin embargo, dado a lo poco frecuente de su localización duodenal y sus características, su manejo óptimo no ha sido bien esclarecido, 5 por lo que presentar la estrategia quirúrgica de manejo de un nuevo caso de GIST a nivel de cuarta porción de duodeno representa un reto digno de divulgar a la comunidad científica.
PRESENTACIÓN DEL CASO
Hombre de 62 años de edad, admitido en el Servicio de Medicina del Hospital Militar Principal/Instituto Superior (HMP/IS), de la ciudad de Luanda, por presentar -según refirió- decaimiento marcado y "masa abdominal izquierda", poco dolorosa, de crecimiento progresivo, en el transcurso de 2020. Pérdida ponderal que no puede precisar. Sin historia de coloración amarilla de piel y mucosas, vómitos de alimentos o sangre, ni alteraciones del hábito intestinal.
En el momento de su ingreso presentaba cuadro febril agudo y anemia. En la pesquisa se diagnosticó positivo a la Covid-19 (enero 2021) por lo cual fue trasladado al Servicio de Infectología. Pasado el cuadro infeccioso retornó al Servicio de Medicina.
Como antecedentes personales, refirió haber sido intervenido quirúrgicamente mediante una laparotomía en 2008 por hemoperitoneo, sin más detalles. Negó hábitos tóxicos y alergias. Negó haber recibido transfusión sanguínea.
Al examen físico
Paciente con mucosas hipocoloreadas.
Parámetros vitales: TA 127/80 mmHg, FR: 20 rpm, FC: 80 pulsaciones por minuto, Temperatura axilar 36 0C.
Aparato respiratorio: expansibilidad torácica conservada, murmullo vesicular conservado en ambos campos, sin presencia de ruidos adventicios.
Aparato cardiovascular: tonos cardíacos rítmicos, sin soplos ni extrasístoles.
Abdomen: incisión media supraumbilical. Se visualiza deformidad en el abdomen con abombamiento y deformidad del hemiabdomen izquierdo.
Se palpa masa de consistencia firme, elástica y poco móvil de superficie lobulada, adherida a planos profundos. Ocupa región mesogástrica e hipocondrio izquierdo, y se extiende por el flanco izquierdo hasta alcanzar la fosa ilíaca izquierda con contacto lumbar.
Auscultación: ruidos hidroaéreos presentes.
Tacto rectal: esfínter anal normotono, sin evidencias de lesiones externas, no presencia de tumor, próstata G II de superficie lisa y regular.
Extremidades: sin detalles a resaltar.
Pruebas realizadas al ingreso
Hemoglobina (Hb) 7,5 g/dl; glucemia 75,5 mg/dl; creatinina sérica 0,98mg/dl; TGP 11 U/L; TGO: 7,0 U/L; F. alcalina 57,3 UI/L; bilirrubina total 0,36 mg/dl.
Bilirrubina directa: 0,19 mg/dl; pesquisa de plasmodium:negativa.
Coagulograma completo
Tiempo de coagulación: 7,5 min; tiempo de sangrado. 2,0 min; coágulo retráctil; conteo de plaquetas: 200x109 /L
Grupo sanguíneo: 0; Factor RH (negativo)
Electrocardiograma: ritmo sinusal
Radiografía de tórax: sin alteraciones de realce.
Ecografía abdominal: se observa debajo del polo inferior del riñón izquierdo masa heterogénea predominantemente hipoecogénica con calcificaciones en su interior, mide 132,5x104,4 mm en su eje mayor.
Ectasia del árbol pielocalicial izquierdo por probable compresión extrínseca.
No se identifican lesiones a nivel de hígado.
Tomografía axial computadorizada (TAC) de abdomen con contraste: como detalle sobresaliente se informa la presencia de una masa voluminosa heterodensa de contornos irregulares en el polo inferior del riñón izquierdo que mide 13,8x9,4 cm en sus ejes mayores axiales, áreas hipodensas sugestivas de necrosis. (Fig. 1 y Fig. 2).
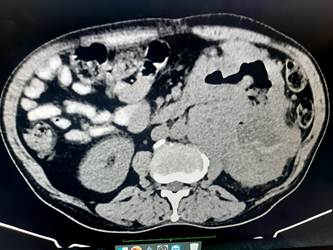
Fig. 1 Topografía de flanco izquierdo. Retroperitoneal y anterior al riñón izquierdo se observa masa heterodensa voluminosa de contornos irregulares y centro hipodenso (sugestivo de necrosis). Compresión de uréter izquierdo, que ocasiona ligera hidronefrosis. Plano de clivage con músculo psoas, riñón y estructuras vasculares vecinas.
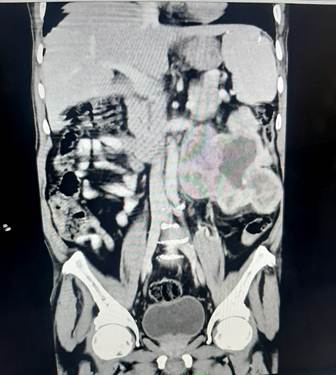
Fig. 2 Masa tumoral que se extiende por debajo del riñón y llega a la línea media, en su extremo inferior alcanza la fosa ilíaca izquierda. Moderada ureterohidronefrosis en riñón izquierdo, probablemente por compresión externa.
Colonoscopia: hemorroides internas grado I. Divertículos en colon sigmoides.
Endoscopia digestiva alta: proceso anarcoproliferativo de duodeno distal. Esofagitis distal grado I. Pangastritis eritematosa erosiva ligera.
Toma de material para biopsia (se envían cinco fragmentos).
Informe de anatomia patológica.
Microscópico: examen histológico con muestra de tejido conjuntivo constituido por células de aspecto epiteloide y fusiforme entrelazadas y focos de congestión.
Sin figuras de mitosis en 10 campos. IM bajo. El hallazgo histológico se corresponde con un GIST. (Examen B-21-285)
Diagnóstico operatorio: tumor GIST duodenal. Clasificación de TNM T4 N0 M0
Acto operatorio
Se instauró anestesia general endotraqueal, dosis inicial de antibióticos y heparina a dosis profiláctica.
Paciente en decúbito supino, se realizó incisión abdominal media supra e infraumbilical resecando cicatriz previa. Se revisó cavidad abdominal después de liberar múltiples bridas y adherencias entre las asas intestinales. No se identificaron metástasis peritoneales ni hepáticas.
Se revisó y palpó primera y segunda porción del duodeno en su cara anterior supramesocólica. Se levantó el epiplón mayor junto con el colon transverso y se observó la cara anterior de tercera y cuarta porción duodenal, esta última alcanzada por tumor. Se identificaron los vasos mesentéricos superiores que se encuentran libres de infiltración tumoral.
Se define este paciente como un caso de GIST primario con infiltración de órgano adyacente. Se visualiza una masa tumoral que tiene como punto de origen la cuarta porción del duodeno y engloba las primeras asas yeyunales prácticamente cerrando la luz de las mismas. Se libera el ligamento fibromuscular de Treitz, en su parte superior, con una zona de adherencias del tumor al borde inferior del páncreas, se identifican las estructuras vasculares de la región, disección laboriosa. La maniobra se realizó de izquierda a derecha.
La masa tumoral no compromete estructuras vasculares importantes (vena mesentérica inferior) por lo que se decide continuar con la resección, la cara posterior del tumor se expone encontrándose un plano laxo avascular. La disección se extiende hasta lograr un adecuado margen de resección proximal del tumor sin sobrepasar los vasos mesentéricos.
En su descenso en el retroperitoneo, el tumor engloba al uréter izquierdo y presenta varias cavidades con material necrótico, y alcanza la fosa iliaca izquierda. (Fig. 3).
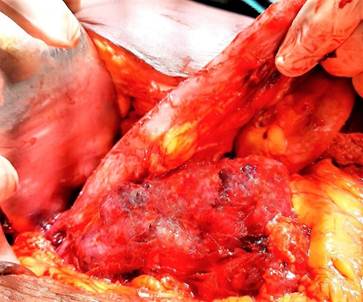
Fig. 3 Masa tumoral que parte de la cuarta porción del duodeno y engloba las primeras asas yeyunales.
Con disección cortante y roma se procede a resecar la continuidad del duodeno en su tercera porción y cierre en dos planos, plano interno surget de la mucosa y puntos separados en la seromuscular, con aguja atraumática e hilo sintético reabsorbible de Vycril 000. Previamente liberada la masa en contacto con páncreas, se continúa la disección respetando la vascularización del colon descendente y sigmoides.
Después de tres horas de cirugía el paciente mostró señales de inestabilidad hemodinámica, por lo que se decidió acortar el acto operatorio. Se resecó una porción de la masa tumoral restableciéndose la continuidad del tránsito intestinal, en busca de funcionabilidad del tracto gastrointestinal, mediante una duodeno-yeyunostomía latero-lateral retrocólica, duodeno en su segunda porción y asa yeyunal que se asciende después de haber obtenido 5 cm de yuyuno distal libre de tumor, se cierra el cabo yeyunal que se asciende en su porción terminal como parte del procedimiento. Después de revisar la hemostasia, se colocan drenajes por contra abertura y se cierra por planos. (Fig. 4).
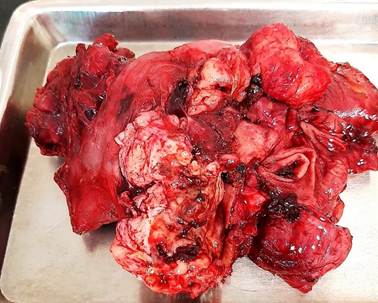
Fig. 4 Pieza operatoria. Se identifica masa tumoral que engloba asas yeyunales, áreas de hemorragia, necrosis y ulceración tumoral.
El curso posoperatorio transcurre con evolución satisfactoria hasta el quinto día, en que se constata salida de contenido oscuro, espeso por el drenaje abdominal de fosa ilíaca izquierda. Se reintervino el paciente y se encontró una de las cavidades del tumor residual con tejido necrótico y pus. Se realizó lavado amplio de la cavidad y se restablecieron los drenajes abdominales.
Dos días después de la reintervención comenzó la salida de líquido lechoso, espeso e inodoro que llevó al diagnóstico de fístula pancreática, aunque la dosificación de amilasa en el líquido no resultó una prueba útil.
El débito de la fístula era inferior a los 200 mls en 24 horas y no interfirió con la evolución posoperatoria, por lo que se decidió esperar la recuperación del paciente y solucionar la fístula en la cirugía definitiva.
En la cirugía final se resecó el resto de la masa tumoral en fosa ilíaca izquierda y flanco, resección del riñón izquierdo, cuyo uréter se encontraba englobado dentro del tumor en aproximadamente 5 cm, control del área pancreática que alimentaba la fístula en el borde inferior del órgano mediante puntos separados con material no absorbible previa resección de la cola de páncreas. Hemostasia, revisión de la cavidad, drenaje del área quirúrgica y cierre de la pared abdominal con puntos de seguridad. Se envió la pieza al Departamento de Anatomía Patológica.
El curso posoperatorio transcurrió durante las primeras 72 h en la Unidad de Cuidados Intensivos sin eventos significativos. Se restableció vía oral a las 24 h con líquidos y en días subsiguientes, sólidos. Deambulación precoz, uso de analgésicos y antibióticos. Se mantuvo el tratamiento con heparina. Después de 10 días de internamiento se dio alta hospitalaria y turno para consulta de seguimiento y consulta de Oncología y comenzar tratamiento con mesilato de Imatinib, teniendo en consideración aspectos como estadio clínico (T4N0M0) de la enfermedad, rotura tumoral, e IM. Al año, el paciente se encuentra sin evidencia de enfermedad recidivante.
DISCUSIÓN
El GIST continúa siendo un raro tipo de cáncer, se estudia cada vez más en los últimos tiempos. Su incidencia en las series reportadas es de 4-10 casos/millón de habitantes/año. Afecta a hombres y mujeres en similar proporción, con una mediana que oscila entre 55 y 65 años.. (2 El paciente que se reporta en este estudio tiene 62 años.
Su localización es predominantemente en el estómago (60 %-70 %), intestino delgado (25 %-35 %), y colon (10 %). Solo 1-5 % de los GIST ocurren en el duodeno, como sitio más común la segunda porción del duodeno. 6
La presentación clínica está en relación con su localización y tamaño. Los GIST de pequeño tamaño suelen ser asintomáticos y se diagnostican de forma incidental. El caso que presenta el autor fue objeto de estudio por tumor abdominal y anemia (probablemente asociada a sangrado oculto). Los tumores voluminosos pueden presentarse con sangrado digestivo y anemia, así se presentó el GIST duodenal que reportan Losada H y col.. (7
Los elementos para realizar un diagnóstico clínico son poco específicos por lo que se retrasa en ocasiones; sin embargo, se reiteran en el caso de GIST de intestino delgado, dolor inespecífico (74 %), masa palpable (72 %), sangrado u obstrucción/suboclusión intestinal (44 %), como se pudo identificar en el presente caso al examen físico con masa palpable y en el acto operatorio prácticamente una oclusión intestinal; de modo excepcional, se puede presentar perforación intestinal (0,8 % al 3 %). 7
En el presente caso predominó la masa abdominal, por lo que el ejercicio diagnóstico clínico fue encaminado a diferenciar las causas de las lesiones abdominales ocupantes de espacio que se expresan como un aumento de volumen. No obstante, el principal problema al evaluar un GIST es determinar si la masa tumoral puede ser resecable.
Desde el punto de vista práctico, pueden agruparse las masas intraabdominales en cuatro grupos: masas intraperitoneales, masas retroperitoneales, masas pélvicas y masas de la pared abdominal, 8 su descripción rebasa el propósito del presente trabajo.
El apoyo de las pruebas diagnósticas llevó a corroborar la hipótesis de que estábamos frente a un paciente portador de un GIST duodenal.
La TAC con contraste, como prueba de elección en pacientes con sospecha de masa abdominal y el GIST es uno de ellos, está en la primera línea de las investigaciones a realizar en pacientes con GIST de gran tamaño. Se identifican como masas grandes, de crecimiento exofítico, heterogéneas y vascularizadas, que pueden tener áreas de hemorragia, necrosis, y quistificación.
En la enfermedad avanzada se identifican: masas irregulares de densidad heterogénea, metástasis peritoneales y hepáticas. Sin embargo, el TAC es incapaz de diferenciar entre las adhesiones inflamatorias y la afectación de órganos vecinos. En el paciente de estudio, evidentemente, se identificaron múltiples adherencias de la masa tumoral e infiltración de las primeras asas yeyunales. En cualquier caso, la TAC ayuda en el diagnóstico y a determinar el estadio de la enfermedad.
Dos estudios que no se deben dejar de mencionar son la resonancia magnética nuclear (RMN) y la tomografía de emisión de positrones (PET, por sus siglas en inglés). La primera utiliza campos magnéticos en lugar de radiaciones, mientras que la PET tiene la ventaja de dar información adicional sobre el tumor. Los tumores consumen azúcar más rápidamente que las células normales, y lo hacen más rápido según va progresando la enfermedad. Por medio de la inyección de azúcares marcados radiactivamente se puede observar tanto el tamaño del tumor como la posible progresión de la enfermedad. 2
Sirve para diferenciar tumores activos de fibrosis y recidivas de necrosis. El PET es idóneo para valorar las respuestas tempranas al tratamiento. Es una prueba cara y tiene una menor disponibilidad que el TAC.
Por su parte, el ultrasonido abdominal (US) no es el primer método usado para visualizar GIST; no obstante, es útil si el tumor es mayor de 5 cm. Hay factores que afectan la confiabilidad de la ecografía como una modalidad diagnóstica, tales como la presencia de necrosis, ulceración, aire en el intestino y la experiencia del operador. 2
La ecografía endoluminal (EUS) es una prueba diagnóstica con mayor rendimiento que el US convencional, ayuda a determinar el origen de los tumores GIST de localización duodenal, en segunda porción en la muscularis mucosae o cuarta porción en la muscularis propia. No hay gran disponibilidad de EUS, en el centro donde trabaja el autor no se cuenta con ella.
La EUS aporta información como la identificación de imágenes hipoecoicas, masas, localización, tamaño, forma y vascularización. Permite tanto la toma de biopsias por aguja fina como toma de muestras para el diagnóstico histológico antes del planeamiento de la cirugía, también en la planificación de la neoadyuvancia o la terapéutica paliativa en general. 2
Un estudio reciente de 142 pacientes con el diagnóstico de GIST, muestra que la EUS tiene mayor sensibilidad y valor predictivo positivo que la TAC e RMN (P = 0.047 and P = 0.005) respectivamente. También evidencia que la toma de biopsia con aguja fina mediante EUS proporciona mayor valor para el diagnóstico de GIST que la biopsia por endoscopia convencional (73 % vs 33,3 %, P = 0.006). 9
Según interpreta Tian Lim, 10 estos resultados con las pruebas diagnósticas quedan explicados por la calidad de los equipos de diagnóstico y la experiencia creciente de los operadores durante años.
Con relación al estudio de la pieza en Anatomía Patológica, hoy día se utiliza un marcador inmunohistoquímico (CD117) de manera sistemática para distinguir entre los GIST y otras neoplasias mesenquimales que afectan al tracto gastrointestinal (tumores no-GIST). 7
Se acepta una sobreexpresión de la proteína KIT (CD117) como marca fundamental en tumores provenientes de las células intersticiales de Cajal, y parece claro que la positividad a CD117 es diagnóstico en este tipo de lesiones en un 95 % de los casos, con un mejor rendimiento que otros tipos de marcadores como el CD34, cuya positividad es del 60 %. Un 5 % de los GIST es negativo para c-KIT, y de ellos, un 90 % tiene mutaciones de KIT. 7 Diversos autores abordan estos aspectos de inmunohistoquímica de modo más detallado. 11
Tratamiento quirúrgico. Estrategia
La opción de resección quirúrgica de un GIST duodenal varía en creciente complejidad dependiendo de la localización, tamaño y estructuras que se encuentren comprometidas. El tratamiento curativo es la resección completa del tumor.
La afección que afecta al duodeno distal a la papila mayor se trata mediante una resección duodenal distal (RDD), la que puede ser total o segmentaria. La RDD requiere un detallado conocimiento anatómico de la zona, siendo frecuente la necesidad de una adecuada exposición del retroperitoneo a través de las maniobras de Kocher y de Cattell-Braash. Sus indicaciones son variadas, siendo lo más frecuente la patología neoplásica, principalmente GIST duodenal. 12
Con menor frecuencia se describen los adenocarcinomas duodenales, pero éstos habitualmente son de diagnóstico tardío, lo que limita su resecabilidad. Otros escenarios para RDD son los tumores primarios de órganos vecinos que invaden el duodeno por contigüidad, cirugía de urgencia por trauma y complicaciones vasculares como fístulas aorto-duodenales. 12
En el presente caso se realizó resección del tumor duodenal invasivo, de más de 10 cm en su diámetro mayor, primeras asas yeyunales y nefrectomía izquierda, órgano cuyo uréter estaba comprometido por infiltración de la masa tumoral y determinaba hidronefrosis renal, aunque autores como Ahmed et al. consideran que rara vez los GIST invaden los tejidos circundantes. 13
La resección quirúrgica es un pilar fundamental en el tratamiento del GIST duodenal, y en el caso del autor, como complicación relacionada con el procedimiento, se produjo una fístula pancreática que resultó de bajo gasto producto del contacto de la masa tumoral con el órgano y la lesión del mismo durante la disección. Ochoa et al 12 atribuyen la morbimortalidad al acto operatorio que incluye resección de la cuarta porción de duodeno a la posibilidad del desarrollo de una fístula duodenal o pancreática.
En el paciente que se relata, la recepción en bloque no fue posible por el cuadro de inestabilidad prolongada durante el transoperatorio. Resultó un acto operatorio difícil con abundante sangrado. Hubo que redefinir el objetivo de la intervención, de lograr la resección total de la masa tumoral y tomar una decisión que permitiera conservar la vida del paciente.
Hay dos preceptos oncológicos que de una manera objetiva se enuncian: la resección de toda la enfermedad visible con la extirpación completa, incluida la seudocápsula que lo recubre, así como órganos que haya invadido la neoplasia, y evitar la rotura del tumor. 12 Se considera que se producen micrometástasis peritoneales con la ruptura de la lesión tumoral. 14
Thacoor A, 15 concluye que la rotura del tumor redujo la mediana de supervivencia de 46 a 17 meses, una cifra comparable a la mediana de supervivencia después de una resección incompleta (21 meses).
La linfadenectomía radical en estos pacientes no resulta una intervención necesaria de manera rutinaria, pues la frecuencia de metástasis regionales es inferior al 5 %.12
La derivación que se realizó en este caso, y logró el objetivo de garantizar el tránsito gastrointestinal, fue una duodeno-yeyunostomía latero-lateral (duodeno segunda porción) con cierre de la tercera porción del duodeno, resultó factible técnicamente y es una experiencia a señalar como una opción viable.
Las series revisadas no aportan evidencias suficientes para apoyar un tipo de reconstrucción sobre la otra, y en general, es determinada por cada centro o caso según las condiciones del paciente.
Melo C. et al, (16 en un paciente con GIST de cuarta porción de duodenal, en que este se tornó inestable hemodinámicamente por presentar sangrado digestivo que conllevó a realizar una laparotomía de urgencia, logró resecar el tumor en el acto operatorio y realizó una de las opciones por las cuales el cirujano puede optar y en su paciente resultó una resolución exitosa, una anastomosis latero-lateral entre tercera porción duodenal y yeyuno.
En una serie reciente 10 de GIST en tercera y cuarta porción de duodenal, la continuidad se realizó termino-lateral, latero-lateral y termino-terminal- a partir del duodeno remanente en tercera porción.
Las derivaciones duodenales son siempre operaciones de necesidad muy poco utilizadas, porque la mayor parte de los cirujanos prefieren, ante un obstáculo duodenal (estenosis, neoplasias) que no puede resecarse, efectuar como más segura una gastro-yeyunoanastomosis.
En lesiones pequeñas y benignas, es posible realizar resecciones en cuña que obtengan un cierre adecuado a través de sutura primaria, o derivaciones con parche de yeyuno o en Y de Roux, sin obstruir el lumen ni la vascularización. Para lesiones mayores y etiología maligna, la resección debe tener una extensión mayor. 10)
Hay experiencias aisladas de resección de tumor GIST por cirugía laparoscópica y técnicas robóticas.10
El paciente de estudio presentaba una combinación de varios factores importantes en el pronóstico, tumor de más de 10 cm en su diámetro mayor, e infiltración de órganos vecinos, asas yeyunales y uréter, rotura del tumor por factores técnicos ya mencionados. Los GIST muy malignos suelen ser grandes y sintomáticos en el momento del diagnóstico. 17)
Un tercer factor a considerar es el IM, muy bajo (IM < 5 por campo) en este paciente, la mitosis (por 20 o 50 campos de alta potencia, según el tamaño del campo del microscopio o por campo de 5 mm2) estos tres elementos se consideran factores pronósticos independientes después de la resección completa del tumor. 18
Los GIST son tumores potencialmente invasivos que metastatizan, incluso 30 años después del diagnóstico. La capacidad de recidiva se cifra en un 50-60 % de los casos. El GIST metastásico es siempre fatal y se presenta con diseminación abdominal, preferentemente hepática y peritoneal. La supervivencia a los 5 años es del 54 % y se observa respuesta a la quimioterapia en menos del 5 % de los casos. 19
Un factor pronóstico médico-dependiente es la radicalidad quirúrgica, y así se distinguen los R0 (tumores resecados sin evidencia de tumor macroscópico ni microscópico en los bordes), R1 (tumores con evidencia de tumor microscópico) y R2 (evidencia de tumor macroscópico). 19
Se plantea que en pacientes con cirugía R1 se puede realizar una reintervención, pero ha de valorarse la pérdida de funcionalidad de una cirugía más radical y debe compartirse esta decisión con el paciente. 20
No obstante, en un metaanálisis reciente, los autores se proponen determinar la influencia de márgenes microscópicos de tumor (R1) en el pronóstico, aspecto que se considera como una variable confusora. Estos autores determinan en sus conclusiones que el estado R1 no influye en la sobrevida de los pacientes con GIST, por lo que la reintervención no es necesaria cuando el margen microscópico evidencia tumor. 21
Podemos concluir que el manejo de un paciente portador de un tumor GIST de localización atípica representa un reto para el cirujano actuante, como miembro del grupo multidisciplinar, pues la única conducta verdaderamente resolutiva es la extirpación radical del tumor, influenciada por su tamaño, localización y extensión, el estado general del paciente para soportar el acto operatorio y estrategia quirúrgica individualizada para lograr funcionabilidad del tracto gastrointestinal, y recuperación exitosa.














