Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Habanera de Ciencias Médicas
versión On-line ISSN 1729-519X
Rev haban cienc méd v.7 n.3 Ciudad de La Habana jul.-sep. 2008
Instituto Nacional de Nefrología Dr. Abelardo Buch López.
EQUIVALENCIA TERAPEUTICA ENTRE IOR® EPOCIM Y EPO SIN ALBUMINA EN PACIENTES CON INSUFICIENCIA RENAL CRONICA
EN HEMODIALISIS
* Jorge F.Pérez-Oliva. Calle O Núm. 305 entre 3ª y 5ª. Ciudad de La Habana. Teléfono: 8810908. jfpolivd@infomed.sld.cu
**Belkis Morejón. Calle 26 y Boyeros.Teléfono: 8812413.
docimef@infomed. sld.cu
*** Alicia Vargas. Mercado Núm.152 (altos) entre Arroyo y Manglar. Ciudad de La Habana.Teléfono: 8786606. alicia@cencec.sld.cu
****Marcia Lagarde.Calle 23 esquina a16 (altos) El Vedado. Ciudad de La Habana. Teléfono: 8338001. mlagarde@infomed sld.cu
*****Ibis Mendoza. Calle 200 esquina a 21. Reparto Atabey. Municipio Playa.
Teléfono: 2717345. ibis@cencec.sld.cu
******Carmen Elena Viada. Calle Núm.216 esquina a 15. Reparto Atabey. Municipio Playa. Ciudad de La Habana. Teléfono:2715057.
* Especialista Segundo Grado en Nefrología. Profesor auxiliar e Investigador auxiliar.
** Especialista Primer Grado en Nefrología. Instructor.
*** Alicia Vargas. Licenciada en Ciencias Farmacéuticas. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) .
**** Especialista Segundo Grado en Hematología Profesor auxiliar e Investigador auxiliar.
***** Master en Ciencias Farmacéuticas. Centro Nacional Coordinador de Ensayos Clínicos (CENCEC).
******Master en Ciencias Estadísticas y Probabilidades.Centro de Inmumología Molecular.
RESUMEN
Ensayo Clínico Fase II-III, controlado, monocéntrico, a doble ciegas y aleatorizado, para evaluar la eficacia y seguridad del tratamiento con EPO Sin/Albúmina con un nuevo estabilizante y determinar la equivalencia terapéutica de esta formulación con el ior® EPOCIM, en enfermos hemodializados. Se incluyeron 60 pacientes, en hemodiálisis iterada 3 veces por semana, Kt/V mayor 1.2, los que mantuvieran niveles iguales o superiores de 10 g/l de Hemoglobina durante al menos 3 meses, tratados con ior Ò EPOCIM, divididos en 2 grupos, con 30 pacientes cada uno. El primero, recibió con EPO S/A la dosis habitual de Eritropoyetina y el segundo, con ior® EPOCIM, ambos por vía subcutánea en dosis 1:1 sin modificación de la dosis, evaluando la respuesta hematológica (hemoglobina/ hematocrito) de ambos productos. Los grupos de tratamiento fueron homogéneos, según las variables analizadas: la edad media para el grupo EPO SA fue de 43.8 años, mientras para el grupo ior® EPOCIM fue de 46.8 años; la media del peso seco fue de 61.1 Kg vs. 60.4 Kg. La dosis de Eritropoyetina administrada solo fue variada en dependencia del cambio de peso del enfermo entre la dosis al inicio y al final de las 12 semanas: EPO S/A 7482.9 vs. 7485.4 UI/Kg/semanal y ior â EPOCIM 8045.3 vs. 8018.6 UI/Kg/semanal. Los resultados iniciales del hematocrito (35.9% vs. 36.6%) y de la hemoglobina (11.6 vs. 11.7 g/dl) mostraron que las medias del hematocrito, para ambos grupos, al final del estudio, tuvieron una diferencia inferior a 3 % (33.8 vs. 34.5) y en la hemoglobina inferior a 1 g/dl (10.6 vs. 10.7), con una disminución ligera al final del tratamiento similar para ambos grupos. Los eventos adversos detectados fueron: dolor en el sitio de la inyección (63 %), hipotensión (53.3 %), calambre (31.7 %) y cefaleas (15 %) atribuibles al proceder de hemodiálisis, con un perfil de seguridad propio de enfermos en hemodiálisis. No se observaron diferencias estadísticas significa-tivas entre los grupos (p=0.5938). Los resultados permiten sugerir la equiva-lencia terapéutica entre EPO S/A y EPOCIM. Se requiere la extensión en tiempo del fármaco; vigilancia de este nuevo producto para establecer sus efectos a largo plazo.
Palabras clave: anemia, eritropoyetina, hemodiálisis, insuficiencia renal crónica, ensayo clínico.
INTRODUCCION
La anemia es un padecimiento común entre los pacientes con Insuficiencia Renal Crónica (IRC). 1 Se asocia con anomalías fisiológicas, entre ellas, la disminución de la llegada y utilización de oxígeno tisular, 2, 3 incremento del gasto cardíaco, hipertrofia ventricular, insuficiencia cardíaca congestiva, 4, 5 disminución de agudeza mental y cognitiva, 6 alteraciones endocrinas y sexuales, 7, 8, 9, 10 y trastornos de la respuesta inmunológica. 11, 12 Desempeña un importante papel en el lento crecimiento en pacientes pediátricos . 13 Todo lo anterior reduce la calidad de vida, 14 interfiere con la rehabilitación y reduce la supervivencia de los pacientes con IRC-T. 15
La etiología primaria de la anemia asociada a la IRC es la insuficiente producción de la hormona renal Eritropoyetina (EPO). 16 Adicionalmente, existen otros factores que contribuyen a esto y la agravan en la etapa de tratamiento dialítico, como son la deficiencia de hierro, 17 el hiperparatiroidismo, 18 las enfermedades inflamatorias crónicas y agudas, 19 la toxicidad por aluminio, 20 deficiencia de folatos, 21 hemolisisrelacionada con soluciones de dializado inadecuadas, 22 pérdidas de sangre relacionadas con la hemodiálisis, 23 malnutrición y subdiálisis.
El tratamiento con EPOr-Hu se ha convertido en la terapia más racional y revolucionaria para la anemia de la IRC-T. 24, 25, 26 En Cuba, se emplea desde 1998 con la realización del ensayo clínico original que permitió su registro nacional, 27 que luego en el 2000 se generalizó 28 a todo el país de modo gratuito para todos los enfermos en tratamiento sustitutivo de la función renal que la requieran y comercializada bajo el nombre de ior® EPOCIM por el Centro de Inmunología Molecular (CIM) y, a partir de 2004, según estrategias del Ministerio de Salud Pública con otro producto desarrollado por el CIGB, cuyo ensayo clínico se realizó también en nuestro Centro 29 y con la finalidad de alcanzar otros segmentos de la población en otras indicaciones demostradas.
Cada vez son más las autoridades sanitarias que entre sus regulaciones exigen que los productos sean libres de albúmina para garantizar su máxima seguridad. Así, la firma Cilag desarrolló una nueva formulación de EPREX® sustituyendo la albúmina por la glicina y polisorbato 80 como estabilizante, lo que luego sería ampliamente comercializada. 30
Como parte de un proceso de mejoría del producto, en el CIM se desarrolló, en fase preclínica, una nueva formulación de ior® EPOCIM, en la cual se sustituye la albúmina humana existente en la formulación de ior® EPOCIM, como estabilizante, por una mezcla de aminoácidos, específicamente alanina, glicina y ácido glutámico, los que forman parte de productos farmacéuticos que se comercializan en la actualidad, ya sea como principios activos o como excipientes de formulación. Actualmente, las formulaciones de EPOr-Hu que se comercializan utilizan, como excipientes que garantizan la estabilidad, además de la albúmina humana, otros aditivos, tales como: aminoácidos, polisorbatos, y urea, entre otros, los cuales pueden utilizarse en mezcla o cada uno por separado.
Nuestro objetivo es exponer los resultados de este Ensayo Clínico Fase II-III, aprobado por las autoridades regulatorias cubanas en esta materia como paso previo a su registro y comercialización.
METODO
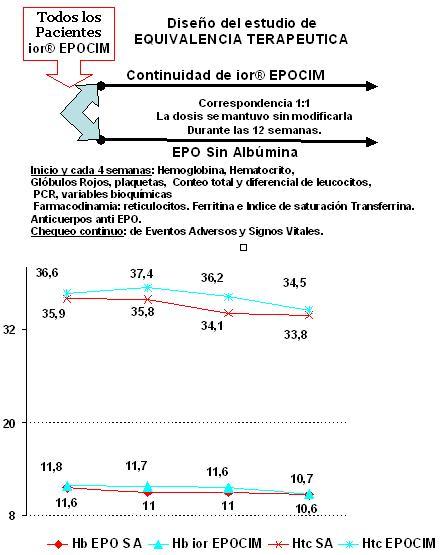
Se realizó un ensayo clínico controlado, monocéntrico, a doble ciegas y aleatorizado, para evaluar la eficacia y seguridad del tratamiento con EPO S/A y determinar la equivalencia terapéutica de esta formulación con el ior® EPOCIM, en pacientes hemodializados en el Instituto de Nefrología, durante un período de tratamiento de 12 semanas, y se evaluó la respuesta hematológica (hemoglobina/ hematocrito) de ambos productos.
Se incluyeron 60 pacientes, con historia de anemia renal, tratados con ior Ò EPOCIM en régimen de hemodiálisis 3 veces por semana, Kt / V de 1.4, los cuales, durante al menos 3 meses previos, mantuvieron niveles iguales o superiores a 30 % de Hematocrito (Hemoglobina 10 g/l), divididos aleatoria-mente en 2 grupos, de 30 pacientes cada uno. El primer grupo recibió tratamiento con EPO S/A con la dosis habitual de Eritropoyetina y el segundo, con ior® EPOCIM, ambos por vía subcutánea y durante 12 semanas.
Este estudio contó con la revisión y aprobación por parte del Comité de Etica en la Investigación Científica y el Consejo Científico del Centro; luego, se presentó a la autoridad reguladora nacional de medicamentos que autorizó el inicio del ensayo. Fue realizado de acuerdo con los principios establecidos en la Declaración de Helsinski y sus posteriores modificaciones, además con las Guías Eticas Internacionales para la Investigación Biomédica en seres humanos. Todos los pacientes recibieron la información necesaria para decidir su participación en el estudio y se obtuvo finalmente su consentimiento por vía escrita.
Del total de enfermos, quienes cumplían los criterios de inclusión, se realizó un listado consecutivo y se determinaron, por asignación aleatoria, aquellos a incluir y el producto a administrar; siendo además a doble ciegas su administración, permaneciendo en el sitio de la investigación los 60 sobres sellados con el nombre del paciente, su número de ficha y dentro de ellos el tipo de Eritropoyetina que recibía.
Para reducir el sesgo relacionado con la adopción de decisiones para realizar ajustes de dosis, basado en la respuesta clínica del sujeto, sólo se determinó que se efectuaría en aquellos casos en los que la hemoglobina hubiera disminuido a 8 g/dL, en el sentido de incrementar la dosis de EPO. En el caso de que el valor del hematocrito sobrepasara de 36%, se disminuiría la dosis de EPO en 25 % por cada administración.
Todos los pacientes incluidos continuaron con la misma dosis que venían recibiendo de ior® EPOCIM. El tratamiento para el ensayo se mantuvo por las 12 semanas de tratamiento, EPO S/A o ior® EPOCIM. Recibieron un rango de dosis entre 20-200 UI/Kg. de peso corporal, en una correspondencia 1:1 (EPO S/A: ior® EPOCIM).
La enfermera responsable de la dispensación de los productos recibió el listado de los pacientes. Los bulbos eran indistinguibles y contenían similar rotulado, reflejando en el exterior el número de inclusión del paciente, de acuerdo con la asignación de tratamientos establecida en la lista aleatoria.
Se realizaron 4 evaluaciones: Inicial, antes de comenzarlo; 2, durante el estudio, (semanas 4 y 8); final en la semana 12, al concluir el tratamiento.
Se consideró que había equivalencia terapéutica entre ambos tratamientos si la media del valor de hemoglobina y la media del hematocrito no diferían en más de 1g/dL y 3 % respectivamente, al comparar ambos grupos, luego de 12 semanas de tratamiento. Ello constituyó la hipótesis de este ensayo clínico.
Los conteos hematológicos y bioquímicos fueron realizados en contadores automáticos hematológico y bioquímico, acorde con los procederes de laboratorio habituales; se efectuaron todos los análisis a ciegas.
Los niveles de EPO fueron medidos por Inmunoensayo Enzimático (EIA) de Alta sensibilidad kit (Quantikine® IVD®, R&D System, Inc, Minneapolis).
Se realizó el monitoreo y registro de los eventos adversos que ocurrieron durante el tiempo del ensayo; se considerará o no relacionado con el fármaco en investigación e indicado por signos, síntomas y/o cambios en los parámetros de laboratorio o clínicos; se incluyeron los relacionados al proceder de hemodiálisis, las enfermedades intercurrentes, exacerbación de condiciones preexistentes y los eventos que ocurran como resultado del retiro de un medicamento, abuso o sobredosis.
Determinación del tamaño de la muestra
Fue estimado basándose en el parámetro de eficacia primario (valor de la hemoglobina al final del tratamiento). Los datos de la literatura reportan que la desviación estándar de la hemoglobina es de 1.3 g/dL. 31
Se utilizó el software Calcul de Tamanys de Mostra, Versión 1.1 de Barcelona con las siguientes cuantificaciones: Nivel de significación (alfa= 0.05). Potencia (1-beta=0.8). Desviación estándar de la hemoglobina (sigma=1.3g/dl). Diferen-cia a detectar (d=1g/dl hemoglobina, d=3 % hematocrito). Se obtuvo 27 pacientes por grupo sin considerar porciento de pérdida. Considerando 10% de pérdida se obtuvo 30 pacientes por grupo. Tamaño definitivo de 60 pacientes en total.
Análisis estadístico realizado
Los datos fueron introducidos en dos bases de datos, creadas al efecto en Fox Prox para Versión Windows 9.1, por separado. Ambas bases se compararon en SCOMP, programa de comparación de bases.
Las variables continuas fueron analizadas por estadísticos descriptivos que incluyen tamaño de muestra, media, mediana, desviación estándar, mínimo y máximo. Las variables discretas fueron analizadas utilizando tablas de contin-gencia (frecuencia y porcentaje). Para dar respuesta a las anteriores, se emplearon, según correspondiese, la estadística siguiente: Prueba exacta de Fisher (2 colas), Prueba Chi Cuadrado de Pearson, Test de Homogeneidad: Prueba Chi Cuadrado, Prueba T-Student, Prueba no paramétrica U de Mann Whitney, Prueba paramétrica para muestras independientes, para el análisis de la Equivalencia terapéutica.
Los niveles de hemoglobina y hematocrito al final del ensayo se consideraron por grupo de tratamiento de acuerdo con el examen de co-varianza. Se estableció la equivalencia cuando 95% del intervalo de confianza del efecto terapéutico estimado del tratamiento está dentro del rango de confianza ( ± 1g/dL para la hemoglobina y ± 3V% para el hematocrito).
RESULTADOS
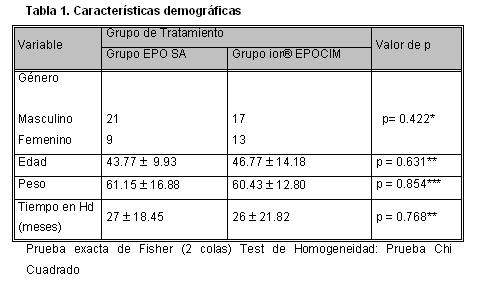
Los grupos de tratamiento fueron homogéneos, según las variables demográficas y de base analizadas. Existió un predominio del género masculino en ambos grupos 21 EPO S/A vs.17 ior® EPOCIM no significativo (p = 0.422). Los promedios de edades 43.77 vs. 46.77 años, peso seco 61.15 vs. 60.43 Kg. y tiempo en hemodiálisis en meses 27 ± 18.45 vs. 26 ± 21.82, no fueron diferentes significativamente en ambos grupos.
Análisis de la eficacia
Las dosis semanales de recombinante Humana Eritropoyetina, (UI/Kg./semanal), inicial y final para el grupo EPO SA de 7482.9 vs. 7485.4, el grupo ior â EPOCIM 8045.3 vs. 8018.6, solo variaron en función del cambio en el peso seco de los enfermos.
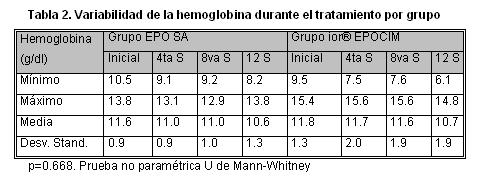
La variabilidad de la hemoglobina entre los grupos EPO SA e ior® EPOCIM fue al inicio 11.6 ± 0.9 vs. 11.8 ± 1.3 y a las 12 semanas de seguimiento de 10,6 ± 1,3 vs. 10.7 ± 1.9 (p=0.668). El comportamiento del hematocrito fue al inicio de 35.9 ± 2.7 vs. 36.6 ± 4.3 y a las 12 semanas de seguimiento de 33.8 ± 3.9 vs. 34.5 ± 5.2 (p=0. 0.570).
Los resultados mostraron que las medias del hematocrito, para ambos grupos, tuvieron una diferencia inferior a 3 % (33.8 vs. 34.5) y en la hemoglobina inferior a 1 g/dl (10.6 vs. 10.7).
La medición de variables farmacodinámicas como hierro sérico, ferritina e índice de saturación de transferrina evidenció un comportamiento similar para ambas formulaciones.
La variable ferritina, (ng/ml), describió un incremento proporcional en ambos grupos de tratamiento durante el estudio EPO SA Inicial 727.0 DS615.2, Final 773 DS 725.2 y ior® EPOCIM Inicial 734.0 DS 665.3, Final 819.6 DS 812.3 En 28 pacientes (46.6 %) se apreciaron valores altos de ferritina, con cifras superiores a los 500 ng/ml, se comportó de forma similar en ambos grupos, 14 en cada grupo de tratamiento.
Respecto al índice de saturación de transferrina (%), los valores luego de finalizar el tratamiento, son inferiores en ambos grupos: EPO SA Inicial 42.3 DS21.7, Final 35.6 DS 78.9 y ior® EPOCIM Inicial 43.9 DS 25.1, Final 36.1 DS 25.1, en relación con los valores iniciales de esta.
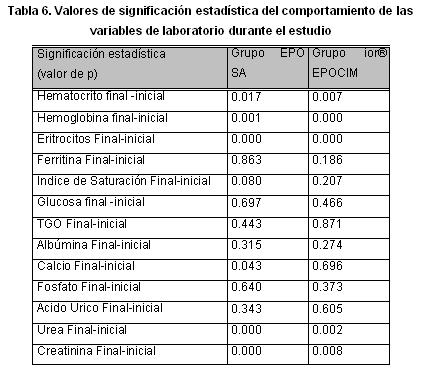
En el análisis de los valores finales e iniciales de hematocrito, hemoglobina, eritrocitos, ferritina, saturación, hierro y ácido úrico, en cada grupo, no presentaron diferencias significativas entre inicio y final. Prueba de Rangos con Signos de Wilcoxon intra o inter grupos.
Con respecto al análisis realizado de las variables bioquímicas, los valores finales e iniciales no tuvieron diferencias estadísticamente significativas en ninguno de los dos grupos. La comparación de los valores de creatinina y urea en ambos grupos, cuando fueron asignados al tratamiento, mostró la homogeneidad de los grupos, lo cual se mantuvo al final del seguimiento.
Análisis de seguridad
De los 60 pacientes incluidos, 59 estuvieron expuestos al tratamiento durante las 12 semanas que duró el estudio, y sólo a un paciente que estuvo expuesto por 22 días al tratamiento (ior â EPOCIM) le fue suspendido este, debido a la aparición de un evento adverso grave, por el que falleció. Los incluidos se tuvieron en cuenta para el análisis de seguridad, ya que todos recibieron al menos una dosis de Eritropoyetina.
Siguiendo lo establecido por las Buenas Prácticas Clínicas para el reporte de eventos adversos en los ensayos clínicos, se recogieron muchos eventos que son comunes en este tipo de pacientes, en particular relacionados con la técnica de hemodiálisis.
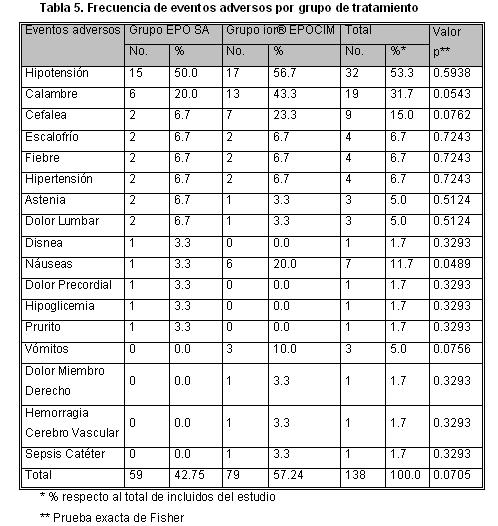
Se reportó una mayor incidencia de eventos adversos en los pacientes que recibieron el tratamiento ior® EPOCIM, aunque la diferencia no fue significativa desde el punto de vista estadístico. En el grupo EPO SA, 20 de 30 pacientes (66.7 %) presentaron eventos y en el grupo ior® EPOCIM, 26 de 30 pacientes presentaron eventos (86.7 %), para un total de 46 de 60 pacientes (76.7 %), que presentaron al menos un evento adverso durante el ensayo.
El principal EA fue el dolor en el sitio de inyección (63,3%) y la Hipotensión (53.3%). No se observaron diferencias estadísticas significativas entre los grupos (p=0.5938). Otro evento que alcanzó una alta proporción fueron los calambres (31.7 %), el cual se presentó en 19 pacientes, 6 (20 %) en el grupo EPO SA y 13 (43.3 %) en el grupo ior® EPOCIM.
Sólo se presentó un Evento Adversograve en un paciente a los 22 días del inicio de la investigación. Como estaba establecido en el protocolo, en la conducta a seguir frente a EA de esta magnitud, se procedió a abrir el sobre con el nombre del paciente y su número de identificación, sellado hasta ese momento, para conocer el producto empleado que resulto ser el ior® EPOCIM y se realizó el reporte expedito de EA Grave.
Este paciente, de 68 años, con IRC-T, filiado como de causa hipertensiva, con una cardiopatía isquémica asociada, tratado desde consulta externa en nuestro Centro, por más de 5 años, presentaba antecedentes de episodios de isquemia cerebral transitoria antes de empezar en hemodiálisis. Se encontraba en tratamiento hemodialítico desde hacia 9 meses y 17 días. Desde el inicio, en hemodiálisis estaba recibiendo ior® EPOCIM con una frecuencia de 3 veces por semana, por vía subcutánea (38.4 UI/Kg. / dosis, 6000 UI/semana), con una respuesta adecuada (hematocrito entre 31- 37 %). El evento ocurrió a los 22 días de incluido el sujeto en la investigación; consistió en una pérdida de la fuerza muscular del hemicuerpo izquierdo, acompañado de toma sensorial que profundizó a un coma profundo, interpretado como una enfermedad cerebrovascular hemorrágica; fue hospitalizado en la Unidad de Terapia Intensiva del Centro e inmediatamente se le suspendió el tratamiento con la EPO; falleció a los 2 días posteriores al evento; se confirmó el diagnóstico por autopsia.
No se encontraron anticuerpos anti EPO en ningún paciente.
DISCUSION
Este estudio compara dos formulaciones para establecer la bioequivalencia terapéutica entre la introducción en los mercados de productos “biogenéricos” o “biosimilares”; es una materia en revisión y discusión, actualmente ambas sometidas a regulaciones internacionales siendo lo mejor realizarlo en voluntarios sanos, 32 o realizar estudios de bioequivalencia, comparando con lo farmacocinético, farmacodinámico, los fármacos en estudio, lo principal para el análisis científico de una droga en desarrollo, 33, 34 que se demuestra en atletas tratados con EPOrHu, 35; habiéndose realizado en nuestro medio estudios con Eritropoyetina de este tipo 29.
Dado que 100 % de la población en hemodiálisis en Cuba recibe Eritropoyetina, nos decidimos por este diseño, avalado internacionalmente, 36 y en Cuba, 37 donde las agencias reguladoras de medicamentos (Centro de Control de Ensayos Clínicos y Centro de Control Estatal de los Medicamentos), a través del cumplimiento de las Buenas Prácticas, además de velar a nivel de la producción por el cumplimiento del principio de “Proceso igual Producto” y del laboratorio por el de purificación y caracterización molecular, en cada caso exigen la intercambiabilidad biológica demostrada en los pacientes, por estudios clínicos estrictos desde el punto de vista de la metodología de la investigación desarrollada y el cumplimiento de las Buenas Prácticas en los ensayos clínicos realizados, pero conociendo que solo un cuidadoso seguimiento fármaco-epidemiológico y monitoreo, a largo plazo, pueden establecer su seguridad y eficacia en el tiempo. 37
El mejor ejemplo de lo anterior es el desarrollo por Cilag de la nueva formulación de EPREX sin albúmina. El reporte de los dos ensayos clínicos a doble ciegas, randomizados, que comparaban la seguridad, tolerabilidad y farmacocinética de las dos formulaciones de la EPREX® (glicina y polisorbato 80 y la disponible hasta ese momento con albúmina como estabilizante) demostró, con voluntarios sanos, semejanza en los parámetros fármaco-cinéticos, indicando que la absorción característica de biodisponibilidad los hacían bioequivalentes. La tolerabilidad y la seguridad no fueron tampoco diferentes. 30
Sin embargo, luego se reporta la Aplasia Pura de Células Rojas inducida por EPO (APCRi-EPO), de infrecuente aparición (tasa de incidencia ajustada a la exposición) en el período 2001-2003 para Eprex con HAS (human serum albumin) de 6 casos por 100 000 pacientes-año, para Eprex HAS-free de 18 casos por 100 000 pacientes-año, para Neorecormon beta de 1 caso por
100 000 pacientes-año, para Epogen de 0.2 casos por 100 000 pacientes-año, imputándola a la nueva formulación α sin albúmina, 38, 39, 40 ya que la inmensa mayoría de los reportes estaban relacionados a la EPOrHu alfa Eprex, (175/191-91.6%) y se han señalado diferentes factores invocados en su génesis. 41 42
Todo lo anterior llevó a que el productor plantease como “la mejor práctica” su empleo EV, seguido de regulaciones en España y otros países de la Comunidad Económica sobre el paso obligatorio de vía SC a EV; sin embargo, no existe para Europa una contraindicación absoluta al empleo por vía SC, 41, 42 y en los Estados Unidos solo afecta a la Eprex y no a las otras formulaciones: EPOrHu Beta (desprovista de albúmina), Epogen o Darbopoetin (análogo hiperglicosilado también alfa de la EPOrHu, con una vida media más larga, que también contiene polisorbato 80, que se puede administrar con intervalos de cada una o dos semanas. 43, 44
Actualmente, se ha demostrado que las intervenciones adoptadas en cuanto a manipulación, almacenamiento y vía de administración para la Eprex ha llevado a disminuir la incidencia de APCRi-EPOrHu en 83%. 45
Por ser ésta, sin dudas, la más grave de las complicaciones, a pesar de no ser fatal, y ser la ior® EPOCIM una EPOrHu alfa, el Grupo Nacional de Nefrología y el Centro para el Desarrollo de la Fármaco-epidemiología, ha seguido su comportamiento internacional muy de cerca, en nuestro medio; hasta el momento actual no se ha reportado ningún caso en los enfermos tratados con la misma en 14 países del mundo y en 8 años de experiencia en Cuba. 46
Dos moléculas de EPOrHu pueden ser semejantes desde el punto de vista fisicoquímico, pero pequeñas diferencias en su composición no se pueden excluir (isoformas, ingredientes, estabilizantes, contaminantes) y ello tener o no repercusión en términos de seguridad y eficacia. 47, 48
Por otra parte, el empleo de diferentes estabilizantes no determina diferencias farmacocineticas, lo que se demuestra en este estudio y es reportado en otros. 29, 30, 49
Nuestros resultados permiten sugerir la equivalencia terapéutica entre EPO S/A y EPOCIM al considerar que el presente estudio tuvo validez interna, ya que los cambios observados se pueden atribuir a la manipulación experimental, debido a que se realizó una adecuada selección del tamaño muestral de los criterios de selección de los pacientes y una adecuada conducción del estudio. El análisis final de la información obtenida de los pacientes tratados evidenció que no existieron diferencias entre las características demográficas y de base de los pacientes estudiados en ambos grupos y mostró que no hubo variabilidad estadísticamente significativa en el nivel de respuesta y eficacia primaria entre ambas formulaciones, ni variabilidad intragrupo al final del tratamiento.
Está establecido que existe una variación de los niveles de hemoglobina en el tiempo. Como factores causales de dicha inconstancia se invocan la variabilidad de las técnicas de laboratorio, aproximadamente para la hemoglobina en 0.30 g/dL (aproximadamente menos de 2DS), factores biológicos de los enfermos, debido a los múltiples eventos clínicos que ocurren en un enfermo urémico: procesos sépticos, malnutrición, microinflamación crónica, pérdidas vitamínicas y hemáticas durante la hemodiálisis o sangramientos digestivos. Los 2 más importantes son la variabilidad de la respuesta individual a la EPO, y el empleo, dosis de sales de hierro. Se señala que la DS de la hemoglobina en enfermos en hemodiálisis es de 1.2 g/dL, mucho mayor que la variabilidad de 0.9 de la población general en US. 50, 51, 52, 53, 54
En un trabajo, involucrando a 48 133 enfermos, seguidos durante un período de 3 meses solo 38.4% de los enfermos no varió el nivel de Hb; 21% disminuyó 25% del percentil previo; en 8% disminuyó por debajo del gol planteado de 11 a 12 g/dl, y aún más; 10.2% estaban por debajo de 10 g/dl, pese a realizar ajustes de dosis de la EPOrHu. El resto de los enfermos se movieron en el sentido de incrementar la Hb incluso sin variar la dosis de EPOrHu. Igualmente notable es que en el seguimiento realizado en el término de un año, 18,633 pacientes (28.7%) categorizados como fuera del rango de gol, variaron su disposición de un extremo al otro. 55
Siguiendo lo establecido por las Buenas Prácticas Clínicas para el reporte de eventos adversos en los ensayos clínicos, se recogieron muchos eventos que son comunes en este tipo de pacientes, en particular relacionados con la técnica de hemodiálisis. Este estudio corrobora la elevada frecuencia de morbilidad intradiálisis reportada en otros artículos, sin encontrar diferencias en cuanto a la frecuencia, intensidad, o severidad de los eventos detectados, así como su presentación en los pacientes debido a las enfermedades intercurrentes propias de la enfermedad causal que origina la enfermedad renal crónica o a esta en su etapa terminal no relacionada con el efecto farmacológico de la Eritropoyetina. 56, 57
El único evento grave presentado por los antecedentes de daño vascular multisistémico y la edad permiten afirmar que existieron factores de riesgo que explican y justifican la aparición del mismo, por lo que se consideró que el evento no estuvo relacionado con la administración del medicamento empleado (ior® EPOCIM) y fue clasificado con causalidad improbable (remota).
No se puede olvidar que las enfermedades cardíacas, unida a los accidentes vasculares-cerebrales representan la primera causa de fallecimiento en estos enfermos internacionalmente; 58, 59, 60, 61 asimismo, en América Latina y Cuba. 62, 63.
Se sabe que el desarrollo de las EPOrHu ha derivado hacia el campo de nuevos factores estimulantes eritropoyéticos, hiperglicosiladas o que actúan en diferentes sitios de la hematopoyesis, que permiten tiempo de administración más prolongados, manteniendo su actividad biológica intacta; la primera de la firma AMGEM fue el NESP (Nuevo factor estimulante eritropoyético) 64 y recientemente de la Roche la CERA (Activador continuo del receptor eritropoyético) 65 en un proceso no exento de contradicciones y reclamaciones comerciales entre las diferentes compañías afectadas. 66
Internacionalmente, se impone la tendencia de tratar la anemia de estos enfermos desde la etapa prediálisis para evitar la aparición de complicaciones cardiovasculares que luego explican que estas sean responsables de más de 50% del fallecimiento. 67, 68, 69, 70, 71
Se acepta por el elevado costo de la EPOrHu la producción en los países en desarrollo de EPO nacionales, es una “alternativa atractiva para extender su empleo dado los altos precios de la EPO de aproximadamente 500 USD mensual por enfermo en USA”, 72 aún más cuando ior® EPOCIM es líder entre los biopreparados cubanos del CIM con una demanda creciente, 73 por lo que
------
esta nueva formulación es atractiva para contribuir a cumplir este papel con un adecuado sistema de vigilancia fármaco-epidemiológico.
Consideramos que este ensayo tiene validez externa; ya los resultados de un estudio pueden ser generalizados a muestras o condiciones espacio-tempora-les diferentes de generalización, pues evidenció la equivalencia terapéutica de una nueva formulación a través de parámetros farmacodinámicos y de seguir-dad biológica comunes a otros estudios realizados con Eritropoyetina Humana Recombinante.
La muestra seleccionada de pacientes con IRC-T, hace que el haber probado, a través de este ensayo, el producto en su población habitual, de modo equivalente, sea válida la extensión del tratamiento a esta con los esquemas terapéuticos aprobados.
ABSTRACT : Therapeutic equivalence between IOR® EPOCIM and EPO without albumin in patients in hemodyalisis with Chronic renal Insufficiency.
A randomized, double blind, controlled, monocentric Clinical Trial Phase II-III is conducted to establish the efficacy and security of the treatment with EPO without/albumin with a new stabilizer and determine the equivalence of this formulation with the ior® EPOCIM in hemodyalized patients. 60 patients were included in iterated hemodyalisis 3 times per week, Kt/V >1,2, those who kept similar or superior levels of 10g/L of Hemoglobin during at least, for 3 months, treated with ior® EPOCIM divided in 2 groups , of 30 patients each. The first, received an EPO W/A, habitual dose of erythropoietin and the second with ior® EPOCIM, both administered s/c in doses of 1:1, no modifications in doses, evaluating the hematological response (hemoglobin, CBC) in both products. The treatment groups were homogeneous, according to the variables: for the group EPO W/A: mean age was 43.8 years, while for the group ior® EPOCIM was 46, 8 years. The media of the dry weight was of a 61,1KG vs. 60, 4 KG. Doses of erythropoietin varied only in dependence with the weight changes of the patient at the beginning and at the end of the 12 weeks. EPO W/A 7482.9 vs.7485.4 U/KG/week and ior® EPOCIM 8045.3 vs. 8018.6 UI/KG/week. Initial results of the CBC (35, 9% vs. 36,6%) and hemoglobin (11,6 vs. 11,7 g/dl) showed that medias of CBC for both groups at the end of the study had a difference inferior to 3% ( 33,8 vs. 34,5) and in hemoglobin , inferior to 1 g/dl (10,6 vs. 10,7), with a slight decrease at the end of the treatment for both groups. The detected adverse effects were: pain in the site of the injection, (63%) hypotension (53, 3%), cramps (31, 7%) and headaches (15%), all attributable to the hemodyalisis process with a profile very similar to all the patients undergoing hemodyalisis. There were no statistical differences among the groups (p=0.5938). The results allow suggest the equivalence of this new product to establish its long term effects.
Key Words : Anemia, Erythropoietin, hemodyalisis, chronic renal Insufficiency, Clinical Trial.
REFERENCIAS BIBLIOGRAFICAS
1. Eschbach JW, Adamson JW. Anemia of end-stage renal disease (ESRD). Kidney Int. 1985; 28:1-5.
2. Horina JH, Schwaberger G, Brussee H, Sauseng-Fellegger G, Holzer H, Krejs GJ. Increased red cell 2,3 diphosphoglyverate levels in haemodialysis patients treated with erythropoietin. Nephrol Dial Transplant. 1993; 8: 1219-1222.
3. Teehan B, Sigler MH, Brown JM, et al. Hematologic and physiologic studies during correction of anemia with recombinant human erythropoietin in predialysis patients. Transplant Proc. 1989; 212:63-66.
4. Wizemann V, Schafer R, Kramer W. Follow-up of cardiac changes induced by anemia compensation in normotensive hemodialysis patient with left-ventricular hypertrophy. Nephron. 1993; 64:202-206.
5. Wizemann V, Kaufmann J, Kramer W. Effect of erythropoietin on ischemia tolerance in anemic hemodialysis patients with confirmed coronary artery disease. Nephron. 1992; 62:161-165.
6. Wolcott DL, March JT, La Rue A, Carr C, Nissenson AR. Recombinant human erythropoietin treatment may improve quality of life and cognitive function in chronic hemodialysis patients. Am J Kidney Dis. 1989;14:478-485.
7. Eschbach JW, Adamson JW. Recombinant human erythropoietin: implications for nephrology. Am J Kidney Dis. 1988; 11:203-209.
8. Ramírez G, Bittle PA, Sanders H, Rabb HAA, Bercu BB. The effects of corticotropin and growth hormone releasing hormones on their respective secretory axes in chronic hemodialysis patients before and after correction of anemia with recombinant human erythropoietin. J Clin Endocrinol Metab. 1994;78:63-69.
9. Schaefer RM, Kokot F, Heidland A. Impact of recombinant erythropoietin on sexual function in hemodialysis patients. Contrib Nephrol. 1989; 76:273-282.
10. Sobh MA, Abd el Hamid IA, Atta MG, Refaie AD. Effect of erythropoietin on sexual potency in chronic haemodialysis patients: a preliminary study. Scand J Urol Nephrol. 1992; 26:181-185.
11. Gafter U, Kalechman Y, Orlin JB, Levi J, Sredni B. Anemia of uremia is associated with reduced in vitro ccytokine secretion: immunopotentiating activity of red blood cells. Kidney Int. 1994; 45:224-231.
12. Vanholder R, Van Biesen W, Ringoir S. Contributing factors to the inhibition of phagocytosis in hemodialyzed patients. Kidney Int. 1993; 44: 208-214.
13. Scigalla P, Bonzel KE, Bulla M, et al. Therapy of renal anemia with recombinant human erythropoietin in children with end-stage renal disease. Contrib Nephrol. 1989; 76: 227-241.
14. Evans RW, Rader B, Manninen DL. Cooperative Multicenter EPO Clinical Trial Group. The quality of life of hemodialysis recipients treated with recombinant human erythropoietin. JAMA. 1990; 263:825-830.
15. Lowrie EG, Ling J, Lew NL, Yiu Y. The relative contribution of measured variables to death risk among hemodialysis patients. In: Friedman EA (ed). Death on Hemodialysis: Preventable or Inevitable? Boston, MA: Kluwer Academic Publishers; 1994, p. 121-141.
16. Eschbach JW. The anemia of chronic renal failure: pathophysiology and the effects of recombinant erythropoietin. Kidney Int. 1989; 35:134-148.
17. Parker PA, Izard MW, Maher JF. Therapy of iron deficiency anemia in patients on maintenance dialysis. Nephron. 1979; 23:181-186.
18. Postasman I, Better OS. The role of secondary hyperparathyroidism in the anemia of chronic renal failure. Nephron. 1983; 33:229-231.
19. Adamson JW, Eschbach JW. Management of the anaemia of chronic renal failure with recombinant erythropoietin. Q J Med. New Series. 1989;73:1093-1101.
20. Kaiser I, Schwartz KA. Aluminium induced anemia. Am J Kidney Dis. 1985; 6:348-352.
21. Hampers CL, Streiff R, Nathan DG, Snyder D, Merrill JP. Megaloblastic hematopoiesis in uremia and in patients on long term hemodialysis. New Engl J Med. 1967;276:551-554.
22. Said R, Quintanilla A, Levin H. Acute hemolysis due to profound hypoosmolality. A complication of hemodialysis. J Dialysis. 1977;1:447-452.
23. Linsay RM, Burton JA, Edward N. Dialyzer blood loss. Clin nephrol. 1973;1:29-34.
24. Eschbach JW, Egrie JC, Downing MR. Correction of the anemia of end-stage renal disease with recombinant human erythropoietin. Results of combined phase I and II trials. N Engl J Med. 1987;316:73-74.
25. Eschbach JW. The future of r-HuEPO. Nephrol Dial Transplant. 1995;10 Suppl 2:96-109.
26. Eschbach JW, Funk DD, Adamson J, Kuhn K, Scribner BH, Finch CA. Erythropoiesis in patients with renal failure undergoing chronic dialysis. N Engl J Med. 1997;276:653-658.
27. Pérez-Oliva JF, Lagarde M, Herrera Valdés R. Eficacia del tratamiento con Eritropoyetina recombinante humana cubana Rev Hab C. Médicas. 2003; (10): 5-10.
28. Pérez-Oliva JF, Lagarde M, Herrera Valdés R. Broad Use of Cuban Recombinant Human Erythropoietin (ior-EPOCIM) in Dialysis Patients at the Institute of Nephrology. MEDICC Review. 2005; 7 (5).
29. Pérez-Oliva JF, Casanovas-González ME, García I, Porrero PJ, Valenzuela CM, Hernández T, Lagarde M, Casanova Y, Avila Y, Vargas A, Bobillo H, Herrera R, López-Saura PA. Comparison of two recombinant erythropoietin formulations in patients with anemia due to end-stage renal disease on hemodialysis: a parallel, randomized, double blind study. BMC Nephrol. 2005; 6(1):5.
30. Cheung WK, Natarajan J, Sanders M, Vercammen E. Comparative pharmacokinetics, safety, and tolerability after subcutaneous administration of recombinant human erythropoietin formulated with different stabilizers. Biopharm Drug Dispos. 2000; 21:211-219.
31. Coladonato JA y col. Treds in anemia management among US hemodialysis patients. J Am Soc Nephrol. 2002; 13(5): 1288-95.
32. Salmonson T, Danielson BG, Wikstrom B. The pharmacokinetics of recombinant human erythropoietin after intravenous and subcutaneous administration to healthy subjects. Br J Clin Pharmacol. 1990; 29:709-713.
33. Levy G. Pharmacodinamic considerations in bioavailability and bioequivalence assessments. In Topics in Pharmaceutical Sciences Edited by: Crommelin DJ, Mida KK; 1991, p. 243-251.
34. Reigner BG, Williams PE, Patel IH, Steimer JL, Peck C, van Brummelen P. An evaluation of the integration of pharmacokinetic and pharmacodynamic principles in clinical drug development. Experience within Hoffmann La Roche. Clin Pharmacokinet. 1997;33:142-152.
35. Varlet-Marie E, Gaudard A, Audran M, Gomeni R, Bressolle F. Pharmacokinetic-pharmacodynamic modeling of recombinant human erythropoietin in athletes. Int J Sports Med. 2003; 24:252-257.
36. Guía para la industria. Estudios de biodisponibilidad y bioequivalencia para productos farmacéuticos administrados oralmente-consideraciones generales. Food and Drug Administartion/Center for Drug Evaluation and Research: September 24, 2001 FDA. USA. Disponible en: http://www.fda.gov/cder/guidance/index.htm
37. Disponible en: http: //www.cecmed.sld.cu. (2006)
38. Locatelli F, Del Vecchio L. Pure red cell aplasia secondary to treatment with erythropoietin. J Nephrol. 2003;16: 461-466.
39. Casadevall N, Cournoyer D, Marsh J, Messner H, Pallister C, Parker-Williams J, Rossert J. Recommendations on hematological criteria for the diagnosis of epoetin-induced pure red cell aplasia. Eur J Haematol. 2004; 73(6):389-96.
40. Kharagjitsingh AV , Korevaar JC , Vandenbroucke JP , Boeschoten EW , Krediet RT , Daha MR , Dekker FW . NECOSAD Study Group . Incidence of recombinant erythropoietin (EPO) hyporesponse, EPO-associated antibodies, and pure red cell aplasia in dialysis patients. Kidney Int. 2005; 68(3):1215-22.
41. Peces R. ¿Es aceptable el costo-beneficio al cambiar la EPO de la vía subcutánea a la intravenosa en los enfermos en hemodiálisis? Nefrología. 2003; 23(4):363-4.
42. Peces R. Aplasia pura de células rojas y anticuerpos anti-eritropoyetina: surgen nuevas evidencias pero persisten las dudas. Nefrología. 2003; 23(4): 295- 297.
43. Intravenous administration required when using Eprex/Erypo (epoetin alfa) in chronic renal failure patients. Johnson & Johnson News. 2002;12(2).
44. Légaré C, Christopher Turner Ch, Klein AV. Use of Eprex in Canada. Can. Med. Association. 2004;171(6).
45. Bennett ChL, Luminari S, Nissenson AR, Tallman MS, Klinge SA, McWilliams N, McKoy JN, Kim K, Allison E, Trifilio SM, Raisch DW, Evens AM, Kuzel TM, Schumock GT, Belknap SM, Locatelli F, Rossert J, Casadevall N. Pure red-cell aplasia and epoetin therapy. New Eng Journ Med. 2005; 35(1):1403-1408.
46. Pérez-Oliva JF, Lagarde M, Herrera R, Magrans Ch. Aplasia pura de células rojas inducida por EPO. Una confirmación de la tesis actual. Nefrología. 2005; 25, (5): 576-577.
47 . Disponible en: http://www.boletinfarmacos.org (2006).
48. Togawa A, Tanaka T, Nagashima S, Keta H, Kobayashi Y, Nishikawa Y, Yanai M, Tanaka H. A comparison of the bioequivalence of two formulations of epoetin alfa after subcutaneous injection. Br J Clin Pharmacol. 2004; 58:269-276.
49. Chamberlain P. Biogenerics: Europe takes another step forward while the FDA dives for cover. Drug Discov Today. 2004; 9:817-820.
50. Jacobs C, Horl WH, Macdougall IC, Valderrábano F, Parrondo I, Abraham IL, Segner A. European best practice guidelines 5: Target haemoglobin. Nephrol Dial Transplant. 2000;15 (4): 15-19.
51. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, Bommer J, Cruz JM, Kerr PG, Mendelssohn DC, Held PJ, Port FK. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis. 2004;44(1):94-111.
52. National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease, 2000. .Am J Kidney Dis. 2001;37(suppl 1):S182-S238.
53. Tonelli M, Blake PG, Muirhead N. Predictors of erythropoietin responsiveness in chronic hemodialysis patients. ASAIO J. 2001;47:82-85.
54. Chang CH, Chang CC, Chiang SS. Reduction in erythropoietin doses by the use of chronic intravenous iron supplementation in iron-replete hemodialysis patients. Clin Nephrol. 2002; 57:136-141.
55. Lacson E, Ofsthun N, Lazarus JM. Effect of Variability in Anemia Management on Hemoglobin Outcomes in ESRD. Am J Kidney Dis. 2003; 41:111-124.
56. NKF-DOQI Clinical Practice Guidelines for Hemodiálisis, Adequacy. Peritoneal Dialysis. Adequacy, Vascular Am J Kidney Dis. 2002.
57. NKF-DOQI Clinical Practice Guidelines for Anemia of Chronic Renal Failure. Am J Kidney Dis. 2001;37(1).
58. Collins AJ, Li S, St Peter W, Ebben J, Roberts T, Ma JZ, Manning W. Death, hospitalization and economic associations among incident hemodialysis patients with hematocrit values of 36-39%. J Am Soc Nephrol. 2001; 12: 2465-73.
59. Locatelli F, Covic A, Chazot C, Leunissen K, Luno J, Yaqoob M. Hypertension and cardiovascular risk assessment in dialysis patients. Nephrol Dial Transplant. 2004;19: 1058-68.
60. Pozzoni1 P, Del Vecchio L, Pontoriero G, Di Filippo S, Locatelli F. Long-term outcome in hemodialysis: Morbidity and mortality. J Nephrol. 2004;17: 87-95.
61. Renal Data System. USRDS 2003 Annual data Report: Atlas of end-stage renal disease in the Unites States. Bethesda, MD, National Institutes of Health; 2003, p. 1-560.
62. Cusumano AM. Datos del 2003 de la Sociedad Latinoamericana de Nefrología e Hipertensión Registro latinoamericano de Diálisis y trasplante. Conferencia impartida en el IX Congreso Centroamericano y del Caribe de Nefrología e Hipertensión. Varadero. Cuba: mayo 2005.
63. Pérez-Oliva JF, Almaguer M, Herrera R. Informe del Registro Cubano de Enfermedad Renal Crónica, Diálisis y Trasplante renal a la dirección del Ministerio de Salud Pública, para la Dirección Nacional de Estadísticas y el Anuario del Año 2005. Instituto de Nefrología. La Habana. Cuba: 2006.
64. Macdougall IC , Matcham J , Gray SJ . Correction of anaemia with darbepoetin alfa in patients with chronic kidney disease receiving dialysis. NESP 960245/246 Study Group . Nephrol Dial Transplant. 2003;18(3):576-81.
65. Roche Holding AG. Announced the completion of four phase 3 trials of the still-investigational antianemia drug CERA (continuous erythropoietin receptor activator) in 2005. 16 de diciembre 2005, Disponible en: http://www . Roche. com
66. Roche to seek approval for anemia drug CERA. Wall street Journal, diciembre 19, 2005 Disponible en: www//thekidney.org
67. Foley RN, Parfrey PS, Harnett JD, Kent GM, Murray DC, Barre PE. The impact of anemia on cardiomyopathy, morbidity and mortality in end-stage renal disease. Am J Kidney Dis. 1996; 28: 53-61.
68. Locatelli F, Conte F, Marcelli D. The impact of hematocrit levels and erythropoietin treatment on overall and cardiovascular mortality and morbidity the experience of the Lombardy Dialysis Registry. Nephrol Dial Transplant. 1998;13: 1642-4.
69. Eckardt KU.Cardiovascular risk Reduction by Early Anemia Treatment with Epoetin Beta (CREATE) Trial. The CREATE trial--building the evidence. Nephrol Dial Transplant. 2001;16 (2):16-8.
70. Furuland H, Linde T, Ahlmen J, Christensson A, Strombom U, Danielson BG. A randomized controlled trial of hemoglobin normalization with epoetin alfa in pre-dialysis and dialysis patients. Nephrol Dial Transplant. 2003;18: 353-61.
71. Roger SD, McMahon LP, Clarkson A, Disney A, Harris D, Hawley C, Healy H, Kerr P, Lynn K, Parnham A, Pascoe R, Voss D, Walker R, Levin A. Effects of early and late intervention with epoetin alpha on left ventricular mass among patients with chronic kidney disease (stage 3 or 4): Results of a randomized clinical trial. J Am Soc Nephrol. 2004;15: 148-56.
72. David Nissen (Ed). Epoetin alfa. In Mosby's Drug Consult. Mosby Inc. St. Louis, Missouri: 2005. ![]()
73. Veloz Martha. Premios nacionales a los productos de mayor exportación. Revista Opciones. Agosto, 2004.
ANEXO