Introducción
El péptido similar al glucagón-1 (GLP-1) y el péptido YY (PYY) son hormonas intestinales, ubicadas en las células L intestinales, que se liberan en respuesta a la ingesta de nutrientes.1 El GLP-1 estimula la secreción de la insulina e inhibe la secreción de glucagón de manera dependiente de la glucosa, además, a niveles fisiológicos, también se asocia con un efecto inhibidor sobre el vaciamiento gástrico y con la disminución del peso corporal, como resultado de la reducción del apetito y de la ingesta energética.2,3 Estas propiedades, llevaron al desarrollo de agonistas del receptor GLP-1 (GLP-1 (RA)), como una opción del tratamiento para personas con diabetes mellitus tipo 2 (DM2), también, para el tratamiento de personas con obesidad.4
Se demostró que los GLP-1 (RA), reducen el peso corporal y los niveles de glucosa en la sangre en las personas con sobrepeso u obesidad con o sin DM2, además, se resalta que la activación de los receptores GLP-1 en el cerebro humano, ayuda a regular el apetito y la recompensa alimentaria.5 Estos agentes son fármacos basados en péptidos que se fueron desarrollando para activar el receptor de la hormona GLP-1 derivada del intestino, que tiene un papel importante en la regulación de la glucosa.6 Estos medicamentos tienen diferentes orígenes y características moleculares; cuatro de ellos: La albiglutida, dulaglutida, semaglutida y liraglutida son análogos modificados de su estructura nativa, mientras que la exenatida y lixisenatida se basan en el péptido exendina, que tienen una estructura similar.7 La activación de estos receptores conduce a la secreción de insulina y a la reducción del glucagón inapropiadamente alto, de una manera dependiente de la glucosa, mejorando el control glucémico. Al contrario, cuando los niveles plasmáticos de glucosa son bajos, los GLP-1 (RA) no estimulan la secreción de insulina, lo que ayuda a mantener el control de la glucemia y al mismo tiempo reduce el riesgo de hipoglucemia, además, los pacientes, experimentan niveles bajos de los lípidos y una reducción significativa de la presión arterial. También, se informó que los GLP-1 (RA) redujeron de manera importante el riesgo de enfermedades cardiovasculares (ECV).8,9
La Asociación Americana de Diabetes (ADA, por sus siglas en inglés) y la Asociación Europea para el Estudio de la Diabetes (EASD, por sus siglas en inglés) recomiendan los GLP-1 (RA) y los inhibidores del cotransportador 2 de sodio-glucosa (ISGLT-2) como la opción de tratamiento de segunda línea preferida para los pacientes con un control glucémico no adecuado a pesar del uso de la metformina.10 La declaración de consenso de la Asociación Americana de Endocrinólogos Clínicos (AACE, por sus siglas en inglés) / Colegio Americano de Endocrinología (ACE, por sus siglas en inglés) también recomiendan un GLP-1 (RA) o ISGLT-2 como una opción de tratamiento preferida de primera línea o, más típicamente, de segunda línea después de la metformina, sobre otras opciones alternativas de medicamentos como un inhibidor de la dipeptidil peptidasa-4, una tiazolidindiona o una sulfonilurea, para pacientes con DM2 y enfermedad cardiovascular ateroesclerótica y enfermedad renal crónica (ERC) en estadio 3 o insuficiencia cardíaca con fracción de eyección reducida.11
Esta investigación tiene como objetivo explicar la evidencia existente sobre los efectos del tratamiento con agonistas del receptor del péptido similar al glucagón tipo 1 en las personas con obesidad y diabetes mellitus Tipo 2.
Material y Métodos
Se realizó una revisión sistémica conforme a los ítems de referencia para publicar protocolos de revisión sistémica y meta-análisis (PRISMA).12
Criterios de elegibilidad
Se analizaron estudios en el idioma inglés y español de los efectos de los GLP-1 (AR) como tratamiento en pacientes mayores de 12 años con obesidad y DM2. Se incluyeron: a) estudios experimentales; b) estudios con texto disponible.
Se excluyeron: a) cartas al editor, resúmenes, documentos; b) estudios de los efectos de los agonistas del receptor de GLP-1 como tratamientos en pacientes sin obesidad ni diabetes mellitus tipo 2; c) estudios sin datos confiables; d) fuentes duplicadas; y e) estudios distintos a los idiomas del español e inglés.
Búsqueda o estrategia de búsqueda
Se realizó una búsqueda bibliográfica de literatura en las bases de datos PubMed/Medline y Scopus desde el 30 de julio hasta el 3 de agosto de 2021. El autor elaboró las estrategias de búsqueda, según las recomendaciones del Manual Cochrane de revisiones sistemáticas.
Se emplearon términos de búsqueda de vocabulario controlado para MEDLINE (MeSH), enlazados en término de texto para cada uno de los conceptos seleccionados mediante operadores booleanos: glp-1 receptor agonists, glp-1 receptor agonists AND obesity, glp-1 receptor agonists AND diabetes mellitus, obesity OR diabetes mellitus type 2 AND treatment.
No se emplearon filtros de fecha ni restricción de formato del documento de búsqueda. Se utilizó el programa de Mendeley Desktop, para gestionar referencias bibliográficas, y para la eliminación de artículos duplicados.
Selección de estudios y extracción de datos
La revisión fue realizada por el autor. Se recuperaron los textos completos de los artículos para determinar la elegibilidad y verificar la lista de inclusión y exclusión. Se utilizó el programa Microsoft Excel para la extracción, almacenamiento y el análisis de datos. Se extrajeron los siguientes datos: autor, año, referencia, país, características de la población, intervención, comparación y resultados.
Síntesis de resultados
Se realizó una síntesis narrativa formal de los datos recogidos, no se realizó una síntesis estadística formal. La síntesis se centró en el análisis cualitativo de las manifestaciones clínicas mencionadas, en cada uno de los países de los estudios publicados.
Evaluación de la calidad de estudio
La calidad de evidencia para cada desenlace se determinó, según la metodología Grading of Recommendations Assessmet, Developmet and Evaluation (GRADE).13 que toma los siguientes criterios: diseño de estudio, riesgo de sesgo, inconsistencia en los resultados, ausencia de evidencia directa, imprecisión, sesgo de publicación y de tratarse de estudios observacionales se considera el tamaño del efecto, la gradiente dosis-respuesta y el efecto de dosis residual. De acuerdo con esta metodología, existen 4 niveles para la calificación de la evaluación de la calidad de evidencia y las referencias de este estudio de revisión. (Tabla 1).
Resultados
Selección y características de los estudios
En la búsqueda inicial se identificaron 370 resultados. Se eliminaron 120 resultados duplicados. Después de filtrar por títulos y resúmenes evaluamos 40 artículos en texto completo. Se registraron inicialmente 20 artículos que brindaron información específica relacionada con los objetivos de este estudio. Además, se realizó una búsqueda secundaria de los 20 estudios incluidos inicialmente, de lo cual se incorporaron 2 estudios adicionales, resultando 22 estudios. Finalmente se adjuntaron 9 estudios experimentales, para el posterior análisis de los resultados y 13 estudios para los comentarios de esta revisión. (Figura 1). Además, se determinó el perfil de evidencia de los 9 estudios para el análisis. (Tabla 2).
Tabla 2 Perfil de evidencia de los GLP-1 (RA) en pacientes con obesidad y DM2

GLP-1 (RA): agonista del receptor del peptido similar al glucagon-1, DM: diabetes mellitus tipo 2, OR: odds Rattio, IC 95%: intervalo de confianza del 95%, p= nivel de significancia
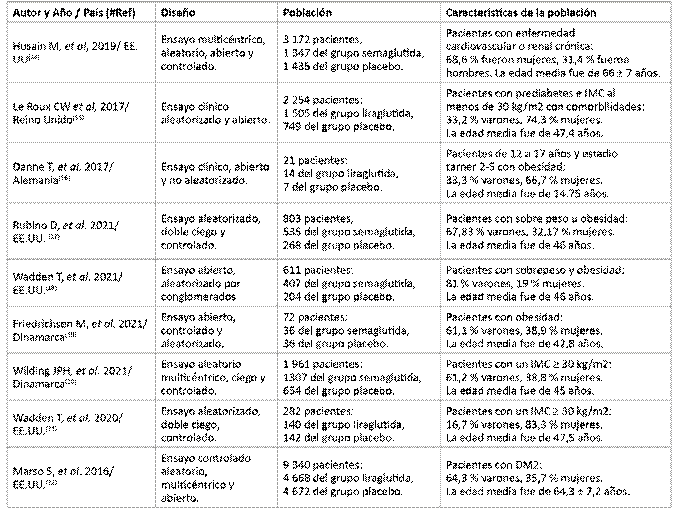
La mayoría de los artículos provienen de EE.UU. (5/9), Dinamarca (2/9), Reino Unido (1/9), Alemania (1/9). El promedio de la población de este estudio fue de 7 050 pacientes. La mayoría fueron hombres y la edad promedio fue de 65 años, de los diferentes estudios. (Tabla 3 y 4).
Tabla 4 Resultados de los GLP-1 (RA) en pacientes con obesidad y DM2

GLP-1 (RA): agonista del receptor del péptido similar al glucagon-1, DM2: diabetes mellitus tipo 2, IM: infarto de miocardio, HbA1c: hemoglobina glucosilada, IMC: índice de masa corporal, IR: índice de riesgo, IC 95 %: intervalo de confianza de 95 %, p: nivel de significancia
Discusión
Efectos de los agonistas del receptor GLP-1 en pacientes con obesidad y DM2
Husain M, et al,14 realizaron un estudio ensayo controlado, aleatorizado y doble ciego, donde incluyeron a 3 172 pacientes (2 176 varones y 996 mujeres), la edad media fue de 66 ± 7 años) que tenían más de 50 años y ECV o ERC; 1 347 (84,7 %) pacientes completaron el estudio con semaglutida oral (dosis objetivo, 14 mg) y 1 435 (90,1 %) completaron con placebo. El resultado primario fue el tiempo desde la aleatorización hasta la primera aparición de un evento cardiovascular adverso importante, una combinación de muerte por causas cardiovasculares (incluidas causas de muerte no determinadas, infarto de miocardio no mortal, o accidente cerebrovascular no mortal). El resultado primario ocurrió en 61 (3,8 %) de 1 591 que recibieron semaglutida oral y 76 (4,8 %) de 1 592 que recibieron placebo; por tanto, se confirmó la no inferioridad para la semaglutida oral en comparación con el placebo (Índice de riesgo (IR)=0,79; IC de 95 %=0,57-1,11; p=0,17). Los resultados de la muerte por ninguna causa, infarto de miocardio no fatal o insuficiencia cardiaca no fatal fueron de 69 (4,3 %) pacientes del grupo semaglutida y 89 (5,6 %) pacientes del grupo placebo, respectivamente (IR=0,77; IC del 95 %=0,56-1,05). Los resultados sobre la muerte por causas cardiovasculares en el grupo semaglutida en 15 (0,9 %) pacientes y en el grupo placebo fueron 30 (1,9 %) pacientes, respectivamente (IR=0,49; IC de 95 %=0,27-0,92). Los resultados de los primeros eventos de angina inestable en hospitalización del grupo semaglutida fueron en 11 (0,7 %) pacientes en comparación del grupo placebo que fueron 7 (0,4 %) pacientes, respectivamente (IR= 1,56; IC de 95 %=0,60-4,01). Los eventos de insuficiencia cardiaca en hospitalización del grupo semaglutida fueron en 21 (1,3 %) pacientes y del grupo placebo fueron 24 (1,5 %) pacientes, respectivamente (IR=0,86; IC de 95 %=0,48-1,55). Se produjeron eventos adversos graves (eventos gastrointestinales, alteraciones metabólicas y nutricionales, alteraciones del sistema nervioso) en varios órganos en 301 (18,9 %) pacientes del grupo semaglutida oral y 358 (22,5 %) en el grupo placebo. Los pacientes que recibían insulina o sulfanilurieas concomitante al tratamiento con semaglutida, sufrían una notable hipoglicemia (1,4 %) en comparación del grupo placebo (0,8 %).
Le Roux CW, et al,15 realizaron un ensayo controlado aleatorizado, donde incluyeron a 2 254 pacientes adultos (1 675 mujeres y 535 varones), la edad media fue de 47,4 años, con diagnóstico de prediabetes y un índice de masa corporal (IMC) de, al menos, 30 Kg/m2 o, al menos, 27 Kg/m2 con comorbilidades, para recibir liraglutida (n= 1 505 pacientes) o placebo (n= 749 pacientes). Los pacientes recibieron 3 mg de liraglutida subcutánea una vez al día o un placebo equivalente, como un complemento de una dieta baja de calorías y un aumento de la actividad física. El periodo de seguimiento para el grupo de liraglutida fue de 90 semanas y para el grupo placebo fue de 87 semanas. Los cambios del peso corporal en los pacientes del grupo liraglutida fueron de -6,1 % y del grupo placebo fueron de -1,9 %; la diferencia del tratamiento de liraglutida vs pacebo (IR= -4,3; IC de 95 %= -0,49 a -3,7; p<0,0001), respectivamente. Los cambios sobre el peso en kilogramos (Kg) de los pacientes del grupo liraglutida fueron de -6,5% y los pacientes del grupo placebo fueron de -2,0%; la diferencia del tratamiento entre ambos grupos (IR= -4,6; IC de 95 %= -5,3 a -3,9; p<0,0001), respectivamente. Los cambios de la cintura abdominal fueron mayores y mejores en el grupo liraglutida respecto al grupo placebo (-6,9 % vs -3,4 %, respectivamente) (IR= -3,5; IC de 95 %= -4,2 a -2,8; p<0,0001). El control de la HbA1c fue mayor en el grupo liraglutida respecto al grupo placebo (-0,35 % vs -0,14 %, respectivamente) (IR= -0,21; IC de 95 %= -0,24 a -0,18). Se informaron eventos adversos graves en 227 (15 %) de 1 501 individuos aleatorizados tratados en el grupo de liraglutida versus 96 (13 %) de 747 individuos en el grupo de placebo.
Danne T, et al,16 realizaron un ensayo controlado aleatorizado, donde reclutaron a 21 pacientes de 12 a 17 años (14 mujeres y 7 varones, la edad media fue de 14,75 años) y estadio de Tanner 2-5, con obesidad (IMC≥ percentil 95 para edad y sexo y a un IMC≥ 30 Kg/m2 para adultos; además el IMC< 45 Kg/m2). Fueron aleatorizados para recibir 5 semanas de tratamiento de liraglutida (0,6 mg con aumento de dosis semanal hasta un máximo de 3,0 mg durante la última semana). El grupo estudio con n=14 pacientes y el placebo con n=7 pacientes. El resultado primario fue el número de eventos adversos emergentes del tratamiento. El cambio de estimación del IMC de los pacientes del grupo liraglutida fue mayor que los pacientes del grupo placebo (-0,12 % vs -0,10 %, respectivamente; IR= -0,02; IC de 95 %= -0,17 a 0,13; p=0,75). Los cambios de estimación sobre la glucosa en ayuna fueron menores del grupo intervención respecto del grupo placebo (-3,51 % vs 0,63 %, respectivamente; IR= -4,14; IC de 95 %= -10,6 a 2,31; p=0,19). Los resultados en los cambios sobre la HbA1c del grupo liraglutida fueron mejores que los del grupo placebo (-0,11 % vs 0,01 %, respectivamente; IR= -0,12; IC de 95 %= -0,31 a 0,07; p=0,21). Los cambios de la presión arterial sistólica del grupo liraglutida tuvieron mejores resultados en comparación del grupo placebo (-7 ± 13 mmHg vs -2 ± 25 mmHg, respectivamente) y los cambios en la presión arterial diastólica de los pacientes del grupo liraglutida fueron mejores que los del grupo placebo (-4 ± 8 mmHg vs -1 ± 13 mmHg, respectivamente).
Rubino D, et al,17 realizaron un ensayo controlado, aleatorizado y doble ciego donde participaron 803 pacientes (634 mujeres y 169 varones, la edad media fue de 46 años) con sobrepeso u obesidad después de un periodo de pre inclusión de 20 semanas con semaglutida subcutánea titulada a 2,4 mg por semana. Un total de 902 participantes con semaglutida subcutánea una vez a la semana durante el período inicial. Después de 20 semanas (16 semanas de aumento de las dosis; 4 semanas de dosis de mantenimiento), 803 (89,0 %) participantes que alcanzaron las dosis de mantenimiento de 2,4 mg/ semana de semaglutida fueron aleatorizados a 48 semanas de semaglutida subcutánea continua en 535 pacientes o cambiaron a placebo en 268 pacientes, más intervención en el estilo de vida en ambos grupos. El criterio principal fue el cambio porcentual en el peso corporal desde la semana 20 hasta la semana 68, los puntos secundarios fueron los cambios en la circunferencia abdominal, presión arterial sistólica y el funcionamiento físico. Los resultados con la semaglutida continua, se produjo el cambio medio en el peso corporal de la semana 20 a la semana 68 fue de -7,9 % frente a +6,9 % con el cambio a placebo (IR= -14,8 [IC de 95 %= -16,0 a -13,5]; p<0,001). Los resultados en sobre la circunferencia abdominal (IR= -9,7 [IC de 95 %= -10,9 a -8,5]), presión arterial sistólica (IR= -3,9 [IC de 95 %= -5,8 a -2,0]) y puntuación de funcionamiento físico Short Form 36 (SF-36) (IR= 2,5; IC de 95 %= 1,6-3,3), también mejoraron con la aplicación de semaglutida subcutánea continua frente a placebo, p<0,001. Se informaron eventos gastrointestinales en 49,1 % de los pacientes que continuaron con semaglutida subcutánea frente a 26,1 % con placebo. Proporciones similares interrumpieron el tratamiento debido a eventos adversos con la continuación de semaglutida (2,4 %) y placebo (2,2 %).
Wadden T, et al.;18 realizaron un ensayo controlado, aleatorizado y doble ciego, donde incluyeron a 611 pacientes con sobrepeso u obesidad (495 mujeres y 116 varones), la edad media fue de 46 años, el tratamiento de 68 semanas con 2,4 mg de semaglutida subcutánea una vez a la semana (N= 407) frente a placebo (N= 204), combinado con terapia conductual intensiva (y una dieta baja en calorías durante las 8 semanas iniciales). Los puntos primarios principales fueron el cambio porcentual en el peso corporal y la pérdida de 5 % o más del peso inicial en la semana 68. Los puntos finales secundarios confirmatorios incluyeron perdidas de, al menos, 10 % o 15 % del peso inicial. En la semana 68, la reducción del peso corporal estimado con respecto al valor inicial fue de -16,0 % para semaglutida frente a -5,7 % para el grupo placebo (IR= -10,3; IC de 95 %= -12,0 a -8,6; p<0,001). La reducción de ≥5 % del peso corporal inicial fue 86,6 % para el grupo de semaglutida frente al 47,6 % del grupo placebo (IR= 6,1; IC de 95 %= 4,0 a 9,3; p<0,001). La reducción en la circunferencia de la cintura respecto al valor inicial fue de -14,6 cm en el grupo semaglutida frente al -6,3 cm del grupo placebo (IR= -8,3; IC del 95 %=-10,1 a 6,6; p<0,001). La reducción de la presión arterial sistólica con respecto al valor inicial fue -5,6 mm Hg en el grupo semaglutida frente al -1,6 mm Hg del grupo placebo (IR= -3,9; IC del 95 %= -6,4 a -1,5). La reducción del peso corporal ≥10 % respecto al valor inicial fue 75,3 % en el grupo semaglutida frente a 27,0 del grupo placebo (IR= 7,4; IC de 95 %= 4,9 a 11,0). La reducción del peso corporal ≥15 % respecto al valor inicial fue de 55,8 % en el grupo semaglutida frente a 13,2 % del grupo placebo (IR= 7,9; IC de 95 %= 4,9 a 12,6). La reducción de la HbA1c respecto al valor inicial fue -0,51 % en el grupo semaglutida frente a-0,27 % del grupo placebo (IR= -0,24; IC de 95 %= -0,29 a -0,19; p<0,001). La reducción de la glucosa en ayunas respecto al valor inicial fue -6,73 mg/dl en el grupo semaglutida frente al -0,65 mg/dl del grupo placebo (IR= -6,09; IC de 95 %= -8,13 a -4,04; p<0,001). Los eventos adversos gastrointestinales fueron más frecuentes con semaglutida (82,8 %) que con placebo (63,2 %). El tratamiento se interrumpió debido a estos eventos en el 3,4 % de los participantes con semaglutida frente a 0 % de los participantes con placebo.
Friedrichsen M, et al,19) realizaron un ensayo controlado, aleatorizado y doble ciego de grupo paralelos en 72 adultos con obesidad (44 varones y 28 mujeres), la edad media fue de 42,8 años, asignados al azar con semagltudia subcutánea (n= 36) una vez a la semana (dosis aumentada a 2,4 mg) o placebo (n= 36) durante 20 semanas; además, se evaluó el vaciamiento gástrico, mediante la absorción de paracetamol después de un desayuno estandarizado. Se evaluaron las calificaciones de apetito informadas por los participantes y las respuestas del Cuestionario de Control de la Alimentación (CoEQ), y la ingesta de energía se midió durante el almuerzo ad libitum. El criterio de valoración principal comparó el efecto de 2,4 mg de semaglutida subcutánea una vez a la semana y placebo sobre el vaciamineto gástrico evaluado por el método de absorción de paracetamol en la semana 20, utilizando el área bajo la curva de concentración-tiempo (AUC) para el paracetamol de 0 a 5 horas después de una prueba estandarizada comida (AUC 0-5 Hr). Los criterios de valoración secundarios relacionados con el vaciamiento gástrico incluyeron el AUC de paracetamol de 0 a 1 hora después de una comida estandarizada (AUC 0-5 Hr). El área bajo la curva de concentración-tiempo (AUC) para el paracetamol 0 a 5 horas después de una comida estandarizada (AUC 0-5 h, para el criterio de valoración principal) aumentó en 8 % (P = 0,005) con 2,4 mg de semaglutida frente a placebo a la semana 20 (no significativo cuando se corrigió para el peso corporal de la semana 20; p =0,12). No se observó ningún efecto sobre el AUC 0-1 h, para la concentración máxima de paracetamol observada o el tiempo hasta la concentración máxima de paracetamol observada. La ingesta de energía ad libitum fue 35 % menor con semaglutida versus placebo (1 736 vs 2 676 kJ; diferencia de tratamiento estimada -940 kJ; P <0,0001). La semaglutida redujo el hambre y el consumo prospectivo de alimentos, y aumentó la plenitud y la saciedad en comparación con el placebo (P<0,02). El CoEQ indicó un mejor control de la alimentación y menos o más débiles antojos de alimentos con semaglutida frente a placebo (P <0,05). El peso corporal se redujo en 9,9 % con semaglutida y 0,4 % con placebo. La seguridad fue consistente con el perfil conocido de semaglutida.
Wilding JPH, et al,20 realizaron un ensayo controlado, aleatorizado y doble ciego, donde inscribieron a 1 961 participantes (1 200 varones y 761 mujeres), la edad media fue de 45 años, con un índice de masa corporal ≥ 30Kg/m2, que no han tenido diabetes mellitus y los asignaron aleatoriamente, en una proporción de 2:1 en 68 semanas de tratamiento con semaglutida subcutáneo (n= 1 307) una vez a la semana (a una dosis de 2,4 mg) o placebo (n= 654), más intervención en el estilo de vida. La estimación primaria evaluó los efectos independientemente de la interrupción del tratamiento o las intervenciones de rescate. El cambio medio en el peso corporal desde el inicio hasta la semana 68 fue -14,9 % en el grupo de semaglutida en comparación con -2,4 % con el grupo placebo, para una diferencia de tratamiento estimada de -12,4 % (IC del 95 %, -13,4 a -11,5; P <0,001). Más participantes en el grupo de semaglutida que en el grupo de placebo lograron reducciones de peso de 5 % o más (1 047 participantes [86,4 %] frente a 182 [31,5 %]), 10 % o más (838 [69,1 %] frente a 69 [12,0 %]) y 15 % o más (612 [50,5 %] frente a 28 [4,9%]) en la semana 68 (P <0,001 para las tres comparaciones de probabilidades). El cambio en el peso corporal desde el inicio hasta la semana 68 fue de -15,3 kg en el grupo de semaglutida en comparación con -2,6 kg en el grupo de placebo (IR= -12,7; IC del 95 %= -13,7 a -11,7). Los participantes que recibieron semaglutida tuvieron una mayor mejoría con respecto a los factores de riesgo cardiometabólico y un mayor aumento en el funcionamiento físico informado por los participantes desde el inicio que aquellos que recibieron placebo. Las náuseas y la diarrea fueron los eventos adversos más comunes con semaglutida; fueron típicamente transitorios de gravedad leve a moderada y disminuyeron con el tiempo. Más participantes en el grupo de semaglutida que en el grupo de placebo interrumpieron el tratamiento debido a eventos gastrointestinales (59 [4,5 %] frente a 5 [0,8 %]).
Wadden T, et al,21 realizaron un ensayo controlado, aleatorizado y doble ciego, donde incluyeron a 282 pacientes (47 varones y 235 mujeres), la edad media fue de 47,5 años, con un IMC ≥30 Kg/m2, por lo que tuvieron un seguimiento de 56 semanas. Compararon el efecto de la liraglutida (n= 140 pacientes) de 3,0 mg una vez al día (0,6 mg adicional para completar la dosis final) versus el grupo placebo (n= 142 pacientes). Los puntos finales primarios fueron el cambio en el peso corporal desde el inicio hasta la semana 56 y la proporción de participantes que perdieron ≥ 5 %. Los puntos secundarios incluyeron la proporción de participantes que perdieron >10 % o >15 % del peso corporal inicial en la semana 56 y la proporción que perdió ≥ 4 % del peso corporal inicial de la semana 16. La pérdida de peso media observada a lo largo del tiempo en los dos grupos en la semana 56 fue de -7,5 % para el grupo de liraglutida y -4,0 % para el grupo placebo (IR= -3,4; IC de 95 %= -5,3 % a -1,6 %; p= 0,0003). La reducción del peso corporal ≥5 % respecto al valor inicial fue de 61,5 % en el grupo liraglutida frente a 38,8 % del grupo placebo (IR= 2,5; IC de 95 %= 1,5 a 4,1; p=0,0003). La reducción del peso corporal >10 % respecto al valor inicial fue de 30,5 % en el grupo liraglutida frente a 19,8 % del grupo placebo (IR= 1,8; IC de 95 %= 1,0 a 3,1; p= 0,0469). La reducción del peso corporal >15 % respecto al valor inicial fue de 18,1 % en el grupo liraglutida frente a 8,9 % del grupo placebo (IR= 2,3; IC de 95 %= 1,1 a 4,7; p=0,0311). Los cambios secundarios finales en la semana 56. La disminución de la cintura abdominal, respecto al valor inicial fue -9,4 cm en el grupo liraglitida y -6,7 cm del grupo placebo (IR= -2,7; IC de 95 %= -4,7 a -0,8; p=0,0063). La disminución de la HbA1c, respecto al valor inicial fue de -0,16 % en el grupo liraglutida y -0,06 % del grupo placebo (IR= -0,10; IC de 95 %= -0,2 a -0,04; p= 0,0008). La disminución de la presión arterial sistólica, respecto al valor inicial fue de -2,8 mmHg y -0,6 mmHg del grupo placebo (IR= -2,2; IC de 95 %= -4,9 a 0,5; p=0,1119) y la disminución de la presión arterial diastólica, respecto al valor inicial fue de -1,0 mmHg y -0,8 mmHg del grupo placebo (IR= -0,2; IC de 95 %= -2,12 a 1,8; p= 0,8691). La disminución del colesterol total, respecto al valor inicial fue de -0,04 mmol/L y 0,06 mmol/L del grupo placebo (IR= -0,10; IC de 95 %= -0,26 a 0,06; p=0,2163). Los eventos adversos gastrointestinales fueron del 71,1 % en el grupo de liraglutida frente a 48,6 % del grupo placebo.
Marso S, et al,22 realizaron un ensayo controlado, aleatorizado y doble ciego, donde incluyeron a 9 340 pacientes con DM2 (6 003 varones y 3 337 mujeres), la edad media fue de 64,3 ± 7,2 años, que tenían un nivel de HbA1c ≥ 7 % sin recibir ningún medicamento anti hiperglucémico oral o insulina. Además, que tengan, al menos, una afectación cardiovascular coexistente (enfermedad coronaria, enfermedad cerebrovascular, enfermedad vascular periférica, enfermedad renal crónica de estadio 3 o insuficiencia cardiaca crónica). Los pacientes fueron asignados aleatoriamente, en una proporción de 1:1, para recibir 1,8 mg (o la dosis tolerada máxima) de liraglutida (n= 4 668) o igualar el placebo (n= 4 672) una vez al día como una inyección subcutánea además de la atención estándar. El resultado primario fue la aparición de muerte por eventos cardiovasculares, infarto agudo de miocardio no mortal o accidente cerebrovascular no mortal. El resultado primario ocurrió en un número menor de pacientes en el grupo de liraglutida (608 [13,0 %] pacientes) que en el grupo placebo (694 [14,9 %] pacientes) (IR= 0,87; IC de 95 %= 0,78 a 0,97; p<0,001). El resultado por muerte por causas cardiovasculares fue menor en el grupo de liraglutida (219 [4,7 %] pacientes) frente al grupo placebo (278 [6,0 %] pacientes) (IR= 0,78; IC de 95 %= 0,66 a 0,93; p<0,007). El resultado por infarto de miocardio fue menor en el grupo liraglutida frente al grupo placebo (6,3 % vs 7,3 %, respectivamente) (IR= 0,86; IC de 95 %= 0,73 a 1,00; p<0,046). El resultado por accidente cerebrovascular fue menor en el grupo liraglutida frente al grupo placebo (3,7 % vs 4,3 %, respectivamente) (IR= 0,86; IC de 95 %= 0,71 a 1,06; p<0,16). El resultado por hospitalización por insuficiencia cardiaca fue menor en el grupo liraglutida frente al grupo placebo (4,7 % vs 5,3 %, respectivamente) (IR= 0,87; IC de 95 %= 0,73 a 1,05; p<0,14). El resultado por eventos microvasculares fue menor en el grupo liraglutida frente al grupo placebo (7,6 % vs 8,9 %, respectivamente) (IR= 0,84; IC del 95 %= 0,73 a 0,97; p<0,02). Los eventos adversos graves fueron menores en el grupo liraglutida frente al grupo placebo (49,7 % vs 50,4 %, respectivamente).