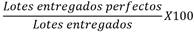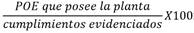Introducción
Las empresas que comercializan productos naturales procesados de uso medicinal han incrementado sus ventas, a nivel mundial, en especial los productos que favorecen las defensas o refuerzan el sistema inmunológico, por ejemplo, Herbalife. Dicha empresa se dedica a la elaboración y comercialización de productos naturales. Alcanzó ventas globales por $4900 millones de dólares americanos en 2019, en Ecuador. Para el mismo año se registró $38 millones de dólares [1]. Debido a las condiciones actuales del COVID-19 se prevé a nivel mundial un incremento de ventas de productos naturales que fortalezcan el sistema inmunológico [1].
Los productos naturales medicinales, llamados también fitofármacos, constituyen una terapia con base científica y técnica. Estos medicamentos en algunos casos llegan a la población sin los estándares mínimos de calidad que la legislación de cada país establece, limitando así en el país acceso de un tratamiento médico, seguro y eficaz [2, 3]. El consumidor busca productos naturales procesados, de origen vegetal y sobre todo responsable con la naturaleza, el medio ambiente y que además asegure su inocuidad [4]. Actualmente los fármacos que se obtienen a partir de plantas tienen un nivel de aceptación mayor en relación a los sintéticos y biotecnológicos [5]. Las Buenas Prácticas de Manufactura (BPM) son base fundamental global en la industria fitofarmacéutica la cual tiene énfasis es su producción y control de calidad [6]. En Ecuador, para: fabricar, importar, comercializar y distribuir un producto natural de uso medicinal es indispensablemente contar con el registro sanitario emitido por el ARCSA, Ecuador [7]
Las BPM como una herramienta gerencial perteneciente al ámbito de la Gestión de la Calidad, cuyo propósito principal es la promoción de hábitos de higiene y procesos seguros para la obtención de productos inocuos que garanticen la satisfacción máxima del consumidor [8]. Las BPM constituyen un campo de mayor importancia para que las industrias puedan ser más eficientes y competitivas en los diversos mercados. La valoración de todos los componentes del modelo de BPM, “se lleva a cabo a través de la aplicación de una escala valorada, la cual tiene como propósito establecer una calificación sobre 100 puntos porcentuales, para identificar los componentes que presentan los mayores problemas en la organización” [8]. Por esta razón se realiza una lista de chequeo, el cual es otorgado por ARCSA, Ecuador en donde están detallados los puntos a cumplir para la obtención de la certificación BPM.
Este trabajo expone un caso práctico de incorporación de un modelo de gestión de BPM en productos naturales de uso medicinal de la empresa La Colmena. La problemática de la investigación se centró en la ausencia de un modelo de gestión adecuado para implementar los requisitos de las BPM en Ecuador establecidos en el Acuerdo Ministerial Nro. 4918, para la Implementación de BPM en Laboratorios Farmacéuticos de Productos Naturales Procesados de Uso Medicinal [9]. Se analizaron en todas las fases de producción en la empresa La Colmena las causas que generaron que la empresa no haya podido reunir los requerimientos instaurados en el Instructivo antes mencionado.
El objetivo de este artículo es el desarrollo de un protocolo de BPM en la industria de productos naturales de uso medicinal.
La empresa La Colmena elabora productos naturales de uso medicinal a partir de su principal materia prima, el propóleo de las colmenas de abejas. La planta de producción contempla la recepción y almacenaje de materias prima, proceso de producción, almacenaje del producto terminado y despacho del mismo. Sus productos son: solución de propóleo al 40% deconcentración y el ungüento de propóleo, siendo estos categorizados por la autoridad competente como producto natural de uso medicinal.
Métodos
El trabajo de investigacion se desarrolló en el laboratorio de productos naturales de uso medicinal La Colmena dedicada a la produccion de derivados de miel de abeja, polen, propóleo y cera de abeja, ubicada en la ciudad de Portoviejo-Manabi-Ecuador.
Nortativa aplicable
Se utilizó la normativa del Acuerdo Ministerial Nro. 4918, emitido por la ARCSA, Ecuador para plantas procesadora de productos naturales de uso medicinal [9].
Se aplicó la metodología descriptiva, deductiva, cuantitativa, con base en la aplicación de una lista de chequeo emitida por ARCSA-Ecuador, para plantas procesadoras de productos naturales de uso medicinal. A partir de la cual se evalúa el cumplimiento inicial por parte de la empresa, seguido de las acciones respectivas para poder subsanar las observaciones de los incumplimientos y así poder alcanzar el porcentaje de la escala valorada para la emisión del certificado BPM. Los componentes evaluados fueron los siguientes:
Administración e información general del laboratorio farmacéutico de productos naturales procesados de uso medicinal.
Personal (calificación profesional - capacitación - vestimenta).
Instalaciones (condiciones generales - áreas auxiliares - mantenimiento).
Sistemas de agua (agua potable - agua purificada).
Almacenes (ubicación - identificación y orden de productos - Instalaciones físicas, elétricas y servicios)
Devoluciones (separación física real y acceso restringido - productos devueltos - acciones y decisiones).
Recolección de productos del mercado (procedimiento operativo - control de calidad - distribución - información de rastreo - retiro de producto y almacenamiento).
Documentación (registro de proceso del lote - envasado - registro de envasado de lotes - documentación general).
Área de muestreo (área física - instalaciones sanitarias).
Central de pesadas (área física - precauciones - sistemas especiales - calibración - elementos de protección).
Producción (área de producción - equipamiento - operaciones).
Control de calidad (Estabilidad - calibración - auditorias de calidad).
Validación (documentación y procedimientos).
La evaluación se realiza a cada componente sobre la base de listados de personal, productos, procesos y servicios, luego por observación directa se verifica el cumplimiento si es que aplica el criterio evaluado. En caso de no cumplir con uno de los criterios se procede a subsanar mediante decisiones y acciones para levantar la no conformidad. El ente regulado (ARCSA) aprueba y certifica las BPM con un 96% de criterios cumplidos en los que aplica.
Resultados
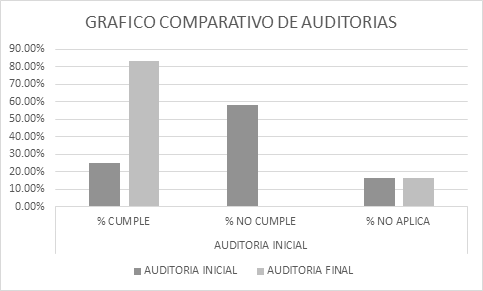
Se realizó una auditoría interna inicial para determinar el estado de la empresa La Colmena en base a las BPM, aplicando la lista de chequeo emitido por el ARCSA, Ecuador (Tabla 1):
Tabla 1 Auditoría interna inicial.
| Parámetros | % CUMPLE | % NO CUMPLE | % NO APLICA |
|---|---|---|---|
| Administración e información general. | 50% | 50% | 0% |
| Personal | 63% | 37% | 0% |
| Instalaciones | 45% | 25% | 30% |
| Sistemas de agua | 23% | 39% | 38% |
| Almacén | 30% | 30% | 40% |
| Devoluciones | 0% | 100% | 0% |
| Recolección de productos del mercado | 0% | 84% | 16% |
| Documentación | 3% | 91% | 6% |
| Área de muestreo | 18% | 50% | 32% |
| Central de pesadas | 54% | 28% | 18% |
| Producción | 43% | 24% | 33% |
| Control de calidad | 0% | 100% | 0% |
| Validación | 0% | 100% | 0% |
| PROMEDIO | 25,31% | 58,31% | 16,38% |
En el análisis de los parámetros de administración e información general del laboratorio farmacéutico de productos naturales procesados de uso medicinal, se observó la falta de planos detallados de la planta de fabricación y un listado detallado de productos que se elaboran. Esto tiene como consecuencia que no se pueda reconocer la distribución de la planta y a su vez se dificulta realizar optimizaciones de la misma. La carencia de una lista de productos que se elaboran provoca el insuficiente control de productos existentes en inventario. Las acciones correctivas fueron: realizar los planos detallados de la empresa y enlistar los productos que se elaboran, mediante la aplicación de las acciones correctivas se logró cumplir los puntos faltantes para este apartado logrando cumplir con el 100% de los criterios evaluados.
En los parámetros correspondientes al personal, se observó la inexistencia de Procedimientos Operativos Estándar (POE) relativos al personal, que contempla la calificación profesional, el uso de vestimenta para el personal de la planta y las visitas. Por otro lado, se advirtió la falta de un organigrama detallado de la empresa y de un plan de capacitaciones del personal que labora en la misma, tampoco existía un registro de estas. Esto incide en la ausencia de personal calificado que daría lugar a: elevados márgenes de error en la producción, limitaría la obtención de productos de calidad. Las medidas de corrección aplicadas fueron: elaborar el POE de calificación profesional y capacitaciones, implementar el POE de utilización de vestimenta tanto para el personal de planta como para las visitas y crear un programa de capacitaciones y fichas de registro de las mismas.
Se determino, la inexistencia de un programa de control de plagas y su registro de ejecución en cuanto a: las instalaciones, las condiciones generales, áreas auxiliares y mantenimiento. Se carecía de un POE de uso, limpieza y mantenimiento de equipos e instalaciones, ni registro del cumplimiento de los mismos. La incidencia de estos incumplimientos conduce a un aumento en el riesgo de invasión de plagas y contaminación por vectores (organismos que transmiten enfermedades infecciosas). Las acciones correctivas fueron: desarrollar un programa de control de plagas y crear una tabla de registros y control de ejecución, implementar un POE de limpieza y mantenimiento de equipos e instalaciones y realizar el registro de su cumplimiento.
En los parámetros de sistemas água potable y água purificada, se determinó que no existían procedimientos ni registros de limpieza y desinfección de tanques o cisternas donde se almacena agua potable. No se realizaban ni se registraban controles de calidad fisicoquímica del agua potable y no se elaboraba ni se registraba controles microbiológicos del agua. La incidencia de la carencia de parámetros de control del agua podría incidir en la calidad del producto final. Las acciones correctivas realizadas fueron: implementar procedimientos y registros de limpieza y desinfección de tanques o cisternas donde se almacena el agua potable, realizar registros y controles de calidad físico químicas del agua potable y llevar a cabo el análisis y registro de controles microbiológicos del agua potable.
En los parámetros del almacén, se evidenció la inexistencia de un POE que resguarde los insumos, materiales y productos ubicados en el interior, POE para la recepción de insumos, movimiento de recipientes, estibado y despacho de productos, no se tenían implementado un control de inventario de insumos y productos. La incidencia de carencia de un procedimiento que resguarde los insumos, materiales y productos puede dar lugar a una contaminación directa de las materias primas y productos terminados. Las acciones tomadas fueron: desarrollar un POE de resguardo de insumos, materiales y productos ubicados en el interior, crear un POE para la recepción de insumos, movimiento de recipientes, estibado y despacho de productos e implementar un control de inventario de insumos y productos.
En los puntos que contemplan las devoluciones del producto, se constató la inexistencia de un área con separación física real y acceso restringido para productos devueltos hasta que se decida su destino, no existía un POE que defina las personas responsables y los criterios de tratamiento de los productos devueltos. La incidencia radica en que un producto devuelto puede contaminar a otros. Para la corrección de dichos puntos, se consideraron: implementar un área con separación física y de acceso restringido para productos devueltos, desarrollar un POE que define las personas responsables y los criterios de tratamiento de estos productos.
Los literales que comprenden la recolección de productos del mercado, se comprobó la inexistencia de un POE que establezca el sistema de retiro de productos del mercado y en caso de ser necesario la comunicación a la autoridad sanitaria competente, no se disponía de un área para almacenar de forma separada y ordenada los productos retirados del mercado. Esto incidía en que los clientes pudiesen estar inconformes con el servicio. Como medida correctiva procedió a: implementar un POE que establece el sistema de retiro de productos del mercado en caso de ser necesario y la comunicación a la autoridad sanitaria competente, asignar un área para almacenar de forma separada y ordenada los productos retirados del mercado.
En los criterios de documentación, registro del lote, envasado, registro de envasado de lotes y documentación general, se evidencio que no existe un POE de la formula maestra y de las consideraciones en cada parte del proceso de fabricación del producto terminado, POE para el registro de proceso del lote, POE para el envasado de productos, POE para el envasado de lotes de producción, POE para cada área o sector de producción. La incidencia de la carencia en estos puntos podría dar como resultados la elaboración de productos con distintos parámetros de formulación ya que no se contaba con la formula maestra. Como medida de subsanación se procedió a: realizar un POE donde contempla la formula maestra de cada producto y las consideraciones de cada parte del proceso de fabricación, POE para el registro de proceso de lote, POE para el envasado de productos, POE para el envasado de lote de producción y POE para cada área o sector de producción.
Para los factores que comprenden el área de muestreo, se constató que no existía un área física separada para el muestreo y un POE para el ingreso de materias primas a muestrear. La incidencia de estos puntos fue la falta de control de calidad ya que no se realizaba el muestreo de los productos para sus análisis antes de su comercialización. Las medidas correctivas fueron: adecuar un área física separada para el muestreo y elaborar un POE para el ingreso de materias primas a muestrear.
Para los puntos de referencia de la central de pesado, se determinó que no existía un área física para la central de pesaje, POE de limpieza del área, POE para la limpieza de utensilios utilizados en el pesaje de productos y materias primas. La incidencia fue la posibilidad de una contaminación cruzada al no existir un área exclusiva para el pesaje. Las acciones correctivas tomadas fueron: adecuar un área física para la central de pesaje, elaborar un POE de limpieza de áreas y ejecutar el POE para la limpieza de utensilios utilizados en el pesaje de productos y materias primas.
En los parámetros de producción, áreas, equipamiento y operaciones, se constató la inexistencia de un POE de limpieza de cada área de la planta, ordenes de producción antes de elaborar un nuevo lote. Esto incidió en la falta de garantías de la calidad e inocuidad del producto terminado al no contar con todos los parámetros a considerarse antes de cada lote de producción. Las medidas de corrección tomadas fueron: realizar un POE de limpieza de cada área de la planta e implementar un programa de órdenes de producción antes de elaborar un nuevo lote de producción.
En los indicadores de control de calidad, estabilidad, calibración y auditorias de calidad, se evidenció la falta de un POE de auto inspección o auditoria de calidad que evalué regularmente la eficacia y aplicabilidad del sistema, un POE para realizar la calibración o calificación de cada uno de los equipos, otro POE con la descripción detallada para muestreos de materia primas y producto terminado para el control de calidad. Además, se requería un POE de aprobación y rechazo de los materias primas e insumos que no cumplan con los parámetros establecidos y, por último, un POE de retención de muestras de materias primas y de producto terminado para análisis de trazabilidad. Como incidencia no se garantizaba la calidad de los productos al no contar con auditorías internas. Como medidas de subsanación, se elabora: un POE de auto inspección o auditoria de calidad para examinar regularmente la eficacia y aplicabilidad del sistema de la garantía de la calidad, un POE escrito para realizar la calibración o calificación de cada lote, un POE con la descripción detallada para muestreos, un POE de aprobación y rechazo de los materiales y un POE de retención de muestras de materias primas y de producto terminado.
En el criterio de validación, se encontró: la falta de un POE de instrucciones de trabajo y estándares, un programa de validación y revalidación de control de calidad, aprobación y seguimiento de actividades. Su incidencia daba la posibilidad de lanzar al mercado productos con bajos estándares de calidad que pudiesen ocasionar inconformidades con los clientes y devoluciones. Como medidas correctivas se implementó un POE de instrucción de trabajo y estándares, y se ejecutó un programa de validación y revalidación de control de calidad, aprobación y seguimiento de actividades.
Se evidencia los porcentajes de cumplimiento luego de las acciones correctivas para subsanar las falencias de la primera auditoría interna que tomó de 5 meses su aplicación en la planta de producción (Tabla 2). Se incumplen los parámetros de control de calidad y validación en un 2% y 4% respectivamente, pues no se han implementado ciertos equipos en el laboratorio de control de calidad; cinco de los trece parámetros se cumplen en un 100% y los restantes parcialmente no aplican.
Tabla 2 Auditoría interna final.
| % CUMPLE | % NO CUMPLE | % NO APLICA | |
|---|---|---|---|
| Administración e información general. | 100% | 0% | 0% |
| Personal | 100% | 0% | 0% |
| Instalaciones | 70% | 0% | 30% |
| Sistemas de agua | 62% | 0% | 38% |
| Almacén | 60% | 0% | 40% |
| Devoluciones | 100% | 0% | 0% |
| Recolección de productos del mercado | 84% | 0% | 16% |
| Documentación | 94% | 0% | 6% |
| Área de muestreo | 68% | 0% | 32% |
| Central de pesadas | 82% | 0% | 18% |
| Producción | 67% | 0% | 33% |
| Control de calidad | 98% | 2% | 0% |
| Validación | 96% | 4% | 0% |
| PROMEDIO | 83,15% | 0,46% | 16,38% |
Como se muestra en la (figura 1), después de las acciones implementadas es notable el crecimiento en el número de criterios cumplidos de un 25 % a un 83% de cumplimientos. Los criterios no cumplidos luego de la aplicación de las acciones correctivas presentan un valor insignificante menor al 1%.
Se presentan los indicadores que nos darán a futuro soporte en el desarrollo y mantenimiento de las gestiones en base a las BPM para poder alcanzar las metas trazadas (Tabla 3) [10].
Tabla 3 Indicadores de gestión BPM.
Discusión
La elaboración y venta de los productos naturales procesado de uso medicinal, deberían de ser controlados desde la materia prima, producción y comercialización para poder asegurar la calidad e inocuidad [11].
Las BPM son un punto inicial para la implementación de HACCP (Hazard Analysis and Critical Control Points - Análisis de Peligros y Puntos Críticos de Control.) y demás sistemas de gestión de calidad que se deseen implementar en una industria, con el objetivo de resguardar la inocuidad de los productos elaborados, además de ser un requisito legal en el Ecuador [12]. El correcto procedimiento para garantizar la higiene en la producción, se fundamenta en medidas para prevenir y eliminar peligros físicos, químicos o biológicos que puedan afectar al consumidor [13].
En el Ecuador se han realizado estudios sobre la inocuidad de los productos naturales procesados de uso medicinal en los cuales se ha evidenciado porcentajes altos de productos que no son inocuos para su consumo desde el punto de vista microbiológico ya que superan los criterios de evaluación de los mismos [11]. Por lo cual, la implementación BPM garantiza al consumidor un producto seguro que no cause afectaciones adicionales a las que ya presentaba antes de la ingesta del medicamento natural.
La aplicación de auditorías internas ayuda a identificar las posibles fallas a cometer, se puede corregir a tiempo alguna desviación y planear estrategia para tomar acciones que permitan recobrar el funcionamiento correcto de los procesos [14].
La mayoría de las micro y pequeñas industrias en el país poseen un nivel de conocimiento bajo en base a las prácticas de manufactura y las consecuencias que puede acarrear en el consumidor la carencia de las mismas [15]. EL consumidor se vuelve cada vez más exigente en base a la calidad de los productos que compra, la inocuidad del mismo es uno de los puntos que más está ganando importancia al momento de realizar la compra de un producto [16].
Implementar las BPM contribuye a un óptimo control de las operaciones, reduciendo las quejas y productos devueltos, es indispensable para lograr la internacionalización de los productos y de mercados exigentes [17]. Las BPM ayudan a describir los componentes de la manufactura como el proceso, empaquetado, manipulación, manejo y almacenaje de los productos terminados (alimenticios, fitofármacos, fármacos o cosméticos) [18].
La industria que elabora productos naturales de uso medicinal es un sector creciente en la economía del país, por lo anterior, apremia la implementación de BPM, para lograr así que los consumidores adquieran un producto de calidad.
Conclusiones
Se determinó el grado de cumplimiento inicial de la empresa La Colmena en base a las BPM, con lo que se llegó a conocer las no conformidades y su posterior subsanación, cubriendo las falencias con el objetivo de obtener la certificación de BPM.
La implementación de estas prácticas influirá en la liberación al mercado de productos que garanticen calidad e inocuidad al consumidor.
Los registros y la documentación de la aplicación de esta norma permitirán la trazabilidad del producto desde la recepción de la materia prima e insumos hasta el producto final, mejorando la organización y productividad de la empresa.
La obtención de la certificación BPM va a incidir en la competitividad en el mercado local y con vistas a un mercado internacional al cumplir con los requisitos establecidos por países terceros.