Introducción
En Cuba el cáncer de cabeza y cuello (CCC) aportó en el año 2021, 1310 defunciones por tumores de laringe y 1577 por tumores de labio, cavidad bucal y faringe.1 Su tratamiento depende del estadio de la enfermedad, tipo histológico y estado funcional del paciente. De manera general, para estadios tempranos (I-II) se utiliza la cirugía y la radioterapia (RT) y para los avanzados (III-IV) se aconsejan combinaciones de RT y quimioterapia (QT).2) Estos son tratamientos invasivos y producen elevado porcentaje de reacciones adversas.3,4
El desarrollo de la biotecnología ha facilitado la creación de nuevas generaciones de productos para el tratamiento del cáncer. Ejemplo de esto es el nimotuzumab, anticuerpo monoclonal (AcM) producido por el Centro de Inmunología Molecular (CIM). Desde el año 2002, tiene el registro en Cuba por el Centro para el Control Estatal de la Calidad de los Medicamentos, Equipos y Dispositivos Médicos (CECMED), para pacientes con carcinoma de células escamosas de cabeza y cuello (CCECC) en estadios avanzados en combinación con RT y/o QT.5
El CCC representa una carga económica sustancial,6,7) pues las terapias biológicas tienen un enorme impacto económico.8) Por este motivo es necesario la incorporación de las evaluaciones económicas de medicamentos (EEM) y análisis de impacto presupuestario (AIP) a los ensayos clínicos (EC). Ambas técnicas evalúan el uso de medicamentos, con el objetivo de ayudar a la sostenibilidad del Sistema Nacional de Salud (SNS).9,10
Debido al desconocimiento de la eficiencia del nimotuzumab y constituir un aspecto relevante para su comercialización, se decidió realizar el estudio de evaluación económica (EE) e impacto presupuestal del fármaco en pacientes cubanos con CCECC en estadios avanzados con el objetivo de evaluar eficiencia de la incorporación del nimotuzumab al sistema de salud cubano como tratamiento en el cáncer de cabeza y cuello.
Métodos
Se desarrollaron dos EEM completas tipo costo-eficacia y costo-efectividad. La primera a partir de los resultados del EC fase III con el uso del anticuerpo monoclonal h-R3 y radioterapia en el tratamiento de pacientes con tumores epiteliales de cabeza y cuello en el período 2002-2008. La segunda EE a partir de los datos del EC fase IV con el uso del anticuerpo monoclonal nimotuzumab en el tratamiento de pacientes con CCECC en estadios avanzados en el período 2009-2013.
El universo estuvo constituido por todos los pacientes diagnosticados con CCECC en estadios avanzados incluidos en los EC mencionados anteriormente.
Se hizo una caracterización demográfica y clínica inicial, a través de las variables: sexo, color de la piel, edad, estado general y estadio. Las fuentes de obtención de la información para identificar y cuantificar estas variables fueron las bases de datos (BD) y cuaderno de recogida de datos (CRD) de cada EC.
Las alternativas de tratamiento analizadas fueron las empleadas en los EC:
Alternativas del EC fase III:
RT + nimotuzumab (54 pacientes). Se indicaron 66 Gy como dosis de RT con cobalto 60 (Co60) o acelerador, en un esquema fraccionado de 2 Gy/diarios hasta completar dosis indicada. Nimotuzumab 200 mg vía intravenosa de forma ambulatoria una vez a la semana, durante seis semanas.
RT + placebo (52 pacientes). Igual al tratamiento anterior, pero en vez de administrar nimotuzumab, se utilizó placebo en igual dosis y frecuencia.
Alternativas del EC fase IV:
RT + nimotuzumab. Se indicaron 66 Gy como dosis de RT con cobalto 60 (Co60) o acelerador, en un esquema fraccionado de 1,8 o 2,0 Gy/diarios hasta completar dosis indicada. Nimotuzumab 200 mg vía intravenosa de forma ambulatoria una vez a la semana, durante seis semanas. Posteriormente, cada 21 días hasta que el paciente presente progresión de la enfermedad, aparición de EA graves o abandono voluntario.
RT/QT concurrente + nimotuzumab. La RT fue igual a la descrita para la alternativa 1. QT: cisplatino (CDDP) 100 mg/m2 o metotrexate 40 mg/m2 o 5FU 1000 mg/m2 días 1, 22 y 43 o semanal durante cinco, seis y siete semanas. Nimotuzumab, administración igual a la primera alternativa.
RT/QT secuencial (se administra la QT de forma no simultánea con la RT) + nimotuzumab. El esquema de RT igual al establecido en alternativa 1. QT: CDDP día 1, 5-FU días 1-4 de la semana, cada 3 o 4 semanas, por 3 ciclos. Nimotuzumab: Administración análoga a la primera alternativa.
Monoterapia con nimotuzumab. Esquema semejante al explicado en la primera alternativa para el nimotuzumab.
QT concurrente con nimotuzumab. La QT se aplicó equivalente a la establecida en la alternativa 2 y la administración del nimotuzumab fue similar a la expuesta en la primera alternativa.
Las evaluaciones económicas se realizaron desde la perspectiva del SNS a nivel hospitalario.11) El horizonte temporal en ambos estudios abarcó un período de cinco años. El primer estudio 2002-2006 y el segundo 2009-2013.
Medida de los efectos sobre la salud
En ambos EC se obtuvieron los tiempos de supervivencia (SV) de cada paciente. Se calculó la sumatoria del tiempo/persona de exposición de las cohortes de estudio. A esos tiempos se le calculó la SV promedio y se convirtió de meses a años para poder estimar los años de vida ganados (AVG) y, posteriormente, se utilizó este indicador en el análisis costo-eficacia/efectividad (ACE).
Para evaluar el tiempo de SV se estimaron las curvas de SV de este parámetro por el método Kaplan-Meier en cada grupo. Se determinaron las medianas y medias de SV y se compararon las curvas obtenidas mediante la prueba Log-rank (Mantel-Cox), con un 95 % de confianza y nivel de significación α = 0,05.12) Se utilizó el programa estadístico para las ciencias sociales IBM SPSS Statistics Versión 22.0.
Medida de los costos. Identificación, cálculos y clasificación
Se tuvieron en cuenta los costos directos sanitarios.13) En ambos estudios económicos, se tuvieron en cuenta los costos del tratamiento recibido placebo/nimotuzumab/RT/QT, de los exámenes complementarios y de consulta externa. En la evaluación económica a partir del EC fase III, se calculó, además, el costo por tratamiento de eventos adversos (EA).
Costo del tratamiento con nimotuzumab/placebo
Se identificó y se cuantificó el tratamiento recibido por cada paciente. Se valoró el costo del nimotuzumab/placebo, de acuerdo a la ficha técnica vigente en el CIM para la EE a partir del EC fase III. Para la EE a partir del EC fase IV se utilizó el costo de adquisición del nimotuzumab establecido ($480,76/bulbo de 50 mg) y la dosis fue de 200 mg (4 bulbos por dosis). Por tanto, cada dosis tuvo un costo de $1923,04/paciente.
Para calcular el costo de administración (CT) se utilizó la ecuación 1:
Donde: COST UNIT es costo unitario de administración del AcM/placebo; ADMÓN: es el número de administraciones de nimotuzumab/placebo por paciente.
Costo del tratamiento RT (CRT). Se identificó y cuantificó el número de sesiones de RT recibidas por paciente. El costo unitario de una sesión de RT se obtuvo a partir de los recursos utilizados en su administración. Se determinó con la ecuación 2.
Donde: COST UNIT RT es el costo unitario de una sesión de RT; SRT es el número de sesiones por paciente.
Costo del tratamiento QT (CQT). Se identificó y cuantificó el número de ciclos de QT recibidos por paciente. Se valoraron los costos de los medicamentos empleados, de acuerdo al costo unitario de cada uno, según su posología y esquema de tratamiento establecido por paciente (ecuación 3).
Donde: COST UNIT QT es el costo unitario del esquema de QT; CiQT son los ciclos de QT por paciente.
Costo de consulta (CC). Se identificó y cuantificó el número de veces que el paciente asistió a consulta. Se valoró el costo de la consulta externa en cada hospital, según la provincia y el tipo de hospital. Los costos se obtuvieron de la BD del Viceministerio de Economía y Administración del Ministerio de Salud Pública (MINSAP) y para el Hospital Hermanos Ameijeiras (HHA) se obtuvieron de los registros de costos de la subdirección económica de este centro.
El costo por concepto de consulta externa se calculó mediante la ecuación 4.
Donde: COST UNIT CE es el costo unitario de la consulta externa; NC es el número de consultas a las que asistió cada paciente.
Costo exámenes complementarios (CEL). Se identificaron y cuantificaron las pruebas de laboratorio e imagenología por paciente. Se consideró el valor de cada examen, de acuerdo a la base de costos estandarizados del MINSAP, excepto para el HHA, donde se usaron los costos de este centro. Se calculó mediante la ecuación 5
Donde: COST UNIT EL es el costo unitario de cada examen de laboratorio; ND es el número de determinaciones realizadas a cada paciente.
El costo de cada prueba imagenológica (CPI) se determinó por la ecuación 6
Donde: COST UNIT PI es el costo unitario de cada prueba imagenológica; CV es la cantidad de veces realizada a cada paciente.
Costo por eventos adversos (solo para la EE a partir del EC fase III). El costo por concepto de evento adverso (CEA) se calculó mediante el costo de cada fármaco empleado, teniendo en cuenta el esquema de tratamiento estipulado.
El costo total de la atención sanitaria recibida por cada paciente (CTAP) por alternativa de tratamiento se calculó mediante la suma de los valores por cada concepto. En la EE realizada a partir del EC fase III, se calculó mediante la ecuación 7.
Donde: CTTO es costo del tratamiento con nimotuzumab + RT o placebo + RT; CC, es el costo de consulta; CEL es el costo de examen laboratorio; CPI es el costo de prueba imagenológica y CEA es el costo por evento adverso.
En la EE realizada a partir del EC fase IV, se determinó a partir de la ecuación 8.
Donde: CTTO es el costo del tratamiento con nimotuzumab + RT o nimotuzumab + quimiorradioterapia (QRT) o nimotuzumab + QT o nimotuzumab; CC es el costo de consulta; CEL es el costo del examen de laboratorio y CPI es el costo de prueba imagenológica.
Los costos de los recursos utilizados en cada administración de placebo/nimotuzumab; de los medicamentos empleados en la QT y de los fármacos para tratar los EA se obtuvieron de la base de precios unitarios 2019 de la Subdirección Económica de la Empresa Comercializadora y Distribuidora de Medicamentos (EMCOMED). En el caso del HHA, la información se obtuvo de los registros de costos 2019 de la Subdirección Económica de este hospital.
Los datos de los test específicos utilizados en el protocolo, que no estaban recogidos en la base del MINSAP, se obtuvieron de los registros de costos del HHA.
Para el cálculo del ACE se determinó el costo promedio de cada alternativa.
El tipo de moneda utilizado en este estudio fue el peso cubano (CUP), que se expresa bajo el símbolo de pesos ($). Los costos se calcularon a precios del año 2019.
Medición del análisis costo-eficacia
Los parámetros utilizados fueron costo/efectividad medio (CEM) y la razón coste-efectividad incremental (RCEI). El CEM se obtuvo para cada opción de tratamiento, al dividir el costo promedio (C) entre la eficacia/efectividad promedio en AVG (E) de cada alternativa (CEM = C/E). Se comparó el valor de cada CEM y se seleccionó la alternativa más eficiente, las alternativas dominadas (produce peores resultados que la mayoría de las alternativas con costos más elevados) y las dominantes (produce mejores resultados en salud con costos asociados menores) en cada EE. El CEM se expresó con el indicador $/AVG.
Se estimó el costo incremental ∆C (diferencia de los costos de cada opción) y la eficacia/efectividad incremental (diferencia entre las eficacias/efectividades de cada tratamiento, ∆E). Con las diferencias obtenidas, se calcularon las RCEI (ecuación 9) al dividir el costo incremental entre la eficacia incremental (∆C/∆E).11
Donde: CA es el costo de la alternativa más costosa; C es el costo de la alternativa menos costosa; EA es la efectividad de la alternativa más costosa; y EB es la efectividad de la alternativa menos costosa.
En el caso de la EE realizada a partir del EC fase IV, las cinco alternativas de tratamiento se organizaron en orden de menor a mayor efectividad y se calculó la RCEI de una opción con respecto a la otra.
Luego, se realizó un análisis de dominancia y se fueron excluyendo las alternativas dominadas, para finalmente, poder calcular la RCEI entre las dos alternativas dominantes.
Cada RCEI se expresó en unidades monetarias adicionales necesarias para ganar un año de vida extra por paciente ($/AVG adicional).
Regla de decisión
Para decidir si las tecnologías evaluadas fueron costo-efectivas, se utilizó como regla de decisión el criterio de selección de intervenciones costo-efectivas (CHOICE), del inglés CHOsing Interventions that are Cost-Effective recomendado por la Comisión de Macroeconomía y Salud de la Organización Mundial de la Salud (OMS), para países que no tienen establecido un umbral de decisión, como es el caso de Cuba.14
Los resultados de RCEI de cada EE se compararon con el producto interno bruto (PIB) per cápita de Cuba que está disponible en la literatura ($9601/habitante en el año 2020).15
Se consideró que si los valores de RCEI estaban por debajo de tres veces el valor del PIB per cápita ($28 803), las tecnologías evaluadas eran costo-efectivas.
Análisis de sensibilidad
En ambas EE, se realizaron análisis de sensibilidad (AS), tanto determinístico como probabilístico para las variables costo y eficacia/efectividad.11,16
Análisis de sensibilidad determinístico
Se realizó un AS univariado y bivariado. Se analizó el peor (mínima eficacia y mayor costo) y mejor escenario (mínimo costo y máxima eficacia/efectividad). Se efectuaron cambios en las variables costo y eficacia/efectividad en cada opción analizada. Se utilizaron variaciones de ± 10 % y ± 5 % con respecto al resultado del caso base (CB) en cada variable, según guía de evaluaciones económicas de México.17 Se obtuvo un valor de RCEI con cada variación efectuada y se realizó un diagrama de tornado.
Análisis de sensibilidad probabilístico
Para las variables costo y eficacia/efectividad, se realizaron 1000 simulaciones Monte Carlo, mediante el uso de macros en Excel 13.0 para cada grupo de tratamiento y las simulaciones, se hicieron mediante programación en Visual Basic para aplicaciones (VBA).11,16
Con las 1000 simulaciones, se generaron las curvas de aceptabilidad. Cada conjunto de costos y efectos (eficacia/efectividad) se transformó en beneficio neto monetario (BNM) con la ecuación 10:
Donde: BNM es beneficio neto monetario; λ es umbral aceptabilidad; E es eficacia/efectividad de cada opción; C es costo de cada opción; λ = $28 803 (3 veces el PIB per cápita).
Se registró el número de veces que cada una de las alternativas obtuvo el mayor valor de BNM. La probabilidad de que cada alternativa fuese costo-efectiva, fue la proporción de veces que obtuvo el mayor beneficio neto.
El rango de probabilidades varía de 0 a 1. Por tanto, el valor de BNM se transformó en 0 y 1 mediante la ecuación 11:
Donde: BNMa es valor del beneficio neto monetario de la primera opción; BNMb es el valor del beneficio neto monetario de la última opción analizada; 1 es costo-efectivo; 0 no es costo-efectivo.
Se plotearon en el eje X los valores de disponibilidad a pagar y en el eje Y las probabilidades de cada alternativa de ser costo-efectiva, con el objetivo de obtener la curva de aceptabilidad para cada una de las opciones analizadas.
Análisis de impacto presupuestal
El AIP se desarrolló de acuerdo a la Guía para la Conducción de Estudios de Evaluación Económica de México17) y la metodología planteada por la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados (ISPOR).18
Se estimó el impacto presupuestario de la incorporación del nimotuzumab en el SNS cubano en el tratamiento de pacientes diagnosticados con CCECC en estadios avanzados. El estudio se realizó desde el punto de vista del SNS.10,11,17,18 El horizonte temporal fue de cinco años (2021-2025).
Para la determinación de la población con la enfermedad se tuvo en cuenta los datos de incidencia y prevalencia en adultos diagnosticados con CCECC.
La incidencia se obtuvo desde el año 2009 hasta el 2017 (1697, 1947, 2445, 2306, 2351, 2338, 2818, 2906 y 2998 casos, respectivamente). Con esos datos, se realizó una proyección mediante un modelo de regresión lineal de los años 2018-2025 y se tomaron para el AIP, los valores del año 2021 al año 2025. Se utilizó el programa Excel versión 13.0. La fuente de información fueron los anuarios estadísticos de salud de Cuba 2012-2020.
Del Registro Nacional de Cáncer Cuba (RNC) 2019 se obtuvieron los datos de prevalencia de los años 2012-2015 (2741, 2987, 3570 y 3167 casos, respectivamente). Al contar con la información, tanto de incidencia como de prevalencia de los años referidos, se utilizó la relación entre ambos valores mediante la ecuación (12).
Se calcularon los valores de R para los años 2012-2015. A esos valores de R obtenidos se les calculó el promedio.
Se determinaron los valores de prevalencia de los años 2021-2025. Se sustituyó en la ecuación 12 el valor promedio de R y los valores de incidencia de los años 2021-2025 obtenidos de la regresión lineal efectuada.
Para la población diana se tuvo en cuenta los datos de prevalencia con los pacientes con CCECC. Se asumió que el 45 % correspondió a estadios III/IV, de acuerdo al comportamiento reportado de la enfermedad en el RNC. Los valores obtenidos conformaron la población diana empleada en el cálculo del impacto presupuestal.
En el escenario actual se consideró solamente el esquema de tratamiento QRT (sin la adición de nimotuzumab):
RT: dosis máxima tolerada de 76 Gy con cobalto 60 o acelerador, en un esquema fraccionado de 1,8 o 2,0 Gy/diarios cinco veces por semana, hasta completar dosis indicada. Para el AIP, se consideró un supuesto de administrar la mayor dosis (76 Gy) fraccionada en 2,0 Gy diarios por 5 días a la semana, lo que arrojó un total de 38 sesiones de RT. Por lo tanto, serían 7,6 semanas que se aproximaron a 8 semanas.
QT: Cisplatino 100 mg/m2 en los días 1, 22 y 43 concomitante con RT.
Para conocer el costo de esta opción, se utilizó la ecuación 13:
Donde: CESN es costo estimado sin nimotuzumab; CTSN es costo del tratamiento sin nimotuzumab; PD es población diana; TPA es la tasa de penetración anual.
En el escenario futuro, se consideró la adición de nimotuzumab al esquema combinado QRT. Se planteó un análisis comparativo de dos pautas de administración: esquema A, según lo dispuesto en el Formulario Nacional de Medicamentos (FNM)19 y esquema B, según los resultados en el EC realizado en la India, con la combinación nimotuzumab y QRT.20
El esquema A se desarrolló en dos etapas:
Inducción: nimotuzumab 200 mg semanal por 6 semanas concomitante a la QRT (se tomó una semana igual a siete días, por lo que serían seis semanas igual a 42 días).
Mantenimiento: nimotuzumab 200 mg semanal cada 15 días hasta la progresión del paciente.
Para el cálculo del número de administraciones de mantenimiento en un año, se asumió que un año es igual a 365 días. Por tanto, se le restaron los 42 días de la fase de inducción, lo que dio como resultado 323 días. Este valor se dividió entre 15 (cantidad de días entre cada administración) y se obtuvo un valor de 21,53 administraciones, las cuales se aproximaron a 21. Por lo tanto, en el año, hubo un total de 27 administraciones por paciente.
Esquema B:
Nimotuzumab 200 mg semanal por ocho semanas concomitante a la QRT. Se incluyen dos semanas extras, donde se tuvo en cuenta, la posible suspensión por toxicidad de la RT y/o QT.
Para conocer el costo de esta opción (CECN), se utilizó la ecuación 14:
Donde: CECN es costo estimado con nimotuzumab; CTSN es costo del tratamiento sin nimotuzumab; PD es población diana; TPA es tasa de penetración; CTN es costo del tratamiento con la adición del nimotuzumab de acuerdo a los esquemas A o B.
Los costos de cada procedimiento utilizado se obtuvieron del registro de costos de la Subdirección Económica del HHA:
RT: cada sesión tuvo un costo de $127,88.
QT: cada bulbo de cisplatino 50 mg tuvo un costo de $61,29. Se realizó el cálculo bajo el supuesto de que, un adulto promedio tiene 1,7 m2 de superficie corporal, y la dosis establecida es de 100 mg/m2. Para este procedimiento se necesitaron cuatro bulbos.
El tratamiento QRT por paciente se calculó con la suma del costo de RT y QT.
Nimotuzumab: cada bulbo de 50 mg tuvo un costo de $320,435 (base de datos de EMCOMED) y la dosis establecida es de 200 mg. Por tanto, se utilizaron cuatro bulbos por dosis, y para estimar el costo del tratamiento con nimotuzumab, se multiplicó el costo de una dosis por la cantidad de administraciones de cada esquema.
El costo por paciente de QRT más nimotuzumab, según esquema de tratamiento, se determinó sumando en cada caso, los costos de RT, QT y nimotuzumab.
Al no contar con información precedente sobre el comportamiento de la cobertura con la opción de QRT para el escenario actual, se asumió que tuviese cobertura del 100 % para cada año. Para el escenario futuro se asumió que el AIP tuviese una tasa de penetración en el primer año del 80 % para los pacientes con el tratamiento actual y del 20 % con el tratamiento actual más nimotuzumab; para el segundo año, del 60 % y el 40 %; para el tercer año, del 40 % y el 60 %; para el cuarto año, del 20 % y el 80 % y para el quinto año, el 100 % de los pacientes recibiría la combinación QRT más nimotuzumab.
Se realizó un AS determinístico univariado con los valores anuales de impacto presupuestal y se calculó su media, valor que fue considerado como CB. El precio de nimotuzumab tuvo una variación entre ±10 % y ±5 %, y la población diana osciló en un rango de ±20 %. Las cifras obtenidas se compararon con el CB, y de esta forma, se evaluó la influencia de ambas variables en el AIP del uso de nimotuzumab. Se construyó un gráfico de tornado y se realizó un AS para ambos esquemas.
Resultados
Se analizaron los datos de los 492 sujetos incluidos en los EC, 106 pertenecieron al EC fase III y 386 al EC fase IV.
En ambas EE a partir de los EC fases III y IV, respectivamente, predominaron los pacientes de género masculino (78,3 % y 80,3%), color de la piel blanco (77,3 % y 82,1 %), estado general 0-1 (99,0 % y 94,0 %) y estadio IV (58,5 % y 66,6 %). La media de edad fue de 62 años en el primer estudio y 61 años en la segunda investigación.
En el EC fase III, la combinación RT + nimotuzumab tuvo una mayor supervivencia global (SG) con una media y mediana de 22,7 y 12,5 meses, respectivamente.
En el EC fase IV, el esquema de tratamiento que tuvo una mayor SG fue RT/QT secuencial + nimotuzumab con una media y mediana de 30,16 y 24,88 meses, respectivamente. La alternativa de menor SG fue nimotuzumab como monoterapia con una media de 12,83 meses y mediana de 8,3 meses.
En el EC fase III, la alternativa más costosa fue nimotuzumab + RT con un costo total de $217 695,15 y un costo promedio de $4031,39 por paciente tratado. En el EC fase IV, la alternativa más costosa fue la combinación RT/QT concomitante + nimotuzumab con un costo total de $7 015 389. En este orden le siguieron las siguientes opciones: nimotuzumab ($3 233 865,39), RT/QT secuencial + nimotuzumab ($2 810 598,15), RT + nimotuzumab ($2 529 490,25) y finalmente, QT + nimotuzumab ($1 518 548,07).
La combinación de mayor costo promedio fue RT/QT secuencial + nimotuzumab con $66 919,00/paciente. Le siguen: RT/QT concurrente + nimotuzumab ($63 776,27/paciente), RT + nimotuzumab ($56 210,89/paciente), QT concurrente + nimotuzumab ($26 181,90/paciente) y, por último, nimotuzumab ($24 685,99/paciente).
El costo total del EC fase III fue de $329 726, 13. La partida de mayor costo fue el tratamiento con un valor de $289 975,56, que constituyó el 87,9 % del costo total del ensayo. De este costo total de tratamiento, el 64,6 % correspondió a la RT, el 34,2 % al tratamiento con nimotuzumab y el 1,1 % al placebo.
El costo total del EC fase IV fue $17 107 891,55. Al igual que en el EC fase III, la partida de mayor costo fue el tratamiento con un valor de $16 644 105,55, el cual constituyó el 97,3 % del costo total del ensayo. De este costo total de tratamiento, el 1,6 % correspondió a la QT, el 21,7 % a la RT y el 76,7 % al tratamiento con nimotuzumab.
La opción nimotuzumab + RT tuvo el costo promedio más elevado y una mayor eficacia ($4 031,39/paciente y 1,893 AVG). El valor de RCEI fue $4501,08 adicionales por cada AVG adicional por paciente, es decir, por cada año extra de vida de un paciente con CCECC en estadio avanzado, el SNS debe asumir un costo adicional por paciente de $4501,08 (tabla 1).
Tabla 1 - Costo promedio, eficacia promedio, CEM y RCEI de cada alternativa de tratamiento. EC fase III, años 2002-2008
|
CP |
CI |
|
EI |
|
|
|
|---|---|---|---|---|---|---|
| Placebo + RT | 2154,44 | 1876,95 | 1,476 | 0,417 | 1459,65 | 4501,08 |
| Nimotuzumab + RT | 4031,39 | - | 1,893 | - | 2129,63 | - |
RT, radioterapia; CP, costo promedio; CI, costo incremental; EI, eficacia incremental; AVG, años de vida ganados; CEM, costo-eficacia medio; RCEI, razón costo eficacia incremental.
El valor de la RCEI obtenido fue menor que el PIB per cápita ($9601),15 por lo que la tecnología evaluada fue muy costo-efectiva.
En el segundo estudio, las opciones de tratamiento se organizaron de acuerdo a su efectividad media en orden ascendente (tabla 2).
Tabla 2 - Costo promedio, efectividad media, CEM y RCEI en cada alternativa de tratamiento. EC fase IV, años 2009-2013
|
CP |
CI |
|
EI |
|
|
|
|---|---|---|---|---|---|---|
| D | 24 685,99 | N/A | 1,070 | N/A | 23 071,02 | N/A |
| E | 26 181,90 | 1495,91 | 1,272 | 0,202 | 20 583,25 | 7405,49 |
| A | 56 210,89 | 30 028,99 | 1,901 | 0,629 | 29 569,12 | 47 740,84 |
| B | 63 776,27 | 7565,38 | 2,032 | 0,131 | 31 385,96 | 57 750,99 |
| C | 66 919,00 | 3142,73 | 2,514 | 0,482 | 26 618,54 | 6520,19 |
A, RT+ nimotuzumab; B, RT + QT concurrente + nimotuzumab; C, RT + QT secuencial + nimotuzumab; D, monoterapia con nimotuzumab; E, QT concurrente + nimotuzumab; CP, costo promedio; CI, costo incremental; EI, efectividad incremental; AVG, años de vida ganados; CEM, costo-efectividad medio; RCEI, razón costo efectividad incremental; N/A, no aplicable.
A mayor efectividad media se incrementa el costo promedio. En este caso, el esquema RT/QT secuencial + nimotuzumab fue el de mayor efectividad media y costo promedio más elevado con 2,514 AVG y $66 919,00 (tabla 2). En ese orden, le siguieron las opciones: RT/QT concurrente + nimotuzumab con 2,032 AVG y $63 776,27, RT + nimotuzumab con 1,901 AVG y $56 210,89, QT concurrente + nimotuzumab con 1,272 AVG y $26 181,90 y, por último, nimotuzumab con 1,070 AVG y $24 685,99.
Al comparar el CEM de cada alternativa, la opción que presentó la mejor relación costo-efectividad fue QT concurrente + nimotuzumab (E) con $20 583,25/AVG, aunque no fue la de mayor efectividad. Cuando se compara esta opción, con la que tuvo menor costo medio (esquema D, nimotuzumab), se observa que su cociente costo/efectividad fue mayor ($23 071,02/AVG), por lo que fue menos eficiente y es una opción dominada, por lo tanto, se eliminó de este análisis.
Al evaluar las otras tres alternativas (A, B y C), se observó que el esquema C (RT/QT secuencial + nimotuzumab) tuvo mayor efectividad media que los esquemas A (RT + nimotuzumab) y B (RT/concurrente + nimotuzumab), así como, tuvo una mejor razón costo/efectividad ($26 618,54/AVG) en comparación con los esquemas anteriores ($31 385,96/AVG y $29 569,12/AVG, respectivamente). Estos resultados indicaron, que las opciones A y B fueron dominadas por C y, por lo tanto, se excluyeron del análisis.
Para el cálculo de la RCEI se tuvo en cuenta las opciones dominantes: C (RT/QT secuencial + nimotuzumab) y E (QT concurrente + nimotuzumab).
La diferencia de los costos incrementales entre las opciones (∆C) fue de $40 737,10 y la efectividad incremental (∆E) 1,242 AVG. El valor de la RCEI fue $32 799,60/AVG adicional, es decir, por cada año extra de vida de un paciente con CCECC en estadio avanzado, el SNS deberá invertir $32 799,60 adicionales.
De acuerdo con la regla de decisión establecida, se observa que el valor de la RCEI fue mayor que el umbral establecido de tres veces el PIB per cápita del país ($28 803,00).15) Por lo tanto, la tecnología fue no costo-efectiva para su uso generalizado en el SNS, por lo que se tendrá que evaluar esta estrategia farmacoterapéutica con una prioridad escalonada e individualizada. Esta opción más costosa, se podrá destinar para los pacientes no respondedores a la aplicación de esquemas de tratamientos menos costosos.
El análisis determinístico realizado en el primer estudio farmacoeconómico arrojó que, tanto en el peor, como en el mejor escenario la tecnología fue muy costo-efectiva. Los valores de RCEI obtenidos fueron $5491,06 AVG extra/paciente y $3688,31 AVG extra/paciente para el peor y mejor escenario, respectivamente.
El AS determinístico para la segunda evaluación económica, entre las opciones QT concurrente + nimotuzumab vs. RT/QT secuencial + nimotuzumab; arrojó en la mayoría de los escenarios, que la alternativa no fue costo-efectiva, resultado similar al CB. Solo en tres de los escenarios, la opción resultó ser costo-efectiva: mejor escenario con una disminución del costo y un aumento de la efectividad del 10 %, en ambos casos ($26 839,96/AVG extra), un 10 % de disminución del costo y aumento del 5 % en la efectividad ($28 116,10/AVG extra), y un 5 % de disminución del costo y aumento del 10 % en la efectividad ($28 331,08/AVG extra). En los tres casos, los valores de las RCEI estuvieron por debajo del umbral establecido ($28 803,00).
Las curvas de aceptabilidad para el análisis probabilístico de las evaluaciones económicas realizadas, se muestran en las figuras 1 y 2, respectivamente.
Se observa que a medida que existe una mayor disponibilidad de presupuesto a pagar para conseguir una unidad adicional de eficacia, expresada en AVG, la opción nimotuzumab + RT será la más costo-efectiva. Por ejemplo, para una disponibilidad de $7500, $9500 y $10 000, la opción será costo-efectiva en un 52,1 %, 52,5 % y 52,7 %, respectivamente. Por su parte, la opción placebo + RT con igual disponibilidad de presupuesto, disminuirá su posibilidad de ser costo-efectiva en 47,9 %, 47,5 % y 47,3%, respectivamente (fig. 1).
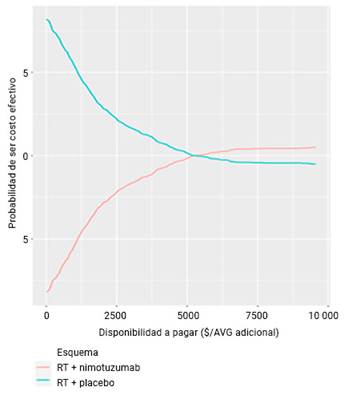
Fig. 1 - Curva de aceptabilidad de ser costo efectivo, resultados del AS probabilístico para evaluar la influencia de los parámetros sobre la RCEI. Evaluación económica EC fase III, 2002-2008.
A medida que exista una mayor disponibilidad de presupuesto a pagar para conseguir una unidad adicional de eficacia, expresada en AVG, la opción RT/QT secuencial más nimotuzumab será más costo-efectiva (fig. 2). Por ejemplo, para una disponibilidad de $10 000, $20 000 y $30 000, la opción será costo-efectiva en un 10,4 %, 18,2 % y 23,3 %, respectivamente.

Fig. 2 - Curva de aceptabilidad de ser costo-efectivo. Resultados del AS probabilístico para evaluar la influencia de los parámetros sobre la RCEI. Evaluación económica EC fase IV, 2009-2013.
Las opciones RT + nimotuzumab y RT/QT concurrente + nimotuzumab, serán más costo efectivas con el aumento de la disponibilidad a pagar, pero en menor medida (10,8 %, 15,3, % y 17,0 % para el caso de RT + nimotuzumab; y 8,4 %, 10,0 % y 15,0 % para la opción RT/QT concurrente + nimotuzumab). Por el contrario, las alternativas nimotuzumab y QT + nimotuzumab para esos mismos umbrales de presupuesto, disminuirán su posibilidad de ser costo efectivas (34,7 %, 22,8 % y 17,1 % para el esquema nimotuzumab, y 35,7 %, 29,7 % y 23,0 % para el caso de QT + nimotuzumab).
Análisis de impacto presupuestario
Se obtuvieron los datos de incidencia de los años 2018 al 2025, a través del modelo de regresión lineal y se tomaron para el AIP, los valores 2021- 2025 (3862, 4034, 4207, 4379 y 4552 casos, y = 182,32x + 1 591,3 R2 = 0,8248).
Los valores de R obtenidos para período 2012-2015 fueron 1,29, 1,27, 1,25 y 1,12 respectivamente, y su valor promedio fue 1,23. Con el valor de promedio de R y los datos de incidencia de los años 2021-2025 se obtuvieron los valores de prevalencia para el mismo período: 4763, 4975, 5188, 5400 y 5613, respectivamente.
A partir de los datos anteriores se obtuvieron los valores de prevalencia para estadios III/IV en el período 2021-2025, y que correspondieron con la población diana establecida (1738, 1815, 1893, 1971 y 2048 casos, respectivamente).
Para el escenario actual, el tratamiento fue QRT, bajo al supuesto de 38 sesiones de RT a un costo unitario de $127,88, se estimó que el costo total de RT fue $4859,44/paciente.
Para el caso de la QT, de acuerdo al costo del bulbo de cisplatino, la dosis establecida y el supuesto de superficie corporal en un adulto promedio; se estimó que el costo total de cada ciclo fue $245,16/paciente. Los tres ciclos tuvieron un costo de $735,48/paciente y el tratamiento QRT por paciente tuvo un costo de $5594, 92.
Para el escenario futuro, el costo de cada bulbo de nimotuzumab 50 mg y para una dosis de 200 mg tuvo un resultado de $1281,74/paciente.
De acuerdo al esquema del FNM, las administraciones de nimotuzumab fueron 27 en un año, por lo que se estimó un costo total por paciente de $34 606,98.
De acuerdo al esquema de la India, el nimotuzumab se administró semanalmente de manera concomitante a la QRT y bajo el supuesto de tratamiento de ocho semanas, se estimó un costo total por paciente de $10 253,92.
La administración de QRT + nimotuzumab, según esquema cubano, tuvo un costo de $40 201,90/paciente, y de acuerdo al esquema hindú, $15 848,84/paciente.
La adición de nimotuzumab a QRT, según el esquema del FNM, tuvo un costo entre $12-70 millones de pesos para el SNS. El valor promedio del presupuesto para el caso base durante los años 2021-2025 fue de $40 380 808,54.
El esquema hindú, arrojó un impacto presupuestal aproximado entre 3 y 21 millones de pesos cubanos. El valor promedio del presupuesto para el caso base en el quinquenio 2021-2025 fue $11 964 684,01.
En ambos casos para un horizonte de cinco años, tasa de penetración fue del 20 % al 100 % con pasos del 20 %, para la población diana seleccionada, y bajo los supuestos de tratamientos establecidos.
El impacto presupuestal disminuyó significativamente de 12-70 millones de pesos, según esquema del FNM, a 3-21 millones de pesos, de acuerdo al esquema hindú. Como se puede apreciar, existe una marcada diferencia entre ambos esquemas, con una media en el período analizado, de $28 416 124,53 millones de pesos cubanos.
Análisis de sensibilidad del análisis de impacto presupuestario
De acuerdo a las variaciones efectuadas, en las variables costo de nimotuzumab y población diana; el cambio en esta última variable (análisis de impacto presupuestario) fue el que más influencia tuvo en la comparación de los valores obtenidos con el CB.
En el caso del esquema del FNM, la variación en ± 20 % de la población diana, representó 16 millones de pesos cubanos, un valor superior a los obtenidos al cambiar el precio de nimotuzumab en cualquiera de las dos opciones (± 5 %, ± 10 %). En el caso del esquema hindú, la variación en ± 20 % de la población diana, representó poco menos de cinco millones de pesos cubanos, lo cual fue superior a los valores obtenidos, si se modificara el precio de nimotuzumab entre un ± 5 % y un ± 10 %.
Discusión
El predominio del sexo masculino coincide con la literatura, en el que el mayor porcentaje de pacientes con CCECC es en el sexo masculino, debido a que, entre otros factores, consumen más tabaco y alcohol.1,21,22 En relación con la edad, estos resultados concuerdan con el Anuario Estadístico de Salud de Cuba 2021, en el que se puede observar, que este tipo de cáncer es más frecuente en el grupo de edad entre 60 y 79 años.1
La eficacia y seguridad de nimotuzumab en pacientes con tumores irresecables avanzados de cabeza y cuello de nuevo diagnóstico han sido evaluadas en diferentes estudios clínicos, controlados y aleatorizados. Las reacciones adversas relacionadas con el monoclonal, son en su mayoría, de intensidad leve-moderada.23,24 Nimotuzumab es el AcM más seguro de su clase, ya que se dirige selectivamente a las células tumorales con alta expresión del receptor, sin unirse a los tejidos normales.23
Los diferentes EC realizados, confirman los beneficios en salud en términos de supervivencia libre de progresión (SLP) y SG de la combinación de nimotuzumab más QRT, en población abierta de pacientes recién diagnosticados con CCC en estadios avanzados, en comparación con la administración de nimotuzumab como monoterapia, o combinado a QT, o RT.23,24,25
El estudio fase III RTOG 0522 evaluó la hipótesis que agregar cetuximab a RT más cisplatino con una dosis de 100 mg/m² mejoraría la SLP. La adición de cetuximab no aumentó SLP, SG, control locoregional (CL) o metástasis a distancia. El régimen de administración del cetuximab, causa efectos adversos más graves, que tienen un impacto negativo sobre el cumplimiento de la RT y neutraliza cualquier beneficio potencial en el control tumoral.26
En el estudio CONCERT-1, 153 pacientes fueron aleatorizados a recibir QRT o panitumumab más QRT. No hay diferencias en CL, SLP y SG entre los dos brazos, y las reacciones adversas graves y muy graves (disfagia, mucositis y radiodermitis) son más frecuentes en el grupo de panitumumab.27
En otras investigaciones llevadas a cabo con la utilización de los regímenes de platino combinados con el cetuximab se obtienen valores de SG menores28,29,30,31 que los reportados en este EC fase IV con la combinación nimotuzumab más QT. En otros estudios se han obtenido medianas de SG de 10,1 meses y 9,2 meses con la combinación de QT más cetuximab32,33 y ambos valores son ligeramente menores al obtenido con la combinación del nimotuzumab + QT (10,5 meses).
La combinación QRT más nimotuzumab es la opción que aporta mejores resultados de SV. Esta alternativa requiere un monto de más de $60 000 por paciente, para lograr tasas de SV a los 12 meses mayores del 70 %, de acuerdo al esquema utilizado en el EC fase IV. La RCEI de esta combinación frente a QT más nimotuzumab es $32 799, 60/AVG, lo que significa que el SNS debe invertir esa cifra por paciente para ganar un AVG adicional.
Lo anterior concuerda con los análisis económicos reportados en los EC con medicamentos para el tratamiento del cáncer,34 en los cuales los fármacos aprobados recientemente tienen costos incrementales mayores que los tratamientos aprobados para la misma indicación en años anteriores.
Una revisión del Instituto Nacional de Salud y Excelencia Clínica (NICE) (del inglés, The National Institute for Health and Care Excellence) sobre la combinación QT basada en platino más cetuximab, arroja un valor de RCEI de £166 307/años de vida ajustados por calidad (AVAC), que está por encima del umbral aceptado por NICE (£20 000-£30 000) para el financiamiento de nuevas estrategias de tratamiento. La decisión de NICE es no recomendar el uso del cetuximab para pacientes con CCECC recurrente o metastásico.35
Los criterios para situaciones terminales establecidos por NICE para las excepciones a su umbral de eficiencia, deben revisarse para cada paciente puntualmente36) o recurrir al Fondo para Drogas contra el Cáncer. En el año 2017, la RCEI promedio para medicamentos aprobados en cánceres avanzados fue de £53 887/AVAC (USD 69 600,84/AVAC) y para medicamentos contra el cáncer no avanzado fue de £41 810/AVAC (USD 54 002,10/AVAC).37
De acuerdo a Hannouf y otros, el costo de la adición de cetuximab a QT de primera línea basada en platino en el tratamiento de pacientes con CCECC recurrente o metastásico es USD 36 000 por paciente (83,5 % del PIB per cápita) y una RCEI de USD 386 000/AVAC. Este valor está por encima del umbral de disponibilidad a pagar por el SNS de Canadá (USD 82 870/AVAC), por lo que la adición de cetuximab a la QT basada en platino no es eficiente, como tratamiento de primera línea para pacientes con CCECC recurrente o metastásico.38)
En China, la combinación cetuximab más QRT de acuerdo a investigación de Lang y Dong, tiene un costo promedio de USD 27 182 (259 % del PIB per cápita), un CEM de USD 21 488/AVG (USD 40 631/AVAC) y una RCEI de USD 97 676/AVG (USD 172 702/AVAC adicional). La combinación QT más cetuximab es una estrategia no costo-efectiva para los pacientes con CCECC recurrente o metastásico, de acuerdo, a la disponibilidad a pagar en China (USD 30 201).39
Los resultados de RCEI de la evaluación económica realizada con la estrategia QRT más nimotuzumab, concuerdan con los estudios mencionados anteriormente,38,39 en los cuales el valor de la RCEI sobrepasa el valor umbral establecido. No obstante, el nimotuzumab está aprobado en las guías cubanas de tratamiento para el CCECC40 y en el FNM,19 lo que sugiere que el costo de su introducción es un valor que el SNS puede estar dispuesto a pagar, para lograr resultados en salud con un fármaco seguro, de calidad y de producción nacional. Por lo tanto, se podría establecer a partir de los resultados de este estudio, un umbral de $33 000/AVG para fármacos oncológicos en Cuba.
Por otra parte, el registro del nimotuzumab para su uso en pacientes con CCECC tiene 19 años de aprobación, por lo que se podría reevaluar su precio unitario. Otra solución, podría ser un cambio de la pauta terapéutica presentada en las guías clínicas cubanas para el manejo de esta localización de cáncer, para tratar de buscar otras alternativas efectivas, y que, a la vez, sean eficientes.
En la actualidad, cada vez es mayor la necesidad de realizar un AIP de conjunto con los análisis de costo-efectividad y costo-utilidad. Muchos países de Europa y Norte-América exigen de forma explícita la realización de AIP, ya que estos estudios son considerados como un elemento necesario para la toma de decisiones y van a complementar la evaluación económica.41
El esquema de tratamiento del nimotuzumab, de acuerdo al EC desarrollado en la India, fue de curso corto de administración y logra un costo evitado que oscila entre ocho y cincuenta millones de pesos cubanos. Estos valores no son despreciables, sobre todo en un momento actual, donde la situación epidemiológica aumenta la demanda de los recursos sanitarios, mientras que su disponibilidad es cada vez más limitada.
Lo anterior, contribuiría a hacer más asequible económicamente a este fármaco en las instituciones de salud, ya que el gasto en medicamentos oncológicos representa el 41 % del presupuesto destinado a medicamentosa y constituye el 29 % de los fármacos que se importan por el país.b
Esta propuesta posibilitaría un porcentaje mayor de cobertura y facilitaría la equidad en la atención a la población candidata al tratamiento con nimotuzumab. Además, permitiría a los decisores de salud, reubicar y utilizar, una parte del presupuesto destinado a las compras del fármaco para otras crecientes y no satisfechas necesidades de salud que tiene la población cubana.
La población diana es el parámetro que más incidiría en el presupuesto destinado a sufragar esta terapia; por lo que destinar un monto de recursos económicos para la prevención de la enfermedad, sería una opción a valorar en términos de eficiencia. Además, se debe prestar atención a las variaciones mayores a las analizadas (± 20 %) para reducir su incertidumbre y, por tanto, su efecto en los resultados alcanzados.
Limitaciones de las evaluaciones económicas e impacto presupuestal
La limitación principal que tuvo el estudio fue que se realizó sobre la base de fuentes de información retrospectivas, es decir, fue un análisis económico a partir de los datos obtenidos de EC terminados, los cuales en su diseño no contemplaron la realización de una evaluación económica.
Las limitaciones pudieran calificarse en dos sentidos: la primera es con respecto a las medidas de eficacia/efectividad y epidemiológicas; y la segunda con respecto al cálculo de los costos.
Respecto a las medidas de eficacia/efectividad y epidemiológicas
Se trabajó con una medida de los efectos físicos (AVG) y no con una de forma utilitaria (AVAC/años de vida ajustados por discapacidad (AVAD). Este aspecto se debe a que no se pudo medir la calidad de vida relacionada con la salud (CVRS) en los EC, y que, en Cuba no existen trabajos previos de medición de este parámetro en pacientes con CCECC.
Debido a lo anterior, el criterio de decisión CHOICE -OMS se estableció para los AVG y no para los AVAC/AVAD, como está estipulado en el uso de esta regla. La consecuencia del uso de esta medida, es que se puede subestimar la RCEI. La forma de eficiencia que se obtiene es de gestión y no de forma asignativa.
No obstante, el registro del medicamento implica que el MINSAP esté dispuesto a utilizarlo según los precios que se muestran en este trabajo; por lo que se puede considerar que el valor umbral de $33 000/AVG puede ser aceptable para este tipo de fármaco.
Otra limitante es la no disponibilidad de datos epidemiológicos desglosados de la totalidad de pacientes con CCC reportados al RNC por etapas clínicas y aquellos, que presentan una recurrencia o enfermedad metastásica evolutiva, así como, la carencia de información sobre la cobertura actual del fármaco. Este aspecto no permite hacer una estimación más exacta en las variables que pueden influenciar en el impacto presupuestario.
Sin embargo, los supuestos y métodos de imputación utilizados (por ejemplo, que la cobertura inicial fuese del 100 % y la proyección del número de casos) redujo, considerablemente, la posibilidad de haber subestimado el impacto presupuestario. En el futuro, la industria biofarmacéutica deberá coordinar con el MINSAP la información sobre la demanda interna del fármaco, para tener una estimación del potencial de venta interno del producto en el país.
Respecto al cálculo de los costos
La mayoría de los centros que participaron en el estudio, no tenían un sistema de costos actualizado, por lo que se tuvo que adoptar y extrapolar los costos de una sola institución, en este caso el HHA, o de la información de la Base de Costos Estandarizados del MINSAP, así como también, de la Base de Precios de Medicamentos de EMCOMED. Esto podría haber sobreestimado la estimación de los costos, para centros con menor cantidad de camas y nivel tecnológico limitado. No obstante, a esta situación existente, se utilizaron bases nacionales de costos, tal y como se recomienda en la literatura.11
Es de señalar, que los límites de las variables escogidas para realizar los análisis de sensibilidad, permiten afirmar que los resultados finales del estudio son robustos e incluir la información de los costos que no fue posible recolectar.
Los cambios actuales en la economía del país implican que, una vez que se hayan culminado estos ajustes, se deben recalcular los costos obtenidos con una información más actualizada que pueda influir en los resultados de esta investigación, con vista a la toma de decisiones en el campo sanitario.
Conclusiones
En la evaluación económica realizada en el EC fase III, en el que se comparan las opciones RT y RT más nimotuzumab, se constata que la combinación es una opción eficiente y está por debajo del umbral de RCEI aceptable para el país, de acuerdo a criterio CHOICE-OMS. En la evaluación económica basada en el EC fase IV, la alternativa RT/QT secuencial más nimotuzumab es no costo-efectiva. No obstante, a partir de que el nimotuzumab está incluido en el esquema terapéutico del MINSAP, se puede considerar que el umbral de RCEI obtenido es aceptable para las nuevas terapias oncológicas en Cuba. El análisis de impacto presupuestal de la alternativa quimiorradioterapia más nimotuzumab tuvo como resultado, que en el escenario de pautas más cortas de administración del AcM, se podrá obtener un considerable costo potencialmente evitado en el período 2021-2025 para el SNS. La incorporación del nimotuzumab significa un costo adicional para el sistema sanitario, pero su elevada efectividad y buena seguridad demostrada en su desarrollo clínico, ameritan su empleo.















