INTRODUCCIÓN
El pseudoaneurisma o falso aneurisma aórtico (FAAo) es considerado como una grave complicación que puede ocurrir varios meses o años después de la cirugía cardíaca1. Se define como una lesión que contiene sangre y que resulta de la interrupción de la pared arterial con extravasación sanguínea, que es contenida por el tejido conectivo periarterial2. Es el resultado de la interrupción de al menos una capa de la pared del vaso en el sitio de canulación o a lo largo de las líneas de sutura de la aorta. Inicialmente, el FAAo está rodeado y controlado por las capas vasculares restantes o estructuras estrechamente relacionadas del mediastino, con o sin desarrollo de una neoíntima.
Cuando la presión del FAAo excede la tensión máxima tolerada por la pared del tejido circundante, se produce la rotura fatal. Otras complicaciones temidas, como una fístula sangrante y la compresión o erosión de las estructuras vecinas, son resultado del aumento progresivo de las dimensiones del FAAo. La disección aórtica, la infección, la degeneración de la pared arterial, los traumas, el uso excesivo de pegamento biológico y una mala técnica quirúrgica son reconocidos como factores de riesgo2-4. El tratamiento quirúrgico sigue siendo la solución, a pesar de los avances de las técnicas endovasculares.
Se describe la variante técnica sin el uso de hipotermia, ni parada cardíaca, empleada por nuestro grupo quirúrgico para enfrentar esta grave complicación en una paciente luego de 11 meses de una cirugía cardíaca valvular.
CASO CLÍNICO
Mujer de 51 años de edad, mestiza, obesa, exfumadora, con antecedentes de hipertensión arterial y fiebre reumática en la infancia con afectación valvular mitral grave (doble lesión mitral con predominio de insuficiencia), que fue remitida a nuestro centro para tratamiento quirúrgico. Se realizó sustitución valvular mitral por una prótesis mecánica bidisco de 27 mm (St. Jude Medical Inc., MN, USA), tras esternotomía media longitudinal, con canulación arterial en la aorta ascendente y venosa bicava (según los protocolos de trabajo del hospital), y el empleo de 72 minutos de pinzamiento aórtico y 105 minutos de circulación extracorpórea (CEC). La paciente tuvo una evolución tórpida y prolongada en la Unidad de Cuidados Intensivos Quirúrgicos (UCIQ) con hipoxemia, ventilación artificial mecánica prolongada y neumonía asociada al ventilador (klebsiella pneumoniae), que resolvió con el tratamiento antimicrobiano recomendado. Fueron necesarios varios procedimientos quirúrgicos para drenaje de derrames pleurales y fue egresada a los 2 meses del postoperatorio con el tratamiento habitual.
En el seguimiento ambulatorio se detectó poco control de la anticoagulación oral (warfarina) y fue difícil conseguir el objetivo terapéutico (INR [International Normalized Ratio] entre 2,5 y 3,5). La ecocardiografía transtorácica (ETT) de seguimiento no evidenció alteraciones del funcionamiento protésico, ni masas paracardíacas o trombos, y la función biventricular era normal; sin embargo, a los 11 meses del postoperatorio ingresó en un hospital municipal cercano a su residencia con un cuadro febril acompañado de disnea, disfagia y dolor torácico opresivo. Al examen físico presentaba el clic protésico bien audible, sin soplos cardíacos, estertores húmedos bibasales, hematuria, equimosis en varias regiones del tórax, abdomen y miembros, y un INR>10. Fue remitida al hospital provincial por el riesgo de sangrado relacionado con los dicumarínicos y hubo empeoramiento clínico con diagnóstico de sepsis respiratoria grave, por lo que se añadió tratamiento antimicrobiano y se trasladó a nuestro centro.
Ingresó en la UCIQ con deterioro hemodinámico y ventilación mecánica por la insuficiencia respiratoria aguda. La radiografía de tórax mostró un ensanchamiento mediastínico importante y el electrocardiograma, una fibrilación atrial con respuesta ventricular rápida. La ETT informó: prótesis normofuncionante, sin gradientes patológicos, ni fugas, ni imágenes de trombos o vegetaciones; con gran imagen ecolúcida de contornos bien definidos que nos hizo sospechar la presencia de un gran FAAo. La tomografía axial computarizada multicorte, contrastada, de urgencia, permitió definir el diagnóstico y diseñar la estrategia de actuación acorde con las características de la complicación (Fig. 1).
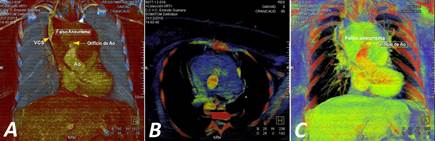
Fig. 1 Imágenes tomográficas que evidencian la interrupción en la continuidad de la pared aórtica con el hematoma contenido por los órganos vecinos del mediastino. A. Vista anteroposterior. Nótese la compresión de la vena cava superior (VCS). B. Corte axial. C. Vista anteroposterior. Ao, aorta.
Se decidió realizar la cirugía urgente, debido al deterioro hemodinámico y el inminente riesgo de rotura del FAAo. Al constatarse un orificio de entrada relativamente pequeño en la aorta ascendente, y con la experiencia de nuestro grupo de trabajo3, se escogió la estrategia de intentar abordar el FAAo sin bajar temperatura, ni parada circulatoria total. Por su cercanía al esternón, se decidió utilizar la CEC con canulación periférica fémoro-femoral previo a la re-esternotomía (Fig. 2). Se colocó una cánula venosa en la aurícula derecha a través de la vena femoral izquierda, y otra en la arteria femoral común del mismo lado para perfusión arterial. Con ello, se logró bajar la presión en el interior del FAAo y reducir los riesgos de accidentes en la reapertura.
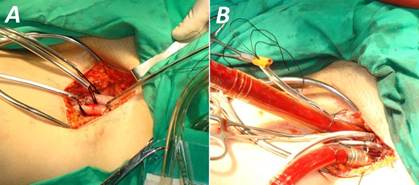
Fig. 2 Canulación periférica para circulación extracorpórea. A. Exposición de arteria y vena femorales izquierdas. B. Cánulas colocadas en ambos vasos.
Una vez establecida la derivación cardiopulmonar, se realizó reapertura esternal con sierra oscilante, y disección cuidadosa de los tejidos circundantes al pseudoaneurisma, hasta exponerlo para abrirlo y localizar el sitio de rotura aórtico, que se encontró en el área de canulación para perfusión arterial. Con el dedo índice del cirujano actuante se ocluyó, permitiendo realizar una «bolsa de señora» a su alrededor. Una vez controlado, se bajó la presión de perfusión (presión media no inferior a 50 mmHg) para anudar y colocar refuerzos de Prolene® 3/0 con tiras de teflón (Fig. 3).
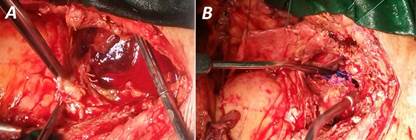
Fig. 3 A. Exposición del falso aneurisma. B. Falso aneurisma reparado con Prolene® 3/0 y refuerzos de teflón.
Se retomó la presión de perfusión a los niveles habituales para cirugía a normotermia, se revisaron las suturas correspondientes al resto de los sitios de canulación, y no se constataron signos de sepsis. El FAAo fue resecado parcialmente, y se tomaron muestras para cultivo. El tiempo de circulación extracorpórea fue de 93 min. El procedimiento quirúrgico se completó de forma habitual y fue trasladada a la UCIQ. La paciente se estabilizó hemodinámicamente y se logró separar de la ventilación mecánica a las 72 horas. Se completó la pauta antibiótica propuesta y fue egresada a los 25 días de la reintervención. Los estudios microbiológicos del contenido y pared del FAAo fueron negativos. La ETT mostró buena función sistodiastólica de ambos ventrículos, prótesis mitral normofuncionante, sin recidivas del FAAo.
COMENTARIOS
Los falsos aneurismas o pseudoaneurismas de la aorta torácica son una complicación rara después de la manipulación quirúrgica de mencionada arteria, que pueden aparecer en los sitios de anastomosis o canulación, o en los de punción para mediciones de presión, purga de aire o inyección de soluciones de cardioplejia. Representan un reto quirúrgico para cualquier equipo de trabajo. Una vez diagnosticados se consideran emergencias quirúrgicas que deben ser resueltas lo antes posible.
Desde finales de la década de los 90 del siglo pasado, los investigadores han informado cifras de mortalidad hospitalaria aceptables, así como seguimientos satisfactorios a medio plazo en pacientes operados por FAAo diagnosticados después de cirugía cardíaca1,2,4-6. Estas experiencias han permitido determinar las estrategias más seguras de reentrada al tórax2,7-10.
Su presentación clínica puede ser aguda, como en el caso descrito, con un cuadro que amenaza la vida del paciente; o puede ser subaguda, con síntomas poco específicos, como disnea, dolor torácico y fiebre, entre los más citados, en dependencia de las series analizadas4,10,11; hasta formas asintomáticas diagnosticadas durante el seguimiento2,12. Incluso, se han descrito formas insidiosas de presentación con infección persistente y embolismos sistémicos2. Se diagnostican con técnicas de imagen13, donde la tomografía juega un papel fundamental en la cuidadosa planificación de los pasos a seguir durante la intervención al precisar su localización, tamaño y relaciones con estructuras vecinas.
Entre los factores responsables del desarrollo de FAAo después de una cirugía cardíaca, se han reconocido las condiciones patológicas de las paredes aórticas, las disecciones, el uso excesivo de pegamentos biológicos y las infecciones. Esta última es la más temida debido al compromiso sistémico y la debilidad de los tejidos. La mayoría de los autores informan infecciones concomitantes como el principal factor predisponente en un número variable de pacientes, desde el 10 al 75%1,2,4,7,10,14. El factor etiológico es difícil de precisar en ocasiones, y esta gran variabilidad probablemente esté condicionada por las diferentes definiciones de estado febril postoperatorio previo, mediastinitis, endocarditis y estado séptico en la reoperación. La paciente que se presenta estuvo en un contexto de sepsis respiratoria nosocomial luego de la primera cirugía que se considera pudiera traducirse en fragilidad de los tejidos y de las líneas de sutura; aunque posteriormente no se encontraron cultivos positivos en la reoperación. El tiempo mediado entre la infección y la aparición del FAAo es perfectamente razonable. Además, el rápido crecimiento del hematoma pudo estar condicionado por la sobre-anticoagulación a la que estaba sometida (cifras de INR muy superiores al rango terapéutico). Otro dato a favor del papel patogénico de la infección en la ruptura de las líneas de sutura y la aparición del FAAo estaría dado por la ausencia de ensanchamientos mediastínicos en las radiografías posteriores a la cirugía mitral y del ETT normal en las consultas de seguimiento.
Los FAAo pueden aparecer secundarios a traumatismos o infecciones, pero la cirugía cardíaca previa suele ser la causa más frecuente1. Han sido descritos fundamentalmente después de cirugía de revascularización miocárdica (en las anastomosis proximales de los injertos venosos)15, de válvula aórtica, o en los procedimientos quirúrgicos relacionados con la aorta ascendente como las disecciones tipo A16. Los sitios de canulación aórticos para establecer la CEC fueron inicialmente los procedimientos más asociados al desarrollo de estos pseudoaneurismas1, aunque la cirugía aórtica cuando emplea conductos protésicos aparece más frecuentemente vinculada a esta complicación en las series más recientes2,7. También se han descrito luego de cirugía valvular mitral17,18. Aun así, su presentación suele ser inferior al 0,5% de todos los casos intervenidos de cirugía cardíaca4,7,11,12.
A pesar de ser poco comunes, acarrean elevadas morbilidad y mortalidad, no solo por el potencial letal de su rotura, sino también por las complejas intervenciones quirúrgicas necesarias para su reparación19. Su incidencia e historia natural no han sido totalmente esclarecidas. Es difícil encontrar en la literatura estudios disponibles que reúnan un número importante de pacientes que pudieran validar la mejor estrategia quirúrgica. Solo existen aislados informes de casos3,20-26 y pequeñas series heterogéneas dedicadas a describir esta inusual complicación1-7,9,10,12,14, en las que la mortalidad asociada a las reparaciones quirúrgicas es difícil de determinar. Las primeras series descritas informaban una mortalidad de 20-40%1,4,9, llegando a ser hasta de 60%15. Las series publicadas más recientemente han logrado reducirla a 6-7%2,6,7 con las diferentes variantes quirúrgicas puestas en práctica.
El tratamiento conservador no parece una opción a valorar en estos casos. El reducido número de pacientes que no han sido operados en algunas series tienen muy cortos plazos de seguimiento5. Si recordamos que su evolución es impredecible, con rotura fatal, o secuelas relacionadas que requieren una cirugía emergente, independientemente del riesgo quirúrgico elevado; la opción quirúrgica no se debe demorar en los casos sintomáticos. Igual conducta se debe seguir con todos los pacientes asintomáticos diagnosticados, que deben ser informados del peligro para la vida, y con quienes serán discutidas las opciones quirúrgicas en primer lugar.
Se han dado pasos de avance en el tratamiento de esta temible complicación, particularmente por vía endovascular27; pero hay limitaciones por las características anatómicas y su escasa disponibilidad por altos costos en países subdesarrollados. Se reserva para los pseudoaneurismas pequeños, sin evidencias de sepsis, ni signos de compresión o isquemia de órganos vitales. Tiene especial utilidad en ancianos o pacientes con alto riesgo quirúrgico. En la literatura disponible existen aislados informes de casos con reparación endovascular exitosa, fundamentalmente en aorta descendente28,29, y otros anecdóticos en la ascendente30.
La cirugía, por tanto, sigue jugando un papel protagónico en la mayoría de las situaciones que enfrentamos aun en la era de las técnicas endovasculares. Las opciones quirúrgicas varían de acuerdo con la presentación clínica del FAAo, su sitio y tamaño; y suelen ser desafiantes sobre todo en el contexto de infecciones, cirugía cardíaca previa y regurgitación aórtica. La mayoría de las intervenciones quirúrgicas son realizadas con el uso de CEC y parada cardíaca cardiopléjica, o bajo parada circulatoria total o parcial, para ello se usan sitios periféricos para canulación arterial y venosa, como los vasos femorales y subclavios. Su elección depende de la experiencia de cada grupo de trabajo y de los resultados de cada centro con una u otra variante técnica empleada. El procedimiento quirúrgico más empleado en los falsos aneurismas postoperatorios es la canulación fémoro-femoral, con descenso de la temperatura corporal hasta 18°C (64°F), reapertura esternal bajo hipotermia profunda y parada circulatoria total6,14,19.
La clave de un tratamiento quirúrgico exitoso radica en dos aspectos fundamentales: prevenir los accidentes quirúrgicos derivados de la reentrada al tórax, causantes de sangrados incontrolables, y la protección cerebral. Respetando el primero, se decidió iniciar la CEC con abordaje extramediastínico antes de la reapertura esternal debido a la cercanía al esternón (menos de 2 cm) del FAAo. En este aspecto coinciden la mayoría de los grupos quirúrgicos. La duda estriba en el uso o no de la hipotermia profunda10,14. Esta es necesaria en la parada circulatoria cuando la ubicación del FAAo impide el pinzamiento aórtico y la infusión de cardioplejia en los ostium coronarios. Su uso implica una serie de desventajas bien conocidas, entre ellas figuran los límites imprecisos de un «tiempo seguro» de parada circulatoria total, y el prolongado tiempo de CEC requerido para enfriar y luego recalentar al paciente, con sus consiguientes riesgos de coagulopatías, complicaciones pulmonares y microembolismos. Para evitarlas, no se considera bajar la temperatura nasofaríngea antes de la reentrada al mediastino, pues el orificio estaba ubicado en un sitio de fácil acceso; y se planea repararlo sin parada cardiopléjica con suturas primarias; dejando su uso reservado en caso de abordaje complicado del pseudoaneurisma, o su rotura accidental en la entrada.
Algunos grupos han desarrollado alternativas para disminuir los largos períodos de parada circulatoria e hipotermia profunda mediante el empleo de un catéter globo (balón) que se infla a través de la boca del pseudoaneurisma bajo visión directa, lo que permite una colocación precisa y evita tediosas disecciones para colocar la pinza aórtica31. También se ha empleado la canulación de la arteria axilar combinada con femoral para insuflar un balón de EndoClamp aórtico (cánula de acceso para perfusión remota en cirugía mínimamente invasiva) y perfusión de la parte inferior del cuerpo para evitar la parada circulatoria hipotérmica21. Estas técnicas tienen puntos débiles susceptibles de crítica. Por un lado, la canulación de la arteria axilar sin pinzar el origen de la arteria innominada no elimina el riesgo de hemorragia masiva durante la reapertura. Por otro lado, el uso de un EndoClamp puede ser peligroso al lacerar o romper una aorta frágil, o desplazarse en el arco y ocluir alguno de los vasos supraaórticos.
Bachet et al8 han desarrollado la hipotermia moderada con canulación directa de ambas arterias carótidas abordadas desde el cuello (sin entorpecer el campo quirúrgico, y fáciles de pinzar), para perfusión cerebral anterógrada selectiva, y así tratar falsos aneurismas gigantes con una entrada segura al mediastino, lo que garantiza la protección cerebral y evita los efectos deletéreos de la hipotermia profunda. Esta técnica permite la disección del mediastino y el control de la aorta distal sin compromiso de la perfusión cerebral aun en los casos de hemorragia masiva por rotura del FAAo, y puede influir en la calidad de una reparación quirúrgica compleja9. La evolución de este método, en cuanto a protección de órganos se refiere, ha sido publicada más recientemente por Martinelli et al32) al adicionar la perfusión visceral continuada y garantizar la protección miocárdica a través de un catéter en el seno coronario. Un catéter globo con amplio rango de insuflado se inserta a través de una arteria femoral y, mediante ecocardiograma transesofágico, se controla su posición en la aorta descendente por debajo del origen de la arteria subclavia izquierda. La otra arteria femoral y su vena homóloga son canuladas para establecer la CEC. Un catéter percutáneo para cardioplejia retrógrada es insertado, bajo el mismo control ecocargiográfico, a través de la vena yugular derecha hasta el seno coronario para aportar la solución cardiopléjica retrógrada (su posición es confirmada con mediciones de presiones); y ambas arterias carótidas son canuladas para garantizar la perfusión cerebral selectiva (según lo propuesto por Bachet et al8). Cuando la temperatura corporal alcanza la hipotermia moderada (26 a 28 °C), se suspende la CEC, mientras se mantiene la perfusión cerebral selectiva por ambas carótidas, se administra cardioplejia por el catéter del seno coronario, y al mismo tiempo, se insufla el globo en la aorta descendente para iniciar la perfusión selectiva de la parte inferior del cuerpo. Con ello se logran perfundir adecuadamente el cerebro, el área esplácnica y el miocardio; lo que permite la reentrada segura al tórax, sin el uso de parada circulatoria hipotérmica y sin riesgos de sangrado importante o embolismo aéreo, en caso de entrada en el FAAo. Aunque complejo e invasivo, este procedimiento innovador se reserva para cuando es necesario en casos de alto riesgo y tiene el inconveniente de no poder ser empleado en casos de enfermedad de la aorta descendente, especialmente en la disección.
En los pacientes con pseudoaneurismas aórticos complejos e insuficiencia valvular aórtica, se debe prestar especial atención a la dilatación ventricular y la subsecuente fibrilación ventricular. En los casos con regurgitación aórtica es preciso utilizar una vía de venteo transapical del ventrículo izquierdo a través de una toracotomía anterolateral12.
Al abordar el tórax, las técnicas quirúrgicas de cierre más usadas son la resección del FAAo y su reconstrucción con parche de pericardio o material protésico, o las reparaciones simples con suturas directas en el sitio de entrada. Las técnicas con parches fueron muy empleadas desde finales de los 90 (siglo XX); sin embargo, algunos grupos las han abandonado por la aparición de recidivas 12. El reemplazo del segmento aórtico involucrado en el FAAo por un conducto protésico es la técnica preferida por muchos grupos2,7,9,12 cuando enfrentan grandes pseudoaneurismas o infecciones de los injertos, con o sin endocarditis valvular aórtica.
En presencia de endocarditis, se siguen los principios generales de resecar y desbridar todo el tejido necrótico, con lavado amplio y el uso de homoinjertos y conductos biológicos, asociados al tratamiento antimicrobiano prolongado; para evitar recurrencias de nueva formación de FAAo. En las infecciones, especialmente mediastinitis, también se debe priorizar el tratamiento agresivo por encima de las reparaciones locales o conservadoras. Coselli et al33) han complementado esta estrategia con el principio de mantener la circulación «in situ» al enfrentar infecciones postoperatorias. Para ello han empleado procedimientos adicionales de cubrir la aorta, cerrar el espacio muerto e irrigar el mediastino con antimicrobianos. Al movilizar colgajos de grasa pericárdica, músculos y omento mayor, y suturarlos en la aorta luego de reparar el FAAo, han obtenido resultados favorables. El parche autólogo de doble capa con fascia lata y vena safena también ha sido empleado con efectividad, como alternativa para evitar materiales protésicos en los pseudoaneurismas sépticos34.
El cierre directo primario con sutura simple y soportes de teflón es otra variante de tratamiento quirúrgico. Considerada salvadora y relativamente sencilla, puede ser suficiente en los casos donde el orificio de la aorta sea pequeño y su localización lo permita, como sucedió en esta paciente, en la cual, además, no impresionaron sépticos los tejidos circundantes. Los refuerzos de teflón deben anclar en tejido aórtico sano para evitar recidivas. Es necesario tener en mente que tal vez esta sea la única solución apropiada en determinados pacientes con altas comorbilidades, a pesar de las recurrencias informadas en varias publicaciones4,6,9 que pudieran sugerir su abandono. Cerrar el cuello de la lesión es el objetivo y la forma de hacerlo será escogida en correspondencia con la situación clínica de cada caso en particular.
El intervalo de tiempo transcurrido entre el diagnóstico del FAAo y el procedimiento quirúrgico inicial es variable y así lo demuestran las distintas series de casos publicados. Puede situarse entre pocos días20, los primeros 12 meses del postoperatorio (en los que son bastante frecuentes), luego de 17 años9,35, o tan distantes como la tercera década después de una cirugía cardíaca18. No por infrecuentes deben ser olvidados. Todo cirujano debe conocer los factores invocados en su desarrollo y tomar cuanta medida de precaución considere necesaria para evitarlos. Siempre deben ser sospechados y los seguimientos a largo plazo con técnicas de imágenes son clave en este punto. Algunos autores recomiendan un seguimiento anual con TAC contrastada en los pacientes sometidos a cirugía aórtica, lo cual está más que justificado en los que tienen riesgos incrementados de desarrollar FAAo, con vistas a la detección temprana de esta complicación, lo que permitiría la reparación quirúrgica en óptimas condiciones, sin deterioro del paciente, y lograr un mejor pronóstico2,9,12.
CONCLUSIÓN
El falso aneurisma de la aorta ascendente es una seria complicación de la cirugía cardíaca y se asocia con alta mortalidad. El diagnóstico temprano con las técnicas de imágenes permite evitar el abordaje quirúrgico en condiciones emergentes y mejorar los resultados postoperatorios. La reapaertura esternal suele ser extremadamente desafiante. La cuidadosa planificación preoperatoria es esencial para una re-esternotomía segura. Las combinaciones de técnicas descritas pueden contribuir a mitigar y minimizar las pérdidas sanguíneas. El uso apropiado de la parada circulatoria hipotérmica permite la disección de las estructuras del mediastino y el control de la aorta, y deben considerarse los métodos para conservar la perfusión cerebral. La elección del vaso periférico para iniciar la circulación extracorpórea (arterias femorales, axilares o carótidas) depende de la experiencia del grupo quirúrgico y la naturaleza del caso en particular. Cada caso con diagnóstico de falso aneurisma de la aorta ascendente debe ser individualizado y tratado como tal, pues la mejor estrategia quirúrgica para evitar la mortalidad perioperatoria y las recurrencias está aún por definir.














