INTRODUCCION
Durante la explotación de un pozo petrolero se generan recortes de perforación, provenientes de la acción rotatoria de la broca con la formación en el interior del hueco del pozo. Estos recortes son transportados por el fluido o lodo de perforación hacia el exterior, por lo que se debe prestar una mayor atención a estos residuos ya que son uno de los contaminantes más producidos en este campo (Castañeda, 2019). Los distintos procesos asociados a la perforación generan grandes volúmenes de desechos, como ripios de perforación, lodos y suelos contaminados con hidrocarburos, cuyos componentes de estructura compleja son difíciles de degradar de manera natural. Estos últimos han sido clasificados como contaminantes de preocupación emergente.
Para la disposición final de los recortes de perforación generalmente se les extrae la mayor cantidad posible de líquidos con los equipos de control de sólidos y se sitúan en unas celdas o piscinas en el suelo afectando el entorno y provocando que los recortes de perforación sean un problema y no un material con algún tipo de uso útil (Castañeda, 2019). La presencia de hidrocarburos en ambientes tanto de suelo como agua, representan un peligro sustancial para el ser humano y otras formas de vida presentes en los ambientes contaminados (Castillo, More, Cornejo, Mialhe, 2020) (Sayed, Baloo, Kumar, 2021). Varias tecnologías de remediación han sido probadas para eliminar estos contaminantes ambientales (Vandera y Koukkou, 2017).
La biorremediación es una alternativa para tratar estos residuos de la perforación petrolera (Salam, 2016); (Rakowska, 2020). Hoy en día tiene gran aceptación como tratamiento para la recuperación de suelos contaminados por ser una técnica que se considera segura y respetuosa con el medio ambiente (Castillo, More, Cornejo, Mialhe, 2020). La biorremediación es una opción factible a nivel mundial por su facilidad de aplicación, ecosostenibilidad y rentabilidad (Ossai, Ahmed, Hassan, Hamid, 2020).
Para desarrollar esta tecnología es necesario conocer los mecanismos de interacción entre la comunidad microbiana, el ambiente y el contaminante. Se ha propuesto que la inoculación de cepas o consorcios microbianos degradadores puede ser beneficiosa para mejorar las tasas de degradación de contaminantes orgánicos en los sitios contaminados. La disponibilidad de consorcios microbianos activos juega un papel importante para mejorar las tasas de degradación del diésel (Lahel et al, 2016).
Los consorcios poseen ventajas para lograr una biorremediación eficaz (Wanapaisan et al, 2018), porque crean una red con diferentes niveles de interacción, mostrando mejor adaptación, supervivencia y permanencia (Zafra, Absalón, Anducho, Fernández, Cortés, 2017). Dichas características les permite soportar entornos fluctuantes, otorgándoles solidez ante los cambios ambientales.
Los microorganismos comúnmente aislados de sitios contaminados por hidrocarburos pertenecen a los géneros: Pseudomonas sp., Acinetobacter, Nocardia, Aeromonas, Bacillus y Serratia (Chebbi et al, 2017) (Pacwa-Płociniczak et al, 2016) (de Souza et al, 2016). Estos microorganismos cuentan con la capacidad de producir biosurfactantes en el medio, aumentando así la biodisponibilidad de los hidrocarburos en el suelo o agua para su degradación.
El objetivo del trabajo fue diseñar un consorcio bacteriano con potencialidad para degradar diésel en lodos y ripios de perforación contaminados.
Materiales y métodos
Muestreo
Se trabajó a partir de cinco muestras de corte y/o ripios de perforación a un tamaño de partículas mayor y menor (TPMYr y TPMr), agente separador (AS-1) y lodo base aceite, obtenidas de la conformación del fluido de perforación en la explotación del pozo Bacuranao 300 L. Las muestras fueron tomadas en frascos de vidrio estériles.
Aislamiento de microorganismos
Las muestras de los cortes y ripios se inocularon en medio Caldo Cerebro Corazón (BioCen®) al 5% con el objetivo de activar la comunidad bacteriana presente, y se incubaron en agitación orbital a 130 rpm durante 96 horas a 37 0C. Se tomó 1 ml y se realizaron diluciones decimales seriadas desde 1:10 hasta 1:107 en solución salina (0,85 %) para el conteo de microorganismos totales siguiendo técnicas estándar de recuento en placas (ISO IS 15188, 2012). Las placas se incubaron a 37 0C por 24 horas.
De los cultivos puros se tomaron inóculos y se diluyeron en 5 ml de solución salina (0,85 %) hasta obtener una concentración aproximada de 6 x 108 células/ml-1 según la escala de McFarland, y se comprobó determinando la absorbancia en espectrofotómetro Genesys 10 S (λ=530 nm). La densidad óptica (D.O) del inóculo fue de 0.451 (DO).
Caracterización fisiológica-bioquímica de las cepas bacterianas
La caracterización preliminar de las cepas en términos de morfología fue realizada mediante pruebas morfológicas, fisiológicas y bioquímicas. Para ello se siguieron los procedimientos descritos en el Bergey’s Manual of Determinative Bacteriology, 1994 (9na edición). Las características culturales de las cepas se basan en el reconocimiento de la forma, opacidad, elevación, superficie, borde, consistencia y color. El estudio de la micromorfología se realizó mediante el método de tinción Gram (BBL, 1974).
Ensayo de inhibición del crecimiento bacteriano
En este ensayo se añadió el medio de cultivo líquido de manera aséptica en placas Petri estériles. Una vez gelificado el medio se añadieron los inóculos en cada placa y se diseminaron con espátula de Drigalsky. Posteriormente se perforaron 6 pocillos de 7 mm de diámetro en cada placa con un perforador metálico previamente esterilizado. Se añadieron 0.2 ml de la suspensión de cada cepa en los pocillos perforados, estos fueron identificados. Las placas se incubaron a 37 0C durante 48 horas. Una vez concluida la incubación se observó la presencia o no de halos de inhibición en los bordes de los pocillos.
Determinación de la concentración mínima inhibitoria (CMI)
Las placas de Agar Nutriente (BioCen®) se inocularon con cada una de las cepas mediante diseminación con espátula de Drigalsky. Posteriormente se perforaron seis pocillos de 7 mm de diámetro en cada placa con un perforador metálico previamente esterilizado. Se evaluaron diferentes concentraciones de diésel (1, 3, 5, 10, 25 y 100%), las cuales fueron preparadas en 5 ml de agua destilada estéril y tres gotas de Tween 80. Se añadieron 0,2 ml de las soluciones de diésel en los pocillos perforados y una con Tween 80. El ensayo se realizó por duplicado y las placas se incubaron a 37 ºC durante 48 h. Una vez concluida la incubación se observó la presencia o no de halos de inhibición en los bordes de los pocillos.
Ensayo de biodegradación de diésel
En el medio Solanás suplementado con diésel al 5% v/v se añadió un inóculo de cada cepa. La concentración del hidrocarburo es equivalente a 53100 mg. l-1 de Hidrocarburos Totales (HCT) para ser empelado como fuente de carbono. Para el control se empleó el mismo medio de cultivo inoculado con microorganismos, pero sin el diésel. Todos los tratamientos se prepararon por duplicado. La incubación se realizó con agitación orbital de 130 rpm (Zaranda GFL 3033) a 37 ºC durante 45 días.
Determinación de Hidrocarburos Totales (HCT)
La concentración de hidrocarburos totales se determinó por el Standard Method 5522 (APHA, 2005), empleando n−hexano como solvente. El porcentaje de remoción de hidrocarburos se calculó mediante la ecuación 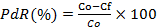 , donde PdR es el porcentaje de remoción, C0 es la concentración inicial y CF es la concentración final.
, donde PdR es el porcentaje de remoción, C0 es la concentración inicial y CF es la concentración final.
Determinación de la velocidad de crecimiento microbiano
Se prepararon inóculos a partir de cultivos frescos y se inocularon en 100 ml de medio Caldo Nutriente. Los cultivos se incubaron en agitación orbital a 130 rpm y temperatura de 37 0C durante ocho horas, el ensayo se ejecutó por triplicado. Cada una hora se tomó una muestra y se determinó la absorbancia en espectrofotómetro Genesys a una λ= 530 nm. Los valores obtenidos se graficaron y a partir de los mismos se calculó la velocidad de crecimiento mediante dos métodos, exponencial ( 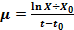 ) y de los incrementos (
) y de los incrementos ( 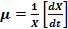 ) donde µ es la velocidad de crecimiento, X es la concentración celular en unidades de densidad óptica final, X0 es la concentración celular en unidades de densidad óptica a tiempo cero, t es el tiempo final y t0 es el tiempo inicial.
) donde µ es la velocidad de crecimiento, X es la concentración celular en unidades de densidad óptica final, X0 es la concentración celular en unidades de densidad óptica a tiempo cero, t es el tiempo final y t0 es el tiempo inicial.
Resultados y Discusión
Aislamiento y Clasificación de las cepas
A partir de las muestras de ripios, agente separador (AS-1) y de lodo se aislaron seis cepas bacterianas, a las cuales se les identificó con letras para su estudio en el laboratorio (Tabla 1).
Los sitios impactados con contaminantes del petróleo, son una buena fuente para obtener microorganismos degradadores. Estos sitios actúan como medios de crecimiento selectivos, donde se desarrolla su capacidad de adaptación frente a los contaminantes tóxicos y la biodegradación (Pereira et al, 2015).
Caracterización de las cepas
La mayoría de las colonias mostraron una gran diversidad fenotípica caracterizándose por ser blancas, opacas, brillantes, con bordes lisos y rugosos. También se detectó presencia de pigmentos amarillo, verde y blanco, que difundían al medio. En el caso de la cepa F no se observó este proceso de difusión del pigmento en el medio.
En cuanto a su morfología celular se observó que todas las cepas correspondían a bacilos. Del total de cepas aisladas, cuatro mostraron una respuesta positiva frente a la tinción de Gram, mientras que los dos restantes fueron negativas.
De acuerdo a las pruebas realizadas se sugiere preliminarmente que las cepas pertenecen a los géneros: (A) Pimelobacter sp., (B) Bacillus sp., (C) Aeromicrobium sp., (D) Arthrobacter sp., (E) Pseudomonas sp. y (F) Flavobacterium sp.
En función de la temperatura necesaria para el crecimiento y del requerimiento salino, todas las cepas mostraron la capacidad de crecer a 30, 37 y 44 ºC. De igual manera crecieron en medio Agar Nutriente/NaCl con una concentración del 5 %. Las cepas de (A) Pimelobacter sp., (B) Bacillus sp., (C) Aeromicrobium sp., (D) Arthrobacter sp., (E) Pseudomonas sp. lo hicieron con 10 %, mientras que al 15 % solo creció (D) Arthrobacter sp.
Pseudomonas sp. han sido aisladas de zonas contaminadas con hidrocarburos y se estudia su potencial biorremediador (Allamin, Iraj, Ismail, Riskuwa, 2014) (Baruah et al, 2017) (Smułek, Sydom, Zabielska, Kaczorek, 2020), así como, los géneros Arthrobacter, Alcaligenes, Aspergillus, Bacillus, Brevibacterium, Candida, Corynebacteium, Flavobacterium, Fusarium, Micrococcus, capaces de usar los hidrocarburos como fuente de carbono para sus funciones metabólicas. (Martínez A, 2018).
Ensayo de inhibición del crecimiento bacteriano
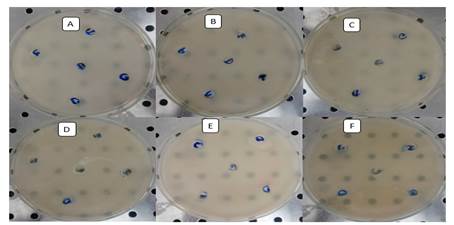
Con el fin de emplear aquellas cepas que no generaran inhibición del crecimiento de otras presentes en el consorcio y así disminuyan la eficiencia de degradación del mismo, se realizaron las pruebas de antagonismo. Todas las cepas crecieron en el medio de cultivo por lo que fue posible unirlas para el ensayo de degradación de diésel y conformar el consorcio. En la Fig. 1 se muestra el ensayo de inhibición del crecimiento para cada una de las cepas donde no se observó la formación de halo entre las seis cepas, mostrando que no había actividad antagónica entre ellas.
Determinación de la CMI para diésel
En la Fig. 2 se muestran las seis cepas crecidas en Agar nutriente con las diferentes concentraciones del diésel (1, 3, 5, 10, 25, 100%), donde se observa que no existe halo alrededor de las concentraciones del hidrocarburo.
El ensayo de inhibición es un criterio importante en la construcción de un consorcio donde los microorganismos tienen la capacidad de crecer y actuar de forma sinérgica, mejorando el proceso de biorremediación (Pereira et al, 2015). Las cepas a su vez no mostraron inhibición por las altas concentraciones de diésel, este resultado pudiera estar relacionado con la naturaleza de las muestras donde se aislaron, lo cual indica que estas pueden utilizarse en procesos de biorremediación de sitios donde el diésel se encuentre altamente concentrado.
Ensayo de biodegradación de diésel
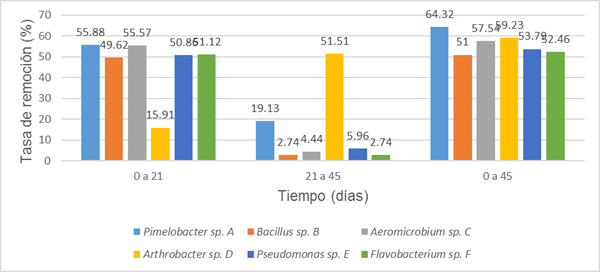
En la Fig. 3 se muestran los resultados alcanzados para la cuantificación de HCT a 21 y 45 días del ensayo realizado, y las tasas de degradación calculadas para los intervalos de 0 a 21, 21 a 45 y de 0 a 45 días.
En cuanto a la determinación de las tasas de remoción en el período de 0 a 21 días destacan las cepas (A) Pimelobacter sp. y (C) Aeromicrobium sp. con valores de degradación de 55,88 y 55,57 %, respectivamente, lo cual es un resultado favorable comparado con los obtenidos por (Mnif et al, 2015) donde utilizando un consorcio + Bacillus subtilis SPB1 + Acinetobacter radioresistens R17 alcanzaron un 48,86 % de remoción de diésel en el mismo tiempo en un medio salino suplementado con diésel al 5 % v/v. También presentaron valores superiores al 50 % las cepas, (E) Pseudomonas sp. y (F) Flavobacterium sp.
La cepa (D) Arthrobacter sp. mostró un valor de 15,91 %, muy bajo en comparación con las mencionadas anteriormente. En el intervalo de 21 a 45 días, la cepa (A) Pimelobacter sp. presentó un valor de degradación de 19,13 %. El resto de las cepas estuvieron entre 2,74 y 5,96 %, sin embargo, la cepa (D) Arthrobacter sp. tenía el valor más alto de este período con un 51,51 %. Esta cepa requiere un proceso de adaptación al diésel superior al resto, ya que, una vez que logra adaptar su metabolismo a esta fuente de carbono su degradación es acelerada. Al final del experimento, todos los valores de las tasas de remoción, fueron superiores a 50 %, destacando las cepas (A) Pimelobacter sp. y (D) Arthrobacter sp. con 64,32 y 59,23 % respectivamente.
Cinética de crecimiento de las cepas
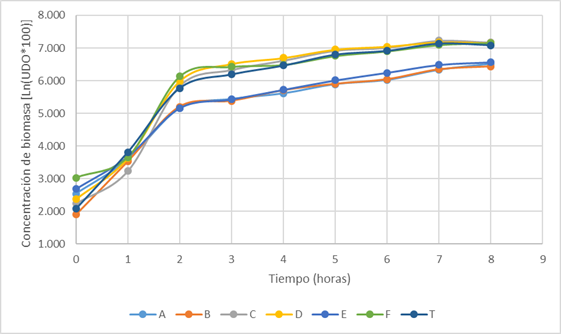
En la Fig . 4 se observan las curvas de crecimiento de las seis y del cultivo mixto (T). La concentración celular se ha representado como el logaritmo natural de 100 veces las unidades de densidad óptica medidas.
Se puede apreciar que la fase de latencia es de apenas una hora en todas las cepas excepto en (B) Bacillus sp. donde esta fase no se observa y comienza inmediatamente la fase de crecimiento exponencial. Teniendo en cuenta esto se puede deducir que la cepa (B) Bacillus sp. es de rápida adaptación a los medios de cultivo.
Al analizar las velocidades de crecimiento calculadas por el método exponencial y el de los incrementos, se aprecia que los valores de las cepas (A) Pimelobacter sp. y (E) Pseudomonas sp. son similares (0,3629 y 0,3400 h-1 respectivamente, por el método exponencial). Por lo tanto, estas cepas pudieran inocularse a la misma vez para conformar el cultivo del consorcio deseado. De las 2 a las 3 h, la cepa (D) Arthrobacter sp. muestra la mayor velocidad de crecimiento (0,0813 h-1) según el método de los incrementos.
Las cepas (C) Aeromicrobium sp. y (F) Flavobacterium sp. mostraron una fase de latencia un poco más marcada que las demás. Todas presentaron una fase de crecimiento exponencial entre la primera y la segunda hora de cultivo, a partir de ese momento entraron en fase de aceleración negativa.
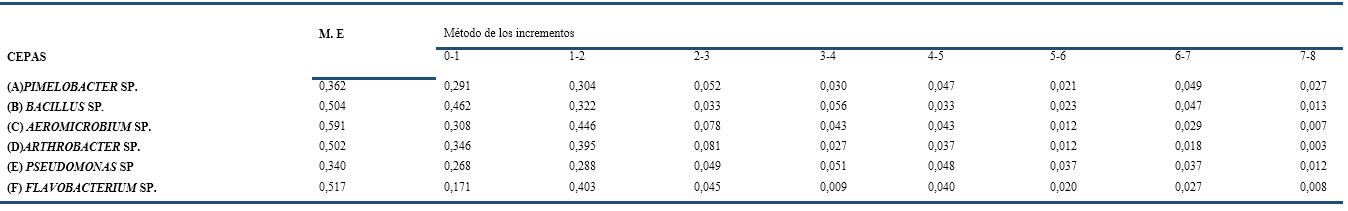
La Tabla 2 expone los valores calculados de las velocidades de crecimiento mediante dos métodos: exponencial (M.E) y de los incrementos. La velocidad de crecimiento en fase exponencial indica la mayor velocidad que posee el microorganismo en su crecimiento ya que se calcula en la fase exponencial de crecimiento positivo, siendo un valor contante y específico para cada uno de ellos en cada medio de cultivo. El método de los incrementos permite observar el comportamiento en cada periodo de tiempo seleccionado, en este caso cada una hora.
Otro aspecto a tener en cuenta es que la cepa de (D) Arthrobacter sp. tiene una velocidad de crecimiento elevada, sin embargo, su tasa de degradación es tardía. Esta característica es típica de microorganismos con tendencias al aumento de la población a expensas de nutrientes de fácil acceso.
El uso de un consorcio bacteriano capaz de degradar hidrocarburos tiene un gran interés. Generalmente se considera que los cultivos mixtos tienen mayor versatilidad metabólica que los cultivos puro (Mnif, Sahnoun, Ellouz-Chaabouni, Ghribi, 2017).
El consorcio bacteriano se conformó con las cepas (A) Pimelobacter sp., (D) Arthrobacter sp. y (E) Pseudomonas sp. basándose en los resultados obtenidos en el ensayo de biodegradación de diésel donde las tasas obtenidas con estas tres cepas fueron de 64,32; 59,23 y 53,79 %. Aunque (C) Aeromicrobium sp., presentaba un mayor valor de tasa de remoción de hidrocarburos que (E) Pseudomonas sp., se decidió utilizar esta última por presentar valores de velocidades de crecimiento similares a (A) Pimelobacter sp. que fue la cepa con la se obtuvieron mejores resultados en el ensayo de biodegradación de diésel.
CONCLUSIONES
Se aislaron y caracterizaron seis cepas bacterianas a partir de muestras de ripios de perforación, separadores y lodo base (diésel) perteneciente a cuatro géneros bacterianos: Pimelobacter sp., Arthrobacter sp., Aeromicrobium sp., y Pseudomonas sp. Se diseñó un consorcio degradador de diésel formado por las cepas (A) Pimelobacter sp., (D) Arthrobacter sp. y (E) Pseudomonas sp.