INTRODUCCIÓN
La lipoatrofia facial (LAF) en personas viviendo con el virus de la inmunodeficiencia humana (PVV) es la manifestación más visible del síndrome de lipodistrofia (SLD). El SLD se ha asociado a la terapia antirretroviral (TAR) con inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) y con inhibidores de proteasa (IP), pero probablemente en su patogenia tienen una función importante otros factores, como los relacionados con la infección por el VIH per se, los factores genéticos, el tiempo de duración de la TAR, la dieta, la edad, entre otros.1,2
El cambio de la fisonomía facial en estas personas, expone su condición como PVV y los hace sentirse estigmatizados. Lo anterior conlleva no solo a problemas psicológicos, sino también a ansiedad y depresión, problemas de relación social o una menor adherencia a la TAR que puede influir en el riesgo del fracaso del tratamiento. La prevalencia de LAF se ha estimado en más del 50% de las PVV que se encuentran recibiendo TAR.3
Las causas de la LAF no se conocen con exactitud, según diversos autores es una condición multifactorial.1 Hasta la fecha, se ha intentado establecer tratamientos paliativos de las alteraciones físicas conjuntamente con otros procedimientos no invasivos, como la modificación de la TAR en busca de combinaciones farmacológicas con una menor incidencia de SLD, o la inclusión de otros fármacos y hormonas. Estos tratamientos pueden reducir el impacto del SLD, pero sus resultados no son ni suficientes ni rápidos, por lo que frecuentemente es necesario recurrir a métodos invasivos que rellenen la zona atrofiada.4 Estos procedimientos consisten en el implante de materiales autólogos o sintéticos.
En PVV el plasma rico en plaquetas (PRP) ha sido empleado para el tratamiento de úlceras crónicas de la piel,5 y como adyuvante del tratamiento de la LAF con injertos de tejido adiposo autólogo.6 Sin embargo, no se encontraron estudios precedentes, que hayan caracterizado, de manera integral, diferentes variables para evaluar la eficacia y seguridad del PRP ozonizado (PRPO3) en el tratamiento de la LAF.
En el Instituto de Medicina Tropical Pedro Kourí (IPK) se desarrolló un estudio con el PRPO3 para el tratamiento de la LAF en PVV cubanas (“Evaluación de la seguridad y efecto de la aplicación de Plasma Rico en Plaquetas activado con ozono para el tratamiento de lipoatrofia facial en pacientes VIH/sida”). El protocolo del estudio fue revisado y aprobado por el Consejo Científico y por el Comité de Ética Médica del propio Instituto.
Para el estudio, se seleccionaron PVV con TAR y manifestaciones clínicas de LAF, atendidos en el IPK. Estos pacientes recibieron una explicación detallada sobre la investigación y dieron su consentimiento verbal y escrito para participar. Un médico evaluó su incorporación al estudio, en función de los criterios de inclusión establecidos. Se incluyeron PVV de cualquier sexo, con edades entre 20-60 años (incluyendo ambos), con una adecuada capacidad funcional (medida como un índice de Karnofsky ( 80), con número absoluto de linfocitos T-CD4+ (LT-CD4+) ≥ 250 cel/mL y carga viral (CV) < 5000 copias/mL.
Se excluyeron PVV que estuvieran recibiendo otro producto en investigación, en período de embarazo o lactancia, con infección aguda en el momento de la captación y/o enfermedades oncológicas y/o enfermedades psiquiátricas, que impliquen la incompetencia del sujeto; mujeres en período de embarazo o lactancia.
Las PVV podían salir del estudio si manifestaban su deseo de salir del estudio, si aparecían reacciones adversas moderadas/graves relacionadas con el tratamiento, incumplimiento del tratamiento y del seguimiento clínico, deterioro del estado clínico, que a criterio del investigador impedía continuar con la administración del producto en estudio.
Procedimiento de elaboración y aplicación del PRPO3
La preparación y aplicación del PRPO3 se realizó en el salón de cirugía del IPK, por personal especializado y cumpliendo las normas de bioseguridad.
El volumen de sangre del paciente, necesario para la obtención del PRPO3, se extrajo de la vía periférica, inmediatamente antes de cada intervención. Para ello se emplearon cuatro tubos heparinizados de vacío (Vacuette®) de 9 mL. Estos tubos se colocaron en un concentrador de células automático Medifuge (Silfradent®), y pasaron por un ciclo de centrifugación que permitió la precipitación ordenada de los elementos de la sangre. Una vez centrifugado, del plasma se separó la fracción rica en células CD34+, luego la fracción de PRP y por último la fracción de PPP (plasma pobre de plaquetas). La porción de PPP se colocó en un equipo de desnaturalización de albúmina APAG (Silfradent®) para su gelificación (plasmagel). El PRP fue activado con ozono a 60µg/mL empleando el generador Ozonobaric P® y con Cloruro de Calcio (CaCl2) 10%. Posteriormente se combinan las tres fracciones, se homogenizaron y el material resultante se aplicó en el tejido subcutáneo, inyectándolo en retirada y en forma radial.
La seguridad se evaluó mediante el seguimiento de los marcadores de progresión en la infección VIH/sida (LT-CD4 y CV), algunos indicadores del estado redox y parámetros hematológicos y hemoquímicos. Se realizó el examen físico a los pacientes antes y después de cada intervención, evaluando la mejoría de la LAF y la aparición de eventos adversos. Los eventos adversos fueron documentados según los modelos establecidos para su reporte y fueron evaluados en cuanto a severidad y causalidad empleando los métodos propuestos por Hartwig y cols.7 y Naranjo y cols,8 respectivamente.
En el estudio se incluyeron 30 pacientes y solo uno presentó un evento adverso moderado. En el resto de los pacientes los eventos fueron los esperados y habituales de la técnica de relleno y relacionados con la aplicación local de PRPO3. En 29 PVV se observó una mejoría de la LAF.
El objetivo de este trabajo es caracterizar un evento adverso moderado relacionado con la aplicación de PRPO3 a una PVV con LAF.
Caso clínico
Paciente masculino de 55 años de edad, color de piel mestiza. Con antecedentes de hipertensión arterial controlada (tratado con inhibidores de la enzima convertidora de angiotensina), alergia y asma bronquial (controlado y tratado con ketotifeno). En paciente refirió no realizar actividades relacionadas con el desarrollo de procesos alérgicos ni tener hábitos tóxicos (no alcoholismo, no tabaquismo ni otras adicciones).
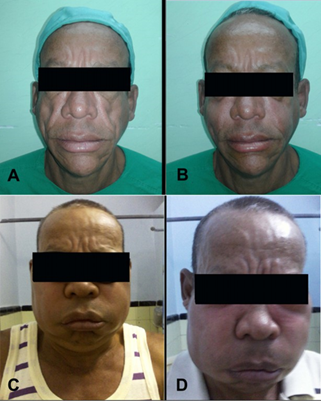
Se diagnosticó seropositivo al VIH en 2002 y en el año 2004 comenzó a recibir TAR con lamivudina, nevirapina y estavudina, hasta el año 2010. A partir de este año, se retira la estavudina del esquema, por la manifestación de lipodistrofia (tanto LAF como lipohipertrofia (figura 1-A) y se incorpora la zidovudina.
En marzo de 2017 el paciente se incluyó en el estudio. Recibió un total de seis aplicaciones con PRPO3 (una aplicación cada 45 días). En las primeras cuatro aplicaciones los efectos adversos presentados por el paciente fueron los esperados y habituales de la técnica de relleno (Figura 1B). Sin embargo, a partir de la quinta intervención experimentó una inflamación aguda en la zona de aplicación de PRPO3 de mayor intensidad y duración a la esperada (Figura 1 C), este cuadro se exacerbó en la siguiente aplicación (Figura 1 D) sin otro síntoma, clasificándose como un evento adverso de intensidad moderada, atribuible o relacionado con la aplicación de PRPO3.
Para tratar este cuadro se le indicó al paciente tratamiento farmacológico con antihistamínicos, y no farmacológico con reposo y fomentos con agua fría. El signo desapareció entre el cuarto y quinto día después del tratamiento. Teniendo en cuenta el protocolo, se le dio salida del estudio y se realizó el reporte del evento adverso de acuerdo al modelo correspondiente.
Las determinaciones de los marcadores de progresión de la infección de VIH (LT-CD4+ y CV) y los indicadores del estado redox (Tabla 1) no se presentaron diferencias entre los valores de cada administración.
Al analizar los valores de las variables hematológicas y hemoquímicas obtenidos antes de la primera aplicación y después de la tercera y la sexta aplicación (Tabla 2), no se encontraron cambios importantes y aquellos observados no tienen implicaciones clínicas que pudieran explicar la ocurrencia del evento adverso.
Esta observación no ha sido reportada previamente en la literatura, aunque en reuniones científicas recientes, especialistas que trabajan con el PRP en Italia y México mencionaron de la aparición de este tipo de evento en algunos de sus pacientes. Consideramos que este evento pudo estar relacionado con alguno de los componentes utilizados para la preparación y la aplicación de PRPO3. Esta valoración se fundamenta en que el tratamiento con antihistamínicos resolvió el cuadro clínico.
Discusión
El PRP es ampliamente empleado en el contexto actual, para promover la curación en ortopedia,9 curación de tejidos blandos,10 tejido nervioso,11 úlceras crónicas de la piel,12 oftalmología13 y odontología;14 con demostrada actividad antimicrobiana.15 Estas aplicaciones se fundamentan en el potencial regenerativo de los factores de crecimiento liberados por las plaquetas al activarse.16
El ozono médico también se ha empleado como activador del PRP. En estudios realizados por Bocci y cols. (1999)17 y Re y cols. (2010),18 han demostrado que la ozonización del plasma heparinizado promueve la agregación plaquetaria acentuando así la liberación de sus factores de crecimiento. La combinación de ambas técnicas, activación con CaCl2 y ozono, acelera la activación de las plaquetas.19
Dado que los preparados de PRP son autólogos, su administración es segura y bien tolerada por los pacientes. Las reacciones adversas graves no son comunes y los riesgos corresponden fundamentalmente a la vía de administración. Sin embargo, los pacientes pueden presentar de forma temporal síntomas no deseados después de la inyección (ej. dolor local, eritema e inflamación).19
En el presente caso, se observó la manifestación de un evento adverso, que no se presentó en los 29 participantes restantes del estudio. En los estudios realizados con la aplicación de PRP o PRPO3 no se encontró reporte de su aplicación para tratar la LAF en PVV, solo en la investigación realizada por Fontdevila y cols 6 se reporta el uso del PRP combinado con injertos de tejido adiposo autólogo. En este caso los autores evaluaron si el PRP mejora la integración de los injertos de tejido adiposo autólogo en el tejido receptor en el rostro, pero no refieren la ocurrencia de un evento similar al descrito en este trabajo. En dicho estudio se realiza únicamente una aplicación del material del relleno a cada paciente, mientras que en el presente estudio se realizaron varias aplicaciones al paciente, buscando la bioestimulación y regeneración del tejido facial dañado. En otro estudio donde se evaluó la eficacia y seguridad del uso del PRPO3 en el tratamiento de la hernia discal,20 no se describe la ocurrencia de este evento tampoco.
En la mayoría de los estudios realizados en el ámbito del tratamiento de la LAF, no se considera de interés describir las complicaciones conocidas como inmediatas y transitorias (edema, eritema, equimosis, la migración, la incisión visible, y otras) que están asociadas normalmente a la técnica de aplicación y con repercusión limitada sobre el aspecto del paciente.21,22,23
La presencia de otros componentes de la sangre también garantiza la eficacia de los tratamientos con PRP. Entre estos componentes encontramos glóbulos blancos, células madre pluripotentes CD34+, el agente de navegación SDF-1α y el factor de células madre.24 Durante el proceso de ozonización del PRP se produce la interacción del ozono mayoritariamente con biomoléculas (ácidos grasos poliinsaturados, antioxidantes y otras) presentes en el plasma. Esta reacción genera productos de oxidación lipídica y peróxido de hidrógeno (entre otras posibles especies reactivas de oxígeno), que podríamos denominar “metabolitos del ozono”. Estos derivados de la reacción del ozono con los dobles enlaces biomoleculares, ejercen diferentes funciones biológicas y terapéuticas, actuando como segundos mensajeros, activadores enzimáticos, mediadores químicos y de respuesta inmune proinflamatoria, entre otros.25
En este entorno se puede producir un proceso de sensibilización a algún componente propio que a nuestro criterio podía desencadenar una respuesta inflamatoria exacerbada, como la presentada por el paciente. Además, el hecho de estar con TAR también tiene un impacto relevante sobre su metabolismo. Sin embargo, para la comprobación de esta hipótesis es necesario llevar a cabo otros estudios.
El seguimiento de los parámetros clínicos evaluados no mostró manifestaciones de toxicidad renal, hepática o sanguínea en el paciente durante el estudio. Tampoco los marcadores de progresión y los indicadores de estado redox del paciente se modificaron.
Hasta el momento de la aparición del evento adverso, el paciente se mostró satisfecho con el resultado que estaba obteniendo con la aplicación del PRPO3. La salida del paciente de la investigación y la conducta terapéutica que se siguió se justificó por la presencia de este evento, no se interrumpió el estudio pues solo se presentó en este paciente y las manifestaciones fueron transitorias.
Tabla 1 Valores de los parámetros relacionados con los marcadores de progresión y los indicadores del estado redox del paciente tratado con plasma rico en plaquetas ozonizado
| Variable | Antes de la primera aplicación | Después de la sexta aplicación |
|---|---|---|
| LT CD4+ (cel/mL) | 820 | 775 |
| CV (copias/mL) | No detectable | No detectable |
| GSH (μM/g Hb) | 515,8 | 590,0 |
| HPO (μM) | 174,3 | 136,0 |
| CAT (U/mg Hb min) | 285 | 240 |
| SOD (U/mg Hb min) | 5,61 | 4,12 |
| PP (μM) | 9,97 | 8,90 |
LT CD4+: Número de Linfocitos T-CD4+, CV: Carga Viral plasmática, CAT: catalasa, SOD: superóxido dismutasa, HPO: hidroperóxidos, GSH: glutatión reducido, PP: potencial de peroxidación.
Tabla 2 Resultados de la evaluación de las variables hematológicas y hemoquímicas en el paciente.
| Variables | Intervalo de Referencia | Antes de la primera aplicación | Después de la tercera aplicación | Después de la sexta aplicación |
|---|---|---|---|---|
| Hemoglobina | 11,0-16,0 g/L | 14,3 | 13,0 | 13,5 |
| Hematocrito | 0,35-0,50 | 0,43 | 0,40 | 0,39 |
| Velocidad de Sedimentación Globular | 0-15 mm/h | 17 | 17 | 15 |
| Número de leucocitos | 4,0-10,0 x 109 /L | 4,9 | 5,0 | 5,0 |
| Granulocitos | 45,0-76,0 % | 58,0 | 66,0 | 51,0 |
| Linfocitos | 17,0-48,0 % | 26,0 | 25,0 | 43,0 |
| Plaquetas | 150-350 x 109 /L | 201 | 215 | 207 |
| Creatinina | 70,7-150,2 μmol/L | 63 | 61 | 96 |
| Ácido úrico | 208-430 μmol/L | 331 | 396 | 391 |
| Albúmina | 35-52 g/L | 52 | 44 | 54 |
| Alanina aminotransferasa | 0-50 U/L | 26 | 38 | 31 |
| Aspartato aminotransferasa | 0-45 U/L | 30 | 35 | 25 |
| Colesterol | 2,59-5,18 mmol/L | 5,2 | 5,1 | 5,5 |
| Triglicéridos | 0,67-1,86 μmol/L | 3,30 | 4,00 | 2,80 |
| Lactato deshidrogenasa | 200-400 UI/L | 261 | 211 | 261 |
| Proteínas totales | 60-80 g/L | 80 | 71 | 81 |
Fuente: Historia Clínica
CONCLUSIONES
En este caso se pudo identificar la aparición de un evento adverso relacionado con la aplicación del PRPO3 en un paciente con VIH. El seguimiento de este evento fue importante para poder apreciar de forma integral el caso y presentarlo a los profesionales de la medicina. Refiriendo además que fue un evento único y que tuvo solución con el tratamiento farmacológico indicado.