INTRODUCCIÓN
Las enfermedades alérgicas afectan de forma significativa la calidad de vida de los pacientes (Arias et al., 2018). La Organización Mundial de Alergia (WAO, siglas en inglés) las sitúa como la cuarta enfermedad más importante en el mundo (Escobar y Guaman, 2018). Por estas razones han sido catalogadas como una de las epidemias no infecciosas del siglo XXI (González, 2018). De ellas, el asma, es la de mayor morbilidad y mortalidad (Asamoah et al., 2017; Castro et al., 2020). En Cuba, el asma es considerada como un problema sanitario importante por parte de las autoridades de salud y se considera la enfermedad crónica más común de las enfermedades pediátricas (Castro et al., 2020). La exposición a ácaros del polvo doméstico es reconocida como el factor de riesgo más influyente en la aparición de enfermedades alérgicas, principalmente del asma (Caraballo et al., 2016; Kang et al., 2018). Los ácaros son los agentes sensibilizantes de mayor incidencia en América Latina. En Cuba, los más frecuentes son Blomia tropicalis (Bt), Dermatophagoides pteronyssinus (Dp) y Dermatophagoides siboney (Ds) (Castro et al., 2020).
La inmunoterapia alergeno específica (IT) es el único tratamiento para las alergias respiratorias capaz de cambiar el curso de la enfermedad, mejora sustancialmente los síntomas clínicos y reduce el consumo de medicamentos (Asamoah et al., 2017). El Centro Nacional de Biopreparados (BIOCEN) desarrolló tres extractos alergénicos estandarizados de ácaros del polvo doméstico: VALERGEN-DP; VALERGEN-DS y VALERGEN-BT (Labrada, 2008). En 2006 se logró el Registro Sanitario en Cuba como vacunas terapéuticas (inyectables) y posteriormente en el año 2009 fue registrada la vía sublingual; para el tratamiento del asma alérgica. Los productos VALERGEN están actualmente indicados para el tratamiento del asma alérgica, de leve a moderada, asociada a estos ácaros. La producción de estas vacunas parte del cultivo de los ácaros del polvo doméstico en condiciones de laboratorio. El resultado de la propagación de los mismos se define como la Materia Prima Alergénica (MPA). Hasta el momento, la MPA se concibe como el primer producto intermedio en el proceso productivo con especificaciones de calidad definidas y métodos de ensayos. El Ingrediente Farmacéutico Activo (IFA) de los extractos alergénicos de ácaros, es el segundo producto intermedio en el proceso de fabricación de este tipo de producto y lo constituyen los extractos alergénicos a granel de los ácaros del polvo obtenido después de la etapa de filtración esterilizante y antes del proceso de liofilización.
Se entiende por extracto alergénico estandarizado un producto con una composición que refleje adecuadamente la composición natural de la fuente alergénica, con actividad biológica consistente lote a lote, expresada preferentemente en unidades que permitan su comparación con otros productos y que sean informativas desde el punto clínico; así como con estabilidad definida, que sirva de base para el establecimiento de su período de validez (Cardona et al., 2018). Las Unidades Biológicas (UB) fueron introducidas en 1989 por las Guías Nórdicas para el Registro de Preparaciones Alergénicas y se definen como la concentración de alergeno capaz de introducir un habón del mismo tamaño que una solución de histamina 54,3 mmol/L, en la mediana de 20 pacientes. Tiene vital importancia la caracterización de los extractos según el perfil alergénico, ya que este puede variar en dependencia de la región geográfica en que nos encontremos, y alergenos que son importantes para una región pueden no serlo para otra, de ahí la importancia de caracterizar el perfil en cada región y/o país, para identificar las proteínas que deben estar presentes en el extracto que se utilice (Larsen y Dreborg, 2020). La técnica de electroforesis en geles de poliacridamida en presencia de dodecil sulfato de sodio (SDS-PAGE, siglas en inglés) es un método rápido, reproducible y de bajo costo a nivel de muestra. Es ampliamente utilizada para cuantificar, comparar y caracterizar proteínas (Wiesner et al., 2021). Se emplea actualmente en el laboratorio de Alérgenos de BIOCEN para determinar la composición de proteínas de los extractos alergénicos de ácaros en el producto terminado.
Según la GUIA No. 41-2013 “Validación de Métodos Analíticos” del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), la validación de los métodos analíticos utilizados en las actividades de control desempeña un papel determinante, pues de ellos depende la comprobación confiable y reproducible de los índices de calidad de las materias primas y productos, lo cual contribuye notablemente al aseguramiento de la calidad, seguridad y eficiencia de los mismos.
Con el propósito de elevar el actual estándar de calidad de estos productos alergénicos, así como asegurar la calidad del producto final es necesaria la introducción del ensayo de composición de proteínas (SDS-PAGE) como método de control de calidad de la MPA y el IFA y establecer parámetros y límites de aceptación para las tres especies de ácaros. Por estas razones, el objetivo de este trabajo fue validar el método de SDS-PAGE para extractos alergénicos de ácarosen las tres etapas del proceso de fabricación (MPA, IFA y producto final).
Materiales y Métodos
Descripción de las muestras
Se realizó un único estudio de validación utilizando como muestras extractos de los ácaros Bt y Ds en las tres etapas del proceso de fabricación (MPA, IFA y producto final). Teniendo en cuenta principio de agrupación de alergenos homólogos establecido por la Monografía sobre Productos Alergénicosde la Farmacopea Europea (2010:1063), los resultados del extracto de Ds son aplicables al ácaro Dp. A continuación, se muestran los lotes empleados:
MPA del extracto alergénico de Bt, lote 1102
MPA del alergénico de Ds, lote 0902
IFA del extracto alergénico de Bt, lote AB12IFA004
IFA del extracto alergénico de Ds, lote AS12IFA001
Producto final del extracto alergénico de Bt(Referencia Interna), lote 601001
Producto final del extracto alergénico de Ds (Referencia Interna), lote 50101
Preparación de las muestras
Las muestras de MPA e IFA fueron concentradas por precipitación con ácido tricloroacético (TCA). Se mezcló cada muestra con TCA al 20 % a partes iguales. Se dejó reposar la mezcla durante 1 h a 4°C y luego se centrifugó a 12 000 rpm, durante 15 min. El sobrenadante fue desechado y el pellet se lavó 3 veces con acetona fría, se centrifugó a 12 000 rpm durante 10 min y se dejó secar bien a temperatura ambiente. El pellet final se disolvió en agua (dilución 1:10). Las muestras de producto final (extractos liofilizados) se reconstituyeron con agua destilada hasta lograr una concentración equivalente a 20 000 UB de Ds y 100 000 UB de Bt. Finalmente se adicionó solución de buffer no reductor para el caso de las muestras de Ds y buffer reductor para las de Bt y se calentaron las muestras el Bloque Térmico por 5 minutos.
Método analítico SDS-PAGE
El sistema consta de una cámara de electroforesis acoplada a una fuente de corriente alterna. La técnica se realizó según PNO 06.054 “Electroforesis de Extractos Alergénicos en gel de poliacrilamida-SDS (Sistema Discontinuo)”. Las condiciones de corrida del gel fueron: 25 mA de corriente y voltaje abierto. Se aplicaron 10µL de cada muestra. Una vez terminada la corrida del gel, se realizó la tinción durante 1 hora en la zaranda a temperatura ambiente y luego la destinción2 ó 3 veces hasta lograr una completa visualización de las bandas. Se realizó el análisis densito métrico mediante el sistema Image Master v4.0 (Amersham Pharmacia) y se determinó el peso molecular de las bandas detectadas y el porcentaje del área bajo la curva de las bandas principales:
15 a 17 kDa y 25 a 26 kDa para Ds (corresponden a los alérgenos mayores Der s 2 y Der s 1 respectivamente) para las tres variantes MPA, IFA y Producto Final.
12 a 21 kDa para Bt (corresponden a los componentes alergénicos principales de dicho ácaro) para las tres variantes MPA, IFA y Producto Final, además se incluye la banda de 28 a 32 kDapara la MPA.
Método de validación
El método de validación fue diseñado de acuerdo con lo expresado en la GUIA No. 41-2013 “Validación de Métodos Analíticos” del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Está compuesto por los ensayos de precisión (repetibilidad, precisión intermedia y reproducibilidad), exactitud, especificidad y límite de detección. Las muestras empleadas y su preparación se describen en los acápites 2.1 y 2.2. Los ensayos se realizaron en tres laboratorios de BIOCEN: Laboratorio de Alérgenos, Laboratorio de Control del Proceso de la Planta de Ingredientes Activos (PIA) y Laboratorio de Control de la Calidad. La técnica de SDS-PAGE se realizó para cada producto como se describe en el acápite 2.3.
La precisión del método se determinó a través de los ensayos de repetibilidad (intraensayo), precisión intermedia (interensayo) y reproducibilidad (interlaboratorio).
La repetibilidad se evaluó por un analista del Laboratorio de Alérgenos. Se realizó la técnica aplicando 6 réplicas de cada muestra. Se determinaron mediante una hoja cálculo en Excel la media, desviación estándar (DE) y coeficiente de variación (CV%) de los valores de los PM y de la suma del porciento del área bajo la curva de cada banda (ΣA%). Se repitió 3 veces el análisis densitométrico de los geles de producto terminado, empleando los mismos parámetros del software. Se tuvieron como criterios de aceptación que los CV% de los valores deΣA% entre réplicas y entre diferentes análisis densitométricos fuera< 5%.
La precisión intermediase llevó a cabopor dos analistas en el Laboratorio de Alergenosdurante 3 días diferentes para cada muestra analizada. Se realizóla técnica para cada muestra por triplicado. Se calcularonla media, la DE y el CV% para cada analista por separado y el total. Los criterios de aceptación adoptados fueron: que los CV% para los valores de ΣA% de las bandas principales entre los diferentes días por un mismo analista y el CV% total fueran <5% y que no existieran diferencias significativas (p>0,05) entre los valores de CV% de diferentes analistas según la prueba de Fisher.
La reproducibilidad de la técnica se determinó por dos analistas en diferentes laboratorios (el primer analista del Laboratorio de Alergenos y el segundo analista de Control del Proceso de PIA en el caso de las muestras de MPA e IFA, en el caso del producto terminado el segundo analista fue de Control de la Calidad). Se realizó el ensayo para cada muestra a dos concentraciones diferentes (40 000 UB-20 000 UB para Dsy 200 000 UB-100 000 UB para Bt). Calcule los valores de la media, la DE y el CV% para cada analista por separado y el total. Los criterios de aceptación fueron que el CV% de ΣA% de las bandas principales entre diferentes días por un mismo analista para cada concentración y el CV% total fueran < 5% y la no existencia de diferencias significativas (p>0,05) entre los CV% de diferentes analistas según la prueba de Fisher.
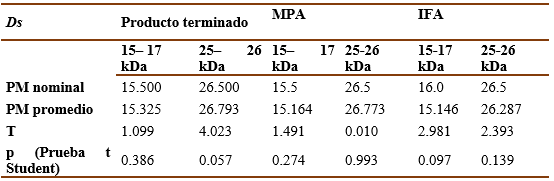
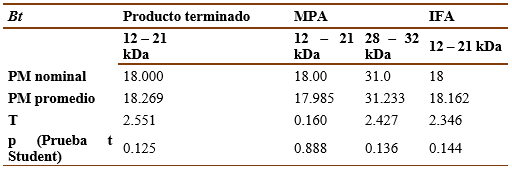
Para evaluar la exactitud de la técnica en la determinación de los pesos moleculares de las bandas principales se tomó los resultados del cálculo de los pesos moleculares obtenidos en el ensayo de repetibilidad para cada producto. Se compararon los resultados de los pesos determinados con el valor real reportado en la literatura para los alérgenos principales de ambos extractos (Bt y Ds). Para ello se utilizó una prueba de t de Student y se tuvo como criterio de aceptación la no existencia de diferencias significativas (p>0,05) entre el valor experimental y el valor real.
El ensayo de especificidad consistió en determinar la posible interferencia del bicarbonato de amonio, componente del tampón de las formulaciones. Se realizó un ensayo para cada producto por un solo analista en el Laboratorio de Alérgenos aplicando en cada uno 2 muestras con bicarbonato de amonio adicional a 2 concentraciones diferentes (5-10 mg/mL). Se realizó el cálculo de los pesos moleculares y se compararon con los resultados de los pesos moleculares de las bandas principales obtenidos en el ensayo de repetibilidad para una de las réplicas de cada extracto alergénico. Para ello se utilizó un ANOVA y se tuvo como criterio de aceptación la no existencia de diferencias significativas (p>0,05) entre los porcentajes de las bandas principales obtenidos entre los extractos alergénicos en su composición original y los que presentan bicarbonato de amonio para cada producto.
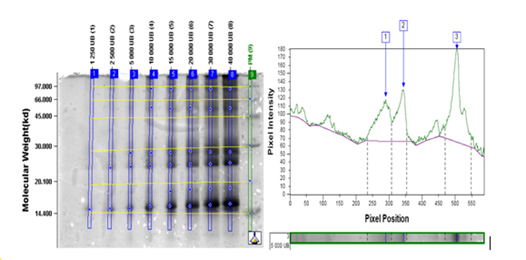
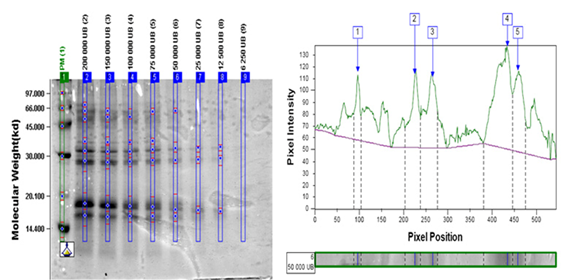
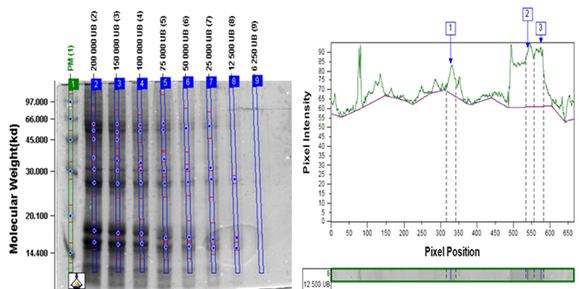
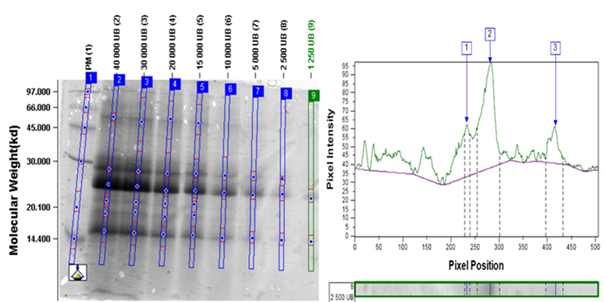
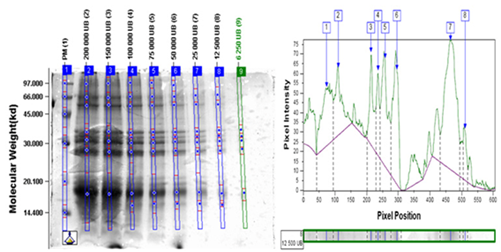
La determinación del límite de detección (LD) se llevó a cabo por un solo analista del laboratorio de Control de la Calidad en el caso del producto terminado y del Laboratorio de Alérgenos en el caso de la MPA y el IFA. Se aplicaron en geles separados cada una de las muestras con las siguientes concentraciones:
Ds: 40 000, 30 000, 20 000, 15 000, 10 000, 5 000, 2 500, 1 250 UB
Bt: 200 000, 150 000, 100 000, 75 000, 50 000, 25 000, 12 000, 6 500 UB
Se realizó el análisis densito métrico de cada gel y se determinó el límite de detección como la menor concentración en que se detectan todas las bandas principales de cada producto. Se tuvo como criterio de aceptación del ensayo que el LD < 20 000 UB para Ds y < 100 000 UB para Bt.
Resultados
Desempeño del método analítico
Los resultados de los ensayos de Repetibilidad para las muestras de IFA, MPA y producto terminado, para Ds y Bt se muestran en las tablas I y II, respectivamente. Como se puede observar los valores del CV% de los valores de ΣA% entre réplicas de cada análisis y entre los diferentes análisis densitométricos son menores que 5%, por lo que quedó demostrada la precisión intraensayo del método.
Tabla 1 Resultados del ensayo de repetibilidad para Ds . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
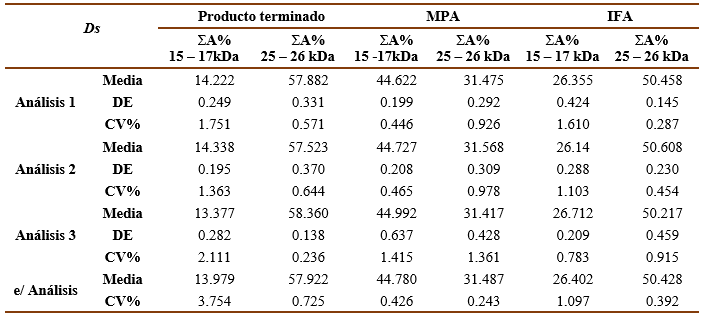
Tabla 2 Resultados del análisis de repetibilidad para Bt . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
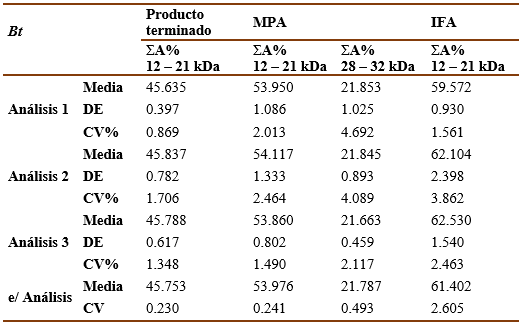
Las tablas III y IV muestran los resultados del ensayo de precisión intermedia para las muestras de Ds y Bt, respectivamente. La precisión inter ensayo quedó demostrada pues, como se puede observar, los CV% para los valores de ΣA% de las bandas principales entre los diferentes días por un mismo analista y el CV% total fueron < 5% y no existieron diferencias significativas (p>0,05) entre los valores de CV% de diferentes analistas según la prueba de Fisher.
Tabla 3 Resultados del análisis de precisión intermedia para Ds . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
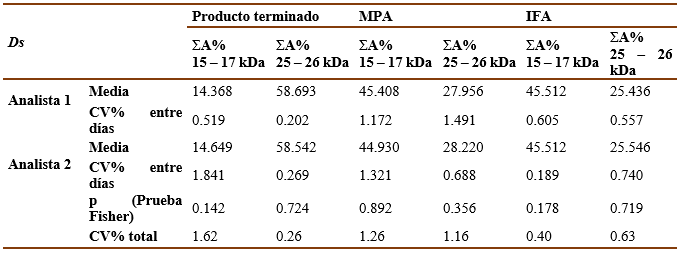
Tabla 4 Resultados del análisis de precisión intermedia para Bt . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
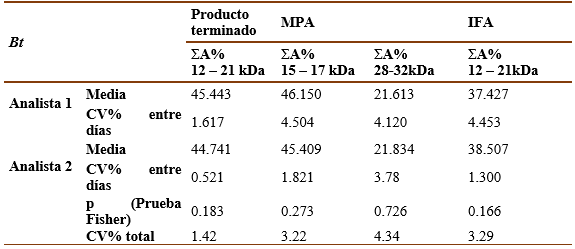
La reproducibilidad del método se evaluó comparando los resultados de la técnica en laboratorios diferentes (el primer analista del Laboratorio de Alérgenos y el segundo analista de Control de Proceso de PIA en el caso de las muestras de MPA e IFA, en el caso del producto terminado el segundo analista fue de Control de la Calidad). Como se puede apreciar en las tablas V y VI, la precisión interlaboratorio quedó demostrada tanto para las muestras de Ds como para Bt, pues el CV% de ΣA% de las bandas principales entre diferentes días por un mismo analista para cada concentración y el CV% total fueron < 5% y no existieron diferencias significativas (p>0,05) entre los CV% de diferentes analistas según la prueba de Fisher.
Tabla 5 Resultados del análisis de reproducibilidad para Ds . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).40 000 UB (Conc. 1), 20 000 UB (Conc. 2)
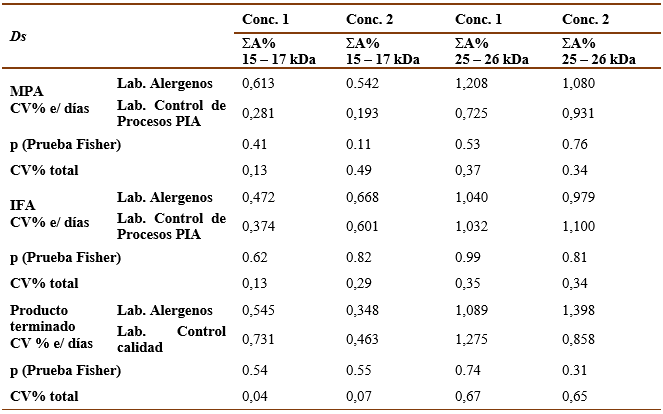
Tabla 6 Resultados del análisis de reproducibilidad para Bt . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).200 000 UB (Conc. 1)100 000 UB (Conc. 2).
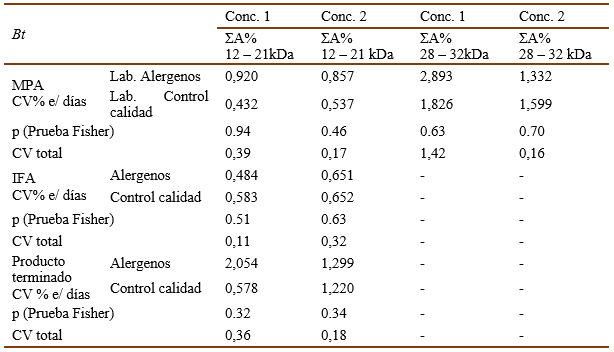
Las tablas VII y VIII muestran los resultados del ensayo de especificidad para las muestras de Ds y Bt respectivamente. El bicarbonato de amonio, componente del tampón de las formulaciones, no ofreció interferencia en la determinación de la composición de proteínas en los extractos alergénicos, pues no hubo diferencias significativas (AMOVA, p>0,05) entre los porcentajes de las bandas principales obtenidos para los extractos alergénicos en su composición original y los que presentaban bicarbonato de amonio para cada producto.
Tabla 7 Resultados del análisis de especificidad para Ds . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
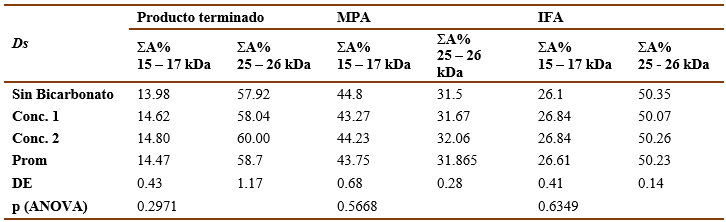
Tabla 8 Resultados del análisis de especificidad para Bt . Sumatoria del porciento del área bajo la curva de las bandas principales (ΣA%).
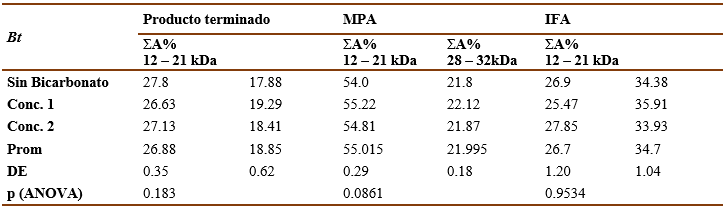
El método demostró ser exacto pues, como se muestra en las tablas IX y X, tanto para las muestras de Ds como para las de Bt, no hubo diferencias significativas (p>0.05, t de Student) entre el valor experimental y el valor real del peso molecular de las bandas principales.
Los resultados de la determinación del límite de detección se resumen en la Tabla XI. Luego se muestran los análisis densitométricos de los geles de MPA (Figura. 1 y Figura. 2), IFA (Figura. 3 y Figura. 4) y Producto terminado (Figura. 5 y Figura. 6) para ambas especies (Ds y Bt). En todos los casos se cumplió con el criterio de aceptación del ensayo LD < 20 000 UB para Ds y < 100 000 UB para Bt.
DISCUSIÓN
BIOCEN desarrolló tres extractos alergénicos estandarizados de ácaros del polvo doméstico: VALERGEN-DP, VALERGEN-DS y VALERGEN-BT para el tratamiento del asma alérgica (Labrada, 2008). En 2006 se logró el Registro Sanitario en Cuba como vacunas terapéuticas (inyectables) y posteriormente en el año 2009 fue registrada la vía sublingual. Los productos VALERGEN están actualmente indicados para el tratamiento del asma alérgica, de leve a moderada, asociada a estos ácaros. Contar con estas vacunas estandarizadas constituye una herramienta de gran valor para elevar la calidad de la atención al paciente alérgico y asmático, su calidad de vida y la progresión de la enfermedad alérgica considerando que la IT es el único tratamiento capaz de modificar el curso de esta enfermedad (Castro et al., 2020).
La producción de estas vacunas parte del cultivo de los ácaros del polvo doméstico en condiciones de laboratorio. El resultado de la propagación de los mismos se define como la Materia Prima Alergénica (MPA). Hasta el momento, la MPA se concibe como el primer producto intermedio en el proceso productivo con especificaciones de calidad definidas y métodos de ensayos. Entre los parámetros establecidos por la Monografía sobre productos Alergénicos de la Farmacopea Europea (2010:1063), están de forma obligatoria la Identidad y la Pureza, entendida esta última como la ausencia de contaminantes vivos como otras especies de ácaros e insectos u otras sustancias alergénicas o ajenas al cultivo. El Ingrediente Farmacéutico Activo (IFA) de los extractos alergénicos de ácaros, es el segundo producto intermedio en el proceso de fabricación de este tipo de producto y lo constituyen los extractos alergénicos a granel obtenidos. La guía europea sobre calidad de los productos alergénicos de la EMA (CPMP/BWP/243/96) estipula la aplicación de ensayo de composición de proteínas o alérgenos, usuales para los productos finales, también a la Materia Primas Alergénica y el Ingrediente Farmacéutico Activo de manera que se pueda asegurar la calidad del producto final ya desde sus estadios iniciales.
La técnica de SDS-PAGE es un método rápido, reproducible y de bajo costo a nivel de muestra. Es ampliamente utilizada para cuantificar, comparar y caracterizar proteínas (Wiesner et al., 2021). Se venía empleando en el laboratorio de Alérgenos para determinar la composición de proteínas en el producto terminado de las vacunas VALERGEN y se hacía necesario extender su uso para los productos intermedios (MPA e IFA). Por tanto, este estudio presenta la validación del método de SDS-PAGE para los extractos alergénicos de ácaros (productos intermedios y final). Durante el desarrollo de un producto, la validación de los métodos analíticos utilizados en las actividades de control desempeña un papel determinante, pues de ellos depende la comprobación confiable y reproducible de los índices de calidad de dicho producto en cada fase del proceso productivo. (GUIA No. 41-2013, CECMED).
Las bandas alergénicas más importantes de los extractos de ácaros del género Dermatophagoides se localizan en las regiones de 15-17, 25-26 y 30 kDa. Los extractos de Dp y Ds producidos en BIOCEN tiene como componentes alergénicos mayoritarios a Der s1 y Der p1, localizados en la región de 25-26 kDa y a Der s2 y Der p2, localizados en la región de 15-17 KDa (Labrada, 2008).
De los alérgenos de Bt, Blo t 5 presenta una unión a IgE de 40-60% ha sido registrado como alérgeno principal junto con Blo t 21 (pesos moleculares de 14 y 13 kDa respectivamente). Blo t 2 es una proteína polimórfica, que presenta tres iso formas de peso molecular entre 13,5-15 kDa (Santos da Silva et al., 2017). Diferentes autores colocan a Blo t 2 como un componente responsable en gran medida de la actividad alergénica del extracto, con un alto reconocimiento por anticuerpos específicos en suero de pacientes cubanos, según se determinó mediante Western blotting (Mateo et al., 2015).
El estudio de precisión de la técnica de SDS-PAGE para extractos de ácaros mostró una buena repetibilidad y reproducibilidad de los resultados, obteniéndose CV menores que 5%. Estos resultados cumplen no solo con los criterios de aceptación de la guía nacional del CECMED (GUIA No. 41-2013), sino también con lo expresado en la guía internacional para la Validación de Métodos Analíticos ICH Q2 (R1). Es importante que los resultados se encuentren en el rango de tolerancia establecido para los productos. Específicamente para la composición de proteínas de los productos alergénicos no se establecen rangos explícitos en los documentos regulatorios internacionales, quedando este aspecto a decisión de los fabricantes. No obstante, en la Monografía para Productos Alergénicos de la Farmacopea Europea (2010:1063), se establecen como rango para el ensayo de contenido de proteínas totales 80-120% y para el de componentes alergénicos individuales 50-150%. La precisión del SDS-PAGE en este trabajo (5%) resultan mucho menor que ambos intervalos, lo cual sostiene la idoneidad de este ensayo para el control de calidad.
Por otro lado, las bandas principales tanto para los extractos de Ds (15 a 17 kDa y 25 a 26 kDa) como de Bt (12 a 21 kDa) fueron identificadas mediante SDS-PAGE con gran exactitud, sin diferencias significativas (t Student, p˃0.5) entre los valores de pesos moleculares determinados experimentalmente y los valores registrados en la literatura.
La elaboración y desarrollo del protocolo de validación se realizó teniendo en cuenta lo expresado en la GUIA No. 41-2013 “Validación de Métodos Analíticos” del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Los resultados obtenidos en la validación cumplieron con los criterios de aceptación establecidos la literatura. Los mismos se considerarán válidos siempre y cuando la técnica se realice como está establecido, necesitándose una revalidación si existieran cambios reales o posibles en su ejecución, realizándose una validación parcial si son cambios menores en el método o una revalidación exhaustiva (revalidación de todos los parámetros aplicables) cuando sean cambios mayores o resultados fuera de especificación imputables al método analítico.
CONCLUSIONES
Quedó validada la técnica analítica SDS-PAGE para la determinación de la composición de proteínas en los extractos alergénicos de ácaros en tres etapas diferentes del proceso de fabricación. Este método se valida por primera vez en BIOCEN para su aplicación como control de la calidad de la Materia Prima Alergénica y para el Ingrediente Farmacéutico Activo (productos intermedios), posibilitando la introducción de esta técnica en el control de dichas etapas. En su conjunto se fortalece el aseguramiento de la calidad de estos productos, con impacto potencial en la seguridad y efectividad de la inmunoterapia alérgeno específica.