1. INTRODUCCIÓN
El Ecuador es uno de los principales países exportadores de camarón a nivel mundial cuyas exportaciones de enero a mayo del 2015 alcanzaron un acumulado de 137,331 toneladas, el cual es exportado en fresco, congelado y en conservas (Banco Central del Ecuador, 2015). La cantidad de residuo sólido generado en la producción camaronera es alto y muchas veces no se le da el tratamiento adecuado, hoy día el interés de utilizar los recursos naturales de manera beneficiosa para la humanidad, ha llevado a realizar diversas investigaciones con la posibilidad de aprovechar los desechos de la industria pesquera, estos desechos son considerados contaminantes, sin embargo, son una fuente para obtener biopolímeros de alto valor agregado como lo es la quitina y su derivado funcional, el quitosano.
La quitina es un polisacárido nitrogenado biodegradable, de alta masa molecular, compuesto por enlaces β(1-4) 2-acetoamida-2-desoxi-α-D-glucosa, o bien por unidades monoméricas de N-acetil glucosamina, el cual se encuentra en grandes proporciones en la naturaleza y es considerada un derivado de la glucosa (Kannan y col., 2010). Posee una consistencia dura e inflexible de tonalidad blanca y se obtiene del exoesqueleto de muchos crustáceos, insectos, hongos y algas, y su producción industrial se basa en el tratamiento del desecho de las plantas procesadora de crustáceos como camarones, langostas y cangrejos (Hernández y col., 2009).
La quitina fue aislada por primera vez en 1811 por Henri Braconnot mientras trabajaba con hongos superiores y la denominó fungina. Más tarde en 1823, Odier encontró el mismo material, es decir quitina, en insectos y plantas, nombrándolo "chitine" (Khoushab y Yamabhai, 2010). En los años 1930 a 1940 se investigó mucho acerca de este polímero, pero los altos costos y la mejor perspectiva de uso de los polímeros sintéticos los renegó.
En 1993 se obtuvo quitina a partir de desechos de camarón con enzimas proteolíticas comerciales, como quimotripsina tipo II (CE 3.4.21.1) y papaína (CE 3.4.22.2). Primero se realizó una desmineralización con ácido acético al 1,75N durante 12 horas a temperatura ambiente, para luego desproteinizarla con quimotripsina (E/S 0,7:100) a un pH 8,0 y temperatura de 40°C un rendimiento de 46,4 % de proteínas y con papaína a pH 8,7 tuvo un rendimiento de 48,8 %, (Gagné, 1993). Después se trabajó con fermentación láctica, obteniendo como condiciones óptimas para la desmineralización y desproteinización, temperaturas entre 30-40°C, y pH que inició en 8 y se estabilizó en 6,8 a las 96 horas, (Pacheco, 2010). Al combinar esto último con enzimas bacterianas comerciales también se obtuvo quitina parcialmente purificada, alcanzándose rendimientos de un 82,58 % en el desmineralizado y 97,79 % en la desproteinización, y los mejores resultados fueron usando N-Proteasa a un pH 7,5 (E/S 0,5:100) y 45°C de temperatura, (Juárez, 2012).
La cabeza de camarón, es uno de los principales desechos que genera la industria camaronera, ya que este producto es comercializado entero o solo la parte de la cola, y hoy se demandan procesos más amigables con el medio ambiente, lo que impulsa el aprovechamiento productivo de estos, ahora subproductos, de manera de añadirles valor, para lo cual existen muchas alternativas de procesamiento como es la producción de harina de pescado. Los residuos del procesado del marisco contienen en general un 14% a 35 % de quitina asociada con proteínas (30% a 40 %), lípidos, pigmentos y depósitos de calcio (30% a 50 %), estimándose por tanto una producción mundial anual de quitina de los residuos de mariscos en aproximadamente 120 000 toneladas, (Pastrana, 2010).
Las posibles aplicaciones de la quitina, y más aún de su derivado principal, el quitosano son diversas y la evolución de su uso es significativa y en crecimiento. Por su naturaleza y actividad biológica, pueden ser aprovechadas en la industria de los polímeros biodegradables para aplicaciones biomédicas, agrícolas y tratamiento de aguas, también para la absorción de metales, como agente antimicrobiano, como aditivo por sus propiedades gelificantes y emulsificantes, y demás aplicaciones en medicina y biotecnología, (Hadwiger et al., 1984), (Rodríguez y col, 2000) y (Struszczyk et al., 1989).
Sin embargo debido a la insolubilidad en la mayoría de los solventes, propia de la quitina la limitan y la principal aplicación se reduce al estado sólido, donde los avances más importantes han sucedido en los campos de adsorción y complejación, por ejemplo en medicina las investigaciones sugieren que puede ser aplicada como material para hacer fibras de suturas absorbentes y vendajes, resistentes al ataque de bilis, ácido úrico y jugo pancreático (Yalpani et al., 1992) (Nakijama et al., 1984). Al igual que el quitosano también ha sido usado para el tratamiento de aguas residuales, en su decoloración y en la remoción de metales pesados como mercurio, cadmio, plomo o cobre en concentraciones de 10 a 50 ppm. Otros derivados de quitina solubles en agua, como la hidroximetilquitina ha presentado buena actividad como floculante frente a efluentes aniónicos, (Peniche-Covas et al., 1987) (Jha et al., 1988) y en la industria textil para impartir flexibilidad y resistencia a la tensión a las fibras textiles, se ha usado también para preparar columnas de cromatografía por afinidad, para la inmovilización de enzimas (Rinaudo, 2006) (Kumar, 2000).
La obtención de quitina se la puede realizar mediante métodos químicos, biológicos y enzimáticos. Sin importar el tipo de método elegido, los procesos a realizar consisten en extraer los componentes presentes en la materia que no sean quitina, como son la desmineralización y la desproteinización, seguida en ocasiones de decoloración, cuyo orden dependerá del origen de la materia prima, o de la intención de recuperación de subproductos (Pastor de Abram, 2004). Por otra parte, los métodos químicos son altamente contaminantes, los métodos biológicos mantienen estrictos controles en variables de proceso, en tanto que los métodos enzimáticos no tienen o son mínimos estos problemas permitiendo así aprovechar estos subproductos, aunque en principio pueden ser más costosos.
Ante esta problemática se realizará la evaluación de un método enzimático para extraer quitina a partir del exoesqueleto de cabezas de camarón (Litopenaeus Vannamei), utilizando enzimas proteolíticas como α quimiotripsina y papaína para la etapa de desproteinización.
2. MATERIALES Y MÉTODOS
2.1. Obtención de quitina
El proceso de obtención de quitina a partir del exoesqueleto de camarón consistió en extraer los diferentes componentes presentes en la materia prima tales como minerales, proteínas y trazas de pigmentos, quedando así finalmente solamente quitina. Este procedimiento se dividió, por lo tanto, en cuatro etapas como son: limpieza y preparación de la materia prima, desmineralización, desproteinización y decoloración.
En la primera etapa, el proceso inició con la recepción y pesaje de la materia prima. Las cabezas de camarón receptadas fueron almacenadas en congelación hasta su uso. Se lavaron las cabezas de camarón con agua de grifo y se realizó un descarnado manual, para una posterior cocción durante 2 horas a 100°C. Las cáscaras cocidas fueron secadas en una estufa marca Memmert modelo Sn55 a 76°C durante 12h y una vez secas fueron molidas en un molino manual marca Corona hasta obtener un tamaño de partícula de aproximadamente 300 micrómetros (malla entre #50 y #60) y almacenadas a temperatura ambiente.
En la segunda etapa, la cáscara molida se sometió a un proceso de desmineralización utilizando para el efecto, ácido acético de grado glacial. Se realizaron varios ensayos con concentraciones de ácido acético glacial al 5, 10, 15 y 20 %, tanto en reposo como con agitación durante un periodo de tres horas para un posterior filtrado al vacío. La mejor concentración de ácido para una óptima desmineralización fue del 15 % en agitación, para una relación muestra - ácido 1:20 (w/v). Una vez determinado el mejor método de desmineralización se procedió a replicar el mismo para el resto del material para su desmineralizado y etapas de obtención de quitina siguientes.
La materia desmineralizada con ácido acético presentó un pH ácido al final del proceso de 4,71, el mismo que fue necesario regular para el posterior paso de desproteinización, que según Nellie Gagné (1993) es de 8 para la α-quimotripsina y de 8,7 para la papaína.
En la tercera etapa se realizó la despigmentación, empleando etanol al 97 % en una relación 1:20 con agitación continua y lavados con agua destilada cada 2 horas, durante 12 horas. La extracción del color fue determinada a través de la absorbancia de los baños de etanol a 470 nanómetros mediante espectrofotómetro UV - visible, que es la longitud de onda característica de la astaxantina (Castro y Sepúlveda, 2000).
La cuarta y última etapa fue la crucial para el proceso de obtención de quitina por la vía enzimática, para lo cual, se manipularon las variables en estudio: tipos de enzima y relación Enzima-Sustrato, como se muestra en la tabla 1, con el fin de determinar cuantitativamente su efecto sobre el sustrato, exoesqueleto de camarón y la liberación de quitina.
Se aplicó un diseño experimental de tipo factorial 22, para las dos variables a dos niveles de la relación enzima - sustrato E/S (0,5:100 y 0,7:100), y con tres repeticiones para cada ensayo, constituyendo un bloque de 12 experimentos dispuestos al azar.
Tabla 1 Tratamientos enzimáticos
| Símbolo | Significado |
|---|---|
| QB1 | α-quimotripsina 0,5:100 |
| QB2 | α-quimotripsina 0,7:100 |
| QB3 | Papaína 0,5:100 |
| QB4 | Papaína 075:100 |
De aquí se obtuvieron como variables de respuesta el porcentaje de quitina, la masa molecular y el grado de acetilación.
Además, se caracterizó el material a través del análisis proximal (AOAC,1990; AOAC, 2000; FAO, 1986) para la determinación de humedad, extracto etéreo, contenido de proteína y cenizas, y con ello determinar la eficiencia de cada uno de los procesos.
2.2. Determinación del porcentaje de quitina obtenida
El grado de pureza de la quitina obtenida se determinó siguiendo el método de Black y Schwartz (1950). Este método consiste en colocar 5 g de muestra de quitina en un matraz balón, se agregan 100 mL de HCl al 3 %, se pone a reflujo por 60 minutos y se lava hasta alcanzar pH 7. La muestra se vuelve a colocar en el matraz y se agregan 100 mL de NaOH al 5 % y se refluja por 60 minutos más, luego se lava hasta eliminar el NaOH. La muestra es pesada y secada a 110°C por 15 minutos y se vuelve a pesar. Por último, se incinera a 700°C por 30 minutos y se pesa. El porcentaje de quitina en la muestra se calcula con la siguiente ecuación (Ecuación 1): (Black y Schwartz, 1950).
2.3. Determinación de la masa molecular
La masa molecular de la quitina fue determinada por el método viscosimétrico. La viscosidad intrínseca de una muestra [η] proporciona, indirectamente, su masa molecular Mv (g/mol), mediante la ecuación de Mark-Houwink (Ecuación 2):
Donde
La viscosidad intrínseca de la muestra se determinó utilizando un viscosímetro Cannon-Fenske 300 (ASTM D 445) con un baño termostático a 20°C por donde se hizo circular 0,1 g de quitina disuelta en hidróxido de sodio 2,77 M. Los parámetros viscosimétricos descritos en la tabla 2 se utilizaron para determinar la viscosidad intrínseca mediante el método gráfico empleando la ecuación de Huggins (Ecuación 3), que relaciona la viscosidad reducida con la concentración del polímero.
Tabla 2 Parámetros viscosimétricos
| Nombre común | Símbolo y ecuación |
|---|---|
| Viscosidad relativa |
|
| Viscosidad específica |
|
| Viscosidad reducida |
|
| Viscosidad inherente |
|
| Viscosidad intrínseca |
La masa molecular se determinó mediante la siguiente ecuación (Ecuación 4), utilizando los siguientes valores para las constantes: K=0,1, a=0,68 a 20°C (Einbu y Varum, 2008).
2.4. Determinación del Grado de acetilación
El grado de N-acetilación de la quitina se determinó mediante valoración potenciométrica. Para ello, se disolvieron 0,5 g de quitina en 20 mL de HCl 0,3 M y se tituló con una solución de NaOH 0,1 M. La valoración se realizó midiendo el cambio de pH cada 2 mL de base añadida, hasta alcanzar un valor de pH de aproximadamente 11. El grado de acetilación se determina obteniendo la derivada del pH en función del volumen de NaOH utilizado, estos valores se grafican y se obtienen dos puntos de inflexión (V1 y V2) que se aplicarán en la ecuación (Ecuación 5), estos puntos representan la cantidad de ácido necesario para protonar los grupos amino de la quitina. Para conocer el grado de desacetilación de la muestra, este valor se resta de 100 y se obtiene el grado de acetilación de la muestra de quitina (Parada y col., 2004).
3. RESULTADOS Y DISCUSIÓN
En la tabla 3 se muestra que la materia prima inicial en base seca estuvo principalmente constituida por proteínas (42,33 %), seguido de cenizas (40,59 %) y se observaron cantidades mínimas de grasa (0,32 %), cabe destacar que el porcentaje de proteínas es similar al observado por otros autores que expresan un contenido de proteínas en exoesqueleto de camarón de 30 al 40 %, sin embargo el contenido de minerales de la materia prima utilizada fue muy superior que el registrado en otros trabajos (10% a 20 %) mientras que el contenido de grasas fue bastante inferior al reportado por la literatura (8% al 10 %) (Juárez, 2012), estos porcentajes varían en función de la especie y del medio de crecimiento, constituyendo un factor de especial atención durante el proceso de obtención de quitina. Se observa además que la materia prima inicial presenta un alto contenido de humedad (57,81 %) que puede ocasionar su deterioro y mediante el tratamiento de preparación esta humedad se redujo considerablemente (3 %) brindando estabilidad a la materia ante el ataque bacteriano.
La proteína y las cenizas son los valores que buscan disminuirse durante los procesos para la extracción de quitina, los cuales como se observa disminuyeron a través de cada etapa del proceso. Después del secado de la materia prima se observa un ligero aumento en el porcentaje de grasas, proteínas y cenizas (0,4029 %, 45,09 % y 42,05 %, en base seca, respectivamente), mediante el tratamiento de desmineralización se consiguió reducir el contenido de cenizas a 1,82 %, es decir que se obtuvo un porcentaje de desmineralización del 95,67 % y se observó una reducción del porcentaje de proteínas del 6,96 %.
Tabla 3 Análisis químico proximal del desperdicio de camarón, desperdicio de camarón seco, desmineralizado y quitina
| Muestra | Humedad (%) | Grasas* (%) | Proteínas* (%) | Cenizas* (%) |
|---|---|---|---|---|
| MP | 57,81 | 0,32 | 42,33 | 40,59 |
| MPS | 3,81 | 0,40 | 45,09 | 42,05 |
| MPDM | 3,26 | 0,98 | 41,95 | 1,82 |
| QB1 | 3,57 | 2,56 | 17,23 | 0,74 |
| QB2 | 4,08 | 2,29 | 11,13 | 0,21 |
| QB3 | 8,08 | 0,71 | 14,50 | 0,314 |
| QB4 | 6,85 | 0,64 | 13,79 | 0,316 |
MP: materia prima, MPS: materia prima cocida y secada,
MPDM: materia prima desmineralizada,
QB1 y QB2: quitina biológica a partir de desproteinización con α-quimotripsina en relaciones E/S 0,5:100 y 0,7:100 respectivamente,
QB3 y QB4: quitina biológica a partir de desproteinización con papaína en relaciones E/S 0,5:100 y 0,7:100 respectivamente. (* en base seca).
En cuanto a la determinación de proteína y quitina respecto de la relación enzima - sustrato E/S, la tabla 4 muestra que el tratamiento QB2 es el que presenta el mayor porcentaje de desproteinización, es decir que la α-quimotripsina en una relación E/S de 0,7:100 resultó como el mejor de todos los tratamientos, obteniendo en promedio un porcentaje remante de proteínas de 11,13%, es decir que mediante este tratamiento se consiguió una desproteinización promedio del 73,48 %.
No obstante, se encontró que no existe diferencia estadística significativa entre los diferentes tratamientos, tan sólo se observa una diferencia estadísticamente significativa entre los tratamientos QB1 y QB2, lo que comprueba que a mayor concentración de quimotripsina ocurre una mayor desproteinización del sustrato. Por su parte, los tratamientos con papaína alcanzaron porcentajes de desproteinización similares, consiguiendo en promedio una desproteinización del 65,43 % y del 67,13 % para la relación 0,5:100 y 0,7:100 respectivamente, estos porcentajes al no presentar diferencias estadísticamente significativas, se pueden considerar ambos tratamientos como aceptables.
Los porcentajes de desproteinización obtenidos mediante los tratamientos enzimáticos fueron superiores a los reportados por otros autores al aplicar otras enzimas, (Duarte y col., 2006) reportaron un 65 % de remoción de proteínas mediante la aplicación de la enzima comercial alcalasa, (Dey y Dora, 2011) por su parte, obtuvieron un 33,13 % de desproteinización al aplicar alcalasas, esto indica que el uso de las enzimas quimotripsina y papaína en cualquiera de las concentraciones arrojan mejores resultados que los reportados por los autores mencionados.
Sin embargo es notable mencionar que Gagné (1993) presenta mejores resultados para los tratamientos con quimotripsina y papaína que la presente investigación, pues dicho autor obtiene un contenido residual de proteínas después de la desproteinización tan bajo como 1,3% y 2,8% para cada enzima respectivamente.
En la tabla 4 se muestra que los parámetros de caracterización de las quitinas obtenidas se acercan a los reportados por la literatura, (Pillai y col., 2009), reportan que para considerar quitina al producto obtenido esta debe tener una masa molecular superior al orden de 106 y un grado de acetilación mayor a 40 %, lo que se cumple para las cuatro quitinas obtenidas.
La quitina que presenta la mayor masa molecular y mayor grado de acetilación fue la obtenida mediante el tratamiento enzimático con papaína en una relación enzima-sustrato 0,7:100; mientras que la quitina que presenta las peores características fue la obtenida mediante el tratamiento con quimotripsina en una relación enzima sustrato 0,5:100. Además, se observa que los dos tratamientos donde se aplicaron una mayor concentración de enzima reflejan un mayor grado de acetilación, es decir que las enzimas actuaron de tal forma que no se produjo la desacetilación de las unidades glicosídicas N-acetiladas, los tratamientos con papaína permitieron obtener quitina de mayor masa molecular que la quitina obtenida por la quimotripsina, es decir que la papaína produce un menor deterioro de la estructura de la quitina.
Tabla 4 Porcentaje de desproteinización y de quitina en muestras sometidas al tratamiento enzimático
| Tratamiento | % Proteína 0 horas | % Proteína 72 horas | % desproteinización | % quitina |
|---|---|---|---|---|
| QB1 | 42,80 | 21,49 | 49,79 | 59,48 |
| QB1 | 41,70 | 15,21 | 63,53 | 69,25 |
| QB1 | 41,34 | 14,98 | 63,76 | 70,01 |
| QB2 | 42,80 | 12,06 | 71,82 | 75,74 |
| QB2 | 41,70 | 9,46 | 77,31 | 80,04 |
| QB2 | 41,34 | 11,86 | 71,31 | 78,31 |
| QB3 | 42,80 | 14,59 | 65,91 | 78,74 |
| QB3 | 41,70 | 13,53 | 67,55 | 80,59 |
| QB3 | 41,34 | 15,36 | 62,84 | 78,24 |
| QB4 | 42,80 | 14,68 | 65,70 | 78,23 |
| QB4 | 41,70 | 12,38 | 70,31 | 81,77 |
| QB4 | 41,34 | 14,31 | 65,38 | 79,23 |
No obstante, es importante considerar que la masas moleculares obtenidas por el tratamiento con quimotripsina 0,7:100 y papaína 0,5:100 son muy cercanas, sin embargo el grado de acetilación exhibido por la primera es mucho mayor que la segunda.
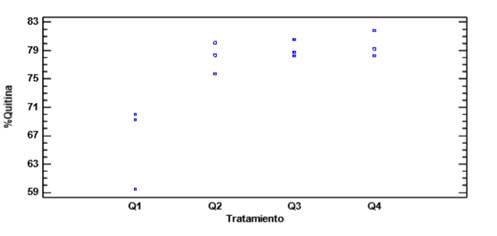
En la figura 1, dispersión del porcentaje quitina, muestra que no existe diferencia estadísticamente significativa entre los tres tratamientos QB2, QB3 y QB4, sin embargo, el tratamiento QB1, quimotripsina en relación E/S 0.5:100, muestra porcentajes de quitina menores que los otros tratamientos (66,24 %).
La tabla 5, muestra que todos los tratamientos `presentan grados de desacetilación de alrededor de 80% y masas moleculares del orden de 106 lo que indica efectividad en los tratamientos al mantenerse integra la estructura molecular y grados de desacetilación bajos.
Tabla 5 Caracterización de la quitina en función de la masa molecular y grado de acetilación
| Ensayo | QB1 | QB2 | QB3 | QB4 |
|---|---|---|---|---|
| Valoración potenciométrica | 67,81 | 80,66 | 55,00 | 80,68 |
| Masa quitina (g) | 0,5001 | 0,4995 | 0,5010 | 0,4999 |
| Volumen de inflexión 1 (mL) | 22 | 22 | 14 | 14 |
| Volumen de inflexión 2 (mL) | 32 | 28 | 28 | 20 |
| Masa molecular Mv (g/mol) | 1,00E+06 | 1,06E+07 | 1,07E+06 | 1,23E+06 |
| Viscosidad intrínseca (mL/g) | 1205,1 | 1251,7 | 1259,4 | 1328,3 |
| R2 | 0,9932 | 0,9585 | 0,9581 | 0,9210 |
4. CONCLUSIONES
El ácido acético al 15 y 20 % mostraron ser concentraciones adecuadas para la remoción de minerales de la cáscara del camarón, alcanzando un 99% de desmineralización para ensayos en pequeñas cantidades de materia (5 g).
Mediante lavados sucesivos con etanol al 97 % fue posible remover trazas de pigmentos libres presentes en el exoesqueleto de camarón, mientras que la otra parte de los pigmentos que se encuentra ligada a la proteína requiere realizar la desproteinización para su remoción.
Todas las enzimas hidrolizaron los péptidos de las proteínas bajo condiciones de pH 8 y temperatura de 40°C durante 72 h. La enzima que proporcionó un mayor porcentaje de desproteinización fue la quimotripsina en una relación enzima-sustrato 0,7:100, con un porcentaje de proteínas remantes de 11,13 %, sin embargo, no presenta una diferencia significativa con la papaína. Esto indica que probablemente las relaciones E/S son muy cercanas, por lo que se deberán realizar estudios con relaciones enzima - sustrato en un intervalo más amplio. También se deberá considerar y medir la actividad enzimática inicial con que se realizan las pruebas.