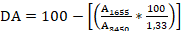INTRODUCCIÓN
Los camarones son crustáceos relativamente abundantes en los cuerpos de agua dulce o salada en todo el mundo, lo cual los convierte en un importante recurso pesquero y alimenticio. Prácticamente, cada país posee recetas y formas particulares para su preparación y consumo.
Estos crustáceos son cultivados en granjas u otros establecimientos mediante la puesta en práctica de los adelantos que ofrece la Camaronicultura. Esta actividad industrial comenzó a desarrollarse en Cuba hacia el año 1986, y el primer plan de cultivo en estanques de tierra se llevó a cabo con el camarón Litopenaeus schmitti. Actualmente, la especie que se cultiva es Litopenaeus vannamei (camarón blanco del pacífico) por su rápida reproducción y conversión de alimentos. Cuba destina este recurso a la exportación, principalmente a mercados de Canadá, Asia, el Caribe y América del Sur (Perera, 2006).
Los camarones de menor tamaño (de acuerdo a la talla comercial) son enviados a la empresa productora de alimentos (Prodal), que pertenece al Grupo Empresarial de la Industria Alimentaria (GEIA) para ser procesados. Allí se extrae el músculo o parte comestible y los residuos o descartes (cabeza y exoesqueleto) son desechados o vendidos a cooperativas porcinas (Laffita, 2015; González, 2017).
En la actualidad existen alternativas tecnológicas para el aprovechamiento de estos residuos y su conversión en productos de alto valor comercial como son la quitina y el quitosano. Estos residuos contienen en general (14 a 35 %) de quitina asociada con proteínas (30 % - 40 %), lípidos, pigmentos y depósitos de calcio (30 % - 50 %), subproductos que también pueden ser aprovechados en el mercado (Mármol y col., 2013).
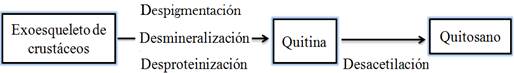
Para la obtención de quitina y quitosano se emplean métodos químicos, biológicos y enzimáticos. El más empleado es el químico y comprende las etapas de despigmentación, desmineralización, desproteinización y desacetilación para la transformación de quitina a quitosano (Ortiz, 2013).
El quitosano es el principal derivado de la quitina y estos dos biopolímeros presentan muchas aplicaciones en diversas ramas de la economía: tecnología de los alimentos, ciencia de los materiales, microbiología, agricultura, tratamiento de aguas residuales como coagulante, sistemas de administración de fármacos, ingeniería de tejidos, bionanotecnología (Khoushab y Yamabhai, 2010); (Cadeza, 2014), membranas funcionales y floculación, entre otros (López y Correa, 2012).
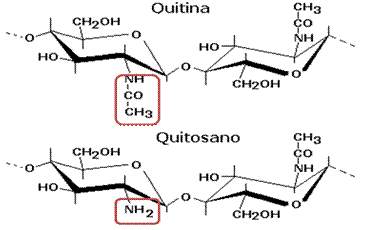
El quitosano se obtiene por la desacetilación de la quitina mediante una hidrólisis termoalcalina. Este es un polisacárido lineal compuesto por dos tipos de unidades estructurales: poli[β-(1,4)-2-desoxi-2-amino-D-glucopiranosa] (D-glucosamina) y poli[β-(1,4)-2-desoxi-2-acetamido-D-glucopiranosa] (N-acetil-D-glucosamina), distribuidas de manera aleatoria a lo largo de la cadena (Cadeza, 2014).
Las aplicaciones del quitosano son numerosas y dependen en gran medida de la presencia de los grupos aminos reactivos, por lo que el grado de desacetilación (DD) es uno de los parámetros principales que lo caracterizan (Atanda et al., 2016).
El grado de acetilación (DA) es un parámetro importante de estudio; ya que tiene un marcado efecto en la solubilidad y las propiedades de ambos polímeros. La quitina presenta un grado de acetilación típico de 0,90, mientras que el quitosano posee un grado de acetilación de menos de 0,35 (Cárdenas, 2010).
La desacetilación de quitina a quitosano se realiza en estado sólido bajo condiciones alcalinas usando NaOH concentrado, o por hidrólisis enzimática en presencia de la enzima quitina desacetilasa. Este proceso involucra la eliminación de grupos acetilos a partir de la cadena de quitina hasta alcanzar un completo grupo amino (NH2). La efectividad de dicho proceso depende de la concentración del álcali, la temperatura y el tiempo de reacción, así como la relación solvente/sólido (Arachchi et al., 2018).
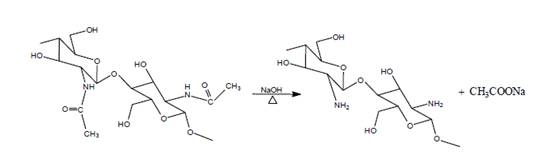
Se han desarrollado numerosos métodos para determinar el grado de N-acetilación de estos polímeros basados en diversas técnicas, entre las que se pueden mencionar la espectroscopia infrarroja, espectroscopía RMN de protón, la potenciometría, la conductimetría y la espectroscopía UV primera derivada (Pérez y col., 2018). Otras técnicas alternativas incluyen el análisis elemental, el análisis térmico, la cromatografía de permeación en gel y el dicroísmo circular (Cárdenas, 2010). En la Figura 1 se representa la reacción termoalcalina de desacetilación de la quitina, mediante el uso de una base fuerte (NaOH).
 Fuente: ref-type="bibr" rid="r5">Cárdenas (2010)
Fuente: ref-type="bibr" rid="r5">Cárdenas (2010) Figura 1 Reacción de desacetilación de la quitina por vía química
En la Figura 2 se presenta la estructura de los dos compuestos, donde puede observarse su similitud y la diferencia fundamental donde en el quitosano aparece el grupo amino cuando es desacetilada la quitina.
El presente trabajo tiene como objetivo evaluar la etapa de desacetilación de la quitina obtenida experimentalmente del exoesqueleto de camarón Litopenaeus vannamei por vía química.
MATERIALES Y MÉTODOS
La diferencia entre la quitina y el quitosano radica en el porcentaje de grupos acetilos que presentan, siendo superior en el caso de la quitina. En la Figura 3 se muestran las etapas para la obtención de quitosano a partir de la desacetilación de la quitina.
En este trabajo se utilizó quitina obtenida experimentalmente a partir del exoesqueleto de camarón Litopenaeus vannamei, procedente de la Empresa Prodal, ubicada en el municipio Regla, provincia La Habana, Cuba.
Esta quitina fue despigmentada con ozono, desmineralizada con HCl a 5 mol/L y desproteinizada con una solución alcalina de NaOH a 1 mol/L y 50 °C, en una relación sólido-solvente de 1:10 p/v para garantizar un buen mezclado entre las dos fases.
Finalmente, mediante la desacetilación se obtuvo el quitosano como derivado de la quitina. El proceso realizado a la muestra de quitina consistió en tratar la misma con una solución de hidróxido de sodio (NaOH) con una concentración de 10 mol/L (40 % en peso), en una relación sólido-líquido 1:4 (p/v) a 80 ºC, 250 min-1 y un tiempo de dos horas. Esta operación se llevó a cabo en un erlenmeyer colocado en una plancha con calentamiento y agitación magnética (aislado térmicamente). Para controlar la temperatura del proceso se empleó un sistema de termopares (Palacio, 2017).
En la etapa de desacetilación se calcularon los grados de acetilación (DA) y desacetilación (DD) de la quitina y el quitosano. Para ello se siguió la metodología propuesta por Khan y col., (2002); Simionatto y Gomes, (2006) y Muslih y col., (2017), la cual consiste en calcular el DD con las absorbancias que se alcanzan a las longitudes de onda de 3450 cm-1 (absorbancia de la banda de referencia; estiramiento de OH-1) y a 1655 cm-1 (absorbancia de la banda de evaluación; amida I) como se muestra en la Ecuación 1:
El grado de acetilación se calculó restando de 100 el DD obtenido. Los espectros IR se realizaron en el Instituto Cubano de Investigaciones de la Caña de Azúcar (ICIDCA), utilizando un equipo FTIR, modelo Vector 22 en el rango de 4000 a 600 cm-1 en unidades de transmitancia. Se utilizó el aditamento ATR con los siguientes parámetros:
Método: Estándar Ajuste de línea base: 64 puntos
Resolución: 4 cm-1 Compensación: aire
Scans: 60 Sensitividad: 1 %
Lo más importante a resaltar de los espectros IR es la diferencia que existe entre la intensidad relativa de la señal, que en la quitina aparece a 1655 cm-1 debida a la tensión de grupos carbonilo amídicos libres, y la banda que corresponde a la flexión del grupo amino, que aparece aproximadamente a 1556 cm-1.
También se realizó la prueba de la solubilidad del quitosano en ácido acético al 5 % (Barra y col., 2012), si luego del filtrado queda retenida una proporción menor al 20 % de la masa inicial, se puede afirmar que se está en presencia de un buen quitosano.
Para ello se empleó una masa de 0,5 gramos, los mismos se adicionaron a la solución de ácido con una relación 1:20 p/v, fueron agitados en una zaranda durante una hora a temperatura ambiente y 220 min-1 y posteriormente fueron filtrados con la ayuda de una bomba de vacío.
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se muestra la composición química del exoesqueleto de camarón Litopenaeus vannamei, a partir del cual se obtuvo la quitina que fue utilizada en esta investigación. Según se observa los residuos de camarón presentan una cantidad apreciable de materia orgánica e inorgánica, indicada por el contenido de proteínas y cenizas respectivamente. Estos valores son reportados por diferentes autores (Ortiz, 2013); (Mármol y col., 2013); (Polo, 2016). Las diferencias existentes entre los resultados obtenidos y los reportados en la literatura, se pueden atribuir a la diferencia de especie, edad, ciclo reproductivo, zonas de cría o captura, estado fisiológico, alimentación, y sexo.
Tabla 1 Caracterización del exoesqueleto de camarón
|
|
||
|---|---|---|
| Humedad (%) | 9,38 ± 0,22 | 10,00 |
| Cenizas (%) | 27,10 ± 1,43 | 30,00 |
| Proteína (%) | 41,23 ± 1,50 | 40,60 |
| Grasa (%) | 0,57 ± 0,03 | ND |
| Fósforo total (%P2O5) mg P2O5/100 g | 3,37 ± 0,04 | 1,57 |
ND. No determinado
3.1 Etapa de desacetilación de la quitina
Para determinar el grado de desacetilación de estos polímeros fue necesario conocer los valores de absorbancia a 3450 cm-1 y 1655 cm-1 (Khan y col., 2002); (Simionatto y Gomes, 2006); (Muslih y col., 2017), para la quitina y el quitosano. A partir de esos valores y mediante la ecuación 1 se obtuvo que para el quitosano el grado de desacetilación fue de 28 %, mientras que para la muestra de quitina fue 29 % respectivamente.
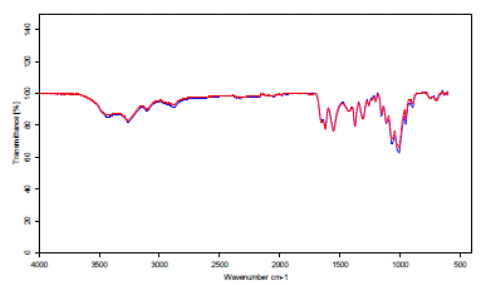
Como se observa, los valores del grado de desacetilación de la quitina y el quitosano son similares, por lo que es de esperar que el grado de acetilación (DA) tengan el mismo comportamiento. Esto permite afirmar que la etapa de desacetilación de quitina no se desarrolló satisfactoriamente. La causa de este resultado puede estar dada por el efecto de una insuficiente desproteinización de la quitina, y en consecuencia una mala desacetilación, ya que el NaOH lejos de desacetilar, se consumió en la eliminación de proteínas que aún se encontraban presentes y no para eliminar grupos acetilo en la quitina, ya que la desproteinización del exoesqueleto de camarón (no presentada) se realizó a una temperatura inferior a la requerida para garantizar este objetivo.
Este resultado se corresponde con el obtenido por Mármol y col., (2004) cuando realizaron la desacetilación de la quitina a 60 °C y HCl al 50 %, donde los espectros IR de ambos biopolímeros fueron similares, lo que indica que no lograron la desacetilación de la quitina.
Otro resultado que corrobora lo planteado anteriormente, es que cuando se realizó la prueba de solubilidad (Barra y col., 2012), la masa retenida de quitosano tras el filtrado fue de 0,4563 gramos, que representa un 89,9 % de la masa inicial, siendo superior al valor límite establecido (20 %), por lo que puede plantearse que el quitosano obtenido no es de buena calidad.
Para una mejor comprensión de lo antes expuesto se muestra la Figura 4, donde se evidencia la similitud de los espectros IR de las dos muestras analizadas.
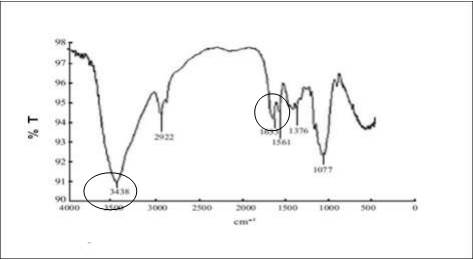
En la Figura 5 se presenta el espectro IR de un quitosano comercial. Las bandas más representativas del biopolímero están ubicadas en aproximadamente 3438 cm-1, que se corresponden al estiramiento N-H para la amida I y la banda ancha de vibración de los grupos hidroxilo. La otra banda característica del grupo carbonilo se encuentra a 1633 cm-1. Para el quitosano obtenido estas bandas no se aprecian con mucha intensidad, obteniéndose las bandas similares a la de la quitina estudiada.
CONCLUSIONES
Las condiciones de la etapa de desproteinización afectan la calidad de la quitina, y por lo tanto, influyen significativamente en su desacetilación. En la medida que la quitina tenga mayor pureza, es decir, que se logren altos rendimientos en las etapas de despigmentación, desmineralización y desproteinización, se obtendrán mejores resultados en la reacción de desacetilación. Debe garantizarse trabajar a temperaturas superiores a la utilizada en este trabajo (cercanas a los 100 °C) para lograr un quitosano de buena calidad.