INTRODUCCIÓN
El colágeno, considerado una macromolécula biológica que constituye gran porcentaje de las proteínas del cuerpo humano, es la proteína más abundante de los mamíferos y la proteína fibrosa estructural clave de la matriz extracelular (MEC) de los tejidos biológicos, tanto en organismos invertebrados como vertebrados (Kular y col., 2014). Se han identificado al menos 28 tipos de colágenos que han sido clasificados principalmente según su estructura (Shoulders y Raines, 2009). Más del 90% del colágeno en el cuerpo es de tipo I, mientras que los otros tipos comunes de colágeno incluyen los tipos II, III y IV. El colágeno comercial se ha extraído tradicionalmente de mamíferos terrestres, como el ganado vacuno y porcino, y se utiliza ampliamente en las industrias alimentaria, cosmética, farmacéutica y biomédica (Gorgieva y Kokol, 2011). Sin embargo, los brotes de encefalopatía espongiforme transmisible (EET) y fiebre aftosa (FA) en dichos mamíferos, la complejidad y costo de la purificación, y las prohibiciones culturales del uso de bovinos, potencia la necesidad de desarrollar una fuente de colágeno que sea una alternativa a la obtenida de los mamíferos terrestres (Lim y col., 2019).
Los organismos marinos son una rica fuente de compuestos biológicamente activos y estructuralmente novedosos. Hasta la fecha, se han aislado muchos componentes biológicos de diversos recursos marinos (Huang y col., 2016). El colágeno marino (CM), derivado de organismos como peces, algas marinas, esponjas y medusas, ofrece ventajas sobre el colágeno de mamíferos, debido a su fácil extracción, alto contenido de colágeno, absorción por el cuerpo humano por su bajo peso molecular, biocompatibilidad, ausencia de riesgos de enfermedades y patógenos animales, respeto al medio ambiente, contenido insignificante en contaminantes biológicos y toxinas y la ausencia de limitaciones religiosas (Lim y col., 2019).
La presente revisión tiene como objetivo presentar una descripción general actualizada del estado del aislamiento de colágeno de subproductos de pescado. La misma está basada en investigaciones publicadas hasta el año 2020.
MATERIALES Y MÉTODOS
El colágeno es una proteína abundante en vertebrados (Paul y Bailey, 2003). Constituye el 30% del total de proteínas animales, de estructura fibrosa y es un componente importante de matriz extracelular de organismos vivos (Arumugam, y col., 2018). En los tejidos humanos se conocen alrededor de 16 tipos de colágenos diferentes, siendo los más abundantes y por lo tanto los más estudiados los de tipo I, presente en hueso, los de tipo II, presente en cartílago hialino y los de tipo III, presente en piel (Usha y col., 2010). El colágeno también está presente en los tejidos conectivos como los ligamentos y tendones. En los vertebrados, como los mamíferos, los peces y las aves, se encuentran diferentes tipos de colágenos, codificados por al menos 45 genes distintos (Meyer, 2019). Proporciona un sistema estructural de sostén extracelular en todos los metazoarios y existe virtualmente, en cada uno de los tejidos animales. Por lo menos 19 tipos distintos de colágenos constituidos por casi 30 cadenas polipeptídicas diferentes entre sí (cada una codificada por un gen separado), han sido identificadas en los tejidos humanos. Aunque muchos de estos colágenos estén presentes en pequeña proporción, pueden desempeñar funciones fundamentales en el desarrollo de las propiedades físicas de tejidos específicos.
Existen diversas investigaciones sobre la extracción del colágeno (León-López y col., 2019), así como de las fuentes y aplicaciones del colágeno marino (Coppola y col., 2020).
RESULTADOS Y DISCUSIÓN
3.1. Colágeno
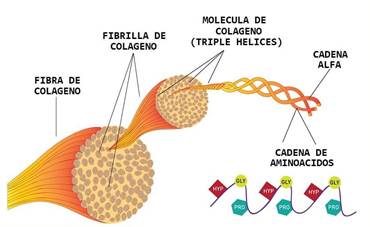
Los colágenos son moléculas triméricas formadas por tres cadenas polipeptídicas que contienen la secuencia de repetición (G-X-Y) n, siendo X frecuentemente prolina, e Y, hidroxiprolina. Estas repeticiones permiten la formación de una triple hélice, que es la característica de la súper familia colágeno. Las cadenas laterales de cada residuo X e Y están en la superficie de la triple hélice, dando a la molécula de colágeno una capacidad significativa para las interacciones laterales con otras moléculas de la matriz extracelular con el resultado de la formación de varios conjuntos supramoleculares (Jürgen y col., 2005).
Todos los tipos de colágenos poseen una estructura helicoidal triple (Figura 1), lo que le confiere una alta resistencia mecánica y capacidad a la retención de humedad. En algunos colágenos la molécula completa es una triple hélice, en tanto que otros poseen la triple hélice solo en parte de su estructura. El colágeno tipo I maduro, compuesto por casi 1000 aminoácidos, pertenece al primer tipo; en esta, cada subunidad de polipéptido, o cadena α, gira sobre su eje, formando una hélice orientada hacia la izquierda y en cada giro hay tres residuos (Herrero y col., 2010). Una característica sobresaliente del colágeno es la presencia de residuos glicina en cada tercera posición en la triple hélice.
3.2. Tipos y formación
Existen al menos 28 tipos de colágenos en función de la estructura de los dominios y su organización superestructural, pero el 80-90% del colágeno del cuerpo está formado por los tipos I, II y III (Shoulders y Raines, 2009). El tipo de colágeno más abundante en el cuerpo, el tipo I, se encuentra en los huesos, la piel, los tendones y los órganos. El tipo II se encuentra en los cartílagos y el tipo III en las fibras reticulares, la sangre y la piel. El colágeno de tipo III se encuentra en la piel, las paredes de los vasos y las fibras reticulares de los pulmones, el hígado y el bazo.
Los tipos IX, XIV y XIX (colágenos asociados a fibrillas con hélices triples interrumpidas) se asocian en bajas cantidades con los tipos formadores de fibrillas y los tipos IV, XIX y XVIII se encuentran en las membranas basales de las células. Los colágenos de los tipos I a IV son los más frecuentes en los invertebrados (Cumming y col., 2019).
El proceso de formación de colágeno ocurre principalmente durante la preparación para la regeneración y desarrollo del tejido embrionario. Las moléculas de colágeno son secretadas por fibroblastos como procolágeno soluble, que está flanqueado por dos estructuras peptídicas globulares que contienen terminales de nitrógeno (N-) y carbono (C-). El procolágeno se secreta dentro de las vesículas, se forma en el aparato de Golgi y, en secuencia, se secreta a la matriz extracelular. En la matriz extracelular tiene lugar la acción de las C- y N-peptidasas para escindir las dos estructuras globulares unidas a los extremos del procolágeno. La acción de estas enzimas es necesaria para iniciar el proceso de fibrilogénesis (producción de colágeno), ya que estas estructuras globulares ligadas al procolágeno ocupan un gran espacio alrededor de la molécula. Así, es necesario que se produzca el proceso de clivaje para formar tropocolágeno y la unión de varias moléculas de este tipo forma fibrillas. Las moléculas de tropocolágeno se unen en forma de conformación del torso a través de asociaciones lado a lado, estabilizadas principalmente por interacciones hidrófobas y electrostáticas.
3.3. Aplicaciones del colágeno
Gracias a sus características químicas únicas, el colágeno se ha utilizado en diversos campos de la industria. Tiene aplicaciones en materiales biomédicos, en la industria farmacéutica, cosmética y en alimentos donde se ha utilizado para la elaboración de alimentos funcionales (Paul y Bailey, 2003).
Es así como se han creado productos como cremas, geles, lociones y mascarillas, además de inyecciones subcutáneas para aplicarse directamente en la piel. Se han desarrollado productos como shampoo, acondicionadores y tratamientos capilares a base de colágeno, que eviten la aparición de signos de debilitamiento. Como se planteó anteriormente, a partir del colágeno se han desarrollado productos como parches y apósitos o gasas, los cuales tienen grandes beneficios al momento de la cicatrización de las heridas pues acelera la reparación tisular, disminuye la respuesta inflamatoria local, y beneficia la capacidad para reducir la carga bacteriana. También se han realizado diferentes estudios para demostrar la aplicabilidad del colágeno como biomaterial en la ingeniería de tejidos, materiales de empaque biodegradable y películas fotográficas siendo el mismo responsable de la rigidez y la resistencia de las fibras (Vallejos, y col., 2014).
3.4. Fuentes de obtención de colágeno
La principal fuente de extracción de colágeno han sido comúnmente los residuos del beneficio de especies bovinas y de la piel, huesos y cartílagos de cerdo (Li y col., 2018). Sin embargo, diferentes estudios han determinado la funcionalidad del colágeno de origen marino, extraído de las pieles de pescado de agua dulce y agua salada como la piel de tiburón, entre otros (Cho y col., 2014).
El colágeno presente en la piel, los huesos, los cartílagos y las escamas de los vertebrados e invertebrados marinos, es más biodisponible en comparación con el colágeno bovino o porcino y tiene una mayor capacidad de absorción (hasta 1,5 veces más eficiente en el organismo) (Cho y col., 2014), y una circulación más rápida en el torrente sanguíneo debido a su bajo peso molecular y al pequeño tamaño de las partículas (Nuñez y col., 2020). Además, los colágenos marinos son similares al colágeno bovino y porcino convencional en términos de composición de aminoácidos y biocompatibilidad.
Este colágeno puede obtenerse a partir de diversos subproductos del pescado que se consume a diario en distintas partes del mundo y que da lugar a una gran cantidad de residuos, que constituyen entre el 50% y el 70% de las materias primas originales generadas en la industria pesquera (Vázquez y col., 2017).
3.4.1 Escamas de pescado
Las escamas de pescado constituyen una cantidad considerable de residuos de las industrias de transformación del pescado. El estudio de Elango y col., (2014), sugiere que el colágeno obtenido de las escamas de los peces posee propiedades típicas del colágeno de tipo I.
3.4.2 Piel de pescado
La piel del pescado suele contener colágeno de tipo I con un alto grado de pureza (en torno al 70%), dependiendo de la edad de la especie y de la temporada (Chinh y col., 2019). El colágeno de la piel de los peces demuestra una excelente capacidad de retener agua (alrededor del 6% de su peso en la exposición al 63% de humedad durante 24 horas) y no muestra ningún potencial irritante, por lo que es adecuado para aplicaciones dérmicas (Cumming y col., 2019).
3.4.3 Espinas de pescado
El colágeno de las espinas de pescado muestra propiedades del colágeno tipo I que consta de dos cadenas α1 y una α2. El colágeno de las espinas de tilapia, bagre, palometa y caballa requiere una temperatura de extracción alta (16,6-19,03°C) y un tiempo de extracción más corto (73,16 h) en comparación con las escamas y piel de pescado, pero su rendimiento de extracción es más bajo (0,64%) en comparación con el que procede de la piel de pescado (Kimura y col., 1991).
3.4.4 Cartílagos de pescado
El colágeno del cartílagos de pescado consiste predominantemente en colágeno tipo II y algunos otros tipos de colágeno en cantidades menores, como el tipo IX y el tipo XI (Cumming y col., 2019). El colágeno del cartílago de pescado muestra una temperatura de desnaturalización más baja que el colágeno bovino, en el rango de 26,3 °C a 35,9 °C, lo que se atribuye al hábitat de la especie.
3.5. Procesos de obtención de colágeno
Existe numerosa información relacionada con procesos industriales relacionados con la manipulación del colágeno. El procedimiento general de aislamiento del colágeno incluye la preparación, la extracción y la recuperación. La preparación consiste principalmente en el lavado, la limpieza, la separación de las partes del animal y la reducción del tamaño cortando o picando las muestras para facilitar el pretratamiento de las mismas (Jongjareonrak y col., 2005). Tras la preparación, se realiza un pretratamiento químico suave para aumentar la eficacia de la extracción y eliminar las sustancias no colágenas. En general, dependiendo de las materias primas y del método de extracción, se pueden realizar diferentes tipos de pretratamientos (tratamiento alcalino o ácido). El pretratamiento se realiza con un ácido o una base diluida para romper el colágeno reticulado antes de la extracción, ya que el colágeno reticulado se encuentra en el tejido conectivo de los animales (Sarrigiannidis y col., 2021). Antes de la etapa de extracción, se requiere la desmineralización de las materias primas para mejorar la eficacia de la extracción de colágeno si el mismo se obtiene de una fuente que contenga gran cantidad de minerales, como el hueso, el cartílago y las escamas (Kittiphattanabawon y col., 2010).
Como se evidencia, el proceso de hidrólisis es la operación principal en la obtención del producto final, aunque también se pueden utilizar otros métodos de separación. A continuación, se describen los más referidos en la literatura.
3.5.1 Hidrólisis ácida
Este tipo de hidrólisis se enfoca en la ebullición prolongada de las proteínas presentes en sustancias proteicas por medio de la utilización de ácidos. Los ácidos (como el HCl y el AcOH) hidrolizan la triple hélice del colágeno y solubilizan sus cadenas simples en solución, donde tiene lugar la despolimerización de proteínas pesadas en péptidos más cortos (Żelechowska y col., 2010). La interacción entre el ácido y las moléculas de colágeno rompe los enlaces cruzados presentes en la hélice de colágeno y aumenta la eficiencia de extracción. Por lo tanto, es de gran interés investigar la eficiencia de extracción utilizando diferentes ácidos para maximizar la pureza y el rendimiento del colágeno extraído.
El AcOH es uno de los compuestos más comunes a través del cual se lleva a cabo la extracción de colágeno de fuentes animales y marinas. El rango de concentraciones para la solución de extracción ácida está entre 0,5 y 1 M, lo que permite la escisión de entrecruzamientos intra e intermoleculares sin afectar la estructura de las cadenas de colágeno, sin embargo en la mayoría de los estudios, los investigadores utilizan AcOH 0,1 o 0,5 M para extraer colágeno de la piel de los peces (Tan & Chang, 2017).
Aunque los métodos de extracción con ácido son los más usados para el aislamiento de colágeno, la alta acidez, el tiempo de procesamiento prolongado y la alta temperatura en los métodos de extracción de ácido pueden inducir negativamente una alta degradación de las cadenas de colágeno soluble.
3.5.2 Hidrólisis enzimática
La hidrólisis enzimática es un bioproceso de gran utilidad que potencializa las propiedades funcionales de la proteína nativa sin alterar su composición nutricional, en el cual, una molécula se escinde como consecuencia de la adición de una molécula de agua; esta reacción se produce cuando uno de los fragmentos de la molécula original gana un ion hidrógeno H+ de la molécula de agua, mientras que el otro fragmento recoge el grupo hidroxilo restante OH-, reacción cuya catálisis es mediada por una enzima de la clase hidrolasa. Las enzimas son biomoléculas de naturaleza proteica que aceleran la velocidad de reacción hasta alcanzar un equilibrio. Constituyen el tipo de proteínas más numeroso y especializado y, actúan como catalizadores de reacciones químicas específicas en los seres vivos o sistemas biológicos. La extracción con pepsina es el segundo método principal para la extracción de colágeno, que permite escindir las regiones telopéptidas de la triple hélice, facilitando la lixiviación de péptidos de colágeno en solución y aumentando los rendimientos de extracción (Ahmedy col., 2020).
Vallejo-Rodríguez y col., (2019) emplearon un pretratamiento enzimático, utilizando pepsina para digerir los extremos telopéptidos de las cadenas de colágeno para facilitar la eliminación de proteínas de la matriz restante. La hidrólisis no se desarrolla en una sola reacción, se trata de un conjunto de reacciones simultáneas de ruptura de enlaces, con distintas especies cargadas en equilibrio, lo que da una gran complejidad a este tipo de procesos. Se ha propuesto que el proceso de hidrólisis está constituido por tres reacciones consecutivas. Primero, la formación de un complejo enzima sustrato (proteína), y después la rotura del enlace anódico dando como resultado la liberación de un péptido. Finalmente, el péptido restante se separa de la enzima después de un ataque nucleofílico de una molécula de agua (Huang y col., 2016).
3.5.3 Extracción profunda con solvente eutéctico (DES)
Se utiliza una mezcla de dos compuestos: uno actúa como Aceptor de enlace de Hidrógeno (HBA), mientras el otro compuesto actúa como Donante de enlace de Hidrógeno (HBD). El método DES se basa principalmente en componentes naturales abundantes, poco tóxicos y biodegradables (cloruro de colina, ácido oxálico, urea, etilenglicol), que hacen que el DES sea especialmente adecuado para la extracción de sustancias químicas valiosas de subproductos animales, marinos y sub productos vegetales (Kimura y col., 1991).
De los seis disolventes eutécticos profundos (DES) investigados por Bai y col., (2017) la mezcla de cloruro de colina (CC) y ácido oxálico (OA) ha demostrado ser la más eficaz, con eficiencias de extracción cercanas al 90% para las pieles de bacalao. Este valor es casi cuatro veces mayor que los rendimientos de extracción obtenidos de AcOH de la piel de tilapia (27,2%). Por tanto, según el mismo autor, el codisolvente CC-OA representa una alternativa sostenible para el aislamiento de péptidos de colágeno de subproductos marinos.
3.5.4 Extracción de fluido supercrítico (SFE)
La extracción de fluidos supercríticos (SFE) se ha convertido en una de las técnicas de extracción verde más populares para extraer compuestos químicos. Se han reportado varias ventajas para la extracción de fluidos supercríticos en comparación con los procesos de extracción tradicionales o clásicos, como una selectividad mejorada, mayores rendimientos de extracción, mejores capacidades de fraccionamiento y menor impacto ambiental (Herrero y col., 2010).
La SFE se basa en el uso de fluido a presiones y temperaturas más allá del punto crítico para lograr cambios físicos significativos que modificarán sus capacidades como solvente. El CO2 es la molécula más utilizada para el método SFE debido a su baja toxicidad, rentabilidad, alta disponibilidad, estabilidad, baja inflamabilidad, aceptabilidad ambiental y condiciones de funcionamiento moderadas (presión y temperatura moderadas). Además, el CO2 podría liberarse después de la extracción de un medio acuoso y, por lo tanto, se obtendrá un compuesto purificado (Sousa y col., 2020).
3.5.5 Extracción de colágeno asistida por ultrasonido
Los procesos de alta temperatura, corta duración (HTST) y alta fuerza de corte son dos características de la extracción por ultrasonido que se han utilizado durante muchos años para producir alimentos para humanos y animales. La formación de cereales, la cocción en la industria alimentaria y la texturización de proteínas se pueden realizar mediante el método de extracción por ultrasonido. El proceso es seguido por diversas reacciones como tratamiento térmico, desnaturalización de proteínas, trituración, hidratación, gelatinización, cizallamiento, mezcla, modelado, expansión, deshidratación parcial, alteración de la textura y destrucción de microorganismos u otros compuestos tóxicos (Cheny col., 2011). Generalmente, algunas de las ventajas esenciales de la extracción por ultrasonido son su fácil operación, producción continua, poca mano de obra requerida, bajo costo de mano de obra y desperdicio limitado, así como una multiplicidad de productos. Como resultado, el método de extracción por ultrasonido se puede utilizar para el pretratamiento para extraer colágeno de los subproductos del pescado. La extracción-hidroextracción (EHE) tiene como objetivo aumentar la solubilidad de las cadenas de colágeno presentes en la muestra mediante un pretratamiento de extracción (Huang y col., 2016).
CONCLUSIONES
La gran variedad de aplicaciones del colágeno y sus importantes funciones en el futuro de la ingeniería de tejidos lo convierten en un biopolímero clave para la salud y el bienestar de los seres humanos. Dada la alta demanda de colágeno, existe una necesidad urgente de encontrar fuentes sostenibles y más baratas de producción de colágeno. La biomasa marina se está convirtiendo en una fuente más atractiva de colágeno. Sin embargo, la variación de la composición dependiente de la fuente, la baja temperatura de fusión del colágeno marino y las bajas temperaturas de desnaturalización limitan sus aplicaciones. Por lo tanto, comprender las propiedades fisicoquímicas y biológicas del colágeno marino y los métodos de extracción y purificación ayudaría enormemente a abordar estos problemas del colágeno marino.