INTRODUCCIÓN
La familia Rutaceae comprende un amplio número de plantas con alto potencial químico y farmacológico. Algunas especies de esta familia han sido reportadas por su acción farmacológica en el tratamiento de enfermedades como la malaria, chagas, leishmania y trastornos ocasionados por la acción de radicales libres (Marín y col., 2016).
Ravenia spectabilis subsp. leonis, es una especie reportada como amenazada para la provincia de Villa Clara. Pertenece a la familia Rutaceae y junto a otras tres especies constituyen la representación del género Ravenia para Cuba (Pérez, 2012).
En Cuba se conocen con el nombre común de Arraiján y se reporta su uso medicinal como antimicrobiano, antioxidante, citotóxico y de inhibición de la acetilcolinesterasa. Además, se describe como especie ornamental, por el atractivo de sus flores (Pérez, 2012). Hoy en día, se tienen pocos datos científicos de esta planta, siendo de interés la realización de estudios sobre su composición química con vistas a su posible uso como ingrediente farmacéutico activo herbario. Solo se ha reportado aislamiento de algunos alcaloides, así como la identificación de compuestos como isatina, lichexantona y algunos terpenos; de la especie que crece en otras regiones del mundo (Tabassum, 2020).
En la literatura no existen estudios analíticos que describan la composición química de las hojas de la especie Ravenia spectabilis que crece en Cuba, lo cual limita su uso en la medicina natural. El presente estudio tiene como objetivo evaluar desde el punto de vista farmacognóstico y fitoquímico extractos obtenidos de las hojas de Ravenia spectabilis, con vistas a su posible uso terapéutico.
MATERIALES Y MÉTODOS
La recolección del material vegetal se realizó en áreas del Jardín Botánico de la Universidad Central "Marta Abreu" de Las Villas (UCLV), en el período comprendido de abril a septiembre del 2022. Se procedió a su identificación según claves taxonómicas (Pérez, 2012). El procedimiento experimental fue desarrollado en el Departamento de Farmacia, Facultad de Química y Farmacia de la UCLV.
2.1. Determinación de parámetros farmacognósticos
2.1.1. Evaluación de tiempo de secado
El secado se realizó por dos vías: a la sombra en bandejas metálicas y mediante calor artificial utilizando estufa, a 35oC. El registro de secado se siguió con una frecuencia de 8 horas entre una pesada y otra hasta obtener peso constante. Las mediciones se realizaron en balanza analítica digital (Sartorius, TE-124S, Alemania). En todos los casos se realizaron tres réplicas. Se evaluó el parámetro tiempo de secado para cada método.
2.1.2. Determinación de humedad
Esta determinación se realizó por el método azeotrópico, según la metodología descrita en la Norma Ramal de Salud Pública (NRSP) 309, (Durand, 1992).
A un balón de 500 mL se transfirieron 200 mL de tolueno, se añadieron 2mL de agua, se destiló en el equipo de determinación de agua por el método del tolueno hasta que el volumen de agua en el tubo colector permaneció constante y se midió el volumen inicial de agua (V₁). Se dejó enfriar el tolueno (tolueno saturado). De la muestra de ensayo pulverizada y tamizada, se pesaron 10g, con un error máximo de 0,5mg y se transfirieron al balón que contenía el tolueno saturado; se destiló hasta que el volumen del agua en el tubo colector permaneció constante y se midió el volumen final (Vf). El contenido de humedad (H) de la muestra de ensayo expresada en porcentaje se calculó mediante la ecuación 1.
Donde:
Vf: volumen final de agua (mL).
V₁: volumen de agua inicial (mL).
100: factor matemático para los cálculos.
M: peso de muestra (g).
2.1.3. Determinación de cenizas totales
En un crisol de porcelana, previamente tarado, se pesaron 2 g de la muestra pulverizada y tamizada. Se calentó suavemente la muestra de ensayo aumentando la temperatura hasta carbonizar en plancha de calentamiento (Stuart SD 300, Reino Unido) y posteriormente se incineró en un horno mufla (Nabertherm, Alemania) a una temperatura de 750°C, durante dos horas. Se enfrió el crisol en una desecadora y se pesó. Se repitió el proceso a partir de la incineración, hasta obtener masa constante (Durand, 1992).
La cantidad de cenizas totales (Ct) se calculó por la ecuación 3:
Donde:
C1: cenizas totales.
M: masa del crisol vacío (g).
M1: masa del crisol con la muestra de ensayo (g).
M2: masa del crisol con la ceniza (g).
H: contenido de humedad (%).
2.1.4. Determinación de metales en las hojas de Ravenia spectabilis mediante Espectroscopía de absorción atómica
Se cuantificaron los metales pesados (plomo y cadmio), minerales (calcio, potasio y magnesio) y oligoelementos (cobre, zinc, manganeso y hierro) presentes en las hojas de la planta.
Los resultados obtenidos fueron comparados con los límites permisibles descritos en la literatura especializada (Hernández y Morataya, 2017), (Urtecho, 2020). Se empleó la ecuación 4 para la cuantificación de los metales presentes en las muestras de ensayo, (Vega, 2022).
Donde:
C: concentración del metal por Kg de muestra (mg/kg).
C1: concentración del elemento cuantificado en la muestra (mg/L).
Vsd: volumen de la solución digerida (L).
mi: masa inicial de la muestra (kg).
FD: factor de dilución.
Los resultados obtenidos se procesaron mediante Microsoft Excel versión 2016 para Windows.
2.2. Metodología de obtención de los extractos
Se pesaron 10 g de muestra y se realizaron extracciones con 100 mL de agua, metanol, acetato de etilo, diclorometano y heptano, a temperatura ambiente, con agitación en zaranda durante 24h. Se realizaron separadamente 2 extracciones bajo las mismas condiciones. Los extractos se filtraron y se evaporó el solvente por rotoevaporación.
2.3. Determinación cualitativa de los compuestos fenólicos en los extractos evaluados
2.3.1. Tamizaje fitoquímico
Se evaluó cualitativamente la composición química de los extractos mediante la técnica para el tamizaje fitoquímico establecida por Miranda y Cuéllar, (2012). Se realizaron los ensayos para los principales grupos de metabolitos. El procedimiento se realizó por triplicado.
2.3.2. Cromatografía en Capa Delgada
Condiciones cromatográficas: Se empleó como fase estacionaria sílica gel GF-60. Cada extracto se evaluó en Cromatografía en Capa Delgada (CCD) empleando las fases móviles n-butanol-ácido acético-agua (40:10:50) [1], diclorometano-metanol (40:60) [2], diclorometano-metanol (60:40) [3], diclorometano-metanol (98:2) [4], n-hexano-acetato de etilo-amoníaco (76:26:10) [5] y acetato de etilo-diclorometano (20:80) [6].
Preparación de las disoluciones de referencia: Se prepararon 4 disoluciones patrones (quercetina, hesperidina, rutina y cumarina). Se pesaron 250 mg de cada patrón, se disolvió en metanol y se llevó a un matraz de 5 mL, completándose dicho volumen con metanol.
Procedimiento experimental: Se inyectó con una microjeringuilla en la placa de 10 x10 cm, 10 µL de los extractos (metanólico, diclorometano, heptano y acetato de etilo) y 5 µL de los patrones preparados anteriormente, realizándose una corrida hasta 8cm en la cámara para cromatografía. Luego, se retiró la placa de la cámara y se dejó secar completamente. Las placas cromatográficas de GF 60 se examinaron a la luz UV a 254 nm y 366 nm. El análisis cualitativo se llevó a cabo mediante el cálculo de factor de retención (Rf).
RESULTADOS Y DISCUSIÓN
3.1. Determinación de parámetros farmacognósticos
No se utilizó el método de secado al sol ya que la presencia de aceites esenciales común en esta familia, limita el uso de este método (Ali y col., 2021).
El tiempo de secado a la sombra de las hojas de la planta fue de siete días, mientras que en estufa demoró cuatro días. Estos resultados pueden deberse fundamentalmente a las variaciones en cuanto a la humedad ambiental en el período de estudio, lo cual justificó que se extendiera el proceso de secado a la sombra hasta siete días. Una vez secado el material vegetal se determinaron algunos parámetros farmacognósticos, cuyos resultados aparecen en la tabla 1.
Tabla 1 Resultado de los parámetros farmacognósticos para las hojas de Ravenia spectabilis
| Parámetros farmacognósticos | Valor (%)± DER |
|---|---|
| Humedad | 8,01±0,124 |
| Cenizas totales | 6,89±0,049 |
DER (Desviación estándar relativa)
Para esta planta se obtuvo un valor de humedad residual de un 8,01%, siendo este valor aceptable para drogas no oficiales (Farmacopea Británica, 2013) y garantiza que el proceso de secado sea adecuado para la correcta conservación del material vegetal. El método de secado en estufa permitió eliminar en un menor tiempo, la humedad del material vegetal. Lo anterior favorece la conservación de la droga y evita el deterioro de esta.
El valor de cenizas es intrínseco de cada planta, el cual puede variar de acuerdo a la época, es por ello necesario establecer un criterio para cada especie vegetal. Como se muestra en la Tabla 1, los valores de cenizas totales se encuentran acorde a lo descrito para otras especies vegetales, lo cual se justifica por las condiciones áridas del suelo donde crece la especie estudiada, correspondiente a las áreas del Jardín Botánico de la UCLV. Es común encontrar especies vegetales que muestran valores superiores a 5%, tal es el caso de algunas especies registradas por el Formulario Nacional de Fitofármacos y Apifármacos (Oubiña y López, 2017) y normas internacionales (Berenguer, 2022).
Determinación de metales en las hojas de Ravenia spectabilis mediante espectroscopía de absorción atómica
La Tabla 2 muestran las concentraciones calculadas para cada elemento químico determinado en base a materia seca. En el caso de que el valor de concentración excediera el intervalo establecido en la curva se tuvo en cuenta el factor de dilución.
Tabla 2 Determinación de algunos elementos metálicos en sólidos pulverulentos de las hojas de Ravenia spectabilis
| Elemento | Concentración (mg/kg) | Límites (mg/kg) |
|---|---|---|
| Zinc | 12,63 | 5-1500 |
| Cobre | 21,73 | 150 |
| Hierro | 162,11 | >27 |
| Manganeso | 39,10 | 1000 |
| Plomo | 8,38 | 10 |
| Cadmio | 0,38 | 0,5 |
| Calcio | 1949,75 | - |
| Potasio | 1479 | - |
| Magnesio | 186,38 | - |
Las concentraciones de los metales pesados y oligoelementos (cadmio, plomo, zinc, cobre, hierro y manganeso) se encontraron dentro de los límites permisibles informados en la literatura. En el caso de los minerales analizados, al no existir una norma que refiera límites permisibles informados sobre el contenido de estos en plantas medicinales, para comparar los resultados obtenidos, solo se hace mención del valor encontrado (Hernández y Morataya, 2017), (Urtecho, 2020). Como puede apreciarse la mayor contribución en el porcentaje de cenizas totales podría atribuirse a la presencia de los minerales con un mayor contenido en el material vegetal.
3.2. Determinación cualitativa de los compuestos fenólicos presentes en los extractos evaluados.
Tamizaje fitoquímico
El tamizaje fitoquímico del extracto acuoso, metanólico y de heptano de las hojas de Ravenia spectabilis permitió evaluar cualitativamente la composición de la planta en estudio. Los resultados obtenidos aparecen en la Tabla 3.
Tabla 3 Tamizaje Fitoquímico de los extractos obtenidos de las hojas de Ravenia spectabilis
| Ensayo | Metabolito | Ext. acuoso | Ext. metanólico | Ext. heptano |
|---|---|---|---|---|
| Dragendorff | Alcaloides | + | - | + |
| Baljet | Cumarinas | ++ | - | + |
| Espuma | Saponinas | + | - | - |
| Cloruro férrico | Taninos | ++ | - | |
| Fehling | Azúcares reductores | ++ | - | - |
| Shinoda | Flavonoides | ++ | ++ | - |
| Liebermann Burchard | Esteroides | - | ++ | - |
| Sudán III | Ácidos grasos | - | + | - |
++ (ensayo muy positivo), + (ensayo positivo), - (ensayo negativo)
Estos resultados sugieren la composición química de las hojas de la planta estudiada. Lo anterior no es concluyente ya que la presencia de los metabolitos secundarios se encuentra influenciada por diversos factores (Miranda y Cuéllar, 2012). En el presente trabajo se identificaron en los extractos evaluados con evidencia muy positiva metabolitos tales como taninos, flavonoides, cumarinas, triterpenos esteroides y azúcares reductores, metabolitos a los que se les atribuye parte de las propiedades antioxidantes de las plantas medicinales (González y col., 2019). También fueron identificados ácidos grasos, alcaloides y saponinas; pudiéndose estos asociar a otras propiedades medicinales de la familia Rutaceae como antimicrobiana, trombolítica y citotóxica.
Cromatografía en Capa Delgada
Para evaluar los extractos por Cromatografía en Capa Delgada se utilizaron las 6 fases móviles identificadas en el epígrafe de materiales y métodos, las cuales han sido descritas en la literatura especializada para la identificación de compuestos fenólicos (Jiménez, 2005), (Medeiros y col., 2015), (Krügera y col., 2018), (Paula y col., 2020).
Los cromatogramas de Capa Delgada de los extractos con el empleo de las fases móviles 1, 2 y 3 mostraron colas en la elución y superposición de manchas. Adicionalmente bajo esta condición todos los extractos eluyeron de forma conjunta con el frente del disolvente. Lo anterior permite afirmar que las fases móviles citadas no son adecuadas para el análisis cromatográfico de los extractos. Teniendo en cuenta los resultados anteriores se decidió probar las fases móviles 4, 5 y 6, las cuales aportaron mejores resultados que se muestran en la Figura 1, donde las eluciones de los metabolitos no presentan colas ni frentes difusos.
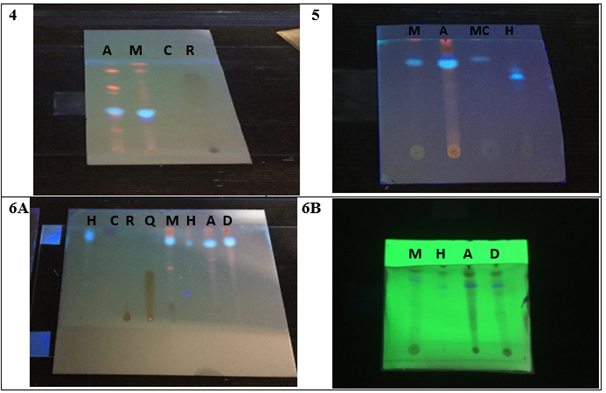
Figura 1 Desarrollo cromatográfico en Capa Delgada con el empleo de las fases móviles 4: n-hexano-acetato de etilo-amoníaco (76:26:10) a 366 nm, 5: acetato de etilo-diclorometano (20:80), 6A: Diclorometano-metanol (98:2) a 366 nm y 6B: Diclorometano-metanol (98:2) a 254 nm
Leyenda: M: metanol, H: heptano, A: acetato de etilo, D: diclorometano, C: coumarina, R: Rutina, Q: quercetina, He: Hesperidina, MC: metanol con carbón activado.
Luego de examinarse a la luz ultravioleta se evidenció la presencia de una mancha azul violácea a 254 nm y azul fluorescente a 366 nm en todos los extractos en las tres fases móviles evaluadas, indicativo de un componente con contenido mayoritario en la planta. De acuerdo al comportamiento cromatográfico se sugiere la posible presencia de metabolitos de naturaleza fenólica, lo que resulta de interés fitoquímico para futuras investigaciones. Además, bajo estas condiciones se observa la presencia de manchas naranjas fluorescentes que pudieran estar asociadas con la presencia de clorofila, ya que al tratar el extracto metanólico con carbón activado para la eliminación de la clorofila desaparece la mancha en el desarrollo cromatográfico (Figura 1-5).
En el caso de la fase móvil n-hexano-acetato de etilo-amoníaco (76:26:10) el medio básico permitió la intensificación de las manchas y una mejor visualización de estas, siendo este comportamiento típico de sustancias de naturaleza fenólica (Krügera y col., 2018).
Es importante destacar que no se evidenció coincidencia de las manchas de las muestras con las de los patrones de análisis evaluados. Por las características de la mancha azul fluorescente a 366 nm, se infiere la posible presencia de metabolitos tales como ácidos fenólicos, cumarinas y flavonoides (Casado y col., 2014), (Linares y col., 2018). Dichos resultados concuerdan con los obtenidos mediante tamizaje fitoquímico.
De forma general la mejor separación cromatográfica se obtuvo para el extracto de acetato de etilo seguido del extracto metanólico, ya que en el mismo se observan un mayor número de manchas y con una mejor separación, lo cual es indicativo de la prevalencia de compuestos de mediana polaridad.
CONCLUSIONES
Los valores de cenizas totales y humedad residual de las hojas de la planta se encuentran acordes a los límites establecidos para otras plantas en farmacopeas internacionales y en el Formulario Nacional de Fitofármacos y Apifármacos.
El contenido de los metales pesados y oligoelementos en el material vegetal se encuentran dentro de los límites permisibles descritos en normativas internacionales.
Los principales metabolitos identificados mediante las técnicas de reconocimiento cualitativo fueron flavonoides, cumarinas y taninos.
Los extractos de acetato de etilo y metanol mostraron un comportamiento cromatográfico indicativo de compuestos fenólicos al ser analizados mediante la Cromatografía de Capa Delgada.














