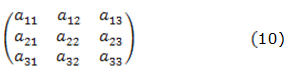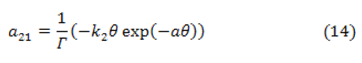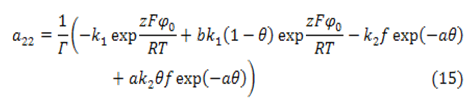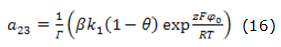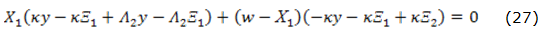Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.29 no.2 Santiago de Cuba may.-ago. 2017
ARTICULOS
Estudio matemático de la estabilidad del estado estacionario en la electrosíntesis de polipirrol sobreoxidado con CoO(OH) en modo potenciodinámico de voltaje constante
Mathematic Stability Studies of the Steady-State in the Electrosynthesis of Oxidated Polipirrol with CoO(OH)
Dr. C. V. TkachI,II, Dr. C. S. C. de OliveiraII, Dr .C. M. Cherkaoui III, Dr. C. R. Ojani IV, Dr. C. P.I. YagodynetsI
IUniversidad Nacional de Chernivtsi, Ucrania, nightwatcher2401@gmail.com
IIUniversidade Federal de Mato Grosso do Sul, Brasil
IIIUniversidad de IbnTofail, Kenitra, Marruecos
IVUniversidad de Mazandarán, República Islámica de Irán
RESUMEN
La síntesis electroquímica del compuesto de polipirrol sobreoxidado con el óxi-hidróxido de cobalto en modo potenciodinámico de voltaje constante es representada matemáticamente. El modelo correspondiente es analizado mediante la teoría de estabilidad lineal y análisis de bifurcaciones. Los requisitos de estabilidad del estado estacionario, así como también las condiciones de las inestabilidades oscilatoria y monotónica, fueron derivados del sistema. Su comportamiento fue comparado con el de los sistemas análogos.
Palabras clave: polipirrol, óxi-hidróxido de cobalto, compuestos poliméricos, oscilaciones electroquímicas, estado estacionario estable.
ABSTRACT
The electrochemical synthesis of overoxidated polypirrol with the cobalt oxy-hydroxide at constant voltage was mathematically represented. The process has been analyzed by means of steady-state stability theory and bifurcation analysis. The steady-state stability requirements and oscillatory and monotonic instability conditions have been obtained. The behavior of the system was compared with the behavior of analogous systems.
Keywords: polypirrol, Cobalt Oxy-hydroxide, steady-state stability, polymeric compounds, electrochemical oscillations.
INTRODUCCIÓN
El oxi-hidroxi compuesto de cobalto, conocido por su fórmula CoO(OH), es uno de los materiales inorgánicos novedosos más promisores [1-3]. Teniendo en vista su color intensamente negro, se ve como alternativa para el dióxido de titanio en dispositivos ópticos, superficies para foto- y fotoelectrodegradación y también como película protectora.
Por otro lado, los polímeros conductores (PC) son una de las clases de compuestos poliméricos más estudiadas durante las cinco últimas décadas [4–7], debido a su capacidad de combinar las propiedades de plásticos (resistencia a la corrosión, resiliencia, flexibilidad, versatilidad en formación, plasticidad) con la conductividad de semiconductores y metales, razón por la que se llaman de "metales sintéticos". Como se modifican fácilmente, tienen un espectro de aplicación muy vasto, desde películas protectoras de corrosión y terminando en sensores y biosensores con diferentes tipos de desempeño analítico. Así se puede concluir que el material, compuesto de un polímero conductor, como polipirrol, polifurano o polianilina con el CoO(OH) tendría propiedades interesantes como protector de corrosión, superficie catalizadora y compuesto electroanalítico.
Su síntesis anódica se realizaría, por ejemplo, por medio de la electropolimerización del pirrol en el medio del sulfato de cobalto con adición de fluoruro de amonio (para aumentar la porosidad del compuesto resultante). Otra posibilidad sería la adaptación de la ruta catódica, presentada en [8], con el uso del nitrato de cobalto (II) como electrolito, y posterior cambio de la polarización del electrodo en medio de fluoruro.
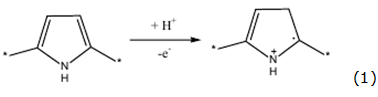
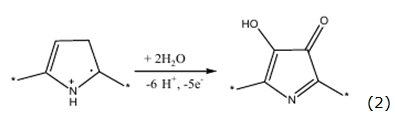
Sin embargo, para la oxidación de los compuestos de cobalto hasta CoO(OH), se emplean los potenciales altos, en los que el polipirrol es sobreoxidado, según el mecanismo representado por las ecuaciones 1 y 2 [9]:
Otro problema de la síntesis puede ser la inestabilidad del compuesto de cobalto en concentraciones elevadas de fluoruro (formando el complejo), que se destruye según la reacción representada por la ecuación 3:
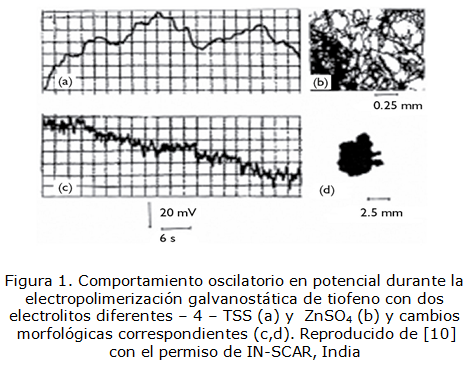
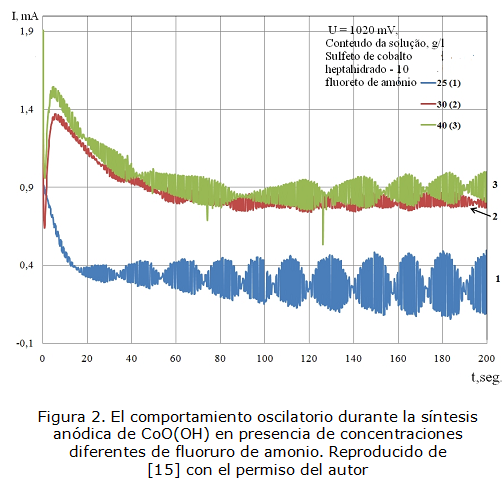
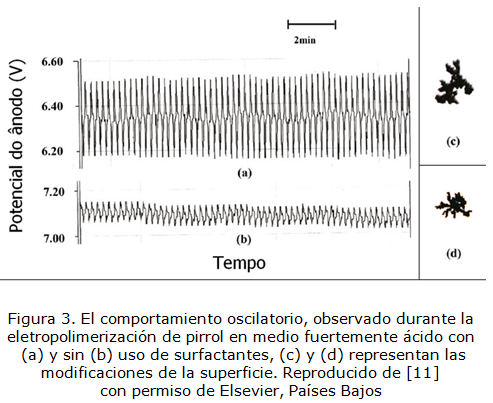
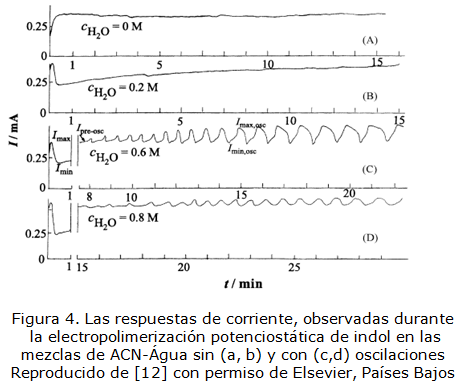
Por otra parte, tanto la electropolimerización [10–13], como la electroxidación de sales de cobalto (II) [14, 15] son procesos que se acompañan por inestabilidades electroquímicas, como oscilaciones en corriente y potencial, cuyas imágenes se presentan en las figuras 1-4:
Reproducido de [10] con el permiso de IN-SCAR, India
Reproducido de [15] con el permiso del autor
Reproducido de [11] con permiso de Elsevier, Países Bajos
Reproducido de [12] con permiso de Elsevier, Países Bajos
La interpretación fenomenológica, usualmente atribuida a tales evidencias carece de un fundamento rígido, aunque puede estar basada en una argumentación lógica. Este fundamento solo puede ser dado por el desarrollo y análisis de un modelo matemático, capaz de describir de forma adecuada su comportamiento.
Esta herramienta también tiene función pronóstico, previendo las propiedades de sistemas que todavía no se han descrito experimentalmente, bien como la comparativa, comparando su comportamiento con el de otros sistemas sin ensayos experimentales.
En este trabajo se continuará la línea de investigación, desarrollada en [16–19], describiéndose el sistema con la electrosíntesis del compuesto de polipirrol sobreoxidado con el oxi-hidróxido de cobalto, partiendo del polipirrol común y el electrolito de sulfato de cobalto y fluoruro de amonio en el modo potenciodinámico con voltaje constante.
El sistema y su modelo
Para describir el comportamiento del sistema con la electrosíntesis potenciodinámica en voltaje constante del compuesto de polipirrol sobreoxidado con el oxihidroxicompuesto de cobalto, se introducen tres variables:
f– la concentración del fluoruro en la capa presuperficial;
θ– el grado de recubrimiento del compuesto del polipirrolsobreoxidado con el oxihidroxicompuesto del cobalto en su forma sintetizada;
q– la carga del ánodo.
Se supone que el reactor se esté agitando intensamente, lo que da posibilidad de despreciar el flujo de convección. También se supone que el electrolito de soporte esté en un exceso significativo, lo que permite despreciar el flujo de migración, bien como los cambios de concentración de la sal de cobalto (II). También se supone que el perfil de concentración del fluoruro en la capa presuperficial sea lineal y el espesor de la capa, constante e igual a δ.
El ion fluoruro entra en la capa presuperficial por medio de su difusión y reacciona con el compuesto de polipirrol con oxi-hidróxido de cobalto (III). De esta manera, teniendo en cuenta la primera Ley de Fick con un coeficiente de modelaje relativo a la capa bimolecular, su ecuación de balance se representa mediante la ecuación 4:
donde Δ es el coeficiente de difusión de fluoruro, f0 es su concentración en la zona interior de la solución y r2 la velocidad de su reacción con el compuesto polimérico.
El compuesto se forma, partiendo del polímero conductor normal, mediante su sobreoxidación en presencia de la sal de cobalto (II) y parcialmente se descompone por reacción con fluoruro. Por tanto, su ecuación de balance (5) se describirá como:
en que Γ es la concentración superficial máxima del compuesto y r1, la velocidad de la reacción de su formación.
Para el modo potenciodinámico de voltaje constante, la ecuación de balance de carga del ánodo (6) se representa como:
donde U el voltaje en el sistema, R la resistencia del ánodo, S el área del ánodo e iF la corriente de Faraday.
Las velocidades de los respectivos procesos se pueden calcular según las ecuaciones 7-9:
siendo los parámetros k las constantes de reacciones correspondientes, α el coeficiente que describe la interacción entre partículas adsorbidas, z es el número de electrones transferidos, F=NA*e es el número de Faraday, φ0 es el salto de potencial en la parte de superficie ocupada por el polipirrol inicial relativo al de carga cero, R es la constante universal de los gases y T la temperatura absoluta del vaso.
En este análisis, se requeriría la obtención de soluciones numéricas del conjunto de ecuaciones diferenciales (4–6). Sin embargo, teniendo en cuenta el desconocimiento (o dificultad de obtención) de valores de algunos parámetros físicos mencionados en las ecuaciones, estamos a priori, analizando la estabilidad general del sistema, según la teoría de Lyapunov, que permite proveer las informaciones necesarias para entender el comportamiento del sistema, sin haber resuelto el conjunto de ecuaciones (4–6).
En términos generales, el comportamiento del sistema en el modo galvanostático debe ser más complicado que en el potenciostático, y el de modo potenciodinámico, de los dos anteriores. Esto se discutirá más adelante.
RESULTADOS Y DISCUSIÓN
Con fines de analizar el comportamiento del sistema con la electrosíntesis del compuesto de polipirrol sobreoxidado con el óxido-hidróxido de cobalto, se investigó el sistema de ecuaciones diferenciales (4–6) y relaciones algébricas (7–9) por medio de la teoría de estabilidad lineal. La matriz funcional de Jacobi, cuyos elementos se calculan para estado estacionario según (10), se puede ver como:
donde:
Los elementos α, ß y ρ son factores que influyen en el proceso electroquímico en la composición de la DCE, en la interacción de partículas adsorbidas de la superficie y en los procesos de resistencia de la película, respectivamente.
La ecuación característica para este sistema se describirá como:
donde:
Se puede apreciar que la inestabilidad oscilatoria es capaz de realizarse en este sistema. La bifurcación de Hopf, que la define en este sistema, se puede realizar en el caso de la satisfacción de la condición:
cuando la ecuación característica tiene una raíz real y las dos complejas conjugadas.
La condición (24) solo puede satisfacerse con la presencia de elementos positivos en las casillas de la diagonal principal del Jacobiano. En ella hay elementos que, siendo positivos, describen tres posibles causas del comportamiento oscilatorio:
 , cuando las influencias del proceso electroquímico a la doble capa son suficientes para propiciar el crecimiento autocatalítico del área, cubierta por el compuesto; lo que es posible, si el polipirrol es un reductor fuerte en la condición de la síntesis. Por ejemplo, en condiciones de la "paradoja de politiofeno", cuando el polipirrol es inestable en las condiciones de su síntesis, la aparición del comportamiento oscilatorio justamente por esa causa es muy probable. Esto también justificaría la dependencia entre la frecuencia y amplitud de oscilaciones (como en la figura 2) y la naturaleza de la solución: el valor de φ0 y el de b están en su función.
, cuando las influencias del proceso electroquímico a la doble capa son suficientes para propiciar el crecimiento autocatalítico del área, cubierta por el compuesto; lo que es posible, si el polipirrol es un reductor fuerte en la condición de la síntesis. Por ejemplo, en condiciones de la "paradoja de politiofeno", cuando el polipirrol es inestable en las condiciones de su síntesis, la aparición del comportamiento oscilatorio justamente por esa causa es muy probable. Esto también justificaría la dependencia entre la frecuencia y amplitud de oscilaciones (como en la figura 2) y la naturaleza de la solución: el valor de φ0 y el de b están en su función.
 , en el caso de la atracción entre las partículas adsorbidas durante la disolución parcial del compuesto, influenciado por la presencia de fluoruro. Esta causa del comportamiento oscilatorio también es típica para los sistemas de electropolimerización (figura 1 y 3) y para la electrosíntesis de óxido-hidróxido de cobalto (figura 2).
, en el caso de la atracción entre las partículas adsorbidas durante la disolución parcial del compuesto, influenciado por la presencia de fluoruro. Esta causa del comportamiento oscilatorio también es típica para los sistemas de electropolimerización (figura 1 y 3) y para la electrosíntesis de óxido-hidróxido de cobalto (figura 2).
 , en el caso de la negatividad del parámetro ρ2, cuando se obtiene un material, incapaz de depositar carga, lo que acontece durante la sobreoxidación de polímeros conductores. En este caso, el valor del parámetro ρ2 crece, por su mejor conductividad, comparada a la del polipirrol sobreoxidado y baja de nuevo durante la disolución parcial del compuesto. Así, se puede confirmar que, como en sistemas análogos, es posible la aparición de estructuras disipativas temporales. En este sistema su probabilidad de aparición es mayor que en los casos de los modos galvano- y potenciostático. Las oscilaciones se esperan periódicas, sin embargo de haber oscilaciones caóticas.
, en el caso de la negatividad del parámetro ρ2, cuando se obtiene un material, incapaz de depositar carga, lo que acontece durante la sobreoxidación de polímeros conductores. En este caso, el valor del parámetro ρ2 crece, por su mejor conductividad, comparada a la del polipirrol sobreoxidado y baja de nuevo durante la disolución parcial del compuesto. Así, se puede confirmar que, como en sistemas análogos, es posible la aparición de estructuras disipativas temporales. En este sistema su probabilidad de aparición es mayor que en los casos de los modos galvano- y potenciostático. Las oscilaciones se esperan periódicas, sin embargo de haber oscilaciones caóticas.
Para simplificar el análisis de Jacobiano, introducimos nuevas variables, de modo que el determinante de la matriz ahora se describirá como:
Empleando el criterio de estabilidad de Routh y Hurwitz, y resolviendo la inecuación Det J<0, se obtendrá el requisito de estabilidad de estado estacionario en la forma de:
De la inecuación (26), se podrá concluir que:
El estado estacionario será estable en el caso de negatividad de w y y, parámetros cuyo valor en el caso de la formación de material conductor es negativo.
También, en el caso de la positividad de parámetro E2, presente en la casilla, correspondiente al elemento negativo, se realizará la condición de estabilidad. Esto describe la estabilidad de estado estacionario durante la interacción repelente entre las partículas adsorbidas del compuesto.
La positividad de E1, que describe la ausencia de influencias de procesos electroquímicos a la doble capa eléctrica. Ella promoverá la estabilidad de estado estacionario.
Satisfaciéndose todos los requisitos, el sistema escoge uno de los estados estacionarios estables, siendo dicha selección dependiente de la difusión de la sal de cobalto y de la resistencia de la superficie.
Cuando las influencias mencionadas están equilibradas, se obtendrá la inestabilidad monotónica, la condición de cuya aparición matemáticamente se describirá según la ecuación 27:
En este caso, en el sistema coexisten varios estados estacionarios, de los cuales el sistema escoge uno que fácilmente se destruye, cuando las condiciones de síntesis se alteran. Los factores que más influyen en la aparición de esta inestabilidad son los de la resistencia del material que viene formándose en la superficie, porque el parámetro que la describe entra en la mayoría de los elementos, cuyo signo es capaz de hacer anular la expresión a la izquierda de (27).
Para algunos polímeros el proceso de sobreoxidación puede ser autocatalítico, especialmente en medio fuertemente ácido. Este fenómeno complicará la estabilidad de estado estacionario, aumentará la probabilidad del comportamiento oscilatorio. Este sistema, también de interés tanto teórico, como experimental, será descrito en uno de nuestros próximos trabajos.
CONCLUSIONES
El estado estacionario será estable en el caso de la formación de material conductor, de la interacción repulsiva entre las partículas adsorbidas del compuesto y ausencia de influencias de procesos electroquímicos a la doble capa eléctrica. Satisfechas las mencionadas condiciones, el estado estacionario será estable y la reacción estará regulada por difusión.
El comportamiento oscilatorio en este sistema es posible y se realizará por causa de la atracción entre las partículas adsorbidas, cambios en la doble capa eléctrica, provocados por el proceso electroquímico y la formación de un material incapaz de conducir corriente eléctrica, o deponer carga. Así se confirma la presencia de estructuras disipativas, características para sistemas análogos.
La inestabilidad monotónica en este sistema es posible, pudiendo realizarse en el caso de equilibrio de fuerzas estabilizadoras de estado estacionario a las inestabilizadoras. Se formará uno de varios estados estacionarios inestables, que se destruye cuando se alteran las condiciones de síntesis.
La autocatálisis dificultará la formación de estado estacionario estable y aumentará la probabilidad de comportamiento oscilatorio.
REFERENCIAS BIBLIOGRÁFICAS
1. YANG, J.; LIU, H.; MARTENS, W.; FROST, R. L. "Synthesis and Characterization of Cobalt Hydroxide, Cobalt Oxyhydroxide, and Cobalt Oxide Nanodiscs . Journal of Physical Chemistry C., 2010, 114, 111–119.
2. WEN WANG, J.; MING KUO, Y. "Hierarchically porous cobalt oxyhydroxide derived from Morpho-butterfly wings: Preparation, characterization, and carbon monoxide detection at low temperatures". Physical State Solid, 2013, 210(3), 494-502.
3. JAGADALE, A. D.; DUBAL, D. P.; LOKHANDE, C. D.; "Electrochemical behavior of potentiodynamically deposited cobaltoxyhydroxide (CoOOH) thin films for supercapacitor application". Materials Research Bulletin, 2012, 47(3), 511-932.
4. SADKI, S.; SCOTTLAND, P.; BRODIE, N.; SABORAUD, G. "The mechanisms ofpyrroleelectropolymerization". Chemical Society Reviews. 2000, 29(5), 283-373.
5. RONCALI, J. "Conjugated poly(thiophenes): synthesis, functionalization, and applications". Chemical Review, 1992, 92(4), 711–738.
6. YAMAMOTO, T. "Molecular assembly and properties of polythiophenes". Asia Materials, 2010, 2, 54-60.
7. OJANI, R.; RAOOF, J. B.; AHMADY, A.; HOSSEINI, S. R.; " Highly improved methanol oxidation onto carbon paste electrode modified by nickel particles dispersed into poly (2,5-dimethylaniline) film". Caspian Journal of Chemistry. 2013, 2(1), 45-57.
8. JUNG, Y., SINGH, N.; CHOI, K.S. "Cathodic Deposition of Polypyrrole Enabling the One-Step Assembly of Metal–Polymer Hybrid Electrodes". Angewandte Chemie International Edition, 2009, 48(44), 8331–8334. DOI:10.1002/anie.200903596.
9. ANSARI, R.; "Polypyrrole Conducting Electroactive Polymers: Synthesis and Stability Studies". E-Journal of Chemistry, 2006, 3(4), 186-201.
10. DAS, N.; GOEL, N.R.; AGRAWAL, S. K.; Gupta, "Growth Patterns of Dendrimers and Electric Potential Oscillations during Electropolymerization of Pyrrole using Mono- and Mixed Surfactants". Journal of Physical Chemistry, 2010, 114(40), 12765-13030.
11. BAZZAOUI, M.; BAZZAOUI, E. A.; MARTINS, L.; MARTINS, J. I. "Electropolymerization of pyrrole on zinc-lead-silver alloys electrodes in acidic and neutral organic media". Synthetic metals. 2002, 130(1), 73-83.
12. SAZOU, D. "The dynamical behavior of the electrochemical polymerization of indole on Fe in acetonitrile–water mixtures". Synthetic Metals. 2002, 130, 45-54.
13. BA-SHAMMAKH, M.S. Thes. Ph. D. King Fahd University of Petroleum and Minerals, Dharan, Saudi Arabia, 2002
14. STADNIK, O.; IVANOVA, N.; BOLDYREV, Y. 218th Int. Electrochem. Soc. Meeting. Abstract # 2240, [Online] available at: http://ma.ecsdl.org/content/MA2010-02/38/2240.full.pdf. Accessed at 8th of August (2015).
15. STADNIK, S.O. Electrochemical and Photoelectrochemical Properties of the Oxide-hydroxide Compounds of Cobalt, Diss. Kand. Chim. N. – Kyiv. (2011)
16. TKACH, V., et al. "The mathematical description for the electropolymerization of furan, pyrrole and thiophene derivatives in alkaline media". Mediterranean Journal of Chemistry. 2015, 3(6), 1122-1128.
17. TKACH, V. V.; NECHYPORUK, V. V.; YAGODYNETS, P. I. "Estudio matemático de las condiciones de estabilidad en la polimerización electroquímica de compuestos heterocíclicos en presencia de oxidantes". Afinidad. 2013, 70(561), 73-77.
18. TKACH, V.; NECHYPORUK, V.; YAGODYNETS, P. "A descrição matemática do comportamento eletroquímico durante o processo da sobreoxidação anódica dos polímeros condutores no meiomuito ácido". Orbital: The Electronic Journal of Chemistry. 2012, 4(1), 39-44.
19. TKACH, V. et al. "A descrição matemática do fenômeno oscilatório durante a síntese eletroquímica dos filmes dos oxi-hidroxicompostos de cobalto (III) e durante a síntese dos compósitos deles com os polímeros condutores". Eclética Química. 2012, 37, 72-78.
Recibido: 28/03/2016
Aceptado: 6/12/2016
Dr. C. V. Tkach, Universidad Nacional de Chernivtsi, Ucrania, nightwatcher2401@gmail.com















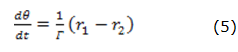
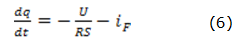 ,
,