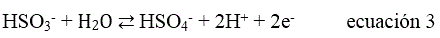Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.30 no.3 Santiago de Cuba set.-dic. 2018
ARTICULOS
Detección de SO2 en vino tinto mediante titulaciones microfoto-coulombimétricas en ausencia de puente salino
Minimal instrumentation diaphragmless microphoto-coulometric Determination of SO2 in red wine
Lic. Francisco Javier Olvera-García, Dr. C Arturo García-Mendoza, M.Sc. Adrián de Santiago-Zárate, Dr. C. Alejandro Baeza-Reyes
Departamento de Química Analítica, Facultad de Química, UNAM, México 04510, CDMX, México, arturogm@unam.mx
RESUMEN
En este trabajo se utilizan celdas electrolíticas de mínima instrumentación y bajo costo para mostrar la relación cuantitativa que existe entre el tiempo de electrólisis (o tiempo de equivalencia) y un pulso de corriente constante en titulaciones redox de metabisulfito, usando yodo electrogenerado sin emplear un puente salino y en condiciones de amortiguamiento de los niveles de acidez generadas in situ. Se encontró que el tiempo de equivalencia obtenido tanto con indicador visual, como con detección microfotocolorimétrica simultánea, es directamente proporcional a la concentración de metabisulfito de sodio estándar, cuyo contenido se puede asociar a la determinación del contenido de SO2 libre en vino tinto.
Palabras clave: microescala, coulombimetría, microfotocolorimetría, titulación sulfitos, vino tinto.
ABSTRACT
A low-cost equipment with locally produced materials and electrolytic cells were built to show the linear quantitative relationship between the time of electrolysis and a constant current pulse during the redox titration of sodium metabisulphite with iodine electrogenerated with no salt bridge used, by means of acidity levels generated in situ. Both, the visual and low cost simultaneous photodetection endpoint were collected to determine free SO2 levels in red wine.
Keywords: microscale, coulometry, photocolorimetry, sulphite titration, red wine.
INTRODUCCIÓN
Las coulombimetría reúne una serie de técnicas que se fundamentan en la primera y segunda ley de Faraday, publicadas por Michael Faraday en 1834. En estas se menciona que la masa de una sustancia transformada en una interfase polarizada durante la electrólisis es directamente proporcional a la cantidad de electricidad transferida a ese electrodo, cuando se hace pasar un pulso de corriente continua, de intensidad fija y conocida durante el tiempo [1]. Lo anterior se expresa, usualmente, en la expresión it = Q = nFNmol, donde Q es la carga en coulombios [C]; n es el número de mol de electrones; F es la constante de Faraday; Nmol es la cantidad de mol electrolizada, i es la intensidad de corriente de electrólisis en amperios [A] y t es el tiempo de electrólisis [s]. En consecuencia, un aspecto fundamental en la coulombimetría es la determinación de la cantidad de electricidad consumida en el proceso.
Una variante de la coulombimetría es la técnica electroanalítica de titulométrica indirecta que se basa en la generación por electrolisis in situ del titulante, en el medio de reacción. Como la mayoría de los métodos cuantitativos de análisis, esta técnica fue originalmente desarrollada en condiciones de escala convencional, donde se emplean electrodos de platino y potenciostatos de costo elevado [2, 3]. Toda vez que la electrólisis es exhaustiva, los tiempos de operación son consecuentemente largos y en algunos casos se tienen análisis que pueden demorar horas. Se tiene así una limitación práctica de la coulombimétrica convencional. La Química Analítica a microescala presenta ventajas en cuanto a la minimización de volúmenes de análisis y en consecuencia de tiempos de operación, costos y desechos [4], brindando un enfoque integral en cuanto a las nuevas tendencias docentes y de investigación. De esta forma el alumno en formación se convierte en más que un operador, en un analista que comprende el fundamento y funcionamiento y optimización de su equipo de trabajo [5].
El SO2 es un conservador y antimicrobiano usado en la industria agroalimentaria para conservar vinos y usualmente se introduce a la muestra por burbujeo y ya en solución se estabiliza como HSO3-. Por su carácter reductor el SO2 se determina por titulación volumétrica directa con yodo en medio ácido, usando almidón como indicador visual del punto de equivalencia o bien, electrogenerando el yodo a partir de yoduro, para titular el ácido sulfúrico [6].
En este trabajo se propone un método por titulación microcoulombimétrica de mínima instrumentación que se basa en la electrogeneración de yodo, en medio yodurado, usando un pulso de corriente constante entre dos electrodos, para titular metabisulfito de sodio en medio acético inicial . Durante el tiempo de electrólisis ocurre la reacción de electrooxidación del yoduro en exceso para formar yodo (ecuación 1) y la posterior formación de la especie soluble de yodo-yodurado (ecuación 2), que es la reacción que desencadena el mecanismo completo del electroanálisis durante la reacción de titulación (ecuación 3) hasta la reacción de monitoreo visual del fin de titulación (ecuación 4).
El principio de la cuantificación se basa en la reacción de la ecuación 1 que es electroquímicamente rápida y acontece en el ánodo. Las reacciones químicas acopladas (ecuación 2 y ecuación 3) a la reacción del ánodo son de cinética química rápida y la agitación vigorosa y constante garantiza que la transferencia de masa no limite tales procesos. Se observó que la corriente de electrólisis es prácticamente constante y farádica, cuando se aplica el pulso de potencial al electrolito soporte inerte de 0,1 mol L-1 de KNO3. Simultáneamente, en el cátodo, se reduce el agua generando iones hidroxilo que son rápidamente neutralizados por el ácido acético para generar el par conjugado ácido acético/acetato, que amortigua in situ el pH en un valor aproximado a 5,0, por lo que no es necesario separar los electrodos con puente salino. De esa forma se evita la consecuente caída óhmica inherente al uso de membranas separadoras. Se han reportado otros caso en donde es necesario el uso de puente salino para no contaminar las semiceldas [7],como en las titulaciones microcoulombimétricas ácido-base [8]. En la figura 1 se esquematiza la secuencia de reacciones electroquímicas y químicas acopladas que ocurren durante la microtitulación coulombimétrica descrita.
MATERIALES Y MÉTODOS
Se realizaron tres tipos de ensayos titulométricos con disoluciones estándar de metabisulfito de sodio R. A. y con muestras de vino tinto cepa Carmenere.
A) Titulación volumétrica a escala convencional
Se estandarizó la solución titulante de yodo/yodurado de concentración nominal 0,01 mol L-1 con tiosulfato de sodio estándar primario, en medio ácido acético pH = 4, usando 0,2 mL de solución de almidón al 1 % como indicador visual. Se empleó una bureta de 10,0 mL previamente calibrada. Una vez estandarizada la solución del titulante se analizaron varias muestras de 10,0 mL de vino tinto cepa Carmenere con 2,0 mL de ácido sulfúrico de concentración 5 mol L-1, usando 0,2 mL de almidón al 1 %.
B) Titulación coulombimétrica con indicador visual
La figura 2 muestra el montaje experimental usado para la titulación coulombimétrica hasta el vire del indicador.
Para construir las curvas de calibración, t = f(mol), se colocaron 4,0 mL de nitrato de potasio 0,1 mol L-1 en la celda coulombimétrica y posteriores alícuotas de estándar 0,005 mol L-1 de metabisulfito de sodio con volúmenes de 20, 60, 100, 140 y 180 µL. Como medio de reacción se usaron 0,2 mL de yoduro de potasio 2 mol L-1, 0,1 mL de almidón al 1 % y 0,03 mL de ácido acético 17,4 mol L-1. Los electrodos fueron conectados a una fuente de poder de 1.3 V, con una corriente constante de 10,5 mA. El experimento completo fue registrado por video usando un teléfono inteligente con el que se pudo determinar con precisión el tiempo de vire del indicador en condiciones de agitación constante. Con las mismas condiciones operatorias se analizaron alícuotas de 1,0 mL de muestra de vino tinto. Se realizaron repeticiones para la curva de calibración (N = 10) y para la muestra de vino (N = 15).
C) Titulación coulombimétrica con detección fotocolorimétrica acoplada simultánea
La figura 3 muestra el montaje experimental para la titulación coulombimétrica con detección acoplada simultánea fotocolorimétrica del vire del indicador.
La celda fue recubierta en su totalidad con cinta de aislar negra para evitar filtraciones de luz parásita. Se utilizó un foco LED como fuente lumínica, alineado a una celda fotorresistiva. La respuesta del fotodetector a la luz emergente no absorbida fue utilizada para calcular la absorbancia durante la microelectrólisis [9]. Se utilizaron las mismas cantidades de reactivos, muestra de vino, medio de reacción y método de determinación visual (figura 3B).
RESULTADOS Y DISCUSIÓN
La tabla 1 muestra los resultados de la determinación de sulfito libre en muestras de vino tinto por el método volumétrico a escala convencional. Se detectó un contenido de 25,9 ± 1 ppm como SO2 libre y contenidos similares mediante las técnicas propuestas en las que siempre se ocupó diez veces menos muestra con respecto a la necesaria al emplear instrumentación convencional.
La figura 4 muestra la curva de calibración tiempo de vire contra la cantidad de metabisulfito estándar obtenida por microcoulombimetría con detección visual. Una cantidad de 16,0 ± 3,5 ppm fue detectada. Se obtuvieron resultados similares de sensibilidad e intensidad de la correlación lineal durante la reproducción del experimento.
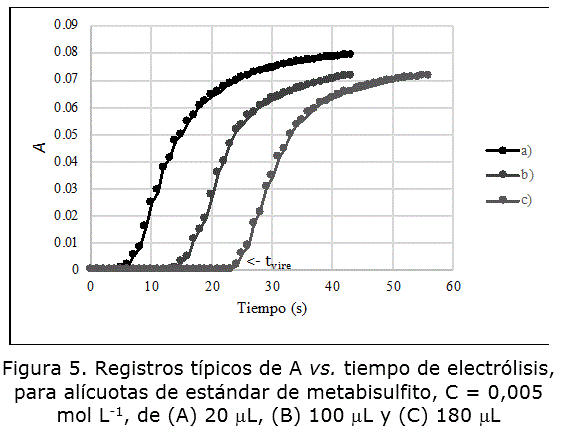
La figura 5 muestra la evolución de la absorbancia con respecto al tiempo durante la coulombimetría a diferentes adiciones de metabisulfito estándar.
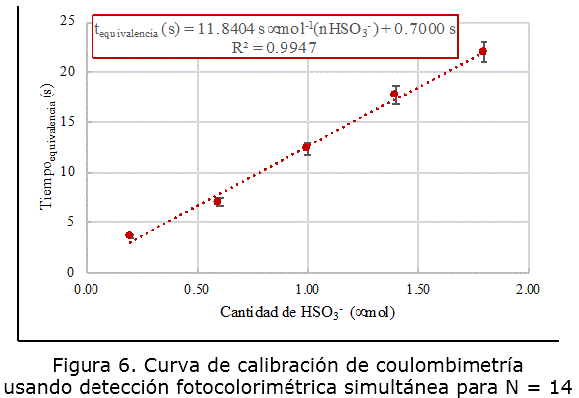
La figura 6 muestra la curva de calibración obtenida mediante monitoreo fotocolorimétrico del viere del indicador simultáneo al experimento culombimétrico. Se detectaron 18,9 ± 3,5 ppm de sulfito libre. La intensidad de la correlación lineal es similar a la obtenida con experimentos basados en la detección visual del tiempo de vire; sin embargo, la detección instrumental de este parámetro es idónea para analistas poco experimentados o alumnos de pregrado en proceso de integración a la investigación.
Los resultados comparativos obtenidos con los tres métodos ensayados se presentan en la tabla 1.
TABLA 1. COMPARACIÓN DE LOS MÉTODOS EXPERIMENTALES ENSAYADOS
| Método | Volumetría a escala convencional | Coulombimetría | Coulombimetría fotocolorimetría |
| Volumen de estándar (mL) | 10,0 | 3,0 | 3,0 |
| Volumen de muestra (mL) | 10,0 | 1,0 | 1,0 |
| Medio de reacción total (mL) | 50,0 | 5,0 | 5,0 |
| Tiempo de análisis (s) | 900,0 | 300,0 | 300,0 |
| Contenido de SO2 libre detectado (ppm) | 25,9 ± 1,0 | 16,0 ± 3,5 | 18,9 ± 3,5 |
El contenido de sulfitos libres promedio fue comparado con el correspondiente en la norma chilena, para muestras de viñedos propios de la localidad. La norma en cuestión indica que el contenido de sulfito libre máximo es de 100 ppm [10], por lo que el contenido encontrado en las muestras está dentro de lo especificado por la norma. Aunque existen metodologías basadas en electrodos selectivos a iones y resonancia magnética nuclear para determinar especies iónicas como potasio, sodio e isómeros de fructuosa respectivamente [11], es cierto que son pocos o casi nulos los métodos reportados a la determinación de sulfitos totales en muestras alcoholicas de matriz compleja, como el vino.
CONCLUSIONES
Los resultados obtenidos bajo los métodos ensayados en este trabajo proporcionan elementos respecto a la toma de decisiones en los análisis de sulfito libre en vino tinto. Tanto el volumen de muestras, tiempos de análisis y precisión se ven mejorados al utilizar equipo construido en condiciones de microescala, usando materiales de bajo costo. Se sienta un precedente para la puesta a punto de determinaciones viables de sulfito libre y sulfito total en otras muestras de alimentos, con sus respectivos tratamientos de muestras.
REFERENCIAS BIBLIOGRÁFICAS
1. EHL, R. G.; IHDE, A. J. "Faraday's Electrochemical Laws and the Determination of Equivalent Weights". Journal of Chemical Education. 1954, 31(5), 226–32. ISSN: 0021-9584
2. BARD, A. J.; FAULKNER, L. R. Electrochemical Methods. New York: Wiley, 2000. ISBN: 9780471043720
3. ZOSKI, C. G. Handbook of Electrochemistry. Amsterdam: Elsevier, 2006. ISBN: 978-0-444-51958-0
4. BAEZA, A.; GARCÍA MENDOZA, A.; VIERNA, L. "Microscale Analytical Potentiometry: Experimental Teaching with Locally Produced Low-Cost Instrumentation". Journal of Modern Education Review. 2013, 3(5), 407–15. ISSN: 2155-7993.
5. DOMINGUEZ, V. C. et al. "The Characterization of a Custom-Built Coulometric Karl Fischer Titration Apparatus". J. Chem. Educ. 2010, 87, 987–991. ISSN: 0021-9584
6. IZURIAGA ESCUDERO, V. "Verificación de un equipo de análisis rápido de determinación de óxido de azufre en alimentos. Tesis de maestría. Escuela Técnica Superior de Ingenieros Agrónomos, Universidad Pública de Navarra, 2014.
7. BAEZA, A; DE SANTIAGO ZÁRATE, A.; GALICIA, E. "Titulación De Halogenuros a Microescala Total Con Microsensores de Ag y Microreferencia De Bajo Costo Sin Puente Salino". Revista Chilena de Educación Científica. 2004, 3(1), 22–25. ISSN: 0717-9618
8. MARÍN MEDINA, A.; GARCÍA MENDOZA, A.; DE SANTIAGO ZÁRATE, A.; BAEZA, A. "Diseño, Construcción y caracterización de titulaciones Microcoulombimétricas Ácido-Base con Monitoreo Visual y Micropotencimétrico: Aproximación Metrológica". Revista Cubana de Química. 2014, 26(2), 26–36. ISSN: 2224-5421.
9. MARTÍNEZ, J. M.; BAEZA, A. "Química Microanalítica: Determinación de ácido acetilsalicílico con Microfotocolorímetros de Mínima Instrumentación (MIMC) de bajo costo". Revista Cubana de Química. 2004, 16(3), 29-39. ISSN: 2224-5421.
10. MINISTERIO DE AGRICULTURA, Producción, elaboración y comercialización de alcoholes etílicos, bebidas alcohólicas y vinagres, Ley Nº 18.455, Edición Junio de 2010, Santiago de Chile, Diario Oficial, 2010.
Recibido: 5/09/2017
Aceptado: 15/02/2018
Dr. C Arturo García-Mendoza, Departamento de Química Analítica, Facultad de Química, UNAM, México 04510, CDMX, México, arturogm@unam.mx