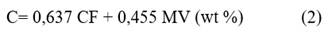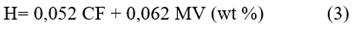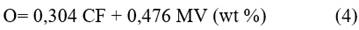Introducción
La limitada reserva de combustibles fósiles enfoca las investigaciones en la actualidad, hacia la búsqueda de fuentes alternativas de energía, como un camino para producir combustibles limpios que propicien un desarrollo sostenible.
La biomasa es una gran oportunidad para la humanidad si está bien gestionada. Los residuos agroindustriales, fuentes de biomasa lignocelulósica, son un potencial de energía renovable. La misma puede ser transformada a materiales carbonosos a través de procesos pirolíticos, lo que incluye la activación química y física.1
La activación química tiene como objetivo transformar el carbonizado en un material altamente adsorbente, debido al incremento y ensanchamiento de su porosidad interna, y puede efectuarse en dos formas: por impregnación directa del precursor con una disolución del agente activante, o por impregnación del carbonizado y luego un tratamiento térmico (pirólisis).
Durante la primera, la materia carbonosa se impregna con una disolución de agentes químicos y se carboniza entre 350 y 900 ºC en atmósfera inerte. Los agentes más utilizados son el cloruro de zinc, el ácido fosfórico y el hidróxido de potasio. El cloruro de zinc ha sido desplazado por otras sales minerales, por problemas de corrosión, bajos rendimientos y presencia de zinc residual en el producto final. Los carbones activados obtenidos son generalmente mesoporosos, de baja densidad y poca resistencia a la abrasión.2
Durante el proceso pirolítico la impregnación química deshidrata el precursor, incrementa el grado de aromatización de la matriz carbonosa y crea una estructura porosa tridimensional rígida. Además, se inhibe o reduce la formación de alquitranes y materia volátil, que puedan bloquear los poros de la superficie, así como incrementa los rendimientos del carbón obtenido.3,4
El carbón activado es un producto que posee una estructura cristalina reticular similar a la del grafito, pero menos ordenada, es extremadamente poroso y puede llegar a desarrollar áreas superficiales del orden de 500 a 1 500 m2/g. Dichas áreas pueden variar dependiendo de la materia prima y del proceso de activación.
El grafito (forma alotrópica del elemento carbono), consistente en láminas de átomos de carbono (grafenos) que forman un sistema de anillos condensado plano. Los grafenos se unen entre sí en la dirección del eje z mediante un enlace de tipo metálico de muy baja energía (del orden de magnitud de las fuerzas de Van der Waals). Existen dos formas posibles de apilamiento de los grafenos: la hexagonal tipo Bernal (ABAB) y la romboédrica (ABCABC). La estructura romboédrica se transforma irreversiblemente en la hexagonal, por lo que no puede estar presente en los grafitos sintéticos obtenidos por tratamiento térmico. A partir de este punto, se denomina abreviadamente al grafito hexagonal (tipo Bernal) como grafito, hecho comúnmente tolerado por las normas de nomenclatura.5
Los carbones obtenidos pueden ser usados como absorbentes en aplicaciones medio ambientales, remediadores de suelos, en dispositivos electrónicos, entre otros usos.6,7
El objetivo de esta investigación es obtener materiales carbonosos para aplicaciones energéticas a partir de residuales de la industria azucarera (bagazo de caña de azúcar), mediante un proceso de pirólisis lenta y activación con cloruro de hierro (III), así como el estudio cinético de su obtención.
Materiales y métodos
Se presentan los materiales y equipos utilizados, así como las operaciones empleadas para la caracterización de la biomasa y su pirólisis. Los equipos utilizados se encuentran disponibles en Laboratorios de la Facultad de Ciencias Naturales y Exactas y el laboratorio de Biomasa, del Centro de Estudio de Energía y Refrigeración de la Universidad de Oriente (tabla 1). Los reactivos utilizados todos son puros para análisis.
Toma de la muestra
La muestra objeto de estudio, bagazo de caña de azúcar, procedió de la provincia Holguín, Cuba. La misma se escogió en el mes de marzo de 2021, con diferentes tamaños de partículas, alcanzando un peso total de 1,5 kg, y fue transportada debidamente empacada hacia los laboratorios referidos.
El bagazo de caña se sometió a secado en la estufa, según la norma UNE-EN-14774-1:2010.8 Luego se pesaron 500 g de muestra seca, en balanza técnica y se sometió al método de cuarteo hasta obtener 250 g, para lograr una muestra representativa. Se trituró en un molino de cuchillas y tamizó durante 10 min, separándose la fracción: menor 0,074 mm, y se realizó nuevamente el método de cuarteo hasta alcanzar 50 g de muestra.
Activación del bagazo de caña de azúcar
Para la activación química de la biomasa objeto de estudio se utilizó disolución de cloruro de hierro (III) a 0,5 mol · L-1. La relación sólido:disolución es 1 g: 6 mL. El bagazo fue impregnado con esta disolución por 24 h, y después filtrado y secado en estufa a 105 ºC.
Análisis elemental e inmediato
La caracterización de la biomasa antes de efectuar el proceso de pirólisis es fundamental. A continuación se muestran los procedimientos experimentales que se utilizaron.
Determinación de humedad
La humedad se determinó, a partir de 1 g de muestra, que se calentó desde temperatura ambiente hasta 110 °C en una mufla durante 1 h.
Material volátil
Se procedió según la norma UNE-EN-15148:2010.9 En un crisol tarado se pesó 1g de la muestra seca, se tapó y se llevó a una mufla a 950 °C durante 7 min. Luego se dejó enfriar en desecadora y se pesó hasta masa constante.
Cenizas
Se aplicó norma UNE-EN-14775:2010.10 En un crisol tarado se pesó 0,5 g de la muestra seca, y se llevó a una mufla a 650 °C durante 3 h. Luego se dejó enfriar en desecadora y se pesó hasta masa constante.
Carbono fijo
Este valor se obtuvo por diferencias a partir de los contenidos de humedad, cenizas y material volátil. Para el cálculo se utilizó la siguiente expresión:
Análisis elemental
Se calculó, de manera preliminar, la composición elemental de la biomasa, partiendo de diferentes correlaciones /2, 3 y 4/ propuestas por Parikh y col., empleando los datos obtenidos experimentalmente en el análisis inmediato.11 El error absoluto promedio del cálculo es de 3,21 %; 4,79 %; 3,4 % con respecto a los valores medidos de C, H y O, respectivamente:
Los autores proponen los intervalos en los que deben oscilar los valores experimentales de materia volátil (MV) y carbón fijo (CF), utilizados para el cálculo y los contenidos de carbono (C), hidrógeno (H) y oxígeno (O) objeto de análisis, los que se especifican a continuación:
57,2 % ≤ MV ≤ 90,6 %; 4,7 % ≤ CF ≤ 38,4 %;
36,2 % ≤ C ≤ 53,1 %; 4,36 % ≤ H ≤ 8,3 %; 31,37 % ≤ 0 ≤ 49,5
Todos estos valores son expresados en porcentajes en masa sobre base seca.11
Análisis térmico convencional
El registro térmico se obtuvo en equipo de análisis térmico simultáneo de NETZSCH STA 449 F3 Jupiter®. Se utilizó una velocidad de calentamiento de 10 °C/min, con flujo de nitrógeno de 60 mL/min, para garantizar la atmósfera inerte y una muestra de 0,5 mg. El procesamiento de los datos de termogravimetría (ATG), termogravimetría derivada (TGD) y calorimetría diferencial de barrido (CDB) se realiza con el software Origin 8.1. Se estudiaron por estas técnicas tanto el bagazo natural, como el modificado con sales de cloruro de hierro (III).
Estudio cinético
El análisis cinético se realizó al aplicar el método de ajuste de las funciones y las ecuaciones de Achar y Coats.12 Para la determinación de los coeficientes de correlación lineal (r), se utilizó el software Microsoft Excel 2007, lo que permitió identificar los modelos cinéticos que determinan la velocidad de reacción. Para el cálculo de la energía de activación se empleó el software Origin 8.
Obtención del material carbonoso en horno tubular
Para la síntesis del material carbonoso se dispone de un sistema conformado por los siguientes componentes: una cámara para la síntesis, un horno programable, un medidor de flujo y un balón de gas inerte. Los gases son expulsados al exterior del laboratorio mediante una manguera. Experimentalmente se colocó el bagazo modificado con cloruro de hierro (III) en la cámara de pirólisis y se hace pasar una corriente de gas inerte con un flujo que varía entre 10 y 20 mL/s. Posteriormente se calentó a una temperatura entre 600 y 900 (C con una velocidad de calentamiento de 10 (C/min y se mantiene esa temperatura entre 30 min y 2 h. La muestra se enfríó dentro del horno, manteniendo la atmósfera inerte y posteriormente se colocó en una desecadora.
Caracterización eléctrica preliminar de los materiales carbonosos
La caracterización eléctrica preliminar se realizó con un sistema que mide bajo presión la relación de la resistividad/densidad másica. Todas las mediciones se realizaron a la temperatura de 27 oC. La muestra se colocó en el troquel, se aplicó la presión y se midió la resistencia eléctrica mediante un óhmetro digital. Antes de colocar la muestra de polvo en el troquel se determinó su masa en una balanza analítica digital.13
Resultados
Análisis inmediato y elemental de la biomasa
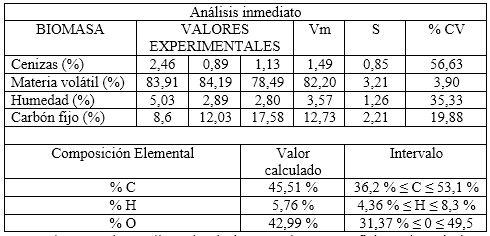
Los parámetros químicos de la biomasa determinan el comportamiento de la misma, durante los procesos de transformación termoquímica. En la tabla 2 se presentan los resultados del análisis inmediato y elemental del bagazo modificado con cloruro de hierro (III).
El valor medio de carbón fijo obtenido fue 12,73 % ( 2,21 para la muestra estudiada, superior al reportado para un bagazo sin modificar que fue de 6,17 %.2 Este incremento de carbonizado es muy favorable, dado su futura aplicación como electrodos en bioceldas de combustible. Albis y colaboradores reportaron la influencia de sales de hierro y de los agentes activantes en general, en el incremento del por ciento de carbonizados.14
Tabla 2 Resultados del análisis inmediato y elemental
Leyenda: Vm valor medio, S desviación estándar, CV coeficiente de variación
La materia volátil es la porción de combustible que se libera en forma de gases y vapores (hidrocarburos) al descomponerse térmicamente la biomasa. En comparación con el carbón mineral, la biomasa sólida tiene un alto contenido de volátiles entre 60 y 80 %.1 En este trabajo se reporta un valor de 82,20 % ( 3,21, algo inferior al de 87,89 % reportado en el bagazo sin modificar.2 Este menor valor se encuentra en total consonancia con el mayor por ciento de carbón fijo ya presentado. Albis explicó que la activación con sales reduce la formación de materia volátil.14
El valor medio de humedad determinado a la biomasa fue de 3,57 % ( 1,26, lo que constituye un valor bajo. Valores inferiores al 10 % justifican la selección de la pirólisis para su termoconversión.1 Además, se prefiere este proceso porque lo que interesa es el carbón sólido.
Las cenizas es la materia inorgánica que queda al finalizar la combustión. Su valor medio fue de 1,49 % ( 0,85. El contenido máximo de cenizas en biomasa herbácea y residuos agrícolas es de un 15 %. Estos bajos contenidos evitan incrustaciones y altos consumos energéticos en los hornos pirolíticos y menor evolución de material particulado a la atmósfera, durante la termoconversión de la biomasa.1
En la tabla 2 se presentan los resultados del análisis elemental del bagazo de caña modificado con cloruro de hierro (III). Los contenidos de carbono, hidrógeno y oxígeno determinados al bagazo de caña sin modificar fueron 43,92 %; 5,76 % y 43,71 %, similares a los determinados en este trabajo.2
A partir de los resultados de los análisis elementales e inmediatos ya referidos para el bagazo objeto de estudio, se precisa en el esquema de la figura 1, que presenta un contenido energético inferior a la turba, carbón mineral de bajo rango.1 Este menor contenido energético de la biomasa objeto de estudio, sugiere aprovecharla en otros usos, como electrodos en bioceldas de combustible.
Análisis térmico cualitativo
En la figura 2 se presentan los registros de Termogravimetría (ATG), Termogravimetría derivada (TGD) y Calorimetría diferencial de barrido (CDB) para el bagazo de caña modificado con cloruro de hierro (III).
La termodescomposición de materiales lignocelulósicos es compleja e incluye la ocurrencia de reacciones simultáneas y consecutivas que no han sido elucidadas totalmente. Sin embargo, todos exhiben un perfil térmico específico que los caracteriza, a partir de los antecedentes bibliográficos existentes en el tema.15 En general, se identifican las etapas de deshidratación de la biomasa y de termodescomposición en este orden, hemicelulosa, celulosa y lignina; dado la diferente estabilidad química y térmica de los constituyentes principales de la misma.
Los perfiles térmicos obtenidos para el bagazo de caña modificado con cloruro de hierro (III) son similares a los presentados para otras biomasas,15,16 lo que demuestra una menor interacción del agente activante. A partir de la interrelación de las tres curvas se distinguen cuatro etapas fundamentalmente (figura 2).
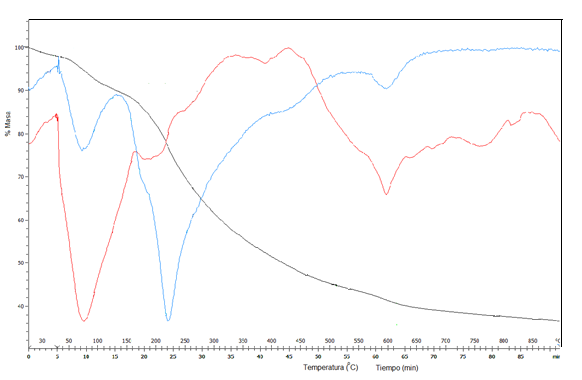
Fig. 2 Curva termogravimétrica (trazo negro), termogravimétrica derivada (trazo azul) y calorimetría diferencial de barrido (trazo rojo) del bagazo activado con cloruro de hierro (III) durante su pirolisis
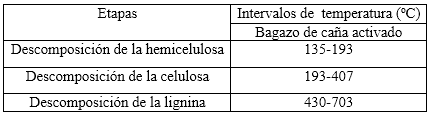
El primer escalón ATG se identifica a temperaturas menores a 50 (C, con una variación de masa de 5,15 % que corresponden a la pérdida de humedad, que es un agua fisisorbida, por ello se desprende a temperaturas tan bajas. Este es muy cercano al valor medio de humedad de 3,57 ( 1,26 % identificado por análisis inmediato y similar al reportado por otros autores.2 Este escalón tiene un pequeño pico endotérmico en la curva CDB. El segundo escalón ATG, con una variación de masa de 7,02 %, tiene lugar en un intervalo de temperatura entre 50-137 (C, y muestra un gran pico endotérmico asociado, lo que indica que la demanda de energía en esta segunda etapa es mayor. El mismo se relaciona con la continuación de la deshidratación del material y particularmente la pérdida de agua de constitución y de algunos productos ligeros volátiles. Algunos autores afirman que el agente activante actúa como deshidratante para inhibir la formación de alquitranes durante la descomposición pirolítica de biomasas.14
A continuación aparece un amplio escalón en la curva ATG en un intervalo de temperatura entre 135-407 (C, con una pérdida de masa asociada de 38,35 % que corresponde a la termodescomposición inicialmente de la hemicelulosa y posteriormente de la celulosa. El hombro de la curva TGD, frecuentemente identificado para otras biomasas,15,16 ayuda a distinguir el límite entre el predominio de un proceso y otro, demostrando las potencialidades de esta técnica para identificar reacciones simultáneas. Además, la misma demuestra que la mayor liberación de materia volátil está asociada a la celulosa. En la curva CDB se distingue en este rango de temperatura un pequeño pico endotérmico primero, más asociado a la degradación de la hemicelulosa y un pico exotérmico amplio más asociado a la degradación de la celulosa. Ambas técnicas térmicas ayudan a demostrar la diferente degradación de ambos constituyentes.
Finalmente se identificó la descomposición de la lignina, para ello se utilizaron, esencialmente las curvas TGD y CDB, en un intervalo de temperatura entre 430-702 (C y una pérdida de masa asociada de 10,64 %. La estabilidad química que implica la existencia de anillos aromáticos en ella, condiciona que sea la última en descomponerse. La curva CDB muestra un efecto endotérmico en un amplio intervalo de temperatura.
Disponer de los tres perfiles térmicos (ATG, TGD y CDB) de la degradación pirolítica del bagazo de caña modificado con cloruro de hierro (III) de forma simultánea, permitió un estudio integral del proceso y una mejor precisión de las etapas por las que transcurre el mismo. Todo lo anterior permitió proponer en la tabla 3 los intervalos de temperatura en los que predomina la termodescomposición de los constituyentes principales de la biomasa, y que son la base del estudio cinético.
Estudio de termolabilidad del bagazo de caña modificado con cloruro de hierro (III)
En las figuras 3 y 4 se representan las curvas ATG y TGD del bagazo modificado con cloruro de hierro (III) y del bagazo sin modificar. La interpretación de los diferentes eventos térmicos fue explicada en el epígrafe anterior, por lo que se centra la atención en su comparación.
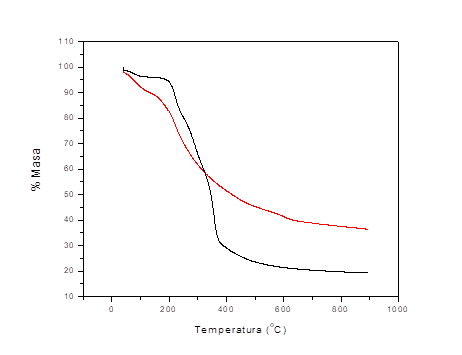
Fig. 3 Curvas de análisis termogravimétrico (ATG) del bagazo de caña sin modificar (negra) y el bagazo de caña modificado con cloruro de hierro (III) (roja)
En general, se observa la influencia de la activación química en la curva ATG. El perfil de estos termogramas muestra una fuerte dependencia con la adición del activante, incluso muchos autores consideran que estos cumplen la función de catalizadores.14 Se distingue la aparición de nuevos escalones TG, debido a la deshidratación más profunda de la biomasa y la separación de los perfiles térmicos, demostrando la mayor termolabilidad del bagazo activado con cloruro de hierro (III), lo que puede favorecer el proceso en vista a sus futuros escalados. Se corrobora la obtención de mayores porcientos de carbonizados y menor materia volátil, demostrados también por análisis inmediato.
Al comparar las curvas de Termogravimetría derivada (TGD) del bagazo sin modificar (curva negra), con el bagazo modificado con cloruro de hierro (III) (curva roja), se identifica que el perfil térmico (forma de las curvas) es más afectado, que el intervalo de temperatura en el cual tiene lugar la reacción de pirólisis.
Albis y colaboradores afirman que el uso de sales de hierro y cinc aceleran fuertemente el proceso de deshidratación/fragmentación inicial de la biomasa y lo desplazan a temperaturas inferiores en comparación con la biomasa natural, algo similar ocurre con la reacción de despolimerización.14 De manera análoga a los resultados obtenidos del análisis inmediato, la materia volátil del bagazo natural es mayor que la del bagazo modificado, lo que se infiere a partir del área de los efectos térmicos.
Análisis cinético del craqueo pirolítico de la biomasa en estudio
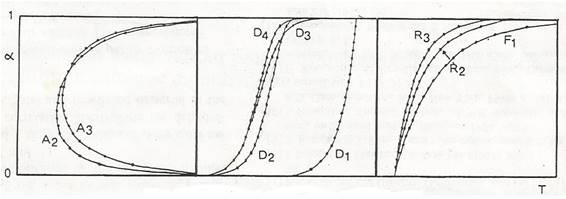
Una de las maneras más simples de identificar el modelo cinético de una reacción química heterogénea es a partir de la comparación de las curvas experimentales α vs T, con un set de curvas teóricas propuesto por Rouqueroll17, representadas en la figura 5.
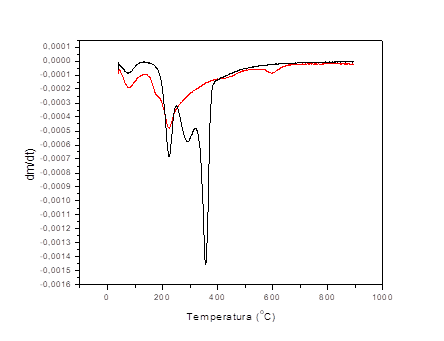
Las curvas experimentales obtenidas durante esta investigación se presentan en la figura 6. Una comparación visual con el set de curvas teóricas permite identificar que el bagazo de caña sin modificar tiene una curva sigmoide, características de procesos difusivos y que en el bagazo modificado con cloruro de hierro (III), la etapa de iniciación de la curva prácticamente desaparece, por lo que es característica de modelos cinéticos de avance de la interfase de reacción. Al parecer la activación química, modifica el modelo cinético que determina la reacción de pirólisis. Albis y col. sugieren un cambio de modelo de reacción en presencia de sales de hierro y de cinc.14
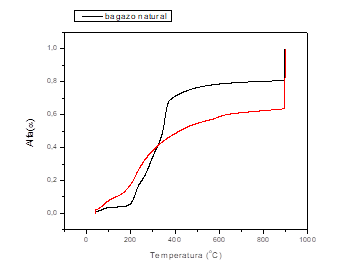
Fig. 6 Curvas de termogravimetría derivada del bagazo modificado con cloruro de hierro (III) (roja) y del bagazo natural (negra)
Para realizar un estudio cinético más detallado se utiliza el método de ajuste de las funciones, a través de las ecuaciones de Coats y Achar, y según la metodología de cálculo utilizada en el estudio de otras biomasas.12,16
En la tabla 4 se presentan los resultados del estudio cinético de la pirólisis de los constituyentes principales del bagazo de caña modificado con cloruro de hierro (III), a la velocidad de calentamiento de 10 ºC/min.
De los resultados presentados en la tabla 4 se observa que tanto para la ecuación de Coats (método integral), como para la de Achar (método diferencial), se distinguen varios modelos cinéticos entre los probables (marcados en negritas), de ellos se escogen D1, D2, D3, R1, R2, (marcados en rojo) como los que determinan el proceso cinético estudiado, por ser los que se repiten por ambos métodos. La similitud entre los modelos probables por ambas ecuaciones y el menor número de ellos identificados para esta etapa de degradación de la hemicelulosa, demuestran la menor complejidad cinética del proceso químico estudiado. Estos modelos están relacionados con procesos difusivos (D) y avance de la interfase de reacción (R).
Tabla 4 Resultados cinéticos de la degradación de la hemicelulosa en el bagazo de caña modificado con cloruro de hierro (III)
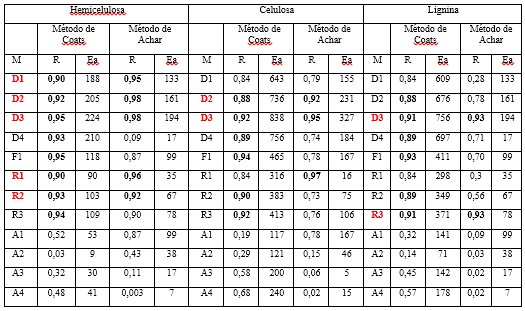
Llama la atención la coincidencia que, tanto los modelos D como los R, fueron los identificados cuando se comparó con el set de curvas teóricas de alfa vs temperatura. Los valores de energía de activación varían entre 35-224 kJ · mol-1 y son similares a los reportados por otros autores en procesos de pirólisis de biomasas.12,16
En la tabla 4 se presentan los resultados de la cinética de la degradación de la celulosa, identificándose los modelos cinéticos D2, D3 como los que determinan la velocidad de la reacción. Los valores de energía de activación calculados se encuentran entre 231-838 kJ · mol-1, algo altos pero característicos de los procesos pirolíticos estudiados.
Se utiliza el método de ajuste de las funciones porque es el único que permite identificar a partir de resultados experimentales, los modelos cinéticos que determinan las velocidades de una reacción química en particular, cuando se aplica análisis termogravimétrico.
Finalmente se presentan los resultados relacionados con la cinética de degradación de la lignina (tabla 4). Los modelos que determinan la velocidad de la reacción son D3, R3. Los valores de energía de activación se encuentran en el intervalo entre 78-756 kJ·mol-1.
El menor número de modelos cinéticos seleccionados para la celulosa y lignina es un indicio del grado de avance del proceso pirolítico que tiene lugar y ha ocurrido en estudios cinéticos de otras biomasas.12,15,16 Llama la atención que, en todo el proceso, los modelos D y R son los que determinan la velocidad de la reacción y coinciden con lo detectado a partir del set de curvas teóricas propuestas por Rouqueroll.
Caracterización óptica preliminar de los materiales carbonosos
La figura 7 (A, B y C) muestra las imágenes obtenidas al visualizar las biomasas estudiadas utilizando un microscopio óptico.
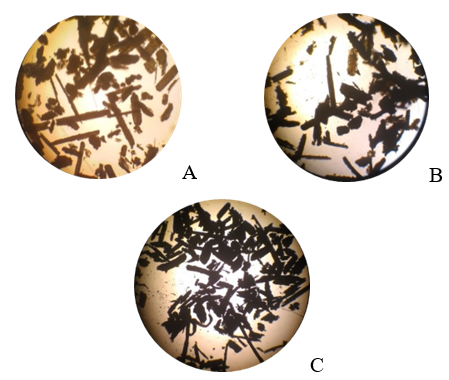
Fig. 7 Microscopía óptica. (A): Bagazo de caña de azúcar sin modificar; (B): Bagazo de caña impregnado con FeCl3; (C): Bagazo de caña activado con FeCl3
El bagazo de caña no modificado (figura 7 A) presenta partículas de diferentes tamaños, generalmente alargadas en una dirección, que recuerdan las microfibras de la biomasa. En el bagazo impregnado con FeCl3 previo a su calentamiento (figura 7 B) no se observan grandes cambios en el tamaño de las partículas. En el bagazo activado con cloruro de hierro (III) (figura 7 C), disminuyen las partículas más largas, lo que es un indicio de la ocurrencia del craqueo pirolítico de la biomasa durante los procesos de carbonización.
Caracterización eléctrica preliminar
A continuación, se presenta la dependencia del cociente de la resistividad/densidad másica (ρ/ρm) en función de la presión de compactación del polvo en el momento de la medición, para el bagazo de caña de azúcar activado con cloruro de hierro (III) (figura 8). Los resultados se comparan con otros carbones activados elaborados por diferentes vías, que sirven como patrón de comparación.13

Fig. 8 Dependencia del cociente de la resistividad/densidad másica (ρ/ρm) en función de la presión de compactación del polvo, para el bagazo de caña de azúcar activado con cloruro de hierro (III)
A presiones bajas, la caída es brusca porque se mejora ostensiblemente el contacto intergranular, la densidad másica aumenta y la resistividad disminuye. Posteriormente se observa cierta tendencia asintótica más relacionada con el comportamiento de las partículas del polvo ante el aumento de la presión.
El valor del cociente (ρ/ρm) para el bagazo activado con cloruro de hierro (III) fue de 2,0 Ω · cm2/g, y demuestra la efectividad del proceso de activación realizado, porque los char presentan valores del mismo muy superiores.(13 Además, el carbón activado obtenido tiene mejor conductividad que el bagazo sin modificar, por lo que preliminarmente es un buen candidato como electrodo para celdas de biocombustible. Cuando se lave el mismo, este cociente ρ/ρm debe disminuir porque las impurezas dificultan la movilidad de los portadores de carga.
Conclusiones
El análisis inmediato y elemental demostraron la composición del bagazo de caña activado con cloruro de hierro (III), su posible termodescomposición a través de la pirólisis, la influencia de la activación salina en el incremento del por ciento de carbonizado, reducción de la materia volátil y su mejor utilización como electrodos en bioceldas de combustible. La discusión integrada de las curvas térmicas permitió identificar las cuatro etapas involucradas en la termodescomposición del bagazo de caña modificado con sales y sus intervalos de temperaturas, así como la fuerte influencia del agente activante, a partir del desplazamiento hacia menores temperaturas del perfil térmico y la aparición de nuevos efectos. El análisis cinético precisó que los modelos D y R en general, determinan la cinética y los valores de energía de activación para la degradación de los constituyentes principales de la biomasa. Las mediciones del cociente de ρ/ρm demuestran la mejor conductividad del carbón activado obtenido y su posible utilización como electrodo en celdas de biocombustible.