Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.35 no.2 Santiago de Cuba Mayo.-ago. 2015
ARTÍCULO ORIGINAL
Evaluación de sustratos con jugo de aloe vera para el crecimiento de lactobacillus plantarum
Evaluation of substrates with aloe vera juice for the lactobacillus plantarum growth
MSc. Heidy Pérez-LeonardI , Dr.C. Aldo Hernández-MonzónII
I: Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar. La Habana, Cuba.
II: Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba. aldohm@ifal.uh.cu
RESUMEN
El Aloe vera es un sustrato no tradicional donde la mayoría de sus carbohidratos se encuentran en forma de polímeros de manosa. Este trabajo tuvo como objetivo evaluar las potencialidades del uso de sustratos a partir de jugo de Aloe vera (sábila) y coproductos azucareros para el crecimiento de Lactobacillus plantarum LB/103-1-5. Se utilizaron como sustratos: jugo de sábila 100 % y combinado con glucosa y melaza, jugo al 75 % con melaza y como sustrato estándar MRS. Las variables respuestas fueron: viabilidad, pH, acidez total y consumo de carbohidratos. La mejor variante de sustrato a emplear como medio de cultivo para el crecimiento de L. plantarum LB/103-1-5 resultó el jugo de sábila al 75 % con melaza. Se obtuvo una viabilidad superior a 9,00 log(ufc/mL), disminución del pH, valores de acidez que denotan producción de ácido láctico, así como el consumo de glucosa y sacarosa asimilada por el microorganismo.
Palabras clave: Aloe vera, fermentación, coproductos azucareros, probióticos.
ABSTRACT
Aloe vera (sabila) is a non-traditional fermentation substrate bearing the most of its carbohydrates in an arrange of mannose polymers. This work had the objective to evaluate potentialities of the use of Aloe vera juice as an early substrate with sugar cane by-products for Lactobacillus plantarum LB/103-1-5 strain growth. Sabila juice at 100 %, supplemented with both glucose and sugar cane molasses at 75 % and MRS growth culture media as control were assessed. Response variables were: viability, pH, total acidity and consumption of carbohydrates. The best substrate variant to be used as culture media for L. plantarum LB/103-1-5 strain growth was sabila juice at 75 % with molasses; this variant exhibited a higher viability up to 9,0 log (UFC/mL), a pH drop, acidity values denoting lactic acid production, as well as glucose and sucrose depletion due to microorganism assimilation.
Keywords: Aloe vera, fermentation, sugar cane by-products, probiotics.
INTRODUCCIÓN
En la industria de alimentos, los cultivos probióticos han sido utilizados como una herramienta en el desarrollo de productos funcionales novedosos, lo cual se ha expandido en el mundo de manera continua [1]. La importancia de ciertas características tecnológicas y fisiológicas de las cepas probióticas contribuye a un número de beneficios en la salud ampliamente comprobados [2]. Los cultivos comerciales usados en estas aplicaciones incluyen cepas de los géneros Lactobacillus y Bifidobacterium.
Para el crecimiento de muchos lactobacilos se consideran indispensables aminoácidos como leucina, valina, ácido glutámico, arginina, tirosina y triptófano; el pantotenato y la niacina son dos vitaminas necesarias, así como la presencia de ciertos metales como el Mn2+ y el Fe2+. Las bacterias ácido lácticas (BAL) son incapaces de sintetizar ciertos aminoácidos y vitaminas esenciales para su crecimiento, lo cual condiciona la necesidad de añadir a los medios de cultivos hidrolizados de proteínas y péptidos como fuente de estos elementos [3].
Lactobacillus plantarum es miembro de la familia Lactobacillaceae, orden Lactobacillales, género Lactobacillus y pertenece a la clase Bacilli. Se considera un candidato ideal para el desarrollo de productos probióticos debido a los altos niveles de este microorganismo en los alimentos. Es una BAL no patógena, Gram-positiva, no esporulada, su genoma es el más grande entre todas las BAL, habita de forma natural en el tracto gastrointestinal y saliva humana, siendo aislado de este último la cepa L. plantarum NCIMB 8826 [2, 4, 5].
Existe evidencia científica de que algunos tipos de vegetales tienen un alto potencial como fuentes de oligo y polisacáridos [6]. El Aloe vera es un sustrato no tradicional para el uso de estos microorganismos, pero es interesante comprobar su potencial, ya que contiene vitaminas y la mayoría de sus carbohidratos se encuentran en forma de polímeros de manosa. Presenta capacidad bacteriostática y bactericida contra patógenos de infecciones, altos niveles de enzimas como catalizadores de células vivas, posee 19 aminoácidos esenciales para la formación y estructuración de las proteínas y también minerales como el calcio, fósforo, cobre, hierro, magnesio, potasio y sodio; fungicida, antibiótico y regenerativo. Todos estos elementos son indispensables para el metabolismo y actividad celular [7, 8].
Debido a sus propiedades nutricionales y composición química, el Aloe vera tiene un alto potencial para promover del desarrollo de bacterias probióticas. En un trabajo de investigación reciente [9] se comprobó que tanto el jugo como la pulpa de Aloe vera es un buen sustrato que permite el crecimiento de bacterias lácticas y la consecuente producción de ácido láctico. Estos investigadores obtuvieron una proliferación máxima del orden 1010 ufc/mL en jugo de sábila al 75 % (v/v) y en el jugo con adición de 5 % (m/v) de glucosa se incrementó la viabilidad hasta 1012 ufc/mL.
Otros investigadores [10] informaron que el jugo de Aloe vera como sustrato vegetal puede ser utilizado como medio de propagación in vitro para las especies probióticas L. plantarum y L. casei. Obtuvieron resultados muy prometedores con viabilidades en el orden de 109 a 1011ufc/mL, los cuales sugirieron que el jugo de sábila pudiera ser utilizado en la elaboración de bebidas fermentadas con bacterias lácticas.
También se ha informado [9] que la planta Aloe vera por los componentes nutricionales que aporta puede considerarse como materia prima para la elaboración de alimentos funcionales y en la actualidad como alimentos del futuro, por lo que el Aloe vera pudiera convertirse en una excelente fuente de productos químicos nutricionales para el desarrollo y comercialización de nuevos productos para la industria alimentaria.
La melaza de caña también se utiliza como sustrato para el crecimiento de L. plantarum con evidencias de que las condiciones óptimas para el crecimiento de este microorganismo fueron: concentración de melaza (20 %), temperatura (30 ± 1 °C) durante 24 horas, pH 5,2 ± 0,1, agitación (100 min.-1) y viabilidad de 4,3x1010ufc/mL [11].
Teniendo en cuenta estos antecedentes este trabajo tuvo como objetivo evaluar las potencialidades del uso de sustratos a partir de jugo de Aloe vera y de coproductos azucareros para el crecimiento de la bacteria probiótica Lactobacillus plantarum LB/103-1-5.
MATERIALES Y MÉTODOS
Para el desarrollo de esta investigación se utilizó la cepa probiótica L. plantarum LB/103-1-5 perteneciente a la colección de cultivos del Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA). Como sustratos se emplearon jugo de Aloe vera (sábila) variedad barbadensis, melaza de caña clarificada y glucosa, y como medios de cultivos caldo MRS y agar MRS para los análisis de la evaluación de la cepa probiótica en los diferentes sustratos.
Para la obtención del jugo de sábila se utilizaron las hojas de la planta, las cuales se lavaron y cortaron en trozos pequeños para macerar en una licuadora (PROTOR SILEX) de uso de laboratorio. El macerado obtenido se filtró para la obtención del jugo libre de fibra para ser utilizado en las fermentaciones.
La determinación de carbohidratos se realizó mediante cromatografía líquida de alta resolución (columna amino, fase móvil AcN:H2O 80:20, flujo de la fase móvil 2 mL/min, temperatura 25 ºC, sensibilidad del detector 0,002 x 10-3 D RI, tiempo de respuesta del detector 0,1) utilizando patrones de fructosa, glucosa, xilosa y sacarosa, según [12].
Los ácidos orgánicos se determinaron por cromatografía líquida de alta resolución empleando un detector ultravioleta (Columna Supelco, Hypersil ODS, fase móvil agua acidulada con H3PO4 al 85 %, flujo 0,5 mL/min, presión 13,3 MPa, detección 210 nm, temperatura ambiente) usando como patrones los ácidos oxálico, málico, láctico, acético y cítrico (lazo 20 uL, detector DAD Knawer, modelo K 2800, bomba Knauer, modelo K 1001), según [13]. El pH se determinó en un medidor RADIOMETER 26 COPENHAGEN utilizando soluciones tampones estándar a pH 4 y 7 con electrodo combinado [14]. La acidez total por un método potenciométrico y se expresó en gramos de ácido láctico /100 mL.
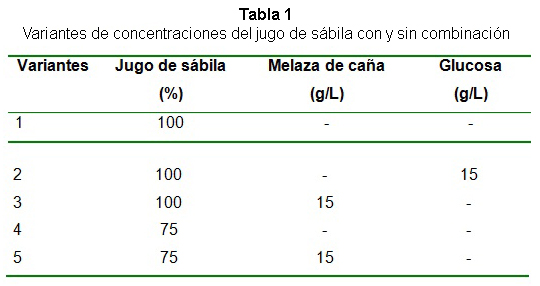
El crecimiento de la BAL se determinó mediante la preparación de diluciones decimales seriados, las cuales se sembraron en placa a superficie incubadas durante 48 h y el resultado se expresó en ufc/mL [15]. El cultivo de la cepa probiótica se preparó en medio caldo MRS ajustado a pH 6,5 e incubado a 37 ºC en condiciones estáticas. Los ensayos de fermentación se realizaron a escala de laboratorio empleando matraces de 250 mL con un volumen efectivo de 100 mL de medio a base de jugo de sábila con pH ajustado a 5,0. Se ensayaron diferentes variantes de concentraciones de jugo y combinaciones de sustratos empleados (tabla 1).
La glucosa y la melaza fueron combinados con una composición de 15 g/L, y en el caso de esta última en base a azúcares reductores totales (ART), con el objetivo de utilizar la misma concentración de azúcar que contiene el medio MRS empleado para comparar todos los sustratos.
El medio control utilizado para la BAL fue MRS [16]. Todos los medios empleados en la experimentación se esterilizaron en autoclave a 118 ºC durante 10 minutos.
Cada fermentación se inoculó con una relación de 1:10, agitación en zaranda a 150 min.-1 con temperatura controlada y los cultivos se incubaron a 37 ºC en una incubadora JOUAN. Las fermentaciones se realizaron por duplicado.
Se determinó el pH y el crecimiento microbiano por recuento total de células viables en las variantes a ensayar, ambos en intervalos de 0, 6, 24 y 48 h.
El perfil de azúcares se analizó a los medios de jugo de sábila puro y los combinados con sustratos al inicio y final de cada fermentación.
RESULTADOS Y DISCUSIÓN
La tabla 2 muestra la composición de los azúcares y ácidos orgánicos presentes en el sustrato no tradicional. Se encontró fructosa y glucosa en los medios a base de jugo de sábila. En el caso del jugo de sábila (100 %) combinado con melaza presentó una composición diferente a los demás medios, puesto que además de fructosa y glucosa se evidenciaron la disponibilidad de otros azúcares como xilosa y sacarosa aportados por la melaza, que permitirán un mayor uso de estos para el crecimiento de la cepa probiótica. En cuanto a la presencia de ácidos orgánicos se detectaron los ácidos málico y oxálico en todos los sustratos con una mayor concentración de ácido málico. En el caso del jugo de sábila con melaza se detectó la presencia ácido láctico.
En la tabla 3 se presentan los resultados del análisis estadístico de la viabilidad del L. plantarum LB/103-1-5 en los sustratos evaluados para diferentes tiempo de fermentación.
En el jugo 75 % no hubo crecimiento, quizás por la falta de nutrientes necesarios. Sin embargo, para el caso del jugo 100 % si se apreció un cambio en el logaritmo de la viabilidad de 8,50 a 9,44 a las 24 h no presentando diferencias significativas (p <= 0,05) con el crecimiento en el MRS, lo que demostró que el Aloe vera no es inhibitorio del crecimiento. A las 48 h se observó una disminución del crecimiento muy probable por el agotamiento de los sustratos.
Para el caso de los jugos con glucosa y melaza manifestaron comportamiento similar al jugo de sábila 100 %, pero con la diferencia que no disminuyó el crecimiento, lo que corroboró la deficiencia de sustratos en el jugo de sábila 100 %. De hecho, a las 48 h los jugos combinados no mostraron diferencias significativas entre ellos, pero sí con el medio MRS, aunque se debe señalar que los valores de viabilidad alcanzados fueron adecuados.
El jugo sábila 100 % con melaza mostró una buena viabilidad y no presentó diferencias significativas con el jugo con glucosa, lo que demostró que los nutrientes de la melaza son asimilados por el microorganismo.
El jugo 75 % con melaza presentó un comportamiento similar a los medios de jugo 100 % combinado hasta las 24 h, sin embargo a las 48 h presentó diferencias significativas con estos y un comportamiento similar con el medio MRS.
A pesar de que el jugo de sábila es un sustrato no tradicional, la diferencia con el MRS fue de solo un ciclo logarítmico de crecimiento al final de la fermentación, este aspecto no es un factor desfavorable o limitante para el uso de medios de cultivo a base de este jugo debido a que una concentración celular de 108 ufc/mL (8,00 log(ufc/mL)) es considerada adecuada.
Al realizar una comparación de estos resultados con el medio jugo de sábila (100 %) se observó la significación que tiene la concentración del jugo en cuanto a la disponibilidad de mayores cantidades de material fermentable, lo cual coincide con una de las escasas investigaciones realizadas con el jugo de esta planta [10].
Además, [9] también utilizaron las mismas concentraciones del jugo de sábila para el crecimiento de L. plantarum NCIMB 11718 y observaron que la concentración neta de Aloe en el medio fue determinante para el desarrollo de los cultivos, ya que en los medios con menor cantidad de jugo (25 % v/v), se registraron crecimientos menores de hasta dos órdenes (105 ufc/mL) que en los cultivos que contenían cantidades mayores de este sustrato. Sin embargo, informaron valores de viabilidad del orden de 107ufc/mL para los cultivos en medio jugo de sábila con 50 y 75 %, los cuales son mucho menor que los alcanzados en este trabajo.
La tabla 4 refleja la utilización de los carbohidratos durante la fermentación inicial y final en cada sustrato.
Como se observa el L. plantarum LB/103-1-5 fue capaz de consumir la glucosa en los diferentes medios de jugo de sábila y MRS, en este último al final de la fermentación presentó un consumo total y más rápido. En cuanto a la fructosa se observó un consumo lento durante la fermentación en todos los medios evaluados.
El jugo de sábila con glucosa presentó un menor consumo de este azúcar con respecto al resto de los medios a las 48 h debido a la presencia de una mayor concentración de glucosa en este medio.
No obstante, en los medios de jugo de sábila con melaza se manifestó un consumo de sacarosa, el cual fue total en el jugo de sábila al 75 %. Otro carbohidrato presente en los medios donde se usó como combinado la melaza fue la xilosa, pero no se apreció el consumo de la misma al final de la fermentación.
El comportamiento del pH durante las fermentaciones de L. plantarum LB/103-1-5 en los distintos sustratos ensayados fue un indicador de interés que indicó la producción de ácidos orgánicos y el crecimiento del microorganismo. Tanto en el medio MRS como en los jugos combinados al final de la fermentación se obtuvieron valores bajos de pH que oscilaron desde 3,7 hasta 4,0. Los medios que se corresponden con estos valores son jugo de sábila 100 % con glucosa (pH 3,7), jugo de sábila 75 % con melaza (pH 3,9) y jugo de sábila 100 % con melaza (pH 4,0).
De estos resultados se destacó el comportamiento del medio jugo de sábila 75 % con melaza por manifestar buena viabilidad, capacidad de disminución del pH y consumo de glucosa y sacarosa comparados con el resto de los medios y similar al MRS.
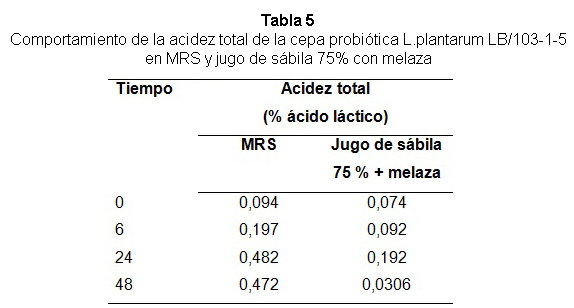
En la tabla 5 se presenta el comportamiento de la acidez, en el medio MRS el incremento fue más rápido, sin embargo fue más lento en el jugo de sábila durante la fermentación. Los valores de acidez alcanzados al final de la fermentación fueron de 0,482 % para el MRS y de 0,306 % para el medio jugo de sábila al 75 % con melaza. Dichos valores podrían ser inhibitorios para bacterias no deseables y se observó que a medida que se incrementó la acidez se manifestó un aumento de la viabilidad del microorganismo.
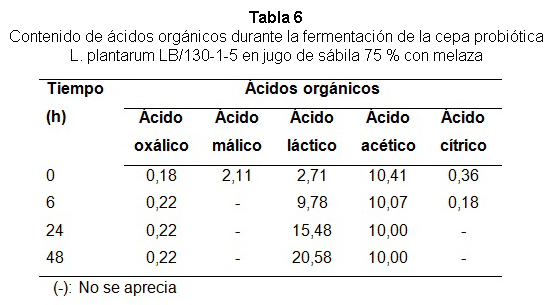
En la tabla 6 se aprecia la presencia de ácidos orgánicos tales como láctico, acético, cítrico y oxálico en el medio jugo de sábila 75 % con melaza durante la fermentación, la mayor cantidad fue de ácido láctico (20,58 mg/mL). Este resultado demostró que la disminución del pH y el incremento de la acidez total observada durante la fermentación en este medio se debieron solo a la producción de ácido láctico como metabolito principal de las bacterias ácido lácticas.
Como se ha reflejado en este trabajo el sustrato seleccionado presentó el mayor potencial y composición adecuada para el crecimiento del probiótico L. plantarum LB/103-1-5 porque los lactobacilos encontraron en este medio, nitrógeno en forma de aminoácidos o péptidos, carbohidratos (glucosa, fructosa y sacarosa) y minerales.
Teniendo en cuenta los precios variables y elevados del medio de cultivo comercial MRS empleado para el crecimiento de lactobacilos, el uso de jugo de sábila 75 % con melaza representaría ventajas económicas por ser una materia prima barata y nutricional con alto contenido de carbohidratos solubles en comparación con el medio comercial.
CONCLUSIONES
1. Se demostró que la cepa probiótica L. plantarum LB/ 103-1-5 posee una capacidad de crecimiento adecuada en los diferentes sustratos utilizados.
2. Se alcanzó una viabilidad entre 9,06 y 9,44 log (ufc/mL) cuando se utilizaron sustratos a base de jugo de sábila y jugos con glucosa y melaza, excepto para el jugo de sábila al 75 %.
3. El sustrato jugo de sábila 75 % con melaza presentó el mejor comportamiento para los requerimientos nutricionales de L. plantarum LB/103-1-5 durante la fermentación, lográndose una buena viabilidad y producción de ácido láctico similar a la alcanzada en el medio estándar MRS.
BIBLIOGRAFÍA
1. SHAH, N. "Functional foods from probiotics to prebiotics". Food technology. 2001, vol 55, pp. 46-52.
2. VASILJEVIC, T, et al. "Probiotics-from Metchnikoff to bioactives". International Dairy Journal. 2008, vol 18, pp 714 - 728.
3. PANDEY, A, et al. "Iron requirement and search for siderophores in lactic acid bacteria". Applied Microbiology and Biotechnology, 1994, vol 40, pp. 735-739.
4. MOLENAAR, D, et al. "Exploring Lactobacillus plantarum genome diversity by using microarrays". Journal Bacteriology. 2005, vol 187, pp. 6119-6127.
5. DEL PIANO, M, et al. "Probiotics: from research to consumer". Digestive and Liver Disease. 2006, vol 38, pp. 248-255.
6. SCHREZENMEIR, J, et al. "Probiotics, prebiotics and symbiotics, definition." American Journal Clinical Nutrition. 2001, vol 73, pp.361-364.
7. LAWRENCE, G, The Health and Medical Use of Aloe vera. Ed. Life Sciences Pres, 1998. pp 80-88.
8. GARCÍA, J, et al. "Preliminary compositional nutrient diagnosis norms in Aloe vera L. grown on calcareous soil in an arid environment". Environmental and Experimental Botan .2006, vol 58, pp. 244-252.
9. CONTRERAS-PINZÓN, M, et al. "Proceso de biotransformación láctica del jugo de Aloe vera". Revista de Ciencia, Tecnología y Educación. 2007, vol 22, pp.35-42.
10. GONZÁLEZ, B, et al. "Aloe vera como sustrato para el crecimiento de L. plantarum y L. casei". Revista Ciencia y Tecnología Alimentaria. 2008, vol 6, pp.152-157.
11. OSSA, J. A, et al. "Evaluación de la melaza de caña como sustrato para el crecimiento de Lactobacillus plantarum". Revista U.D.C.A Actualidad and Divulgación Científica. 2010, vol 13, pp. 97-104.
12. DIRECCIÓN BIOTECNOLOGÍA. ICIDCA Determinación simultánea por CLAR de mono, di sacáridos y glicerol. PNO-B-En-22. Manual de procedimientos en el departamento de Bioquímica, La Habana, Cuba. 2008.
13. DIRECCIÓN BIOTECNOLOGÍA. ICIDCA Determinación por CLAR de ácidos carboxílicos en caldos de fermentación. PNO-B-En-23 Manual de procedimientos en el departamento de Bioquímica, La Habana, Cuba. 2008.
14. DIRECCIÓN BIOTECNOLOGÍA. ICIDCA. Determinación de pH. PNO-B-Eq-29 Manual de procedimientos en el departamento de Bioquímica, La Habana, Cuba. 2008.
15. DIRECCIÓN BIOTECNOLOGÍA. ICIDCA. Determinación del crecimiento microbiano en placa. PNO-M-En-10. Manual de procedimientos en el departamento de Bioquímica. La Habana, Cuba. 2009.
16. MAN, J, et al. "A medium for the cultivation of lactobacilli". Journal of Applied Bacteriology. 1960, vol 23, pp.130-135.
Recibido: Noviembre 2014
Aprobado: Febrero 2015
MSc. Heidy Pérez-LeonardI. Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar. La Habana, Cuba.