Introducción
El dengue es una de las enfermedades más importantes en términos de morbilidad y mortalidad humana.1 Se estima que más de 2000 millones de personas viven en áreas de riesgo; y que cada año ocurren alrededor de 390 millones de infecciones por dengue, de las cuales 96 millones manifiestan algún signo de severidad.2 El agente etiológico de la enfermedad es un complejo viral, formado por los cuatro serotipos del virus del dengue (VDEN 1-4),3 que se transmite al hombre por la picadura de un mosquito infectado con el virus, principalmente del género Stegomya.4 La infección por cualquiera de los cuatro serotipos virales puede ser asintomática, conllevar a la fiebre del dengue u ocasionar una forma más severa de la enfermedad conocida como dengue severo.5
Actualmente solo existe una vacuna licenciada contra este patógeno, Dengvaxia(, desarrollada por la compañía Sanofi Pasteur, la cual está registrada en 20 países.6),(7 Esta vacuna atenuada se obtuvo a través de la sustitución de los genes codificantes para las proteínas prM y E del virus 17D de la Fiebre Amarilla, por las proteínas equivalentes de los virus del dengue.8 Los virus quiméricos resultantes (CYD) han demostrado ser inmunogénicos en humanos en términos de inducción de una respuesta de anticuerpos neutralizantes contra los cuatro serotipos virales; pero a su vez, inducen una baja respuesta inmunitaria celular debido a la carencia de las proteínas de la cápsida y las proteínas no estructurales 3 y 5, las cuales se han identificado como los principales blancos de la respuesta inmunitaria celular contra este patógeno.9),(10 Los recientes estudios de eficacia con Dengvaxia( demuestran que en áreas endémicas donde se ha administrado la vacuna, la taza de hospitalización es mayor en las personas vacunadas, que la observada en personas que no han recibido la misma.11 Debido a estos resultados, la Organización Mundial de la Salud (OMS) recomienda la administración de la vacuna solo a personas mayores de nueve años de edad y en áreas con más de un 80 % de prevalencia de la enfermedad.12
Por lo tanto, el desarrollo de nuevos candidatos vacunales y/o estrategias de inmunización continúan siendo una prioridad para la OMS y la comunidad científica. En estos momentos solo existen otros dos candidatos vacunales en estudios clínicos fase III y que también se basan en virus vivos atenuados.13),(14),(15),(16)(13-16 Estos candidatos han demostrado ser seguros e inmunogénicos en humanos, pero tienen como desventajas fundamentales su reactogenicidad, la posibilidad de reversión a la virulencia y que se requieren generalmente de la administración de dos o tres dosis en esquemas de un año.17 Además, su eficacia protectora aún está por demostrarse. Otros candidatos vacunales se basan en proteínas recombinantes,18),(19),(20),(21 que si bien no presentan estas desventajas por ser antígenos que no se replican, son menos inmunogénicos y requieren del empleo de adyuvantes o su combinación con otros candidatos en esquema de inmunización complementarios, para desarrollar una respuesta inmunitaria eficaz.
Métodos
Animales
Primates no humanos sanos de la especie Macaca mulatta obtenidos de la Isla Reu, perteneciente a Polyvac (Vietnam), mantenidos de acuerdo con las recomendaciones de la guía para el uso y cuidado de los animales de esta institución. Para los procedimientos, los animales fueron anestesiados con ketamina 10 mg/kg de peso corporal antes de las inmunizaciones y extracciones de sangre.
Cepas virales y proteínas recombinantes
Para las inmunizaciones de los animales, ensayos de neutralización y el experimento de reto viral se emplearon las cepas DENV-1 Jamaica (AF42562), DENV-2 SB8553 (FM986658), DENV-3 Nicaragua (FJ882576) y DENV-4 Dominica 814669 (AF326573), producidas en células Vero. La formulación tetravalente de proteínas recombinantes Tetra DIIIC incluyó 100 μg de las proteínas recombinantes DIIIC-1, DIIIC-2, DIIIC-3 y DIIIC-4 agregadas con el oligonucleótido inmunopotenciador (ODN 39M) y adyuvadas en alúmina a 1,44 mg/mL. Como placebo se empleó una formulación con iguales componentes, excepto las proteínas recombinantes. La formulación vacunal de virus vivos atenuados, se desarrollada por el NAID y licenciada a la compañía Vabiotech, incluyó las cepas virales DENV-1 Nauru/74 (WP), DENV-2 Tonga/74, DENV-3 Sleman/78 and DENV-4 Dominica/81.
Resultados y discusión
Este trabajo recoge los resultados de dos estudios realizados en primates no humanos que demuestran la posibilidad de combinar en esquemas de inmunización complementaria dos tipos de candidatos vacunales, la formulación basada en proteínas recombinantes Tetra DIIIC y el candidato de virus vivos atenuados TV005.
En un primer estudio, tres grupos de primates no humanos se inocularon con cepas infectivas de VDEN-1, VDEN-3 o VDEN-4 (103 PFU o 104 PFU), respectivamente y se comprobó la replicación viral a través de la detección de viremia por aislamiento viral en células Vero. Como resultado se detectó viremia en los animales inoculados con cada uno de los virus, con una media de duración de 4,7 días, 3,0 días o 4,0 días, respectivamente. Ocho meses después de esta infección, los animales recibieron una inmunización complementaria con el candidato vacunal cubano tetravalente de proteínas recombinantes Tetra DIIIC. Antes y después de esta dosis a los animales se les realizaron extracciones de sangre para evaluar la respuesta inmunitaria humoral y celular inducida. La respuesta de anticuerpos antivirales se determinó por un ELISA indirecto contra los cuatro serotipos virales. Como resultado, todos los animales en el día 0 (día de la administración de la formulación Tetra DIIIC), mostraron títulos de anticuerpos antivirales contra los cuatro serotipos, independientemente del serotipo viral inoculado previamente. Treinta días después la dosis complementaria con la formulación Tetra DIIIC, se observó un incremento significativo en la respuesta de anticuerpos antivirales (Figura 1).
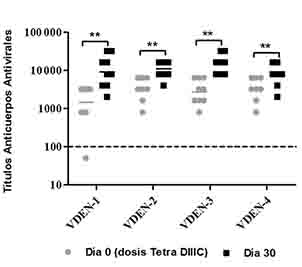
Fig. 1 Respuesta de anticuerpos antivirales. Nueve monos rhesus se inocularon con VDEN-1, VDEN-3 o VDEN-4, y 8 meses después se les administró una dosis de Tetra DIIIC. La respuesta de anticuerpos se determinó por ELISA en los días 0 y 30 tras la dosis de Tetra DIIIC. Los datos representan la media geométrica de los títulos de anticuerpos de dos experimentos independientes. El análisis estadístico se realizó por una prueba de Wilcoxon (**: P ( 0,01). La línea de puntos representa el valor de positividad.
Adicionalmente, la funcionalidad de estos anticuerpos se evaluó a través de un ensayo de neutralización viral in vitro (PRNT) en células Vero contra cada serotipo viral. Igualmente, se observó un incremento en la respuesta de anticuerpos neutralizantes después de administrada la formulación Tetra DIIIC, independientemente del serotipo empleado durante la infección viral (Figura 2). Estos resultados sugieren que la región del DIII incluido en las proteínas recombinantes DIIIC es capaz de llamar a las células B memoria específicas para esta región y que se generan durante la infección viral, lo cual soporta la potencialidad de utilizar este fragmento viral en candidatos vacunales basados en proteínas recombinantes y además sugiere que la formulación Tetra DIIIC podría ser administrada en individuos positivos a VDEN, con la finalidad de incrementar la madurez y afinidad de la respuesta inmunitaria humoral, evitando así posibles complicaciones típicas de las infecciones secundarias o terciarias con un serotipo heterólogo.
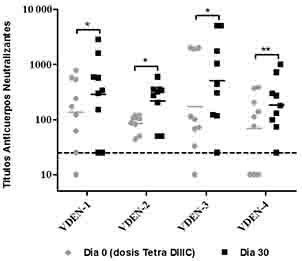
Fig. 2 Respuesta de anticuerpos neutralizantes. Nueve monos rhesus se inocularon con VDEN-1, VDEN-3 o VDEN-4, y 8 meses después se les administró una dosis de Tetra DIIIC. La respuesta de anticuerpos se determinó por PRNT en los 0 días y 30 días tras la dosis de Tetra DIIIC. Los datos representan la media geométrica de los títulos de anticuerpos de dos experimentos independientes. El análisis estadístico se realizó por una prueba de Wilcoxon (*: P ( 0,05, **: P ( 0,01). La línea de puntos representa el valor de positividad.
La capacidad de la inmunización complementaria con la formulación Tetra DIIIC de llamar la respuesta inmunitaria celular previamente generada por la infección viral, se evaluó a través de la medición de los niveles de IFN( en los sobrenadantes de cultivos de las células mononucleares de sangre periférica (PBMC) de los animales, tras la estimulación in vitro con los antígenos virales, el día de la dosis con Tetra DIIIC y 30 días posteriores a la inmunización. De forma similar a lo obtenido en la evaluación de la respuesta inmunitaria humoral, la respuesta inmunitaria celular se incrementó significativamente después de la administración de la formulación Tetra DIIIC (Figura 3). El papel antiviral del IFN( contra los VDEN está ampliamente demostrado y la secreción de esta citocina correlaciona con la protección y el estado subclínico de la enfermedad. Los resultados muestran que la formulación Tetra DIIIC es capaz de reforzar también la inmunidad mediada por células, previamente generada por la infección viral, lo cual avala el empleo de la proteína de la cápsida, identificada como el principal blanco de la respuesta de linfocitos T CD4+ citotóxicos y productores de IFN( que se generan durante una infección natural. La proteína de la cápsida está incluida en las proteínas DIIIC por lo tanto, la formulación Tetra DIIIC contiene epítopos para este subgrupo de células T las cuales son eficientemente llamadas tras la administración de la formulación.

Fig. 3 Respuesta inmunitaria celular. Nueve monos rhesus se inocularon con VDEN-1, VDEN-3 o VDEN-4, y 8 meses después se les administró una dosis de Tetra DIIIC. El día de la dosis y 30 días después, los PBMC de los animales se estimularon in vitro con cada VDEN y se determinaron las concentraciones de IFN( por ELISA. El análisis estadístico se realizó por una prueba de Wilcoxon (*: P ( 0,05, **: P ( 0,01).
En un segundo estudio en primates no humanos, se evaluó la combinación de Tetra DIIIC y la formulación tetravalente de virus vivos atenuados por vía molecular TV005, desarrollada por el Instituto de Salud de los Estados Unidos y licenciada a la compañía vietnamita Vabiotech. Los monos rhesus se dividieron en cuatro grupos, dos grupos se inocularon con las combinaciones de una o dos dosis de Tetra DIIIC y posteriormente una dosis del candidato TV005. Un tercer grupo de animales recibió solamente la formulación TV005 y un cuarto grupo se inoculó con una formulación placebo. Luego de las inmunizaciones, a los animales se les determinó la respuesta inmunitaria humoral inducida, en términos de respuesta de anticuerpos antivirales y neutralizantes. En la figura 4 se muestran los títulos de anticuerpos neutralizantes medidos por PRNT contra cada serotipo viral.

Fig. 4 Respuesta de anticuerpos neutralizantes contra virus dengue en monos inmunizados con la combinación Tetra DIIIC/TV005. Las muestras de sueros obtenidas antes de la inmunización (día 0), un mes después de la última dosis (día 90) y en el momento del reto (día 197) se evaluaron por PRNT en células Vero. (A) Anticuerpos neutralizantes contra VDEN-1. (B) Anticuerpos neutralizantes contra VDEN-2. (C) Anticuerpos neutralizantes contra VDEN-3. (D) Anticuerpos neutralizantes contra VDEN-4. La línea discontinua representa el valor de positividad. Los Día 90 y Día 197 se compararon utilizando la prueba de Wilcoxon (*: p ( 0,05).
Como se observa en la figura 4, en el Día 90 (un mes tras la última dosis con la formulación Tetra DIIIC), solo los animales que recibieron dos dosis de Tetra DIIIC tuvieron respuesta de anticuerpos neutralizantes in vitro a los cuatro serotipos virales. Sin embargo, luego de la administración de la formulación TV005, se observó un refuerzo en la respuesta de anticuerpos neutralizantes a los serotipos 1, 2 y 4 solo en los animales inmunizados con una dosis de Tetra DIIIC. Los animales que se inocularon con dos dosis de Tetra DIIIC incrementaron los títulos de anticuerpos neutralizantes solo para el serotipo 4. Aunque en este ensayo no se encontró una diferencia cuantitativa en los niveles de anticuerpos neutralizantes generados entre los grupos que recibieron la combinación Tetra DIIIC/TV005 y el grupo que recibió una única inmunización con TV005, probablemente la naturaleza diferente de ambos inmunógenos debe tener un efecto en la respuesta inmunitaria humoral inducida, en cuanto a la diversidad de epítopos presentados y la madurez de la afinidad de estos anticuerpos.
Adicionalmente, tras la administración del candidato vacunal TV005, se evaluó en este estudio la capacidad de replicación de las cepas virales atenuadas mediante la titulación en células Vero, en los 10 días posteriores a dicha inoculación. Como resultado, en los animales inoculados con una dosis de TV005 se detectó una viremia de corta duración de 1 día a 2 días para los serotipos VDEN-1, VDEN-2 y VDEN-4, con títulos de 101,6 PFU/mL a 102,1 PFU/mL. Los niveles de viremia obtenidos fueron similares a los reportados en humanos inmunizados con este candidato vacunal. Para el serotipo 3 no se detectó viremia probablemente debido a la prevalencia de inmunidad a este serotipo en los animales inmunizados. En los animales inmunizados con la formulación Tetra DIIIC, con una o dos dosis, interesantemente se observó una reducción significativa en los niveles de replicación de las cepas virales que componen la formulación TV005 (Tabla 1).
Tabla 1 Viremia producida por los virus vivos atenuados de la formulación vacunal TV005 administrada en el día 120
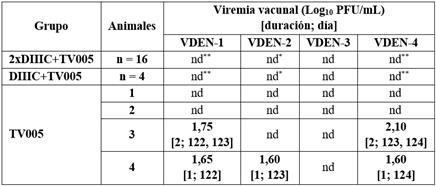
La carga viral se determinó por aislamiento viral en células Vero, empleando anticuerpos específicos contra cada serotipo viral. La viremia se comparó entre los grupos empleando una prueba de Kruskal-Wallis y una prueba a posteriori de Dunn, en dos experimentos independientes (*: p < 0,05; **: p < 0,01). nd: no detectada (< 1).
Finalmente se evaluó la capacidad protectora de la combinación Tetra DIIIC/TV005 administrada en un régimen de inmunización complementario 77 días después de la última inmunización. Para este experimento los grupos 2xDIIIC+TV005 y Placebo se dividieron en cuatro subgrupos y se retó cada uno con un serotipo viral diferente. En el caso de los grupos inmunizados solo con TV005 y una dosis de Tetra DIIIC, debido al bajo número de animales incluidos, solo se realizó el reto viral con el VDEN-2.
Como se muestra en la figura 5 , todos los animales del grupo Placebo mostraron viremias detectables tras el reto viral, con una duración media de 4,5 días, 3,75 días, 2,75 días y 3,0 días, 67,0 días para VDEN-1, VDEN-2, VDEN-3 y VDEN-4, respectivamente (Figura 5).
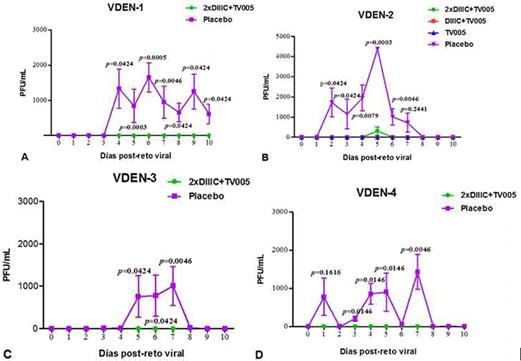
Fig. 5 Viremia tras el reto viral en primates no humanos inmunizados con la combinación Tetra DIIIC/TV005. Los monos se retaron con 103 PFU de cada VDEN, 77 días después de las inmunizaciones (día 197). Las muestras de sueros se colectaron diariamente y la viremia se determinó por aislamiento en células Vero. Los gráficos representan el curso temporal de los títulos virales promedio de cada grupo, inoculado con igual serotipo viral (n = 3 o n = 4). Los datos representan la media ± error estándar de la media de dos experimentos independientes. El límite de detección del ensayo es 10 PFU/mL. Los títulos virales se analizaron por una prueba de Mann-Whitney, comparando los valores de los animales Placebo y animales vacunados.
En los grupos inmunizados con una o dos dosis de Tetra DIIIC y posteriormente con la formulación TV005, aunque la viremia vacunal fue indetectable (Tabla 1), los animales resultaron protegidos tras el reto viral infectivo (Figura 5). Estos resultados nos sugieren que, aunque la inmunización con Tetra DIIIC reduce la capacidad de replicación de los virus que conforman el candidato vacunal atenuado TV005, existe aún un bajo nivel de replicación, indetectable por las técnicas analíticas empleadas, que es suficiente para reforzar la inmunidad previamente generada por la inmunización con la formulación Tetra DIIIC y esta respuesta inmunitaria es capaz de proteger frente al reto viral. Así la reducción de la replicación del candidato atenuado TV005, producida por la administración de la Tetra DIIIC tiene implicaciones clínicas importantes, debido a que esta formulación recombinante puede representar una solución potencial a los problemas de reactogenicidad asociados a los candidatos vacunales vivos atenuados como lo es la formulación TV005. Además, la formulación Tetra DIIIC tiene como ventaja la capacidad de reducir la replicación del candidato TV005, sin afectar la inmunogenicidad del mismo, como se observó en las condiciones experimentales examinadas en este estudio. La combinación Tetra DIIIC/TV005 representa una alternativa atractiva para el desarrollo y evaluación clínica de candidatos vacunales administrados de forma complementaria. Esta combinación podría incrementar el perfil de seguridad de la vacuna TV005 y además potenciar la respuesta inmunitaria con el objetivo de evitar los eventos severos asociados a las infecciones con los VDEN.
Conclusiones
Los resultados presentados en este trabajo constituyen la prueba de concepto de estrategias de inmunización complementarias contra los virus dengue, combinando las proteínas recombinantes del candidato vacunal cubano Tetra DIIIC y virus vivos o una formulación tetravalente de virus vivos atenuados (TV005). La novedad principal de este trabajo, con respecto a trabajos previos presentados a la Academia de Ciencias de Cuba, es la demostración por primera vez, de que la formulación tetravalente Tetra DIIIC es capaz de reforzar la respuesta inmunitaria humoral y celular inducida en primates no humanos por virus infectivos. Además, la formulación Tetra DIIIC también es capaz de generar una respuesta inmunitaria humoral funcional que reduce la viremia producida por un candidato vacunal de virus vivos atenuados, sin afectarse la capacidad protectora de la combinación ante el reto viral. Estos resultados avalan el empleo de la formulación Tetra DIIIC en esquemas de inmunización complementaria, tanto para incrementar la respuesta inmunitaria generada por una infección viral o para limitar la reactogenicidad asociada a la replicación de candidatos vacunales basados en virus vivos atenuados. Ante la expansión global de este patógeno humano y su vector trasmisor, así como la no disponibilidad de una vacuna preventiva, segura y eficaz, o de un tratamiento antiviral para los individuos infectados, la presente estrategia representa una alternativa vacunal muy atractiva.














