Introducción
Desde la primera década del siglo xxi, estudios biomoleculares sobre homeostasis de ácidos biliares describieron la existencia de receptores nucleares y transportadores localizados en hígado, intestino y otros órganos, con los cuales estos interactúan. Por la actividad biológica que ejercen, descrita recientemente en el marco de un nuevo paradigma en la fisiología humana, son considerados como moléculas de señalización y metabolitos del destino final del colesterol hepático, donde se expresa la secuencia continua de sus acciones vinculadas a sus propiedades físico-química (anfipáticas, detergentes, estado hidrofílico o hidrofóbico), su conjugación o no (glicina o taurina), síntesis (primarios o secundarios), transporte (hepático o intestinal), etcétera.1),(2
Evidencias recientes acerca de la amplificación de la respuesta inflamatoria asociada a la acción tóxica de los ácidos biliares motivaron a estudiar los efectos digestivos y extradigestivos que permitieran definir los ácidos biliares como agentes clave en la fisiopatología, útiles en la clínica y en futuras terapéuticas para el control del destino final del colesterol.3) Sus trastornos homeostáticos se asocian a esteatohepatitis no alcohólica, colestasis del embarazo, enfermedad de Crohn, colitis ulcerosa, síndrome de intestino irritable, dislipidemias, diabetes mellitus, insuficiencia cardiaca, arritmias, neumonía intersticial, insuficiencia túbulo renal, Parkinson, Alzheimer, tromboembolismo, etcétera.4),(5
El objetivo de este artículo fue describir las actividades biológicas y tóxicas que sustentarían los elementos fisiopatológicos actuales asociados al descontrol en la homeostasis de los ácidos biliares, que pudieran definir su participación en la amplificación de la respuesta inflamatoria en enfermos de la COVID-19 con comorbilidades diversas, para incluirlos y evaluarlos como posible agente pronóstico de la enfermedad.
Desarrollo
Aspectos metodológicos
El método consistió en una revisión sistemática, crítica y actualizada, en idioma español e inglés, de las evidencias en las bases de datos nacionales e internacionales como PubMed, Medline, Scielo, Lilacs, y Elservier, así como, los estudios de observación, caso control y metanálisis relacionados con este tema, desde el año 2000 hasta el 2020. Se utilizaron como criterios de selección: un índice de materia médica con palabras clave: secuencia, inflamación, colesterol, ácidos biliares, molécula de señalización, y abreviatura AB, relacionados con los mecanismos biomoleculares del proceso inflamatorio en niveles suprafisiológicos.
La novedad de este artículo radica en ofrecer una visión holística de la posible participación de los ácidos biliares en el proceso de desarrollo de la COVID-19. No existen reportes que aborden de forma integrada su participación en ninguno de los estadios de esta enfermedad. De surgir nuevas evidencias científicas de los proyectos que se desarrollen a partir de su determinación sérica o en heces, tendrán el sello de la ciencia cubana al enriquecer el marco teórico-conceptual de la patogenia de la enfermedad. Como resultado, se asentarían las bases en la prevención, manejo del control metabólico y actualización de los protocolos de atención para pacientes con la COVID-19.
Ácidos biliares
Los ácidos biliares son moléculas anfipáticas, detergentes, conjugadas con glicina o taurina, resistente a la precipitación por iones Ca2+, solubles en pH ácido y agua, sintetizados entre 200 y 600 mg diarios en el hígado humano. El 95 % de esta cantidad es absorbido en el intestino y transportado por la circulación enterohepática al hígado, el 5 % se excreta en heces, mientras otra porción muy pequeña es reabsorbida por los túbulos renales y retornan al hígado a través de la circulación sistémica. (6),(7 Los mismos participan en la absorción de lípidos, vitaminas liposolubles, Ca+ y xenobióticos, acciones que justifican su presencia en la luz intestinal para ejercer actividades biológicas como: formar micelas (emulsión de grasas/vitaminas liposolubles), regular la regeneración y proliferación celular, controlar la microbiota intestinal, la motilidad intestinal y el transporte de agua y electrolitos, ejercer un papel pleotrópico (homeostasis del colesterol, lípidos, lipoproteínas, glucosa y energético), excreción de xenobióticos, modular la liberación de enzimas pancreáticas, la permeabilidad intestinal celular, paracelular y la autofagia celular del epitelio intestinal, actuar como sustancias proinflamatorias e inmunorreguladoras del sistema inmunitario innato y antimicrobianas.8),(9) Acciones que le atribuyen el carácter de moléculas de señalización con doble acción: la antinflamatorias o de tolerancia inmunitaria, al actuar en condiciones fisiológicas como ligandos endógenos sobre receptores nucleares con el fin de mantener la integridad, funcionabilidad e interacción de la barrera mucosa intestinal con los otros órganos; y la proinflamatorias o de intolerancia inmunitaria, que en condiciones no fisiológicas relacionadas con el descontrol de su homeostasis, sus niveles suprafisiológicos y la amplificación del proceso inflamatorio.
Sobre los efectos tóxicos de los ácidos biliares, se evidencia la existencia de un trastorno del destino metabólico final del colesterol y de la glucemia que, entre otros, pudiera estar relacionada como expresión de la segunda acción referida, con la amplificación de la respuesta inflamatoria del proceso de la COVID-19, generadora de una liberación descontrolada y persistente de biomarcadores proinflamatorios (citocinas, eucosanoides, metabolitos reactivos de oxígeno y nitroso, componentes de los sistemas del complemento, inmunitario innato y adaptativo) que dañan las membranas plasmáticas de las células epiteliales, los organelos intracelulares (mitocondrias, núcleos, retículo endoplasmático, peroxisomas, etcétera.), al ADN y a los genes y actúan sobre los macrófagos e inducen a la lisis y apoptosis celular.10),(11
Receptores nucleares X
Son una clase de proteínas ubicadas en el interior de las células que transcriben la señal de los ácidos biliares para el control y la regulación de sus actividades biológicas (Figura 1), a través de la expresión de genes específicos y, de ese modo, controlan en el organismo procesos de desarrollo, de homeostasis y del metabolismo.12 Actualmente, los reconocidos son: el receptor farnesoide X (RFX), el del hígado X (RHX), el del pregnano X (RPX) y el de la vitamina D X (RVDX). Los receptores de ácidos biliares acoplados a la proteína G de membrana (RABPG) que son el receptor del factor de crecimiento epidérmico 5 (RFCE5), el de la esfingosina-1-fosfato (RE-1F), el del factor de crecimiento de fibroblasto 19 (RFCF19), el del constitutivo de androstano (RCA).12
Transportadores de ácidos biliares
Los transportadores son proteínas o polipéptidos que regulan la absorción de los ácidos biliares, a nivel del íleon terminal y su entrada al hígado a nivel del espacio sinusoidal en las membranas de las células hepatocitarias. En las membranas de los enterocitos se encuentra el transportador apical de ácidos biliares dependiente de Na+ (TAABNa+), el de la proteína transportadora ileal de unión a ácidos biliares (PTIAB) y el transportador de solutos orgánicos heterodímero α/β (OSTα/β). En el espacio sinusoidal se ubica el polipéptido cotransportador sinusoidal de taurocolato dependiente Na+ (PCSTNa+) y en el citoplasma hepatocitario, el de la bomba expoliadora de sales biliares canalicular (BESBC). Estos, una vez activados intervienen como sensores intracelulares, de la luz intestinal, de la circulación enterohepática y sistémica, y por retroalimentación negativa controla la homeostasis de los ácidos biliares protegiendo así al organismo de su potencial tóxico. Por ello, las nuevas terapéuticas deberán estar dirigidas a su control y prevención.12),(13
Estudios in vitro e in vivo evidencian que los ácidos biliares en condiciones fisiológicas se acoplan a los mencionados receptores y transportadores. De esta manera, inducen cambios conformacionales en la membrana plasmática que facilitan su paso hacia el citoplasma, donde incrementan la actividad del AMPc, contactan con los organelos, generan tolerancia inmunitaria, mantienen la integridad anatomofuncional del sistema hepatointestinal y de la circulación enterohepática, cuyo beneficio trasciende a células plasmáticas, linfocitos T, macrófagos, fibroblastos, y células epiteliales del pulmón, corazón, riñón, y cerebro. Sin embargo, en condiciones no fisiológicas, los ácidos biliares, por adoptar una concentración creciente, sobresaturan los receptores y transportadores, ejercen acción antagonista, y sus efectos tóxicos se suman a la acción de los mediadores de la inflamación liberada, generadora de la intolerancia inmunitaria, con similitud demostrada en los estados inflamatorios de otra diversidad de enfermedades digestivas y extradigestivas. 14),(15
Actividad pleotrópica de los ácidos biliares
El papel protector a nivel hepatointestinal y de otros órganos se justifica por su actividad pleotrópica, expresada a través de sus efectos agonistas sobre los receptores nucleares, que trasmiten su acción señalizadora para la inhibición de la lipogénesis y el incremento de la tasa metabólica hepática.2),(16) Estudios experimentales en ratones sin RFX, diabéticos y tipo salvaje infectados por adenovirus o tratados con el agonista del receptor RFX (GW4064) constituyen la evidencia primaria experimental que demuestra que la expresión y activación de este receptor por aumento sérico de ácidos biliares, del colesterol, los triglicéridos y las lipoproteínas (VDLH, LDH), regulan el metabolismo lipídico hepático (lipogénesis, lipolisis, lipoproteínas) al inducir la expresión de apolipoproteína C-II humana. Al activar la lipoproteína lipasa, disminuyen los niveles séricos de triglicéridos presentes en las lipoproteínas (VLDL y quilomicrones), catalizan la lipólisis, controlan el destino del colesterol, inhiben la unión entre la enzima sulfato hidrolasa hepática y el esterol regulador del factor de transcripción lipogénico 1c (en inglés: SREBP-1c).
También, disminuyen la síntesis de colesterol de novo al inhibir al factor de transcripción (proteína de unión a elementos reguladores de esterol-2 (PUERE-2). Los ácidos biliares, además, inducen la expresión y activación del receptor de activadores de la proliferación peroxisomal α (RAPP-α) que incrementa la oxidación de ácidos grasos.2),(17 Estudios en tejido hepático demuestran que la inducción transcripcional de la enzima carboxilesterasa 1 hepática (CES-1) y la activación de los RFCF19, intervienen en el catabolismo de los triglicéridos, la cetogénesis, la gluconeogénesis y el destino del colesterol, reacciones bioquímicas que reducen los niveles séricos de triglicéridos y de los ácidos biliares y mejoran la sensibilidad a la insulina.18
Acerca de la interacción entre los ácidos biliares y la activación, expresión de los RFCF19 y RFCE5, otros estudios reportan nuevas acciones que enriquecen aún más su diversidad de funciones. Por ejemplo, el RFCF19 suprime la lipogénesis de ácido graso hepático inducida por la insulina, como resultado de la inhibición de la expresión del gen lipogénico (en inglés PGC-1α) al inducir la síntesis de la enzima sulfato hidrolasa hepática en la grasa parda. Mientras, el RFCE5 provoca disminución de la resistencia a la insulina, tras el aumento de la enzima activadora de la hormona tiroidea tipo 2 yodo tironina desyodasa (DIO2) dependiente de AMPc, y la activación de la hormona tiroidea (T3) en la grasa parda y el músculo estriado. Estos mecanismos refuerzan el hecho que su activación por ácidos biliares intervenga en la regulación del gasto energético, efecto valorado como futura terapia de la obesidad y el descontrol metabólico asociado a la disfunción gastrointestinal aguda.19),(20
El 50 % del destino final del colesterol está constituido por ácidos biliares, a la vez que constituye la forma de eliminarse y reciclarse en humanos, a través de su homeostasis, así como por activación de los transportadores intestinales y hepáticos, que los dota de una acción protectora y controladora del metabolismo del colesterol, lipídico y de sí mismo.21
El TAABNa+ absorbe los ácidos biliares desde la luz intestinal, los transporta por el citoplasma del enterocito hasta que se unen al TSO-α/β en su posición basolateral, que los transfiere a través del sistema porta, a la circulación enterohepática hasta llegar al hígado.
En el espacio sinusoidal se unen al PCSTNa+, que los pasa al citoplasma hepatocitario, donde se unen a la BESBC, lo cual favorece la salida de las micelas mixtas (ácidos biliares más colesterol solubilizado más fosfolípidos) y evita su permanencia y contacto con el epitelio colangiolar o canalicular.21
La malabsorción intestinal de ácidos biliares incrementa su eliminación en heces y conlleva a un aumento concomitante de la absorción de colesterol hepático, lo que incrementa su destino hacia la síntesis de ácidos biliares de novo, como ocurre en el síndrome de intestino corto (> 100 cm) y cirugía bariátrica. Ello explica los bajos niveles de colesterol y LDL séricos en estos casos. Se confirma así que la excreción alta de ácidos biliares en heces disminuye el hipercolesterolemia, y justifica la acción farmacológica de las estatinas y el bezafibrato que inhiben a los transportadores ileales. Sin embargo, los glucocorticoides usados en la ileítis, al inhibir a la interleucina -1β (IL-1β) y al factor de necrosis tumoral α (TNFα) y controlar la inflamación, los enterocitos expresan el TAABNa+, lo que incrementa la absorción de ácidos biliares y controla el destino del colesterol.22
Ácidos biliares y metabolismo de la glucosa
Estudios recientes de los receptores RFCE5, RFCF19 y los transportadores evidencian el control homeostático de la glucemia. Al ser activados y expresados por los ácidos biliares séricos o luminales, inhiben la gluconeogénesis, estimulan la glucogenólisis y glucogénesis hepática, controlan la absorción intestinal y las acciones de la glucosa sobre las hormonas del tejido adiposo (leptina). También actúan sobre las enzimas pancreáticas que regulan la secreción de insulina y la digestión (lipasa, amilasa, tripsina, etc.), las cuales favorecen o no los estados de euglucemia sérica, de tolerancia a la glucosa y la sensibilidad a la insulina. Estos efectos son atribuidos a la inhibición transcripcional de genes gluconeogénicos que codifican las enzimas fosfoenolpiruvato carboxicinasa (FFPCX) y la glucosa 6-fosfatasa ante niveles altos de ácidos biliares intrahepáticos. Por su parte, la elevación de glucosa intrahepática induce la activación y expresión directa del RFX hepático, al estimular la transcripción, producción y secreción de insulina por las células β pancreáticas, con lo cual ejerce así su autocontrol. Sin embargo, estudios del efecto de los ácidos biliares sobre los RFX intestinales en ratones alimentados con dietas ricas en grasa son controvertidos.
Unos investigadores notifican que su activación con la Fexaramina (agonista), al disminuir la síntesis de los ácidos biliares mejora la sensibilidad a la insulina y reduce la gluconeogénesis hepática. Otros reportan que la inhibición de la síntesis de los ácidos biliares mantiene la homeostasis de glucosa al originar efectos similares, incluida la tolerancia a la glucosa. Por otra parte, los ácidos biliares en la luz intestinal en períodos diurnos o postprandial, estimulan e incrementan las concentraciones plasmáticas del RFCF19 que transcribe su señal y regula el metabolismo de la glucosa hepática, efecto euglucémico similar a la insulina. Además, los ácidos biliares al estimular las células L enteroendocrinas del íleon y el colon incrementan la excreción del péptido glucagón-1 (GLP-1) con acción hipoglucemiante al incrementar la secreción de insulina e inhibir la de glucagón por un mecanismo dependiente de AMPc/Ca+. De igual forma retardan el tránsito gastrointestinal, efecto que se agudiza ante niveles suprafisiológicos de los ácidos biliares en la disfunción gastrointestinal.23
Otro de los mecanismos que explica el control metabólico de la glucosa por los ácidos biliares es su concentración en la circulación enterohepática (en la etapa de posabsorción intestinal) lo cual depende de transportadores ileales. En las enfermedades inflamatorias, al estar disminuida la actividad y expresión de estos, la absorción luminal de glucosa esta disminuida; este efecto es similar al de trastornos metabólicos como diabetes, esteatohepatitis no alcohólica, obesidad, enfermedades cardiovasculares, renales y neuropsiquiátricas, donde sus niveles se encuentran altos.24
El control sobre el metabolismo de los ácidos grasos y la glucosa, justifican la intervención de los ácidos biliares en el metabolismo energético, hecho evidenciados en estudios de ratones deficientes de leptina y con diabetes inducida por dieta, donde la expresión y activación del RFCF19 por los ácidos biliares incrementa la tasa metabólica y reducen la adiposidad al - inducir el receptor de leptina hepático, - reducir la expresión de acetil-CoA carboxilasa 2, e incrementar la oxidación de ácidos grasos.25
Los cambios metabólicos posayuno del catabolismo al anabolismo, se subordinan a una regulación compleja de hormonas pancreáticas, incretinas (GLP-1), adipocinas, y a las acciones de los RXF y RFCF19 por los ácidos biliares, que justifican su incremento pospandrial intrahepáticos y séricos, influyendo en el metabolismo energético.26
Ácidos biliares y absorción de calcio y fosforo
El control de la absorción de iones de calcio (Ca) y fosforo (P) está determinado de una parte por la activación del RVDX a nivel del duodeno por los ácidos biliares, que propicia la movilización al hueso, de estos iones, y de la otra parte por el incremento de la permeabilidad intestinal celular y paracelular que por sí mismo realizan los ácidos biliares. De esta forma, se explica la hipercalcemia en la disfunción gastrointestinal aguda asociada a niveles suprafisiológicos de los ácidos biliares en la luz intestinal.12
Ácidos biliares y barrera mucosa epitelial
La barrera mucosa epitelial consiste en un conjunto de células epiteliales del intestino, unidas entre sí y recubiertas por mucina e IgAs, que desempeñan diversas funciones como absorción, secreción e inmunitarias, pues expresan en sus membranas moléculas de histocompatibilidad tipo II (MHC-II), secretan citocinas y actúan como moléculas presentadoras de antígenos. El mantenimiento de su función depende de la influencia que ejercen sobre ella los ácidos biliares.2),(3
En condiciones inflamatorias, la acción detergente y los niveles suprafisiológicos de los ácidos biliares en la luz intestinal, se suman a la amplificación de la respuesta inflamatoria, al fallo de la tolerancia inmunitaria y la disbiosis. Estas acciones de los ácidos biliares mencionadas favorecen la disfunción gastrointestinal aguda, la translocación bacteriana, la sepsis, el fallo multiórgano y la muerte. En estudios de ratas con colestasis obstructiva, sobrecrecimiento y translocación bacteriana tratadas con ácido quenodesoxicólico se demostró que al actuar como agonista del RFX hepático e intestinal, disminuía significativamente la magnitud de dichos daños, al inhibirse la síntesis hepática e incrementar la absorción intestinal de los ácidos biliares.27),(28 De igual forma, se demostró la expresión de genes (angiogenina, anhidrasa carbónica 12, óxido nítrico y IL-18) con efectos antibacterianos. Efectos similares han sido observados en ratones deficientes de RFX con idénticos daños, tratados con agonistas del RFX (ácido obeticólico y ácido ursodesoxicólico: AUDC) cuyas acciones se expresan en la restauración de la permeabilidad intestinal, del control de la tolerancia inmunitaria, del efecto antibacteriano, del mantenimiento de la microbiota intestinal y del incremento de la expresión de las proteínas de unión estrecha (claudina-1 y occludina), dado que estos estimulan la síntesis de ácidos biliares primarios, hidrofílicos, conjugados con taurina, los cuales preservan la integridad y funcionalidad de la barrera mucosa epitelial.29
Ácidos biliares y sistema inmunitario
El efecto inmunitario de los ácidos biliares primarios, hidrofílicos y conjugados con taurina se expresa en condiciones fisiológicas al lograr su control homeostático que les permite ejercer su acción de tolerancia inmunitaria. El ácido quenodesoxicólico, al activar los receptores RFX hepático e intestinal, los situados en las células del sistema inmunitario (T CD4, T CD8 ), y los de los monocitos (CD14), inhiben la liberación de citocinas (IL-1β, IL-6 y el TNFα) en los niveles de ARNm y proteínas, estimulada por los liposacáridos, que expresan como efecto el de tolerancia inmunitaria.30) Este fenómeno se reafirma con el uso del ácido obeticólico y el AUDC que al ser agonistas del RFX, inhibe la síntesis de ácidos biliares y su señalización transmembrana en los polimorfonucleares y los monocitos CD14+. De este modo, atenúan el proceso inflamatorio restaurando la tolerancia inmunitaria y la microbiota intestinal.31
Además, el AUDC es considerado un hepatoprotector importante con fuertes propiedades antioxidantes: por sus acciones antiinflamatorias e inmunomoduladoras, su probable eficacia para suprimir el síndrome de tormenta de citocina, e inferirse sus efectos terapéuticos prometedores en la neumonía y el edema pulmonar en los casos de la COVID-19, ha motivado a investigadores de China, Qatar, Arabia Saudita, Yemen y de EE. UU., a incluirlo en los protocolos de tratamiento para pacientes de esta enfermedad.32 Estos efectos beneficiosos se atribuyen a la modulación eficaz de las citocinas derivadas de Th-2, la inhibición de la apoptosis de las células epiteliales de las vías respiratorias, al incremento de ácidos biliares hidrofílicos, y estimula la depuración del líquido alveolar en el edema pulmonar inducido por lipopolisacáridos a través de la vía ALX / AMPc / PI3K, que mejora el síndrome de dificultad respiratoria aguda.33),(34
Ácidos biliares y autofagia celular
La autofagia es una vía de degradación lisosomal en la que la célula autodigiere sus propios componentes para proporcionar nutrientes en condiciones adversas. También es una oportunidad para librarse de orgánulos dañados, proteínas mal plegadas o microorganismos invadidos. La autofagia hepática en condiciones fisiológicas mantiene la integridad del hígado y de sus funciones metabólicas, no así cuando existen hepatopatías crónicas asociadas a desordenes metabólicos como por ejemplo en la esteatohepatitis alcohólicas y no alcohólicas, entre otras.35),(36
Este proceso se ha comenzado a relacionar con los efectos tóxicos de los ácidos biliares hidrofóbicos y conjugados con glicina. Diversos estudios reportan, que niveles suprafisiológicos de ácidos biliares intrahepatocitarios, al activar el RFX, inhiben la actividad transcripcional del gen de autofagia celular. Estos estudios enfatizan la acción protectora de este receptor para los colangiocitos. Los supraniveles de ácidos biliares originan un descontrol de la autofagia, al impedir una regeneración colangiolar adecuada según la etapa de la colestasis obstructiva. La etapa temprana de la colestasis se denomina “colestofagia” y la tardía o prolongada “colestopagia”. Estos conceptos contextualizan la fisiopatología de la colestasis, de la lesión del epitelio biliar y de las respuestas adaptativas de los hepatocitos a la colestasis.37) En este contexto, han comenzado a surgir nuevos enfoques terapéuticos para la colestasis que incluyen al AUDC y al ácido obetalónico, por sus efectos antiinflamatorios e inmunomoduladores.38),(39),(40
Estudios en ratones con daños hepatocitarios por ligadura de las vías biliares con bloqueo del flujo biliar al intestino, puso de manifiesto la interrupción de las acciones de los ácidos biliares sobre los receptores y transportadores, que, al ser tratado con agonistas, los daños desaparecieron. Demostrándose así el efecto hepatoprotector de estos receptores al controlar la homeostasis de los ácidos biliares y la expresión de genes de la enzima óxido nítrico sintetasa (ONS) intestinal con actividades antibacterianas. De esta forma, se potencializa la biotransformación de los ácidos biliares primarios a secundarios por la microbiota colónica y su excreción en heces. Se ha evidenciado en pacientes cirróticos quienes presentan un descontrol de la síntesis de ácidos biliares y de la microbiota intestinal, al ser tratados con ácidos ursodesoxicólico, disminuyen el sobrecrecimiento bacteriano, lo cual promueven un nuevo enfoque fisiopatológico en enfermedades metabólicas y disbiosis.41),(42
Ácidos biliares, motilidad, transporte de agua y electrolitos
Diversos estudios evidencian que niveles suprafisiológicos de ácidos biliares, al acoplarse a los receptores de proteína G, ubicados en el músculo liso, sistema nervioso entérico y en las células L (en el íleon terminal), ejercen una acción antagonista: retardan el vaciamiento gástrico, reducen el tiempo de tránsito duodenal e incrementan el del colónico. Esto se expresa en la clínica como disfunción gastrointestinal aguda asociada a hipomotilidad intestinal, disbiosis y biotransformación exagerada a ácidos biliares secundarios, los cuales deterioran la integridad de la barrera mucosa intestinal e inducen la translocación bacteriana, la sepsis, el fallo multiórgano y la muerte, evidenciándose que los ácidos biliares secundarios son punto clave en la fisiopatología de enfermedades digestivas, extradigestivas y metabólicas graves y críticas en humanos. 43),(44),(45
Estudios del RFCE5 ubicado en las células L demuestran que, al ser activados por los ácidos biliares, estimulan la liberación del péptido YY. Este péptido controla la función de la válvula ileocecal, origina el retardo e inhibición del vaciado y la secreción gástrico-pancreática, y la hipomotilidad intestinal. Por otra parte, su activación unida a la hipersecreción de 5-hidroxitriptamina (5-HT) y del péptido gen de la calcitonina en colon, en colecistectomizados, bariátricos y otras derivaciones digestivas, explican la hipermotilidad y la malabsorción de agua y electrolitos, expresados en diarreas secretoras: postprandiales, amarillas, verdosas, fétidas, explosivas, espumosas y con quemazón perianal que sufren estos pacientes.15
Reportes actuales desde el año 2020 a principios de 2021
Reportes actuales de la pandemia SARS-CoV-2, sugieren al síndrome metabólico como probable denominador común en las comorbilidades y la mortalidad de los pacientes con la COVID-19.46),(47),(48),(49 Estudios recientes han comenzado a anunciar la posible relación entre la infección por el SARS-CoV-2 y el daño canalicular biliar, cuyas funciones esenciales consisten en: mantener la barrera del epitelio colangiolar, la homeostasis, el transporte, la recolección y la excreción de los ácidos biliares primarios secretados.50 En este sentido, se reporta, que la infección por SARS-CoV-2 anula la expresión de Claudina 1 (CLDN1) de la unión de los colangiocitos, originando ruptura del epitelio ductal y, por ende, una pérdida de su función de barrera, a lo cual se unen los daños de los organelos intracelulares (mitocondria, retículo endoplásmico, núcleo, etcétera) de células infectadas con SARS-CoV-2.51 Más importante aún, es el reporte de una disminución significativa de la expresión de dos genes transportadores de ácidos biliares, el soluto portador de la familia 10 miembro 2 (SLC10A2) y el de fibrosis quística regulador de conductancia transmembrana (CFTR), en la posinfección por SARS-CoV-2. Los datos indican que la infección por SARS-CoV-2 al originar estos daños canaliculares en pacientes con la COVID-19, podrían favorecer la acumulación de ácidos biliares sistémicos (Figura 2).52),(53
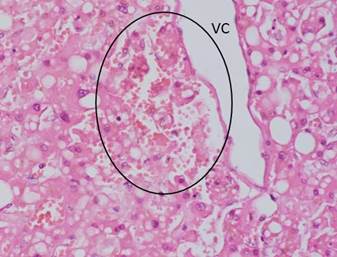
Fig. 2 Corte histológico de hígado de paciente fallecido con COVID-19 donde se observa destrucción del parénquima hepático alrededor de la vena centro lobulillar, zona donde se inician los canalículos biliares (no se observan). Nótese la abundante cantidad de vacuolas grasas grandes y pequeñas en los hepatocitos, manifestación de severo trastorno metabólico previo y reciente. Leyenda: VC, vena centrolobulillar. (HE, 40X)
Conclusiones
Se pudiera sugerir como hipótesis que los ácidos biliares constituyen un eje que transversaliza el proceso de la COVID-19 y participan activamente en cada uno de los estadios, por lo cual pudieran ser considerados como agente pronóstico. Bajo esta premisa se justificaría la necesidad de realizar estudios clínicos que permitan determinar y corroborar que los niveles de ácidos biliares en suero se encuentran altos en pacientes con la COVID-19 y quizás pudieran erigirse como agentes pronóstico de esta enfermedad.















