INTRODUCCIÓN
Las garrapatas son artrópodos ectoparásitos que causan daños directos a los organismos que parasitan, sin embargo, su capacidad como vectores de muchos agentes patógenos que producen enfermedades en los hospederos es el principal perjuicio que ocasionan tanto a la ganadería como a los animales de compañía y al hombre. 1 Hasta finales de la década de 1980, el control de garrapatas se basaba fundamentalmente en el uso de productos químicos. 2 Sin embargo, el uso intensivo e indiscriminado de todos los tipos de químicos ha conducido al desarrollo de cepas de garrapatas multi-resistentes en gran cantidad de países. 3-7
La idea de que las vacunas son potencialmente seguras, más baratas y más eficaces como profilácticas que los acaricidas se basa principalmente en nuestra experiencia con las vacunas antimicrobianas. 8 Sin embargo, la complejidad bioquímica de los parásitos como las garrapatas, el alto número de diferentes especies que existen y su capacidad para parasitar todas las clases de vertebrados terrestres, las múltiples etapas en su ciclo de vida y su contacto con el sistema inmunológico del huésped sólo durante su período de alimentación, determinan que el control de estos ectoparásitos mediante inmunizaciones es una tarea desafiante para los desarrolladores de vacunas contra las garrapatas. 9
Las propiedades inmunogénicas de la proteína P0 han sido demostradas en experimentos donde fue usada como antígeno recombinante contra los microorganismos Toxoplasma gondii, Neospora caninum, Trypanosoma cruzi, Leishmania infantum y varias especies de Babesia y Plasmodium.10-15 Los experimentos realizados con ARNi específico en los cuales se silenció la expresión del gen de P0 en la garrapata Haemaphysalis longicornis mostraron una disminución considerable en la ganancia de peso de estos parásitos y una mortalidad del 96 %. 16 Sin embargo, la identidad de secuencia entre la proteína P0 de garrapatas y sus hospederos es mayor del 80 % 17 y esto puede resultar en la inducción de tolerancia o en la generación de auto-anticuerpos en el organismo hospedero inmunizado. Para evadir este inconveniente, un péptido de 20 aminoácidos localizado cerca de la región C terminal de la proteína P0 de garrapatas del género Rhipicephalus (de a.a. 282 al 301) (pP0) mostrando la más baja identidad de secuencia con la proteína ortóloga en mamíferos y una identidad de secuencia mayor del 85 % entre especies de garrapatas se seleccionó como antígeno. Sin embargo, los péptidos son generalmente malos inmunógenos y son rápidamente aclarados del torrente sanguíneo. Es por ello que, en vacunas, se usan conjugados a proteínas altamente immunogénicas que mejoran su presentación al sistema inmune del individuo vacunado. Considerando las propiedades adyuvantes descritas para las nano partículas de Bm86 producidas por la levadura Pichia pastoris en el CIGB, 18 esta proteína pudiera ser adecuada para la presentación eficiente del pP0 al sistema inmune del hospedero. El objetivo de este trabajo fue la caracterización molecular detallada del conjugado químico entre el péptido de P0 y la proteína Bm86 y la evaluación de su eficacia contra diferentes especies de garrapatas mediante experimentos de inmunización de diferentes mamíferos hospederos y reto con diferentes especies de garrapatas de interés económico o de salud pública.
MÉTODOS
Obtención del conjugado
El péptido de 20 aminoácidos correspondiente a los aminoácidos 282-301 de la proteína ribosomal acídica P0 de garrapatas (NH2-AAGGGAAAAKPEESKKEEAK-CONH2) (pP0) sintetizado químicamente usando el método Fmoc 19 con un residuo de Cys adicionado a su extremo N-terminal se conjugó a la proteína Bm86 producida por fermentación de un clon recombinante de levadura Pichia pastoris y purificada según la PP0 establecida para la obtención de la IFA de la vacuna Gavac TM. El N-β (maleimidopropyloxy) succinimide ester (BMPS) se utiliza como agente de enlace bi-funcional entre los grupos aminos primarios (residuos de lisina y el grupo amino terminal) de la proteína Bm86 y el grupo tiol del residuo de Cys intencionalmente adicionado al extremo N-terminal del pP0.
Análisis SDS-PAGE y estimación de la carga útil de pP0 del conjugado pP0-Bm86
El conjugado pP0-Bm86, la proteína portadora Bm86 y los productos desglicosilados de estas proteínas se analizaron usando SDS-PAGE al 8 % en condiciones reductoras. El gel se tiñó con azul de Coomassie R-250 (Sigma, EE.UU.). Se utilizó un kit de peso molecular de amplio rango (Bio-Rad; EE. UU.) para estimar las masas moleculares de las proteínas. La carga útil del pP0 se determinó mediante el software Gel Analyzer disponible en http://www.gelanalyzer.com/ calculando la diferencia de masa entre la Bm86 desglicosilada y el centroide de la banda correspondiente al conjugado pP0-Bm86 desglicosilado y dividido por la masa molecular del pP0 (2 kDa).
Análisis por Cromatografía líquida- espectrometría de masas en tándem (LC-MS/MS)
Los péptidos proteolíticos resultantes de las digestiones del conjugado pP0-Bm86 con tripsina (Promega, EE. UU.) y la proteasa V8 de Staphylococcus aureus (Sigma, USA) se separaron en una columna analítica de fase inversa con un flujo constante de 400 nL/min mezclando el tampón A (solución de FA al 0,1 %) y el tampón B (90 % de ACN/0,1 % de FA) en un gradiente lineal del 3 % al 70 % de B. Los espectros de masas de los péptidos eluidos se adquirieron de 300 a 2000 Da a 2 GHz. El espectrómetro de masas se calibró usando una mezcla de polietilenglicoles (G1969-85000, Agilent Technologies). Las corridas de LC-MS/MS se exportaron como archivos *.mgf utilizando el software de análisis cualitativo MassHunter (versión 5.0) de Agilent Technologies y se cargaron en cuatro software utilizados para la identificación de péptidos enlazados: Peaks, 20 pLink, 21,22 StavroX 23 y Protein Prospector .24,25 La identificación de los sitios de conjugación se basó en la asignación de los espectros MS/MS a péptidos proteolíticos de Bm86 y pP0 unidos a través del BMPS, conocidos como péptidos enlazados intermoleculares de tipo II. 26
Experimentos de inmunización y reto
Todos los procedimientos que involucraron animales se llevaron a cabo según la guía para el cuidado y empleo de animales de laboratorio 27 y los protocolos de ensayo se aprobaron por los Comités de Ética de las instituciones donde se realizaron los experimentos. En todos los ensayos, se utilizó el conjugado pP0-KLH como control positivo y animales inyectados con PBS como controles negativos. Los conjugados se formularon en preparaciones oleosas utilizando Montanide ISA 50 (SEPPIC, Francia) en una proporción 60/40 de inmunógeno/adyuvante. Las inmunizaciones se realizaron los días 0; 21 y 36 con 500 ug/animal de los conjugados. En el caso de los bovinos se utilizó la vía intramuscular profunda en la tabla del cuello y en el caso de conejos y perros la vía subcutánea. Las muestras de suero de los animales en cada experimento se utilizaron para medir la respuesta específica de IgG totales contra los antígenos mediante un ELISA indirecto. 28,29
Quince días después del último refuerzo de la vacuna se retaron los animales con garrapatas en condiciones de infestación controlada en cámaras elaboradas artesanalmente y pegadas al dorso afeitado de los animales. Los bovinos se retaron con 3000 larvas de Rhipicephalus microplus, los perros con los 3 estadios de Rhipicephalus sanguineus (300 ± 25 larvas, 150 ± 10 ninfas y 50 adultos: 30 hembras y 20 machos) y los conejos con 1900 ± 115 larvas de Amblyomma mixtum en un ensayo y con 40 adultos (20 machos y 20 hembras) de Ixodes ricinus en el otro. La eficacia de los conjugados se calculó en porcentaje como E = 100x (1- [RL x VL x RN x VN x RA x PA x FE]) donde RL y VL representan los efectos sobre el rendimiento de larvas y la mortalidad en el proceso de muda en comparación con el grupo control, respectivamente. RN y VN son los efectos de cada inmunógeno sobre el rendimiento y la mortalidad de las ninfas en el proceso de muda en comparación con el grupo control, respectivamente. RA y PA son los efectos de cada inmunógeno en la recuperación y ovoposición de las hembras en comparación con el grupo control, respectivamente. FE es el efecto de cada inmunógeno sobre la fertilidad de los huevos. Se calculó como la relación entre los porcentajes de eclosión de los huevos puestos por garrapatas alimentadas sobre animales vacunados en comparación con el grupo control. En el caso de R. microplus que es una especie de un hospedero se usaron sólo los parámetros relacionados a las hembras y en el caso de las de 3 hospederos en que no se usaron los 3 estadios se tuvieron en cuenta sólo los parámetros correspondientes al estadio utilizado. Los parámetros de los grupos vacunados que no fueron estadísticamente diferentes en comparación con los del grupo control no se incluyeron en el cálculo de la eficacia. Se realizaron además estudios de histología y ultraestructura de los ovarios de garrapatas R.sanguineus alimentadas sobre los perros inmunizados.
Experimento de microinyección de RNAi en garrapatas Ixodes ricinus
Se microinyectaron 30 garrapatas hembras de I. ricinus con aproximadamente 0,5 µL(5x1012 moléculas/uL) de ARN de doble cadena de P0 (P0-dsRNA) y otras 30 con la cantidad equivalente de ARN de doble cadena correspondiente a la secuencia del gen codificante de la proteína verde fluorescente (GFP-dsRNA) utilizado como control no relacionado. Un día después de la microinyección las garrapatas se alimentaron sobre curieles durante 10 días y luego se determinó el peso de las hembras recogidas y su ovoposición.
RESULTADOS Y DISCUSIÓN
El conjugado pP0-Bm86 desglicosilado migra en el SDS-PAGE como una banda difusa de 34 kDa de ancho que varía de 93 kDa a 127 kDa. De acuerdo con la diferencia de masa observada de 2 kDa a 36 kDa respecto a la proteína desglicosilada Bm86 (91kDa) se estimó que la carga útil oscila entre 1 y 18 moléculas de pP0 por cada molécula de Bm86 (figura 1). Este resultado demuestra que el conjugado pP0-Bm86 es muy heterogéneo en tamaño, probablemente porque en la conjugación química el exceso de BMPS reacciona con todos los residuos de lisina accesibles en la superficie de la proteína con la subsecuente unión extensiva del pP0 que también se agrega en un exceso molar en el paso final de la reacción. 30 En ensayo de Western Blot el conjugado pP0-Bm86 es reconocido por un suero policlonal obtenido contra el conjugado pP0-KLH (figura 1).
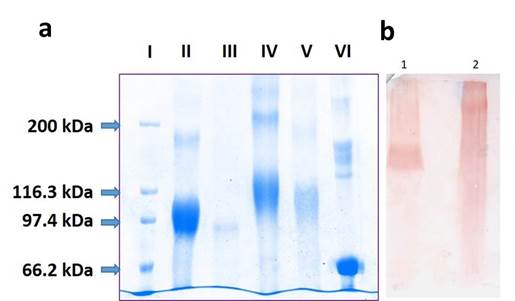
Fig. 1 A) Análisis SDS-PAGE (8 %) en condiciones reductoras. I) marcador de peso molecular de amplio rango; II) proteína Bm86 N-glicosilada expresada por el clon de levadura de P. pastoris recombinante, IFA de GavacTM; III) proteína Bm86 desglicosilada con PNGasa F; IV) conjugado pP0-Bm86; V) conjugado pP0-Bm86 desglicosilado con PNGasa F; VI) Proteína estándar de peso molecular 67 kDa (BSA). B) Western Blot utilizando anticuerpo policlonal generado en conejos inmunizados con el conjugado químico pP0-KLH como anticuerpo primario. Se realizó la transferencia a partir de un SDS-PAGE al 8 % en condiciones reductoras. 1) Quimera pP0-Bm86 producida en P. pastoris y 2) Conjugado químico pP0-Bm86
El análisis de espectrometría de masas (LC-MS/MS) encontró 49 residuos de lisina de los 54 presentes en la secuencia de la proteína Bm86 y su extremo N-terminal conjugados al pP0. Sin embargo, también se observó que 46 de los 49 residuos de lisina conjugados también se encontraron sin modificar y se detectaron como péptidos lineales, lo que sugiere su modificación parcial después de la reacción de conjugación. Esta conjugación parcial de los residuos de lisina de la proteína Bm86 contribuye a la heterogeneidad de tamaño mostrada por el conjugado pP0-Bm86 en el análisis SDS-PAGE. Sin embargo, la relación cuantitativa entre los residuos de lisina libre y conjugada para cada sitio individual no se ha determinado. Solo 3 residuos de lisina en la secuencia de la proteína Bm86 se detectaron como completamente conjugados (K102, K302 y K600). No se encontró evidencia de conjugación en los residuos de Lys (K) ubicados en las posiciones 180, 431, 484, 495 y 505.
El análisis de LC-MS/MS también permitió la verificación del 91 % de la secuencia de la proteína Bm86 superponiendo la información proporcionada por todas las digestiones proteolíticas, incluida la identificación de péptidos lineales y enlazados. Ninguna de las 5255 proteínas incluidas en la base de datos de secuencias de la célula huésped de P. pastoris se identificó en el conjugado pP0-Bm86, lo que confirma la pureza de la proteína Bm86 (Lot: 14.1302-4) utilizada en el proceso de conjugación.
Las modificaciones post-traducción (PTM) encontradas en el conjugado pP0-Bm86 fueron características de las proteínas expresadas en levaduras 31 y por tanto no deberían asociarse a la reacción química usada para obtener el conjugado. La N-glicosilación fue la PTM más abundante encontrada con residuos heterogéneos de manosa desde Man8 a Man12, donde los más abundantes fueron Man8 y Man9.32 La secuencia de aminoácidos de la proteína Bm86 tiene cuatro sitios potenciales de N-glicosilación en los residuos de Asn 122, 163, 329 y 363. En este análisis se observaron también péptidos con un incremento de su masa molecular en 162 Da que tentativamente pudieran deberse a la presencia de O-glicopéptidos porque esta es una PTM también encontrada con frecuencia en las proteínas heterólogas expresadas en levaduras. 32,33 Sin embargo, la asignación certera de esta O-glicosilación basada en las evidencias experimentales del análisis de MS/MS no fue posible debido a la inestabilidad de esta PTM en las condiciones utilizadas.
En todos los experimentos de inmunización realizados se obtuvieron títulos de anticuerpos IgG totales específicos contra el pP0 presentes en el suero de los animales inmunizados. También se observaron títulos de anticuerpos contra las proteínas transportadoras usadas para la conjugación del péptido. En ningún caso se observaron diferencias estadísticamente significativas entre los títulos contra el péptido generados por el conjugado pP0-Bm86 comparados a los obtenidos con el conjugado pP0-KLH. Las tablas 1 y 2 resumen los efectos de estas respuestas inmunes en perros y bovinos contra garrapatas R. sanguineus y R. microplus, respectivamente. Se obtuvieron reducciones significativas, en comparación con el grupo control, en los rendimientos de ninfas y adultos y también en la mortalidad durante el proceso de muda de las ninfas de las garrapatas R. sanguineus. Como se describió previamente, 17 una gran cantidad de hembras ingurgitadas de animales vacunados con pP0 no fueron capaces de poner huevos y murieron pocos días después de ser recolectadas. Esta mortalidad se incluyó en el parámetro de rendimiento de las hembras, que resultó ser estadísticamente diferente en los grupos vacunados en comparación con el grupo control. También hubo diferencias estadísticamente significativas en el porcentaje de huevos eclosionados en el grupo inmunizado con conjugados de pP0 en comparación con el grupo control. La eficacia global calculada para los inmunógenos pP0-KLH y pP0-Bm86 fue del 95 % y 86 %, respectivamente.
Tabla 1 Efecto de la inmunización de perros con los conjugados del pP0 sobre la infestación de garrapatas R. sanguineus
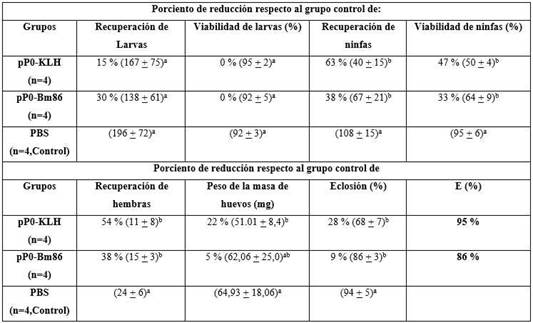
La E (eficacia) se calculó como 100 × [1 - (RL × VL × RN × VN × RA × PA × FE)] donde RL, VL, RN, VN, RA, PA y FE representan el efecto del inmunógeno sobre la producción de larvas, viabilidad de larvas, rendimiento de ninfas, viabilidad de ninfas, rendimiento de hembras, peso de la masa de huevos y fertilidad de los huevos, respectivamente. En el cálculo sólo se incluyeron los parámetros que mostraron diferencias estadísticamente significativas en comparación con el grupo control. Entre paréntesis, se muestra el promedio ± DE de cada parámetro registrado. Diferentes letras a y b como superíndices significan grupos estadísticamente diferentes (ANOVA, prueba múltiple de Bonferroni, p < 0,05).
En el experimento con bovinos, se obtuvo una reducción significativa en el rendimiento de hembras R. microplus alimentadas sobre bovinos inmunizados con conjugados de pP0 en comparación con el grupo control (tabla 2). Un gran número de ellas no pusieron huevos y murieron pocos días después del desprendimiento o pusieron significativamente menos huevos que las alimentadas sobre bovinos del grupo control (figura 2A). La muerte durante la ovoposición se incluyó dentro del parámetro de rendimiento de las hembras. También se encontraron diferencias estadísticamente significativas en la eclosión de los huevos cuando se compararon los grupos vacunados con el grupo control. La eficacia global calculada para los conjugados pP0-KLH y pP0-Bm86 contra garrapatas R. microplus fue del 89 % y 84 %, respectivamente. Se encontró tanto en el experimento en perros como en el de bovinos que la eficacia estaba positivamente correlacionada con los títulos de anticuerpos específicos contra el pP0 (Coeficiente de Pearson r > 0,99).
Tabla 2 Efecto de la inmunización de bovinos con conjugados del pP0 sobre la infestación de garrapatas R. microplus
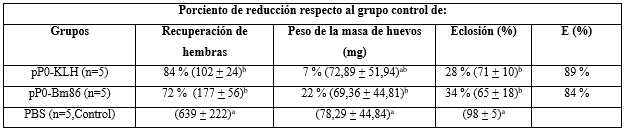
La E (eficacia) se calculó como 100 × [1 - (RA × PA × FE)] donde RA, PA y FE representan el efecto del inmunógeno sobre el rendimiento de las hembras, el peso de la masa del huevo y la fertilidad de los huevos, respectivamente. Sólo los parámetros que muestran diferencias estadísticamente significativas en comparación con el grupo control se incluyeron en el cálculo de E. Entre paréntesis, se muestra el promedio ± DE de cada parámetro registrado. Las letras a y b como superíndices significan grupos estadísticamente diferentes (ANOVA, prueba múltiple de Bonferroni, P< 0,05).
Los cambios morfo-histológicos observados en los ovarios de las hembras R. sanguineus alimentadas sobre los perros inmunizados podrían explicar los efectos sobre la eclosión de los huevos (figura 2C). Los ovocitos pre-vitelogénicos de hembras alimentadas sobre ambos grupos inmunizados con conjugados de pP0 mostraron formas irregulares y también vacuolización citoplasmática, lo que es indicativo de muerte celular. Además, se observaron gran cantidad de ovocitos con una reducción significativa en la deposición de gránulos de vitelo en relación al grupo control. La microscopía electrónica de barrido (SEM) verificó que los ovarios de hembras alimentadas en perros control estaban más desarrollados, presentando una cantidad significativamente mayor de ovocitos maduros que los ovarios de hembras alimentadas en grupos inmunizados (figura 2B). Los ovarios de las hembras alimentadas sobre los perros inmunizados con pP0-KLH y pP0-Bm86 tenían algunos ovocitos maduros, pero también una gran cantidad de ovocitos inmaduros adheridos a la pared del ovario.
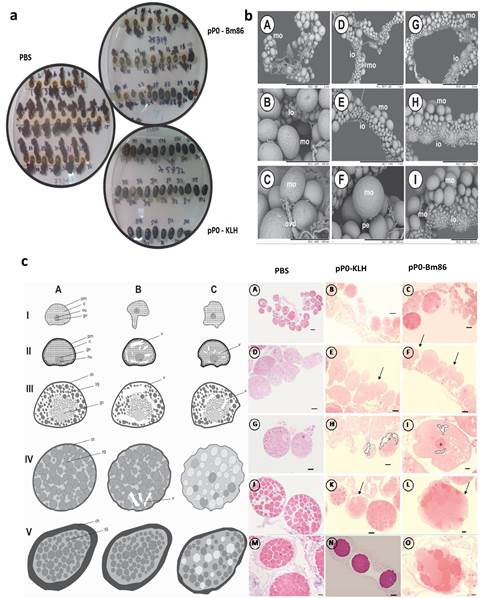
Fig. 2 A) Hembras ingurgitadas de R. microplus. Ovoposición normal en hembras alimentadas sobre bovinos del grupo control, rara y anormal para muchas hembras alimentadas sobre los bovinos inmunizados con pP0-Bm86 y no se observó ovoposición en absoluto para muchas hembras alimentadas sobre los bovinos inmunizados con pP0-KLH. B) Microscopía electrónica de barrido de ovarios de hembras R. sanguineus alimentadas sobre perros pertenecientes al grupo control (A, B y C), al grupo inmunizado con el conjugado pP0-KLH (D, E y F) y al grupo inmunizado con el conjugado pP0-Bm86 (G, H e I). mo = ovocitos maduros; io = ovocitos inmaduros, ovd = oviducto; pe = pedicelo. Barra de escala: A, G = 2 mm; D, E, H = 1 mm; B, I = 500 µm; C, F = 300 µm. C) Cambios histológicos en ovocitos de hembras de R. sanguineus alimentadas sobre perros inmunizados. AA Representación esquemática donde A representa el desarrollo normal de los ovocitos en el grupo control (PBS); B y C representan cambios histológicos que aparecen en ovocitos de hembras alimentadas sobre perros inmunizados con pP0-KLH y pP0-Bm86, respectivamente; I = ovocito I; II = ovocito II, III = ovocito III; IV = ovocito IV, V = ovocito V; pm = membrana plasmática; nu = nucleolo; gv = vesícula germinal; c = citoplasma; yg = gránulos de vitelo; ch = corion; v = vacuolización. BB Cortes histológicos de hembras R. sanguineus; A, B y C muestran ovocitos pre-vitelogénicos y vitelogénicos de los 3 grupos experimentales; D, E y F muestran la morfología de ovocitos pre-vitelogénicos con formas anormales señaladas en E y F; G, H e I muestran ovocitos III con vacuolización citoplasmática en ovocitos de grupos inmunizados (punteados) en G y H; J, K y L muestran ovocitos vitelogénicos donde la vacuolización y formas anormales también son evidentes en K y L; M, N y O muestran detalles de ovocitos maduros de hembras de los 3 grupos experimentales; Barras de escala: A, D, G, J, M = 200μm; B, C, N = 100 μm; E, F, H, K = 50 μm; I, L, O = 20 μm. El número de ovocitos maduros e inmaduros adheridos a la pared del ovario en cada muestra y el número de gránulos de vitelo dentro de los ovocitos en las secciones histológicas se compararon mediante ANOVA y prueba de comparación múltiple de Bonferroni realizadas en Prism (versión 6.0 para Windows; GraphPad Software, EE. UU.).
No se realizó un análisis ultraestructural de ovarios de garrapatas R. microplus alimentadas sobre ganado vacunado, pero probablemente ocurrieron los mismos cambios que los observados en los ovarios de garrapatas R. sanguineus alimentadas sobre perros vacunados, teniendo en cuenta el efecto similar observado.
En el experimento en conejos, después del desafío con larvas de garrapatas A. mixtum, el rendimiento medio de larvas alimentadas mostró diferencias estadísticamente significativas entre el grupo vacunado y el grupo control (17 % ± 11 vs. 35 % ± 24 de larvas recuperadas) así como el número de ninfas recién mudadas a partir de las larvas alimentadas en el grupo vacunado en comparación con las ninfas mudadas del grupo control (24 % ± 6 de mortalidad en el grupo pP0-KLH vs. 16 % ± 8 en el grupo de control, (figura 3A). No hubo diferencias estadísticamente significativas en el peso de las larvas entre los grupos. La eficacia calculada fue del 54 % y el 46 % para los antígenos pP0-KLH y pP0-Bm86, respectivamente contra larvas de garrapatas A. mixtum. La eficacia global calculada de la vacunación con cualquier antígeno contra una especie de garrapatas debe considerar los efectos en cada etapa de su ciclo de vida. En las garrapatas de un huésped, el efecto de la vacuna observado en los adultos es el resultado acumulativo del efecto en cada etapa de la vida de la garrapata alimentada sobre el mismo huésped vacunado. En el caso de las especies del género Amblyomma que son garrapatas de 3 huéspedes,34 debe esperarse un aumento en la eficacia si al efecto observado sobre las larvas se le adicionaran los efectos sobre ninfas y adultos. 35-37 No obstante, este ensayo constituye un estudio que sugiere que el antígeno basado en el péptido de la proteína P0 de las garrapatas del género Rhipicephalus podría ser útil en el control de garrapatas del género Amblyomma. Existen pocos ensayos publicados que utilicen antígenos contra especies de este género de garrapatas y dentro de estos, todos utilizaron una de sus 3 etapas parasitarias en los ensayos de desafío 38 debido a las dificultades para el establecimiento de colonias de este género de garrapatas en condiciones de laboratorio para su uso como modelos experimentales. La eficacia obtenida en este ensayo se encuentra entre las más altas informadas hasta el momento.
En los ensayos con garrapatas I. ricinus, el peso de las hembras microinyectadas con el dsRNA de P0 se redujo significativamente con respecto al de las hembras microinyectadas con el dsRNA de GFP utilizado como grupo control. Un día después de la recolección final de las hembras alimentadas sobre los curieles, todas las hembras microinyectadas con el dsRNA de P0 estaban muertas. Por el contrario, todas las hembras microinyectadas con el dsRNA de GFP pudieron completar la ovoposición y los huevos eclosionaron normalmente (figura 3B). En el experimento de inmunización en conejos usando el conjugado químico pP0-Bm86, las hembras de I ricinus alimentadas sobre el animal vacunado con el conjugado pP0-Bm86 tuvieron una reducción estadísticamente significativa en su peso en comparación con las hembras alimentadas sobre animales inyectados con PBS.
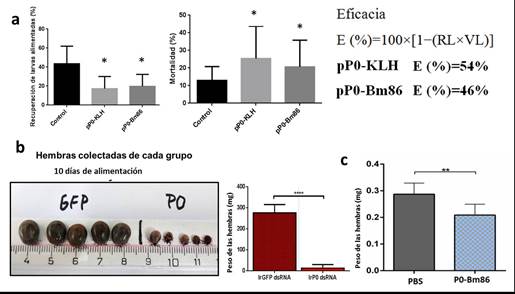
Fig. 3 A) Porcentajes promedio de larvas de Amblyomma mixtum recuperadas de grupos experimentales y mortalidad de las larvas alimentadas en el proceso de muda. Las desviaciones estándar de los grupos están representadas por barras de error en la dirección positiva. Los asteriscos representan diferencias estadísticamente significativas (Anova seguida de prueba de Bonferroni, * P < 0,05). B) Efecto observado sobre las garrapatas hembras de I. ricinus microinyectadas con dsRNA de P0 (Prueba t, ****P < 0,0001). C) Efecto sobre el peso de las hembras adultas de I. ricinus alimentadas sobre conejo inmunizados con el conjugado pP0-Bm86 (Prueba t, **P < 0,01)
La eficacia obtenida contra estas cuatro especies de garrapatas demuestra la hipótesis de que debido a la conservación de la secuencia del pP0 entre diferentes especies de garrapatas, este pudiera ser un antígeno de amplio espectro. Estos resultados demuestran también que el efecto sobre la ovoposición en cantidad y calidad está mediado por afectaciones en el desarrollo de los ovocitos y en la disminución del contenido de gránulos de vitelo dentro de los ovocitos.
Otra conclusión importante de este trabajo es que la proteína Bm86 podría ser una sustituta adecuada de KLH como transportadora del pP0 ya que fue capaz de estimular la respuesta inmune de los animales vacunados contra el péptido. El conjugado pP0-Bm86 sería una variante factible desde el punto de vista económico para el desarrollo del pP0 como vacuna comercial contra garrapatas ya que la proteína Bm86 es el ingrediente farmacéutico activo de la vacuna GavacTM. (18) Desde hace más de 20 años, esta proteína se produce por fermentación de un clon de levaduras P. pastoris obtenido por técnicas de ADN recombinante con un proceso robusto y muy bien establecido con buenas prácticas de producción.
En las condiciones experimentales ensayadas, el conjugado pP0-Bm86 a pesar de ser eficaz contra las garrapatas no muestra un aumento de la eficacia con respecto a las obtenidas con el conjugado pP0-KLH, como podría esperarse de una vacuna candidata en la que se combinan 2 antígenos diferentes. Una explicación a este hecho, sugerida por nuestros resultados, es que la conjugación parcial de pP0 a 49 de 54 residuos de Lys y el extremo N terminal de la proteína Bm86 podría eliminar, al menos en cierta medida, epitopos importantes de Bm86 que son responsables del efecto protector de este antígeno contra las garrapatas. No obstante, nuestra experiencia con el uso de GavacTM nos permiten afirmar que la reducción de las poblaciones de garrapatas en condiciones de producción es posible mediante el empleo de estrategias de manejo integradas cuya columna vertebral es la vacunación, incluso si la eficacia de la vacuna no es del 100 %. 35,39,40 En este caso, los antígenos basados en este péptido de la proteína P0 han mostrado eficacias suficientes contra diferentes especies de garrapatas que lo convierten en un candidato muy atractivo para el diseño de estrategias sostenibles de control de garrapatas.














