INTRODUCCIÓN
Dentro de las especies en peligro de extinción, las tortugas marinas son particularmente sensibles por el gran número de amenazas que enfrentan. 1 La pérdida de sus áreas de anidación debido a la urbanización de las zonas costeras, a la erosión y al aumento del nivel del mar es una de ellas. 2 El cambio climático amenaza a las tortugas marinas dada la vulnerabilidad de su hábitat clave, ante el incremento del nivel del mar y el efecto de los eventos meteorológicos de gran intensidad. Además, el ascenso de la temperatura constituye la afectación más directa del cambio climático a estas especies.
Ante esta situación, se hace imprescindible reconocer las características de las playas y aquellos factores que influyen en la selección del sitio de anidación por las tortugas marinas, ya que afectan directamente los sucesos reproductivos. 3 En particular, las primeras etapas del ciclo de vida son las más vulnerables, ya que inciden en el éxito del desarrollo embrionario y la sobrevivencia de las crías en tierra. 4
El éxito de eclosión de los nidos depende de la interacción de diversos factores que afectan directamente la anidación. 5 Variables como la temperatura de la arena, la salinidad y humedad de la misma, 6 están directamente relacionadas con el desarrollo embrionario. A estos se suman otros factores que también influyen en la selección del sitio de anidación, entre los que cabe destacar: el tamaño del grano de arena, 7 la distancia a la línea de marea alta 8 y la presencia o ausencia de vegetación. 9 Aún no está bien documentado el grado de influencia de dichos factores en la selección de los sitios de anidación 4 y, por ende, su efecto sobre el éxito de eclosión. 5
El impacto que pueden tener las características de la vegetación en el éxito reproductivo, ha sido pobremente evaluado en la literatura científica, con la excepción de unos pocos estudios. 10 Se ha verificado, que este factor es determinante en el desarrollo embrionario, por lo que afecta la selección del sitio de anidación. 11 Diferentes especies de tortugas pueden seleccionar dónde anidar, en asociación o no con la vegetación de la playa, 11,12,13 y como resultado su éxito reproductivo varía. Cambios drásticos en las características de las playas, tales como los inducidos por eventos meteorológicos de gran intensidad o la acumulación masiva de sargazo en las playas, puede afectar considerablemente el éxito de las tortugas para lograr una anidación exitosa y para que las crías lleguen al mar.
Considerando los efectos del cambio climático sobre las playas de anidación, el manejo de vegetación tiene mayor trascendencia, ya que constituye una alternativa para reducir el estrés térmico. 14 Esto resulta particularmente necesario en áreas de anidación insulares como las del archipiélago cubano donde la franja arenosa es estrecha y puede verse comprometida por el desarrollo de la vegetación. 15 Más aún, si existen evidencias de que un proceso de feminización puede estar produciéndose en áreas de anidación cubanas. 16,17 Por ello los resultados de este trabajo permiten valorar las acciones de manejo necesarias para mitigar el efecto del cambio climático en el éxito reproductivo de las tortugas marinas en Cuba.
Por todo lo anterior, los objetivos del presente trabajo fueron estimar la proporción sexual por temporada a partir de la temperatura y el período de incubación para las playas analizadas, evaluar la influencia de la presencia de la vegetación en la distribución de los nidos y el desarrollo embrionario, relacionar los cambios geomorfológicos ocurridos por el paso de tormentas tropicales en la Península de Guanahacabibes con el éxito reproductivo de las tortugas marinas y documentar los impactos que generan las acumulaciones masivas de sargazo sobre la conducta y el éxito reproductivo de tortugas marinas.
MÉTODOS
Área de estudio. El estudio se realizó en 10 playas de la costa sur de la Península de Guanahacabibes (desde 22o00 'N-84o50' W hasta 21o59 'N-84o44' W). La selección de playas siguió los criterios de Azanza et al.18 El estudio de la incidencia del sargazo y los efectos de la vegetación se realizaron en La Barca, ya que esta playa tiene la mayor actividad de anidación y la frecuencia de monitoreo más intensa en el área. 19
Diseño de muestreo. Los datos se recopilaron de 1998 a 2019. Hasta la temporada 2010 incluida, el monitoreo se realizó siguiendo el protocolo de Azanza et al.;20 después de 2010, los datos fueron recolectados de acuerdo con Moncada et al.21 La fecha en que se informó el primer rastro se consideró el comienzo de la temporada, en tanto que como final de la temporada se tomó la última fecha en que se registró cualquier actividad de anidación. Cada estación se dividió en intervalos de 15 días para determinar el pico de anidación.
Todas las hembras encontradas se midieron y etiquetaron con marcas de acero inconel (Style 681, National Band & Tag Company) en la aleta delantera derecha, con vistas a poder determinar la frecuencia de anidación (el número de veces que las hembras marcadas anidaron con éxito en una sola estación). Las crías se seleccionaron al azar y se midieron dentro de la primera hora de alcanzar la superficie del nido después de la emergencia; fueron liberados inmediatamente luego de que se tomaron las medidas.
El monitoreo diurno también se realizó en otras 5 playas (Las Canas, Resguardo, Las Cadenas, Caleta Larga y Cayuelos), al menos una vez por semana, para determinar el número total de nidos depositados. La fecha de oviposición se estimó de acuerdo al criterio de Moncada et al.21
Se colocaron sensores de temperatura HOBO® en el centro de los nidos, que registraron la temperatura sincrónicamente cada 2 horas, durante el período de incubación. Con el objetivo de evaluar la influencia de la temperatura sobre las anomalías congénitas, en los nidos con sensores, se determinó el total de embriones con conchas supernumerarias y malformaciones en el carapacho, las más frecuentes en playas de Guanahacabibes. 22 Estas anomalías morfológicas, se relacionaron solamente con la temperatura del tercer tercio del desarrollo embrionario, porque según Miller et al. (23 es, durante esta etapa, que ocurre la formación del caparazón y de las escamas.
Para determinar la relación de la cobertura vegetal con el número de nidos y el éxito de anidación en cada playa, se establecieron 3 transectos perpendiculares a la línea de costa en los que se ubicaron 2 parcelas de 100 m2, según el ancho de la franja de vegetación. La relación de la presencia de vegetación con el número de nidos, el éxito de anidación y el éxito de emergencia, se determinó en cada zona de la playa: la zona A que es la más cercana a la línea de marea alta; la zona B que se corresponde con la posplaya y la zona C delimitada a partir de la línea de vegetación. Se tomó evidencia fotográfica de la posible influencia del sargazo sobre la actividad de anidación en la playa. La identificación del sargazo se realizó mediante fotografía.
Análisis estadístico
Antes del análisis los datos se probaron para determinar la normalidad y la homogeneidad de la varianza, utilizando una prueba de Kolmogorov-Smirnov y de Levene, respectivamente. El análisis de regresión se utilizó para determinar la relación. La correlación de Pearson se empleó para determinar si hubo alguna tendencia temporal en el número de nidos, la duración de la temporada y el número de huevos por hembra durante el período de estudio. Las diferencias entre valores medios se determinaron mediante la prueba no parámétrica de análisis de varianza, Kruskal-Wallis. En caso de encontrar diferencias entre las temporadas analizadas, se realizó una prueba de comparación de medias a posteriori. Se tomó en cuenta, para todas las pruebas, un nivel de significación de 5 %. Las pruebas se realizarán en el programa STATISTICA 7.0.
RESULTADOS
Se observó un incremento anual en el número de nidos de tortuga verde por temporadas (Pearson, r = 0,46; p = 0,06), aunque con picos de anidación bienales y un máximo en el 2013. Para caguama, el aumento significativo en el número anual de nidos se verificó hasta el 2016, cuando alcanzó su máximo (Pearson, r = 0,48; p = 0,04), Sin embargo, dado el descenso experimentado del 2017 al 2019, la tendencia total en el período de estudio no es significativa (Pearson, r = 0,25; p = 0,26).
Respecto al momento en que ocurre el pico de la anidación sólo se encontró una relación negativa significativa para el caso de caguama (Pearson, r = -0,74; p < 0,001) como se muestra en la figura 1. Para tortuga verde, la variación interanual no permite detectar una tendencia clara en esta variable (Pearson, r = 0,19; p = 0,43).
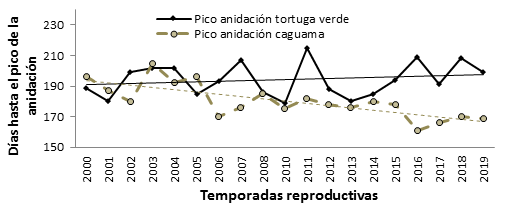
Fig. 1 Variación temporal del pico de la temporada reproductiva de caguama y tortuga verde en la pensínsula de Guanahabibes, Cuba.
También se encontró una correlación negativa significativa entre el número de huevos puestos y el año para las dos especies (rcaguama= -0,55; p = 0,01 y rtverde = -0,57; p < 0,001); evidenciando que el número promedio de huevos por nidada está disminuyendo con el tiempo.
Se observó una disminución en el tamaño medio de las crías entre los años 2013 y 2015 (figura 2), con una variación del largo medio para tortuga verde de 5 mm y para caguama de 3 mm. Del 2016 al 2019, las tallas promedio de ambas especies mantenido estables con un valor de 54 mm para tortuga verde y de 46 mm para caguama.
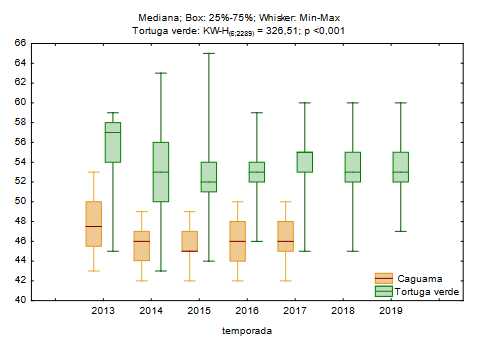
Fig. 2 Variación temporal en la talla de las crías de caguama y tortuga verde que anidan en la Península de Guanahacabibes, Cuba.
Temperatura y éxito reproductivo
Los valores de temperatura durante el segundo tercio de la incubación, el período de incubación y la proporción de hembras tienen un comportamiento temporal diferente (figura 3), mientras el período de incubación medio ha disminuido con el tiempo, la proporción de hembras tiene valores medios cada vez más altos.
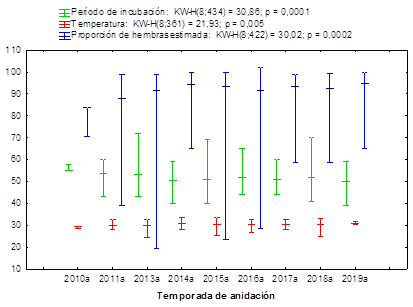
Fig. 3 Temperaturas de incubación durante el segundo tercio de desarrollo embrionario, el período de incubación y la proporción de hembras en nidos de Chelonia mydas en playas de la Península de Guanahacabibes, Cuba.
Las temperaturas se mantuvieron, en su mayoría, por encima de los 29,5 ºC, con un incremento en los nidos en temporadas sucesivas hasta el 2015. En correspondencia con las elevadas temperaturas registradas en los nidos, los períodos de incubación encontrados fueron bajos. La estimación de la proporción por sexos a partir de la temperatura indica valores superiores al 90 % de hembras durante todo el período estudiado con excepción del año 2012.
El éxito de eclosión promedio por temporada en los nidos a los que se les midió la temperatura fue superior al 87 %, con excepción de los nidos del año 2016 en playa la Barca. Incluso 2 de los nidos que tuvieron una temperatura promedio del tercer tercio superior a los 35 °C, presentaron un éxito de eclosión superior al 94 %.
Relación de la cobertura vegetal con el éxito reproductivo
Fue mayor la preferencia por anidar en la parte intermedia de la playa, donde aparecen parches de vegetación (zona B) respecto al área totalmente cubierta por vegetación (zona C). Sin embargo, el éxito de anidación es similar en las 3 zonas, aunque la zona C presenta el mayor valor (95 %).
La cobertura de vegetación correlaciona positiva y significativamente con el número de nidos (r = 0,56; p = 0,01), como se muestra en la figura 4. Sin embargo, no se evidencia correlación entre la primera variable y el número de intentos de anidación.
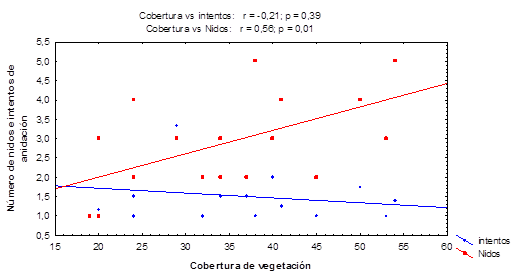
Fig. 4 Efecto de la cobertura vegetal de Suriana maritima y Tournefortia gnaphalodes sobre el éxito reproductivo de tortugas marinas en playas de la Península de Guanahacabibes.
Se evidencian diferencias significativas para el período de incubación de los nidos que reciben diferentes grados de sombra (H (2,139) = 22,08; p < 0,01). Se observa un gradiente en la mediana del período de incubación que va del mayor valor en los nidos con sombra total, hasta el valor más pequeño en los nidos sin sombra.
Sargazo
Se evidenció un incremento en frecuencia y magnitud de las arribazones de sargazo a la Península de Guanahacabibes. La afluencia de Sargassum fluitans se hizo masiva en La Barca después de junio de 2015. Sin embargo, la masa crítica se logró en la primera quincena de julio, cuando casi 1,5 m de las algas se depositaron en la orilla, y alrededor de 10 m tierra adentro se cubrieron con material flotante. Este fenómeno se repitió en las temporadas 2017, 2018 y 2019, con un incremento en la magnitud de la biomasa que arribó a las costas en años sucesivos.
El comportamiento de la anidación de las tortugas verdes y caguamas se vio afectado de varias maneras. Primero, y lo más obvio, las tortugas tuvieron que vencer la barrera para salir del mar a la playa y regresar después de la puesta. En segundo lugar, el número de fallas en la anidación aumentó, precisamente, cuando la mayor cantidad de algas estaba en la costa. Nuevamente es la caguama la más afectada, con valores bajos de éxito de anidación en el período de arribazón de sargazo, que llegan a 0 en el 2019, aunque se observan afectaciones para tortuga verde en los últimos años. El éxito de la eclosión no se vio afectado, pero el acceso al mar fue difícil para los recién nacidos, ya que tuvieron que atravesar la masa de algas.
Efecto de los huracanes en el éxito reproductivo
A lo largo del período de estudio, 24 eventos meteorológicos afectaron de manera directa o indirecta a la Península de Guanahacabibes, con un impacto variable en el éxito reproductivo de las tortugas marinas que anidan en esa zona. La frecuencia anual promedio de estos eventos es de 1,2; aunque varía de períodos sin actividad (2011 al 2015), hasta años con un máximo de 6 eventos, como fue el caso del 2020. Se observó una relación débil y negativa entre el número de ciclones y el número de nidos por temporada para el caso de tortuga verde (Spearman, r = -0,50; p = 0,04), pero no para caguama (Spearman, r = -0,29; p = 0,25).
La mayor incidencia de ciclones 14 ocurrió entre los meses de septiembre y octubre, justo cuando se produce la mayoría de las eclosiones en los nidos. De ellos, el 78 % fueron huracanes, mientras que en el período de junio a agosto sólo ocurrieron 10 ciclones, el 30 % de los cuales fueron huracanes. Con relación a las afectaciones a los nidos, los años 2004, 2005, 2018 y 2020 fueron los de mayor porcentaje, al superar el 30 % de pérdida de los nidos.
DISCUSIÓN
La población de anidación de la caguama de Guanahacabibes, aunque pequeña en comparación con otras poblaciones, muestra signos importantes de recuperación, con una tendencia positiva en el número de nidos por temporada y altos niveles de éxito de eclosión. 24,25 Guanahacabibes se confirma como el sitio que contiene la cuarta población de anidación según el número de nidos (y la tercera con mayor densidad de nidos), después de Cayo Largo, Isla de la Juventud y San Felipe. 26 Las bajas tasas de anidación de la población de caguama en Guanahacabibes, podrían ser el resultado de la alta frecuencia de huracanes en el área. Dewald y Pike 27 encontraron que la mayor parte de la anidación de caguamas se produce en áreas con frecuencias moderadas de huracanes.
Los patrones de anidación bienal de estas poblaciones se han mantenido estables a lo largo del tiempo, similar al reportado anteriormente por Azanza et al., (28 pero este patrón no se ha descrito para las caguamas en poblaciones de anidación más grandes 29,30,31 en Florida o cualquier otro lugar de Cuba, excepto en las últimas 4 temporadas de anidación. 26
Está apareciendo un patrón interesante en algunas áreas de anidación de tortugas marinas, donde el pico de la temporada ocurre más temprano. 29,32,33 Este fenómeno, también se observó para la población de caguama de Guanahacabibes, aunque la población de tortuga verde parece que está retrasando el pico de anidación. Esto podría deberse al aumento de la temperatura, por lo que requiere de evaluaciones adicionales. Pike et al.33 también encontraron correspondencia de la duración de la temporada de anidación con la temperatura de la superficie del mar para la caguama, pero no para las tortugas verdes, 34 confirmando que las caguamas son altamente sensibles a la variación de temperatura. Las poblaciones que se reproducen en condiciones óptimas pueden experimentar una disminución a medida que aumenta la temperatura, lo que cual podría ser el caso de Guanahacabibes. 35
Del mismo modo, la reducción en el tamaño de las crías observada a lo largo de los años puede deberse también a las altas temperaturas de incubación; 36 como resultado, Glen et al.37 sugirieron que las crías desarrolladas en ambientes de alta temperatura son menos vigorosas. Pike 38 indicó que los cambios en las temperaturas de los nidos podrían alterar significativamente los fenotipos de las crías. Dado que la temperatura en Guanahacabibes está aumentando, y que las crías se están volviendo más pequeñas, es muy posible que la aptitud de la descendencia que se ha producido en esas playas se haya visto comprometida y podría aumentar la mortalidad en las primeras etapas.
Relación de la presencia vegetal con el éxito reproductivo
La preferencia de las hembras por anidar en la zona con vegetación (o cercana a esta) puede tener varias explicaciones. Una posible causa, según Ferrer et al., (39 es el riesgo de derrumbe que sufre la cámara de incubación en las zonas de playa abierta, principalmente si la arena es muy seca. También puede ser una estrategia para evitar las inundaciones prolongadas en las áreas cercanas a la línea de marea. 40 Además, las raíces de las plantas propician un sustrato adecuado para la construcción de los nidos, ya que reducen la compactación de la arena 11) aunque existen diferencias entre especies vegetales. 41,42 Otros estudios han verificado la preferencia por anidar en la zona B o zona de interfase entre la vegetación, mientras que alcanzan el mayor éxito de anidación en la línea de vegetación. 43,44
El menor éxito de emergencia de las crías en la zona cercana a la línea de marea alta (A), se debe a todos los factores de riesgo que afectan a los nidos en esta zona. Kamel y Mrosovsky (42.43) plantean que la cercanía a la línea de marea alta, disminuye el éxito de incubación y el éxito de emergencia. Si los huevos son colocados próximos al agua, tienen una alta probabilidad de ser destruidos por la erosión de la playa o por el efecto del oleaje. 8,45 Aunque no sean destruidos, la inundación es riesgosa, porque ocasiona un súbito descenso de las temperaturas, con el consecuente efecto sobre diversos procesos, como los metabólicos, la determinación del sexo, la corrosión del nido y una reducción en la disponibilidad de oxígeno. 6,44
Respecto a las especies vegetales presentes, se le debe dar seguimiento a la distribución de I. pes-caprae, ya que las crías pueden quedar atrapadas en sus lianas cuando salen de los nidos. 41 Según Rivas y Marco 46I. pes-caprae posee un rápido crecimiento, se esparce superficialmente por el suelo arenoso y sus profundas raíces pueden penetrar varios metros en todas las direcciones, incluyendo profundidad.
El aumento de la cobertura pudiera representar una limitante para el proceso de anidación, ya que la presencia de vegetación densa pudiera obstaculizar el proceso de cavar el nido. 47 Sin embargo, en Guanahacabibes se encuentra una relación positiva entre el número de nidos y la cobertura vegetal, lo que puede deberse a que la cobertura no es tan elevada, y a que las tortugas verdes prefieren áreas con vegetación para anidar. 42 Parece ser que los niveles de cobertura no son suficientes para impedir el proceso de excavación del nido, sino que son otros factores los que determinan que se produzcan más o menos intentos. 47
Efecto de la temperatura sobre la proporción sexual, el éxito de eclosión y las malformaciones
Coudert 48 plantea que el período de incubación de los embriones está inversamente relacionado con la temperatura dentro del nido. Esta es la razón por la cual se observa un comportamiento inverso de estas variables a lo largo del tiempo en Guanahacabibes. A su vez, la vegetación tiene el potencial para afectar la temperatura y el período de incubación. 13 Sin embargo, la mayoría de los nidos incubados en Guanahacabibes tienen una producción de hembras superior al 90 % lo que indica que la sombra mitiga, pero no soluciona completamente el problema de las elevadas temperaturas en el área. 49,50 En la literatura está descrito el efecto negativo de las altas temperaturas para la sobrevivencia de los embriones de tortugas marinas. Varios autores aseveran que el sombreado constituye una estrategia efectiva para mitigar las altas temperaturas de la arena, 44,51,52 ya que convierte temperaturas subletales en niveles óptimos 14) y de esta manera aumenta la calidad de los neonatos. 53 De lo contrario, se pueden generar anomalías en el desarrollo 54,55 que pueden disminuir la emergencia de los neonatos 56 o reducir las probabilidades de supervivencia las crías que lleguen al mar. 57 El incremento en la velocidad del desarrollo embrionario causado por las altas temperaturas, puede ser la causa de la aparición de errores en el proceso de formación de los escudetes 58,59 y otras anomalías.
El éxito de eclosión encontrado en Guanahacabibes por temporada, es superior al reportado en muchas áreas de anidación. Los cambios temporales en el éxito de eclosión, podría indicar cambios en los factores que influyen en éste.
Sargazo
De acuerdo con Maurer et al., 60, el sargazo ha proliferado fuera del Mar de los Sargazos, especialmente en el Golfo de México. 61 La fuente de nutrientes para esta cantidad masiva de algas, parece estar asociada con el río Amazonas. 62
Se han reportado floraciones de sargazo previas en 2011 63,64 y 2014 65 en el Caribe y Cuba. 66,67 En sitios como Antigua, donde estaban cubiertos del 10 % al 15 % de ciertas partes de la costa, 60 se registran por primera vez afectaciones a las tortugas marinas. Actualmente se trabaja en la predicción de la llegada de estas masas de algas, a partir de la modelación, para poder tomar las medidas necesarias de contención a escala local. 68,69,70
En el estudio realizado por Moreira y Alonso, 67 afirman que, en el archipiélago del sur de Cuba, el sargazo llega durante el verano, mientras que en las zonas del norte se observa durante el invierno, dependiendo de los vientos predominantes.
Las arribazones influyeron en la anidación de las tortugas marinas. En primer lugar, para las caguamas, vencer la barrera y llegar al mar, resultó especialmente difícil, ya que son más pequeñas y débiles que las tortugas verdes, lo que parece explicar por qué se atascaron más fácilmente que las verdes. En segundo lugar, el aumento en el número de fallas en la anidación, pudo deberse a la dificultad que tuvieron las tortugas para emerger a la playa, lo cual las alentó a desovar en lugares menos adecuados.
Varios especialistas 71,72 han discutido a fondo el peligro de los obstáculos que enfrentan las crías. Incluye el aumento de la mortalidad por hipertermia, agotamiento, ahogamiento y vulnerabilidad a la depredación.
Efecto de los huracanes
En términos poblacionales, la tortuga verde que anida en Guanahacabibes, que es la especie con mayor potencial de afectación por los ciclones, mostró gran plasticidad en la conducta de anidación de las hembras como para poder adaptarse a los cambios geomorfológicos generados por los ciclones (cambios en la distancia recorrida e incremento en los intentos de anidación hasta conseguir sitios propicios). Así mismo, aunque los niveles de eclosión de crías descienden en los años en los que impactan los huracanes, esta población muestra un éxito de eclosión promedio superior al 85 %, 73 lo cual es mucho más alto que el que reportan la mayoría de las áreas de anidación. Sin embargo, la ubicación de esta área en una zona de tránsito frecuente de eventos meteorológicos severos, y el incremento de su frecuencia por temporada observado, en los últimos años, 74 constituye un motivo de preocupación y de seguimiento a esta temática, para tener la capacidad de tomar las medidas necesarias para la conservación de la especie, 75 incluyendo el traslado de nidos, en caso necesario.
Conclusiones
Las elevadas temperaturas registradas y los valores de éxito de eclosión, demuestran la elevada resistencia térmica de las tortugas marinas en las playas analizadas. Las temperaturas del tercer tercio del desarrollo embrionario fueron las que más influyeron en la disminución del éxito de eclosión. El aumento de la temperatura de los nidos provocó una elevada proporción de hembras.
La vegetación de costa arenosa desempeña un papel determinante en la anidación de las tortugas marinas ya que, tanto su presencia como su grado de cobertura vegetal, tienen un impacto positivo en el éxito reproductivo de los nidos en Guanahacabibes. La sombra de la vegetación incrementa el éxito de emergencia de los neonatos al mismo tiempo que aumenta la duración del período de incubación, lo que permite que las crías completen de forma óptima su desarrollo.
Las transformaciones en las playas generadas por ciclones y las arribazones de sargazo pueden afectar el éxito de eclosión de las crías y la conducta de anidación de las hembras. Sin embargo, las poblaciones de tortugas verde que anidan en Guanahacabibes muestra, hasta el momento, la resiliencia suficiente para superar los efectos negativos de ambos fenómenos, no así la caguama, especialmente con el sargazo.














