Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.50 n.3 Ciudad de la Habana sep.-dic. 1998
Detección de anticuerpos, antígenos y complejos inmunes circulantes en las fascioliasis aguda y crónica. Resultados preliminares
Dra. Liliana Pelayo,1 Lic. Ana Margarita Espino,2 Dra. Blanca E. Duménigo Ripoll3 y Dr. Carlos M. Finlay Villalvilla4Resumen
Se estudió un total de 24 pacientes con fascioliasis, de los cuales 19 se encontraban en la fase crónica y 5 en la fase aguda. Se detectó la presencia de antígenos y complejos inmunes circulantes (CIC) en el 100 % de los pacientes con fascioliasis aguda que tenían menos de 30 días de evolución de los síntomas clínicos, en tanto que la presencia de coproantígenos se hizo evidente en el 100 % de los pacientes crónicos. En este grupo se observó un significativo número de casos con elevados niveles de anticuerpos y 43,7 % de casos con CIC detectados tanto por la técnica de precipitación con PEG como por la de desviación del C1q. Se encontró una correlación altamente significativa entre el conteo de huevos y los niveles de CIC por ambas técnicas, así como una correlación significativa entre el conteo de huevos y los niveles de coproantígenos.Descriptores DeCS: FASCIOLIASIS/inmunología; COMPLEJO ANTIGENO-ANTICUERPO/análisis; FASCIOLA HEPATICA/inmunología; ANTIGENOS HELMINTICOS/análisis; ANTICUERPOS HELMINTICOS/análisis.
La fascioliasis producida por Fasciola hepatica es una enfermedad parasitaria de difícil diagnóstico, frecuente en los mamíferos herbívoros y el hombre. De forma clínica se caracteriza por 2 etapas, una invasiva, que tiene lugar pocas semanas después de la infección, que se manifiesta por la presencia de hepatomegalia y eosinofilia sanguínea,1 y una segunda etapa, que comienza varios meses después de la infección, caracterizada por la localización del parásito en los conductos biliares y por la aparición de angiocolitis como síntoma más común.2,3
El diagnóstico de certeza de esta enfermedad presenta grandes dificultades puesto que el hallazgo de los huevos del parásito en las heces y el fluido duodenal se hace imposible en la fase invasiva de la enfermedad, porque el parásito se encuentra inmaduro en migración por el parénquima hepático, en tanto que en la fase patente, cuando el parásito alcanza la madurez sexual e inicia la oviposición, la excreción de huevos es intermitente.
Como una solución al diagnóstico de esta parasitosis, nuestro laboratorio ha desarrollado un conjunto de técnicas inmunoenzimáticas basadas en la detección de los antígenos metabólicos del parásito en el suero y las heces de los pacientes,4,5 así como de anticuerpos específicos contra estos antígenos,6 mediante los cuales se ha podido realizar el diagnóstico sensible y específico de la enfermedad y se ha podido evaluar el éxito terapéutico.7
Los complejos inmunes circulantes (CIC) han sido detectados en una gran variedad de enfermedades parasitarias y han sido relacionados con la presencia de lesiones inmunopatológicas.8,9 La mayor parte de los pacientes con F. hepatica desarrollan una inmunidad mediada por células y una elevada respuesta de anticuerpos contra los antígenos del parásito.10,11 Esta respuesta humoral podría ser seguida por la formación de CIC, los cuales podrían estar involucrados en los mecanismos inmunopatológicos de la relación huésped-parásito.
En el presente trabajo nos propusimos como objetivos, evaluar nuestras técnicas de diagnóstico en pacientes que se encontraban en las fases aguda y crónica, e investigar la presencia de CIC y correlacionarlos con el conteo de huevos y el tiempo de evolución de los síntomas clínicos.
Métodos
Universo de estudio
El universo de estudio comprendió 51 individuos, de éstos, 19 eran pacientes que se encontraban en la fase crónica, y que fueron confirmados en el Instituto de Medicina Tropical "Pedro Kourí" como casos de F. hepatica por el hallazgo de los huevos del parásito en las heces. Otros 5 pacientes se encontraban en la fase aguda, lo cual pudo determinarse por la ausencia de huevos en las heces, el antecedente de haber ingerido berro silvestre y el tiempo de evolución de los síntomas clínicos. Los restantes 27 eran individuos sanos con repetidos exámenes parasitológicos negativos que fueron utilizados como controles. A todos los pacientes y al grupo control negativo se les realizó punción venosa para la obtención de suero y se les tomó una muestra de heces.A cada uno de los sueros se les determinó la presencia de anticuerpos contra F. hepatica mediante un ELISA indirecto,6 la presencia de antígenos circulantes4 y la de complejos inmunes circulantes (CIC) por los métodos de precipitación con polietilenglicol9 y desviación del Clq.12
Las muestras fecales fueron divididas en 2 porciones, una de las cuales fue analizada por la técnica de Kato Katz13 para la observación y conteo de los huevos del parásito, y la otra fue estudiada por la técnica de detección de coproantígenos descrita en trabajos previos.5
Los pacientes en la fase aguda fueron estudiados de forma evolutiva hasta la observación de los huevos, para lo cual se colectó una muestra semanal de heces que también fue estudiada por una técnica de detección de coproantígenos. Además de la muestra de heces, se colectó una muestra de suero y en todos los casos se procedió a su estudio por técnicas de determinación de antígenos circulantes, anticuerpos y CIC, se registró la fecha en que cada determinación se hizo positiva o negativa, y se correlacionaron éstos con el tiempo de evolución de los síntomas.
Obtención de antígenos de excreción secreción
Los antígenos de excreción secreción (ES) fueron obtenidos a partir del mantenimiento in vitro de adultos de F. hepatica, los cuales fueron extraídos de los conductos biliares de reses sacrificadas en el Combinado Cárnico de Candelaria, Pinar del Río, mediante el procedimiento seguido por Espino y otros.6Ensayo inmunoenzimático sobre fase sólida (ELISA) para la detección de anticuerpos
Se utilizó el método de ELISA indirecto establecido por Espino y otros6 para la detección de anticuerpos con la utilización de antígenos de ES de F. hepatica. La concentración de antígeno utilizada para el recubrimiento de la placa fue de 60 mg/mL, las muestras de suero fueron trabajadas a la dilución 1:800 y el conjugado a la dilución 1:5 000. El valor de corte establecido para este ensayo fue de 0,36 a partir del cual toda muestra estudiada fue considerada como positiva.Ensayo inmunoenzimático sobre fase sólida para la detección de antígenos circulantes y de coproantígenos
Se utilizó un ELISA tipo sandwich según el método descrito por Espino y otros,4,5 para la detección de antígenos de ES de F. hepática en sueros y heces de pacientes con fascioliasis. El valor de corte establecido para estos ensayos fue de 0,21 para la detección de antígenos circulantes y de 0,24 para la de coproantígenos.Detección de complejos inmunes circulantes (CIC)
Método de precipitación con polietilenglicol (PEG) 6000. Para la realización de esta técnica se siguió el procedimiento descrito por Lunde y Paranjape.9 Para ello cada muestra de suero fue previamente diluida 1:3 con tampón borato de sodio 0,1 M pH 8,4; mezclado a partes iguales con PEG 6000 hasta una concentración final de 4,16 % y después se incubó durante 60 min a temperatura ambiente (TA). Al finalizar la incubación, los valores de absorbancia de cada muestra fueron leídos a 450 nm contra tampón borato en un espectrofotómetro (Pharmacia LKB Ultrospec III) y los resultados se expresaron mediante la fórmula siguiente:DO = DO2 - DO1
Donde DO2 es la absorbancia obtenida para cada muestra problema conteniendo PEG 6000 y DO1 es la absorbancia de su respectivo blanco reactivo. Se consideró positiva toda muestra cuyo valor de absorbancia fuera mayor o igual que 0,13 según el criterio de absorbancia media (DO) + 2 desviaciones están- dar (DE) del grupo control negativo.
Método de desviación del C1q. Para la realización de este ensayo se utilizó el procedimiento descrito por Sobel y otros.12 Para ello cada muestra de suero fue diluida 1:2 en tampón veronal salino 0,1 M pH 7,2 con 6 % de Clq marcado con I125 e incubado durante 30 min a TA. Esta preparación posteriormente, fue mezclada a partes iguales con eritrocitos sensibilizados con un suero antieritrocitos de carnero de la clase IgG. Después de agitar, la mezcla fue incubada a TA durante 60 min posterior a lo cual, ésta fue aplicada sobre un gradiente de sacarosa al 40 % diluida en tampón fosfato de sodio 0,05 M pH 7,0 y centrifugada a 1 500 rpm durante 5 min. El sobrenadante fue separado del precipitado y la cantidad de Clq marcado con I125 presente en cada fase fue determinada en un contador gamma. Los resultados fueron expresados en porcentaje de inhibición (I) mediante la fórmula siguiente:
Análisis estadístico
Cada muestra de suero y heces fue analizada por duplicado en los ensayos de detección de anticuerpos y de antígenos, y el resultado fue expresado como la DO media para cada determinación. Las diferencias entre los valores medios del grupo positivo y del negativo en cada una de las técnicas aplicadas fueron determinadas mediante una prueba de la t de Student.Para conocer si existe correlación entre el número de huevos por gramo de heces y los niveles de coproantígenos y CIC se utilizó una prueba de función de potencia.
Resultados
Como se observa en la tabla, todos los pacientes en la fase aguda presentaron niveles crecientes de anticuerpos anti-F. hepatica. La presencia de antigenemia pudo ser demostrada en el 100 % de los pacientes con fascioliasis aguda que presentaban un tiempo máximo de evolución de los síntomas de 15 a 30 d. Después de este intervalo de tiempo los niveles de antígenos circulantes no fueron detectables en ninguno de los pacientes, en tanto que comenzaron a observarse niveles detectables de CIC por ambas técnicas utilizadas.| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | |
En 3 de los 5 pacientes en la fase aguda la presencia de coproantígenos pudo ser demostrada entre los 37 y 42 d de evolución de los síntomas, en tanto que los otros 2 resultaron altamente positivos desde su incorporación al estudio con 28 y 30 d de evolución. Todos estos pacientes fueron seguidos por parasitología y luego de repetidos exámenes se pudo demostrar la presencia de huevos cuando habían transcurrido 70 d de iniciados los síntomas clínicos.
A diferencia de los pacientes en la fase aguda, sólo 3 de los 19 pacientes crónicos estudiados (16 %) resultaron positivos en la detección de antígenos circulantes con valores medios de absorbancia de 0,33 ± 0,05. En tanto que 16 de 19 (84 %) presentaron niveles detectables de anticuerpos en un rango de absorbancia de 0,29 a 1,95; con un valor medio de 0,92 ± 0,493. El 100 % de los pacientes crónicos presentaron niveles detectables de coproantígenos con valores de absorbancia entre 0,3 y 2,19, para una media de 1,421 ± 0,557.
La presencia de CIC fue demostrada en 9 de los 19 pacientes crónicos (47,3 %) con valores que oscilaron entre 0,14 y 0,28 por la técnica de PEG, y valores de 21 a 32 % por la de desviación del Clq, para una media de 0,216 y 26,6 %, respectivamente. Todos los pacientes que resultaron positivos a la detección de CIC lo fueron por las 2 técnicas.
Ninguno de los controles negativos presentaron niveles detectables de anticuerpos ni resultaron positivos en los ensayos de detección de antígenos y CIC. Se encontraron diferencias altamente significativas entre los niveles de CIC y de anticuerpos del grupo de pacientes con fascioliasis crónica respecto al grupo control negativo, para una p < 0,01.
Al correlacionar el número de huevos por gramo de heces con los niveles de CIC determinados por la técnica de PEG y desviación del Clq se encontró relación positiva, para una p < 0,01 (figs. 1 y 2). Del mismo modo, en la figura 3 se observa la correlación encontrada entre el conteo de huevos y los niveles de coproantígenos, la cual resultó positiva (p < 0,01) cuando el conteo de huevos no excedió de 150 huevos/g de heces.
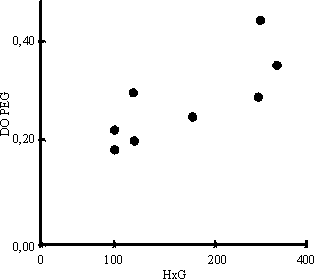
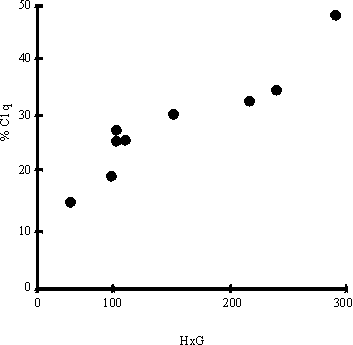
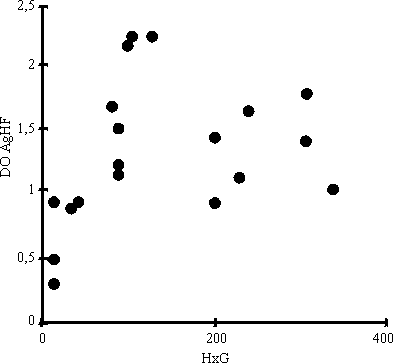
Discusión
Como se observa en los resultados del presente trabajo, el ensayo de detección de antígenos circulantes presentó su mayor utilidad diagnóstica en las etapas más tempranas de la fase aguda de la enfermedad, se observó que los niveles más elevados de antigenemia se encontraban asociados con los menores tiempos de evolución de los síntomas clínicos.Se ha descrito que durante las primeras 3 ó 4 semanas de la infección el parásito inmaduro se encuentra en migración por el parénquima hepático,1 por lo que sus productos de excreción-secreción son vertidos a la circulación y pueden ser detectados en la sangre en forma libre. La presencia de estos productos en la circulación constituye el principal estímulo antigénico al sistema inmunológico del huésped e induce de manera inmediata la formación de anticuerpos específicos contra el parásito, a partir de las 2 ó 3 semanas de infección, lo cual se corresponde con lo reportado por otros autores.14
Una dinámica de antigenemia semejante a la observada en estos 5 pacientes, fue descrita previamente por nuestro grupo en un modelo experimental, en el cual ratas de la raza Wistar que fueron infectadas con metacercarias de F. hepatica, presentaron antígenos circulantes entre las semanas 1 y 3 de la infección.15 Teniendo en cuenta estos resultados y si se relacionan éstos con la ya conocida trayectoria del parásito dentro del huésped, podemos establecer que la presencia de la antigenemia está vinculada con las etapas en las que el parásito inmaduro comienza a migrar por el parénquima hepático y vierte a la circulación sus productos de excreción y secreción, en tanto que se demuestra la ausencia total de ésta en los períodos más avanzados de la fase aguda y en la vasta mayoría de los pacientes crónicos.
A diferencia de la antigenemia, la presencia de coproantígenos se hizo evidente en todos los pacientes en la fase aguda con más de 28 d de evolución de los síntomas y en todos los pacientes crónicos, lo cual nos permitió inferir, que los coproantígenos están relacionados con los períodos en que el parásito, alojado en los conductos biliares, se encuentra en fase de maduración sexual o en su forma adulta, de modo que el valor diagnóstico de su detección podría ser útil no sólo en la fase prepatente sino también en la fase patente de la infección tal como hemos descrito en trabajos previos.5,15 Dado que el número de casos agudos estudiados en el presente trabajo es muy pequeño, estos resultados no pueden ser aún considerados como concluyentes y éstos deberán ser verificados con un número mayor de casos en la fase aguda, por lo cual, se ha diseñado un estudio mucho más amplio y se encuentra en fase de desarrollo.
En este estudio la presencia de CIC fue observada tanto en pacientes en la fase aguda como en la crónica, lo cual sugiere que éstos pudieran estar asociados con la actividad de la infección. La presencia de CIC en los pacientes con fascioliasis aguda es fácilmente comprensible si tenemos en cuenta que éstos son la consecuencia inmunológica de una constante estimulación antigénica proporcionada por el parásito en su migración por el parénquima. En otras enfermedades parasitarias como la esquistosomiasis, es muy frecuente el hallazgo de CIC en la fase aguda de la infección8 asociados con el desarrollo de lesiones inmunopatológicas. Aunque en la fascioliasis este fenómeno aún no ha sido descrito y son muy pocos los trabajos que abordan esta temática, no debe ser descartada la posibilidad de un fenómeno similar, si tenemos en cuenta que un elevado número de los pacientes sintomáticos que se encuentran en fase invasiva presenta entre sus síntomas clínicos más frecuentes reacciones tóxicas y alérgicas así como hepatomegalia.1
Los complejos inmunitarios de la sangre circulante son eliminados con rapidez en su mayor parte por el sistema de fagocitos mononucleares, en particular por las células de Kupffer. Cuando el parásito se aloja en los conductos biliares escapa definitivamente a la acción del sistema inmunológico del huésped, y desaparece de esta forma la fuente de antígeno que el parásito vertía a la circulación. Debido a esto, constituye una aparente contradicción en el presente trabajo, el hallazgo de CIC en pacientes crónicos que se encuentran en una fase de exceso de anticuerpos. Estos resultados pueden ser explicados si tenemos en cuenta que en la fase crónica de la fascioliasis y en dependencia de la intensidad de la infección, la función hepática suele encontrarse afectada y con ella la posibilidad de un adecuado funcionamiento de la dinámica de eliminación de los complejos inmunitarios.
Otro de los resultados importantes obtenidos en este estudio es la demostración de la correlación existente entre el número de huevos, los coproantígenos y los niveles de CIC, lo cual se corresponde con los resultados obtenidos por Espino y otros5 y Sampaio-Silva y otros.16 Esto podría apoyar la hipótesis antes expuesta.
Si tenemos en cuenta que el número de huevos puede estar asociado con el número de parásitos alojados en el hígado, es muy probable por tanto, que los niveles de complejos inmunes así como los de coproantígenos estén directamente relacionados con el número de parásitos alojados en el conducto biliar5,16 y pudiera constituir un criterio indirecto de intensidad de la infección. En aquellas circunstancias donde debido a infecciones muy intensas la relación existente entre el número de huevos y la cantidad de parásitos se hace difícil de correlacionar,1 es de suponer que también el conteo de huevos y la concentración de coproantígenos dejen de guardar relación. Este hecho pudiera explicar el por qué en aquellos individuos donde el conteo de huevos fue superior a los 150 huevos/g no se encontrara relación positiva con los niveles del antígeno en las heces.
Se ha demostrado que en áreas endémicas, la reinfección por F. hepatica puede ocurrir con frecuencia,1 de tal manera que la fase aguda de una infección secundaria puede superponerse a la fase crónica de la infección inicial o simplemente, que el individuo pueda reinfectarse de forma continua, de modo que varias infecciones sucesivas puedan cursar a intervalos de diferencia cortos. Si esto ocurre, es muy probable que pacientes crónicos puedan tener antígenos circulantes tal como ha sido reportado por Espino y otros,4 y pudiera también ser una posible explicación al hecho de que en el presente estudio, 3 de los pacientes crónicos tuvieran a la vez niveles detectables de antigenemia, complejos inmunes, anticuerpos y coproantígenos, de la misma manera que pudiera explicar el hallazgo de que 2 de los pacientes en la fase aguda presentaran tan elevados niveles de coproantígenos con sólo 28 y 30 d de evolución.
Summary
24 patients with fascioliasis were studied. 19 of them were in the chronic stage and 5 in acute stage. The presence of antigens and of circulating immune complexes (CIC) was detected in 100 % of the patients suffering from acute fascioliasis with less than 30 days of evolution of the clinical symptoms; whereas coproantigens were present in 100 % of the chronic patients. In this group it was observed a considerable number of cases with elevated levels of antibodies. 43.7 % of the cases with CIC were detected by using the precipitation technique with PEG and that of Clq deviation. A highly significant correlation was found between the eggs counting and the CIC levels by both techniques. Another important correlation was established between the eggs counting and the levels of coproantigens.Subject headings: FASCIOLIASIS/immunology; ANTIGEN- -ANTIBODY COMPLEX/analysis; FASCIOLA HEPATICA/immunology; ANTIGENS, HELMINTH/analysis; ANTIBODIES, HELMINTH/analysis.
Referencias Bibliográficas
- Chen MG, Mott KE. Progress in assessment of morbidity due to Fasciola hepatica infection: a review of a recent literature. Trop Dis Bull 1990;87:1-38.
- Biguet J, Caprón A. Aspects épidemiologiques, cliniques et diagnostiques actuels de la distomatose hépatique á Fasciola hepatica en France. Rev Gastroentérol 1966;21:55-65.
- Wattre P, Caprón M, Caprón A. Le diagnostic immunologique de la distomatose á Fasciola hepatica. Lille Med 1978;23:292-6.
- Espino AM, Marcet R, Finlay CM. Detection of circulating excretory secretory antigens in human fascioliasis by sandwich enzyme-linked immunosorbent assay. J Clin Microbiol 1990;28:2637-40.
- Espino AM, Finlay CM. Sandwich enzyme-linked immunosorbent assay for the detection of excretory secretory antigens in human fascioliasis. J Clin Microbiol 1994;32:190-4.
- Espino AM, Duménigo BE, Fernández R, Finlay CM. Immunodiagnosis of human fascioliasis by enzyme-linked immunosorbent assay using excretory secretory products. Am J Trop Med Hyg 1987;37:605-8.
- Espino AM, Millán JC, Finlay CM: Detection of antibodies and circulating excretory secretory antigens for assessing cure in patients with fascioliasis. Trans R Soc Trop Med Hyg 1992;86:649.
- Lawley TJ, Ottesen EA, Hiatt RA, Gazzle LA. Circulating immune complexes in acute schistosomiasis. Clin Exp Immunol 1979:37:221-7.
- Lunde MN, Paranjape R, Lawley TJ, Ottesen EA. Filarial antigen in circulating immune complexes from patients with Wuchereria bancrofti filariasis. Am J Trop Med Hyg 1988;38:366-71.
- Armour J, Dargie JD. Immunity to Fasciola hepatica in the rat. Successful transfer of immunity by cells and by serum. Exp Parasitol 1974;35:381-8.
- Poitou Y, Baeza E, Boulard C. Humoral and cellular immune responses in rats during a primary infestation with Fasciola hepatica. Vet Parasitol 1992;45:59-71.
- Katz N, Chavez A, Pellegrino J. A simple device for quantitative stool tick-smear technique in schistosomiasis mansoni. Rev Inst Med Trop Sao Paulo 1972;14:397-400.
- Langley R, Hillyer GV. Detection of circulating parasite antigen in murine fascioliasis by two site enzyme linked immunosorbent assay. Am J Trop Med Hyg 1989;41:472-8.
- Espino AM, Marcet R, Finlay CM. Fasciola hepatica: Detection of antigenemia and coproantigens in experimentally infected rats. Exp Parasitol 1997;85:117-20.
- Sampaio-Silva ML, Santoro F, Caprón A. Circulating inmune complexes in human fascioliasis. Relationship with Fasciola hepatica egg output. Acta Trop 1981;38:39-44.
Dra. Liliana Pelayo. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.















