Introducción
La algarrobina es un producto concentrado, cuyos carbohidratos, azucares y otros componentes como proteínas, taninos extraídos de la vaina de algarroba durante el proceso de lixiviación (S/L) a temperatura de ebullición, para luego concentrar los sólidos solubles durante un periodo de tiempo hasta llegar a una baja actividad de agua y concentración de solidos solubles entre 70 a 80 % de sólidos solubles en la algarrobina encontrados en el mercado. Según Ludeña & Ludeña (2018), el bajo consumo per cápita y la menor frecuencia de consumo en un alimento procesado a alta temperatura contribuye a no sobrepasar los límites de ingesta de hidroximetilfurfural.
Durante la caramelización, los azúcares reductores a través de la enolización‐1,2 sufren reacciones de deshidratación y ciclación para formar finalmente el HMF. En condiciones de baja humedad, se ha propuesto una vía alternativa de formación de HMF a partir de la degradación de sacarosa en fructosa, que conlleva la formación del catión reactivo fructofuranosil, el cual puede convertirse directamente a HMF (Yaylayan, et al., 2003). Según Ludeña & Ludeña (2018), a mayor tiempo de exposición, a temperatura constante, en la evaporación de agua y concentración de sólidos solubles, en la obtención de algarrobina, mayor contenido de HMF.
Según Capuano & Fogliano (2011), mencionan que la reacción de Maillard y caramelización son altamente dependientes de la temperatura y tiempo aplicados, y las condiciones del medio de reacción. La formación de HMF es a su vez directamente dependiente de estos factores, en este sentido, los productos reducidos en HMF suelen tener reducciones en el color y aromas que los caracteriza.
Ferrera (2016), refiere que la mayor preocupación está relacionada a la conversión a sulfoximetilfurfural (SMF), un compuesto que se ha reportado como mutagénico e iniciador de tumores en la piel de los ratones, además de células bacterianas y mamarias. Por otro lado, Hamzalıoğlu & Gökmen (2020), estudiaron la formación de acrilamida en el café durante el tostado. Para este propósito, se propuso un modelo cinético completo que incluye los pasos elementales para la formación de acrilamida.
Los cambios en sacarosa, azúcares reductores, aminoácidos libres, asparagina, acrilamida, 3-desoxiglucosona, metilglioxal, glioxal y 5-hidroximetilfurfural se controlaron en el café durante el tostado a 200, 220 y 240 ° C. Las rutas dominantes de reacciones complejas que conducen a la acrilamida se desentrañaron mediante un enfoque de modelado cinético de múltiples respuestas. Los resultados del modelo indicaron que la sacarosa se degrada en glucosa y un catión fructofuranosilo reactivo. Curiosamente, la glucosa participa principalmente en la formación de intermedios, glioxal y especialmente 3-desoxiglucosona en lugar de la formación de acrilamida. Por otro lado, el catión fructofuranosilo contribuyó principalmente a la formación de 5-hidroximetilfurfural, que resultó ser el precursor intermedio más importante de la acrilamida formada en el café durante el tostado. S
Nhi, et al. (2020), consideran que los cambios provocados por la aplicación de la deshidratación al vacío en la textura del zumo dieron lugar a una mayor pérdida de agua y a un mayor contenido de azúcar (52,92 ± 0,79 °Brix), también menciona que el 2,2-difenil-1-picrilhidrazilo (DPPH) y el 2,2-azinobis-(3-etilbenzotiazolina-6-sulfonato) (ABTS) del zumo de pomelo se ven afectados por el calor y, en menor medida, por la presión.
Según Nguyen, et al. (2017), plantean que la fructosa contribuyó considerablemente a la formación de acrilamida y a la formación de HMF a través de la caramelización en los cuatro tipos de galletas, además no se encontró una correlación clara entre la acrilamida y el HMF en las galletas horneadas, ni entre la asparagina y la suma de las concentraciones de glucosa y fructosa en la harina de trigo.
Materiales y métodos
Para la caracterización de la vaina de algarroba se preparó la materia prima (algarroba) se le realizo una molienda en un molino manual (marca Corona) por 2 veces consecutivas graduando el ajuste de eje, el algarrobo molido paso por un tamiz N°70 (marca Fisher Scientific Company con abertura de malla 212 μm) y después se almaceno en frascos de tapa hermética para su posterior uso. Para determinar la Humedad y solidos totales se realizó en una estufa marca Memmert, modelo UF110 plus siguiendo el método “Standard Method for Determination of Total Solids in Biomass - Laboratory Analytical Procedure LAP-001”.
Para la determinación de Ceniza se realizó en un horno mufla marca Hornos Felix, modelo HM 010 siguiendo el método “Determination of Ash in Biomass - NREL/TP-510-42622”.Para el contenido de extractivo se realizó en extractores soxhlet (marca Pyrex) siguiendo el método “Standard Method for the Determination of Extractives in Biomass -Laboratory Analytical Procedure LAP-010”.Se determinó el análisis de perfil de aminoácidos en vainas y extracto de algarrobo. Para el análisis de aminoácidos se realizó según el manual de instrucción de WATERS “Waters AccQ Tag Chemistry Package - Instruction manual number WAT052874 Los carbohidratos estructurales se midieron usando el método “Determination of Estructural Carbohidrates and Lignin in Biomass- Laboratory Analytical Procedure. Se determinó azucares reductores totales mediante el método Antrona. Para el tratamiento de extracción (nivel laboratorio), se trabajó en lotes de 2 kg de vainas de algarrobo por batch y 8 litros de agua. Las vainas fueron pesadas, trozadas. Posteriormente se colocaron en un recipiente con agua y se procedió a realizar el proceso de extracción, (100 °C x 2.5 h). Luego se filtró, y el extracto fue colocado en un rotaevaporador al vacío, para su concentración.
En el producto concentrado se analizó color con un Colorímetro Konica Minolta CM-5, determinándose los parámetros de color (L*, a* y b*) a partir de los cuales se calculó el índice de pardeamiento (IP); sólidos solubles totales (°Brix) e Hidroximetil furfural por HPLC. Se realizó en los laboratorios del medio ambiente de la Universidad Nacional de Trujillo. Wang, et al. (2021), proponen un método aplicado con éxito al análisis de HMF en bebidas azucaradas para verificar la viabilidad en muestras reales. También Cui, et al. (2020), desarrollaron un método basado en cromatografía de gases acoplada con espectrometría de masas de triple cuadrupolo (GC-MS / MS) combinada con extracción Queches para detectar furfurales, incluidos furfural, 2-acetilfurano, 5-metil-2-furfural y 5-hidroximetil-2 -furfural, en productos lácteos a base de leche.
Resultados y discusión
La tabla 1 muestra el análisis de composición química de la vaina de algarroba en estado fruto de cáscara amarilla, donde los valores de humedad y el contenido de cenizas, para el análisis difieren, pero en el contenido de sólidos totales están dentro del rango Ludeña (2012), encontró en la pulpa de algarroba 12.76% de humedad, 3.45% de ceniza, 59 % de sólidos solubles, 5.29 de pH valores muy aproximados a los de la tabla 1.
Tabla 1 - Composición química de la vaina de algarroba.
| Análisis | Valor 1 |
a
|
|---|---|---|
| Humedad (%) | 37.1698 ±1.6552 | 7.3 a 12.5 |
| Sólidos totales (%) | 62.8302± 1.6552 | 59.3 a 64.8 |
| Cenizas (%) | 4.3641±0.1238 | 2.58 a3.79 |
| Extractivos (%) | 80.6065±1.5710 | |
| pH (unidades) | 5.25 a 6.16 | |
| Proteínas (%) (factor 6.25) | 6.03 a 8.43 | |
| Azucares reductores (g/100g glc. Eq.) | 2.19 a 2.83 | |
| Carbohidratos totales (%) | 33.72 a 49.73 |
El contenido proteico de 6.03 a 8.43 % y de carbohidratos totales 33.72 a 49.73 %, muestras de algarroba de Piura, es menor a los que muestran Colqui & Domínguez (2018), reportando 11,6% de proteínas y 56% de carbohidratos de las muestras de pulpa de algarrobo del distrito de Tucúme; y, 11,2% de proteínas, 57% de carbohidratos y 3,2% de lípidos para las muestras del distrito de Olmos en Lambayeque; no mostrando diferencias significativas.
En algunos casos las diferencias de los valores reportados en la tabla 1, son posiblemente al estado de madurez de la vaina de algarrobo, al tipo de suelo y al estado fitosanitario del algarrobo ya que últimamente los algarrobos silvestres están padeciendo de una plaga en el algarrobo y la recurrente es la enallodiplosis discordis de la familia cecidomyiidae. Esta larva termina por secar las hojas, las cuales van cayendo y el algarrobo no puede hacer fotosíntesis y al final el algarrobo muere por inanición, según Ana Juárez, mencionado en el periódico el tiempo (Piura, 2018).
Tabla 2 - Porcentaje (%) de carbohidratos en vainas de algarrobo.
| Carbohidratos | Valor (%) |
|---|---|
| Celobiosa(disacar.) | 3.699 |
| Glucosa (monosa.) | 7.609 |
| Xilosa | 5.087 |
| Galactosa (monos.) | 0.6198 |
| Arabinosa | 0.8618 |
| Manosa ( monosa.) | 0.0855 |
La tabla 2, muestra los azúcares presentes en la vaina de algarrobo, entre monosacáridos de 5 carbonos (xilosa 5.087%, arabinosa 0.8618%) y monosacáridos de 6 carbonos (glucosa 7.609%, galactosa 0.6198%, Manosa 0.0855%); además de disacáridos (Celobiosa 3. 699%). Se observa mayor presencia de glucosa con 7.609% en la vaina de algarroba, indicando su presencia en la reacción para la formación de HMF en la algarrobina. Los valores de azucares reductores mostrados en la tabla 1 como de la tabla 2, son diferentes esto podría deberse al estado de madurez de la vaina y tiempo de almacenamiento que pudo tener como fruto. Según Bermello & García (2015), encontraron en la algarroba prosopis pallida azucares solubles totales de 48.5 g/100bs, sacarosa 46.1, fructosa 1.26, glucosa 1.02, xilosa 0.27 en g/100bs. valores mucho menores que los que se muestra en la tabla 1 y 2, esto podría deberse a la maduración de la vaina de algarroba
Tabla 3 - Determinación de la luminosidad (L*) y parámetros cromáticos (a* y b*).
| Color Hunter Lab | |||||
|---|---|---|---|---|---|
| ID-CSIC | Muestra | L | a* | b* | E |
| GR139-01 | Muestra A | 72.15 ±0.14 | 3.01±0.06 | 30.02±0.11 | 78.20±0.21 |
| GR139-02 | Muestra B | 69.59±0.18 | 4.86±0.08 | 23.11±0.12 | 73.48±0.20 |
| GR139-03 | Muestra C | 63.95±0.03 | 7.65±0.06 | 24.00±0.05 | 68.73±0.05 |
| GR139-04 | Muestra D | 69.38±0.24 | 3.81±0.09 | 28.38±0.20 | 75.06±0.37 |
| GR139-05 | Muestra E | 64.01±0.06 | 7.68±0.03 | 23.90±0.05 | 68.75±0.09 |
La tabla 3, muestra los parámetros cromáticos de la vaina de algarroba, donde la muestra A y D, presentan mayor tendencia al color intenso amarillo (+b indica amarillo, -b indica azul), siendo más luminosa la muestra A. respecto a las demás muestras.
Tabla 4 - Sólidos solubles del extracto de la algarroba.
| Muestra: Agua: | 1:4 |
|---|---|
| Extracto | SS (°Brix) |
| 1 | 11.5 |
| 2 | 12 |
| 3 | 12 |
| Promedio | 11.833 |
| D.E | 0.236 |
| CV | 2.44% |
La tabla 4 muestra los sólidos solubles en un promedio de 11.833% azucares extraídos del trozo de la vaina de algarroba sometido a una temperatura de ebullición, la relación de algarroba trozada con agua es de 1:4, Ludeña (2012), extrajo 14 % de sólidos solubles, probablemente la vaina de algarroba tuvo mayor madurez con más contenido de azucares. En el proceso de lixiviación del transporte de los azucares de la vaina de algarrobo al medio liquido (agua) no solo se transportan azucares sino también taninos y otros componentes. Según Bermello & García (20215), la pulpa de algarroba tiene taninos condensados 0.41 g /100 bs y polifenoles solubles totales 0.81 g/100bs.
Tabla 5 - Análisis de azucares simples en extracto de algarroba.
| Carbohidrato | Valor (g/l) |
|---|---|
| Fructuosa | 0.014655 |
| Glucosa | 0.002923 |
| Sacarosa | 0.1520767 |
La tabla 5 muestra los azucares simples presentes en el proceso de extracción, donde los azucares formarán parte de la formación de acrilamida (Ludeña, 2018; Ciesarová, 2021), como de los HMF, otros azucares contribuirán al sabor dulce y otros expresados en sólidos solubles, contribuirán al sabor amargo de la algarrobina.
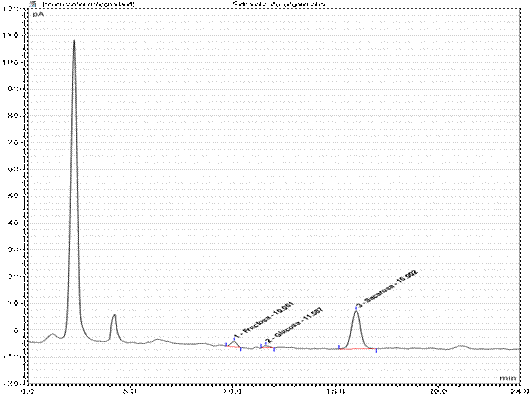
La fig. 1 muestra el espectro de los azucares presentes en el extracto de la vaina de algarroba, de la tabla 5.
Tabla 6 - Concentración de azucares reductores en el extracto de algarrobo.
| Concentración (g/l) | |
|---|---|
| Extracto de algarroba | 52.89±0.459 |
La tabla 6, muestra el contenido de extracto de azucares reductores en el extracto de azucares extraídos por lixiviación con una cantidad de 52.89±0.459, azucares que participarán en la reacción de Maillard. Según Jiménez & Peñafiel (2016), el HMF es un contaminante químico derivado de la reacción de Maillard, formado por la deshidratación de la fructuosa. Esta reacción ocurre principalmente en aquellos alimentos que contienen azúcares reductores que sufren un procesado térmico por calentamiento o conservación a temperaturas ambiente y se produce generalmente a baja actividad del agua.
Tabla 7 - Tratamiento de extracción (nivel laboratorio).
| Tratamientos | Presión (kPa abs) | T°C |
|---|---|---|
| T1 | 101.33 | 100 |
| T2 | 81.43 | 95 |
| T3 | 54.03 | 85 |
A nivel experimentar en la tabla 7, se observa que en el rotavapor con el extracto de azucares (lixiviado), sometiéndolo a tres tratamientos de presión y temperatura
Tabla 8 - Parámetros de color e Índice de pardeamiento de miel de algarrobo.
| Tratamientos | L* | a* | b* | IP |
|---|---|---|---|---|
| T1 | 27.35 | 4.96 | 5.88 | 36.6 |
| T2 | 21.99 | 3.45 | 4.27 | 32.7 |
| T3 | 22.19 | 2.21 | 2.91 | 21.0 |
La tabla 8, muestra el índice de pardeamiento (IP), a mayor luminosidad mayor índice de pardeamiento, mostrando la muestra de algarrobina un color marronesco, por efecto de la temperatura moderada (85°C) a 54.03 kpa, respecto a la temperatura de concentración (100°C) a presión de vacío a 54.03 kpa abs, de la algarrobina.
Ludeña (2012), obtuvo una algarrobina color oscuro a una temperatura de 105°C a presión atmosférica y a 72% sólidos solubles. Tal como se observa en la tabla 8, la muestra de miel concentrada a mayor temperatura y presión presentó mayor valor de IP. Según Nhi, et al. (2020), mencionan que la alta presión mostró efectos insignificantes sobre el color. Sin embargo, un mayor tiempo de calentamiento pareció provocar el pardeamiento del zumo. En comparación con la muestra fresca, el valor de la diferencia de color total (DCT) de la muestra tratada fue de 6,73 ± 0,58 tras 150 minutos de calentamiento a 85°C.
Tabla 9 - Contenido de Hidroximetilfurfural en miel de algarroba.
| Tratamientos | Presión (kPa) | T°C | HMF (ppm) |
| T1 | 101.33 | 100 | 181.16±5.91 |
| T2 | 81.43 | 95 | 175.18±0.58 |
| T3 | 54.03 | 85 | 174.55±1.83 |
| Muestra comercial | 236.85±6.07 | ||
| Reducción | 26% |
La tabla 9, muestra el contenido de HMF, mostrando que a mayor presión de vacío menor contenido de HMF (174.55±1.83) a una temperatura de 85°C, aunque sus valores de HMF no muestran mucha diferencia significativa entre las muestras; pero si mucho menor al contenido de HMF encontradas por Ludeña (2012), obteniendo en tres muestras 593 ug/kg, 431 ug/kg y 0 ug/kg de HFM a presión atmosférica, a 105°C, donde a mayor tiempo en el proceso de concentración mayor presencia de HMF, encontrándose muestras incluso con 0 ug/kg de HMF, dando entender que el HFM también se puede descomponer a otros elementos, supuestamente tóxicos o no.
Según Crăciun, et al. (2020), encontraron un contenido de HMF (mg/kg) de 1.21±0.03 a 1.18-1.25 de miel de la acacia Rumania, mucho menor que las muestras de algarrobina, De aquí podemos deducir que, para obtener algarrobina, depende del material donde se encuentra la solución a concentrar, utilizar un rota vapor (material de vidrio), es diferente a concentrar en ollas de aluminio como en los peroles de bronce., influenciando mucho la conductividad térmica del material; además también hay que considerar el tiempo de exposición, concentrar bajos volúmenes de una solución es más manejable que grandes cantidades durante la concentración, esto también influye en la presencia de acrilamida como de hidroximetilfurfural.
Según Arrivas (2013), menciona que la RM y la caramelización se ven favorecidas en gran medida por la relación temperatura/tiempo y las condiciones del medio de reacción (contenido de agua, acidez, cationes divalentes). De esta manera, disminuyendo la temperatura durante el procesamiento y/o almacenamiento se consigue disminuir la formación de HMF de una manera sencilla. En general, el aumento del tiempo de almacenamiento también aumenta la cantidad de HMF formado. Condiciones de baja y moderada humedad se asocian a un aumento en la formación de HMF, debido a que la RM se ve acelerada por la deshidratación del azúcar.
En condiciones extremas de procesado se ha observado un descenso del HMF en galletas debido a la degradación de éste a productos secundarios, la mayor parte volátiles (Ameur, et al., 2006). Sin embargo, estas condiciones afectarán de forma drástica a la calidad del producto pudiendo llegar a generarse otros compuestos indeseados como la acrilamida. Por lo expuesto, el sistema de concentración al vacío permitió reducir el color en un 11% y 43% a las presiones 81.43 kPa (95 °C) y 54.03 kPa (85 °C) respectivamente, en comparación al tratamiento a condiciones normales (101.32 kPa).
Por otro lado, se realizó una evaluación sensorial con público consumidor, reportándose ligera reducción del sabor amargo en los tratamientos elaborados a presión de vacío. Sin embargo, se recomienda realizar un análisis descriptivo con panelistas entrenados para validad los resultados. También se puede observar de la tabla 9, que el sistema de concentración al vacío permitió obtener muestras con 26% menos HMF respecto a una marca comercial. Según Hamzalıoğlu & Gökmen (2020), la sacarosa se degrada en glucosa y un catión fructofuranosilo reactivo. el catión fructofuranosilo contribuyó principalmente a la formación de 5-hidroximetilfurfural, que resultó ser el precursor intermedio más importante de la acrilamida formada en el café durante el tostado.
Según Vieira, et al. (2017), analizaron HMF en 38 muestras de zumos y néctares de manzana comerciales donde el 100% tenía presencia de HMF con un intervalo de 0,7 -27 mg/L y media de 6,7 mg/L con un porcentaje de 15,8% (n=6) de las muestras positivas a HMF y por encima de los límites legislados. Marcondes, et al. (2021), mencionan que en el contenido de 5-HMF en los 23 productos a base de tomate analizados osciló entre 1,30 y 312 mg kg-1, lo que se correlacionó positiva y significativamente con los niveles de azúcares (fructosa y glucosa) y la acidez.
Este estudio pone de manifiesto la importancia del control del 5-HMF en los productos a base de tomate, así como la necesidad de establecer límites máximos legales para ofrecer un producto seguro al consumidor. Jung, et al. (2021), evaluaron el impacto de la acidez en los parámetros cinéticos de la conversión hidrotermal de fructosa a 150 ° C.
Los parámetros de reacción se variaron en el tiempo (5-180 min), ácido (NaHSO4, H3PO4, ácido cítrico y ácido fórmico) y concentración de ácido (0,016 a 1,6 mol / l). Los datos experimentales se evaluaron con un modelo cinético novedoso que incluye la formación de HMF, LA y huminas. Si bien se esperaba que la tasa de deshidratación de fructosa a HMF y la tasa de rehidratación de HMF a ácido levulínico dependieran linealmente de la concentración de protones, los resultados muestran que en realidad existe una relación exponencial. Esto puede explicarse por la participación del ión ácido en reposo en las reacciones de deshidratación y rehidratación. Por el contrario, la tasa de formación de humin depende linealmente de la concentración de protones y, además, la sensibilidad de esta relación es bastante baja. Esto aclara por qué altas concentraciones de ácido o concentraciones de protones, respectivamente, aumentan la formación de LA a expensas de la formación de humina.
Conclusiones
En el estudio se demostró que para la extracción de azucares se utilizó una dilución algarroba trozada con agua en 1:4
A presión de vacío de 54.03 kpa absoluta, con 85°C de temperatura se obtuvo 174.55±1.83 de HMF, con una reducción del 26% respecto a la algarrobina comercial.
El color de la algarrobina concentrada a vacío es marronezco a comparación del color oscuro de la algarrobina comercial. A mayor presión de vacío menos HMF y menor índice de pardeamiento (IP).