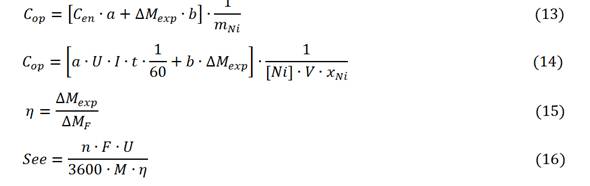Introducción
La electrocoagulación se ha presentado como un método efectivo para la remoción deníquel de residuales líquidos de diferentes industrias.1,2,3,4,5,6,7,8
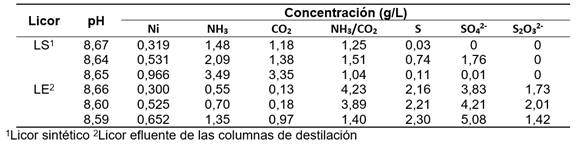
En el caso de la industria del níquel en Cuba por la tecnología de lixiviación carbonato-amoniacal, en el proceso de destilación y obtención del carbonato básico de níquel, sistema Ni(II)-NH3-CO2-SO2-H2O, se obtiene un efluente líquido con una concentración de níquel disuelto remanente entre 0,2 y 1,0 g/L y varias especies en composición según las proporciones: 1,5≤NH3/CO2≤2,0; 1,8≤Ni/S≤3,2; 10,4≤CO2/S≤13,8.9)
En estudio a escala de laboratorio se determinaron las condiciones más favorables para la remoción del níquel de ese efluente industrial con el par de electrodos Al/Al. A una concentración inicial de 660 mg/L se obtuvo un 95 % de eficiencia a 9,8 mA/cm2, 60 ºC, pH 8,65 y 40 min de electrólisis.10) A los valores definidos para las variables independientes y níquel inicial entre 293 y 1356 mg/L, se determinó la cinética de reacción, la isoterma de adsorción, se caracterizó el precipitado por los métodos ICP-OES, DXR y FTIR, y se analizó el mecanismo de remoción. Se propuso un modelo cinético el cual sugiere que el proceso está determinado por la contribución simultánea de la resistencia de los mecanismos: nucleación, difusión externa, la reacción química y un posible efecto autocatalítico.
Posteriormente, a escala de banco se obtuvo una eficiencia de remoción promedio de 99,67 (+/-0,06) % para níquel inicial de 300 a 652 mg/L. El modelo cinético presentado previamentefue representativo de los nuevos resultados experimentales con un coeficiente de determinación (R2) de un 99,59 %.
Por otra parte, en la literatura se hacen referencias a varios modelos cinéticos de adsorción (8,11,12,13,14,15) y de isotermas de adsorción8,11,12,13,14,15,16,17;teniendo en cuenta la caracterización del producto portécnicas como: DXR, FTIR, SEM, TGA-DSC, y el análisis de las interacciones químico-físicas adsorbato-adsorbente,se plantearon mecanismos de remoción.
Este trabajo tuvo el propósito de determinar la cinética e isoterma de adsorción para la remoción de níquel del sistema Ni(II)-NH3-CO2-SO2-H2O por electrocoagulación a escala de banco, estimar el costo de operación y contrastar los resultados con los estudios previos a escala de laboratorio.
Fundamentación teórica
La adsorción es un fenómeno superficial en el cual átomos, iones o moléculas de gases, líquidos o sólidos disueltos son retenidos en la superficie de una sustancia sólida o líquida. Una de las etapas del proceso de electrocoagulación consiste en la adsorción de los contaminantes sobre los coagulantes.1,2,3,4,5,6,7,8,10,11
En la literatura se identifican los modelos conceptuales: Modelos de isotermas de adsorción y modelo de superficie de coordinación.
Los modelos de isoterma describen el equilibrio de la adsorción de un material en una superficie a temperatura constante. Representa la cantidad de material unido a la superficie en función del material presente en la fase gas o en la disolución.11-16
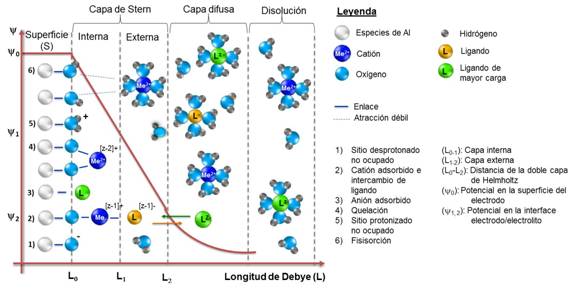
Por su parte, el modelo de superficie de coordinación trata la superficie de adsorción como un plano de grupos hidróxidos, X-OH, donde X representa átomos de metales (Ni, Fe, Al). Se considera que en los sitios de adsorción el -OH es un ligando ácido-base sensible y forma complejos en la disolución. Incorpora el modelo de la doble capa eléctrica modificado por Stern y Grahame (figura 1).18,19
La coordinación en la capa interior de Stern (plano interno de Helmholtz) consiste en que el ion central y el ligando están en contacto directo en un sitio específico de la superficie, con una interacción fuerte y estable. Involucra enlace iónico, covalente o la combinación de ambos.
Por otra parte, la coordinación en la capa exterior de Stern (plano externo de Helmholtz) resulta cuando una o más moléculas de agua se interponen entre el ion central y el grupo funcional ligando de la superficie con carga opuesta. Involucra interacciones electrostáticas débiles, se le denomina adsorción no específica y neutraliza la carga superficial en sitios deslocalizados.20,21,22,23,24
El ion difuso se refiere al ion central rodeado de moléculas de agua (solvatado) el cual neutraliza la carga superficial en sitios deslocalizados. Los iones solvatados son intercambiables tanto de la esfera exterior como el ion difuso, por varias reacciones en equilibrio en la superficie de coordinación.23
Materiales y métodos
El licor alimentado a la celda de electrocoagulación procedió de la empresa productora de níquel en Punta Gorda, Cuba. Se utilizó licor efluente de las columnas de destilación, además, se prepararon licores sintéticos a partir del Licor Producto (9), licor efluente y agua destilada (tabla 1).
La electrocoagulación se realizó en un reactor cilíndrico de 25 L de capacidad útil, equipado con dos impelentes y dos pares de electrodos planos Al/Al.
Las variables dependientes fueron la remoción de níquel (X, %), el consumo de energía y de electrodo; las variables fijas, densidad de corriente de 8,3 mA/cm2, pH 8,65, tiempo de retención 40 min y temperatura de 60ºC; variable independiente, composición iónica del licor de alimentación.
Se determinó la capacidad de adsorción (Qt) o cantidad de adsorbato adsorbido por unidad de adsorbente (mg/g) (1).10,13
donde
C0 (mg/L) es la concentración inicial de níquel;
Ct (mg/L) concentración en cada intervalo de tiempo en la fase líquida;
V (L) volumen de disolución;
ΔMF(g) cantidad de metal que se disuelve de acuerdo a la Ley de Faraday (2).
donde
M (26,98 g/mol) peso molecular del [Al];
I (A) intensidad de corriente;
t (min) tiempo de electrocoagulación; nnúmero de electronespara aluminio (n=3);
F constante de Faraday (96487 c/mol);
L número de electrodos ánodos.
Cuando la duración del proceso es lo suficientemente prolongado, Qt es constante y determina la carga o capacidad de adsorción en el equilibrio (Qe) experimental, correspondiente a la concentración (Ce) en el equilibrio.
Se evaluaron varios modelos de cinética de adsorción (11-15(tabla 2) y de isotermas de adsorción 11-13,15-17 (tabla 3).
Los parámetros de los modelos se ajustaron aplicando el StatGraphic 5.1 y el Microsoft Excel; la mejor calidad de ajuste se decidió por el mayor coeficiente de determinación (R2). Se calculó el costo de operación por kg de níquel removido (Cop, CUP/kg), la eficiencia de la corriente eléctrica (() y el consumo específico de energía por kg electrodo disuelto (See, kW-h/kg), (3)-(6).4,10
donde
Cen (kW-h) consumo de energía;
ɑ (3,88 CUP/kW-h) costo de la energía eléctrica;
b (46,08 CUP/kg) costo del electrodo de aluminio;
ΔMexp pérdida de peso experimental de los electrodos;
mNi (kg) masa de níquel removido;
U (V) tensión;
[Ni2+] (g/L) concentración inicial;
V (L) volumen útil de la celda;
xNi fracción convertida o remoción de níquel.
Resultados y discusión
La eficiencia de remoción de níquel (X) por electrocoagulación alcanzó un promedio de 99,65 (+/-0,07) % al procesar los licores efluentes del proceso industrial de destilación y la concentración en equilibrio (Ce) resultó menor que 2 mg/L en el residual. En la medida que incrementó la concentración de 300 a 652 mg/L, aumentó la capacidad de adsorción (Qe) y sugiere que no se consiguió la máxima capacidad a las condiciones experimentales (tabla 4).
Tabla 4 Concentración en equilibrio y capacidad de adsorción del níquel a 8,3 mA/cm2, 60ºC, 40 min y pH8,64+/-0,033
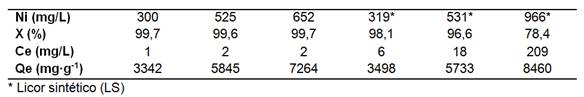
Sin embargo, al utilizar licor sintético la remoción (x) fue inferior y disminuyó con el incremento del níquel en disoluciónpara un níquel remanente entre 6 y 209 mg/L.
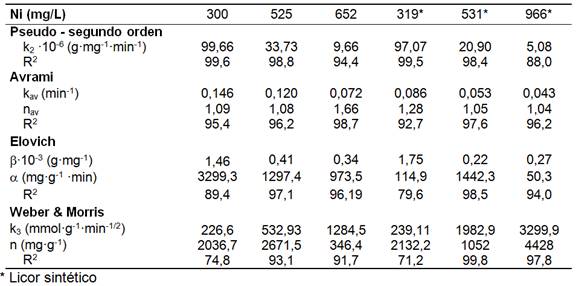
Los resultados experimentales se ajustaron a los modelos cinéticos de adsorción. De acuerdo al coeficiente de determinación (R2), se ordenaron por su calidad de ajuste según: (1) pseudo-segundo orden > (2) Avrami> (3) Elovich> (4) Weber-Morris >>> (5) pseudo-primer orden (ver tabla 5).
El modelo de pseudo-segundo orden mostró que en la medida que incrementó la concentración inicial de níquel disminuyó la constante de velocidad (k2), lo que se atribuye a la saturación de los centros activos de la superficie de adsorción con el catión [Ni2+] incrementando el tiempo necesario de electrocoagulación. Al operar con los licores sintéticos se alcanzó menor k2 y se atribuye a la inferior concentración de especies aniónicas, fundamentalmente de azufre [SxOy Z-].
Por su parte, el modelo de Avrami tuvo una calidad de ajuste 95,4≤R2≤98,7% para los licores efluentes del proceso y la constante cinética (kav) también disminuyó proporcionalmente con la concentración de [Ni2+]. Fue más representativo de los datos para alta concentración inicial de [Ni2+].
El modelo de Elovich supone que los sitios activos del adsorbente son heterogéneos y exhiben diferentes energías de activación. La constante cinética de velocidad (α) incrementó proporcionalmente con la concentración de [Ni2+], sugiere que incide más de un mecanismo en el proceso (89,4≤R2≤97,1 %); y la constante (β) relacionada con la energía de activación y la extensión de la superficie de adsorción, disminuyó con el incremento del [Ni2+] en todo el intervalo.
Por su parte, el modelo de Weber-Morris fue menos representativo de los datos (74,8≤R2≤93,1 %) refleja la influencia de la transferencia de masa externa seguido por la difusión interpartícula en poros de diferentes tamaños. Sugiere que el transporte de soluto a través de la estructura interna de los poros del adsorbente y la difusión propiamente dicha en el sólido no es un paso en el mecanismo, en correspondencia con el modelo de tiempo de conversión (Parte I), donde la difusión interna pudo prescindirse del proceso por su baja significación estadística.
Isotermas de adsorción de níquel
El modelo más representativo de los datos para los licores efluentes fue la isoterma deKoble-Carrigan (Ak: 3638 mg/L, Bk: 0,09 mg/L, p: 1,08), con un coeficiente de determinación (R2) 96,2%, refiere que la adsorción es una mezcla (Langmuir y Freundlich) y no precisamente la monocapa ideal de adsorción, homogénea y de sitios idénticos, sino que la distribución de los sitios activos y la energía en la superficie tiende a ser heterogénea; además, no se desprecian las interacciones entre el adsorbato.
En cambio, para el licor sintético, la isoterma más representativa fueLangmuir (99,9 %) seguida porKoble-Carrigan (99,8 %). De ambos modelos se puede inferir como posible mecanismo fundamental la quimisorción monocapa sobre un número finito de sitios específicos. Los parámetros de Langmuir son: qmax: 8 879 mg/g;KL: 0,096 7 L/mg y la constante de equilibrio 0,011≤RL≤0,031.
Análisis del mecanismo de remoción del níquel
A partir del análisis cinético y de isotermas de adsorción, siguiendo los resultados presentados en la parte I de este trabajo, se refiere que el proceso de remoción del níquel por electrocoagulación del sistema Ni(II)-NH3-CO2-SO2-H2O está determinado por la resistencia de los mecanismos:
La formación aleatoria del electrocoagulante Al(OH)3 y el crecimiento de la superficie de adsorción, a partir de las reacciones de hidrólisis y polimerización del aluminio, originando las especies monoméricas, poliméricas, oligoméricas de aluminio y el Al(OH)3, donde se produce la adsorción de los contaminantes (Ni2+, SxOy z-, CO3 2-, NH3) en los centros activos por interacción electrostática y superficie de coordinación, y la posterior cristalización, en competencia con aquella nucleación que se produce al crecer los depósitos sobre los electrodos (ecuación de Kolgomorov-Johnson-Mehl-Avrami-Erofeev). La difusión externa del adsorbato en la película o capa límite hasta la superficie del adsorbente (modelo 2D).La reacción química en los centros activos de la superficie de coordinación (Ley de Potencia) y la contribución de un posible efecto autocatalítico (Roginskii-Shultz).
La significación estadística de la concentración de azufre y dióxido de carbono sobre la remoción, de acuerdo al modelo tiempo de conversión, ratifica el efecto favorable de los aniones [SxOy z-; CO3 2-] sobre el proceso. Estos son atraídos por fuerzas electrostáticas para balancear las cargas y se adsorben en la superficie de coordinación; en interacción con la concentración inicial de níquel, activanun efecto sinérgico que propicia la remoción.
Costo estimado de operación
Se determinó el costo de operación (Cop) por consumo de electrodo y de energía eléctrica para el licor efluente del proceso. A un 98% de remoción de níquel, los costos fueron entre 9,268 y 13,352 CUP/kgde Ni; mientras que para un 99% de remoción, Cop incrementó hasta un 18,8% para un níquel remanente máximo de 7 mg/L (tabla 6).
Tabla 6 Costos estimados de operación para la remoción de níquel por electrocoagulación, 8,3 mA/cm2, 60ºC, pH 8,64+/-0,033
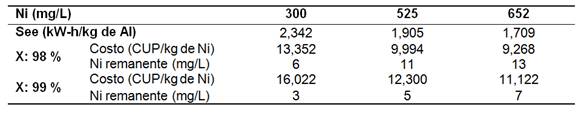
De acuerdo al mecanismo de remoción, se considera de interés evaluar la recirculación de una suspensión del producto obtenido, a determinada concentración de sólidos, al reactor de electrocoagulación a condiciones no saturadas de los sitios de adsorción, según el modelo de isoterma a seguir.
Conclusiones
Se obtuvo una eficiencia promediode remoción de níquel por electrocoagulación del licor efluente del proceso de destilación industrial, sistema Ni(II)-NH3-CO2-SO2-H2O, de 99,65 (+/-0,07) %, parauna concentración en equilibrio residual menor o igual que 2 mg/L y capacidad de adsorción entre 3342 y 7264 mg/gen el intervalo definido para las variables independientes.
Se estima que el proceso se encuentra probablemente bajo el control de la resistencia de los mecanismos reacción química y su contribución autocatalítica.
El costo de operación por consumo de energía eléctrica y de electrodo fue 11,12 y 16,02 CUP/kgde Ni y el consumo específico de energía de 1,709 a 2,342 kW-h/kg de Al.
Nomenclatura
ɑ: Costo de la energía eléctrica (CUP / kW-h)
ɓ: Costo del electrodo (Me, CUP / kg)
Cen: Consumo de energía (kW-h)
Cop: Costo de operación por kg de níquel removido (CUP/kg)
F: Constante de Faraday (96487 c / mol)
I: Intensidad de corriente (A)
See: Consumo específico de energía eléctrica por kg de electrodo (kW-h/kg)
t: Tiempo de electrocoagulación (min)
U: Tensión (V)
X: Remoción de Ni (%)
ΔMexp: Pérdida de peso experimental de los electrodos (g)
ΔMF: Cantidad de metal que se disuelve de acuerdo a la Ley de Faraday (g)
Eta-𝜂: Eficiencia de la corriente eléctrica