INTRODUCCIÓN
Las biotecnologías reproductivas como la superovulación (SOV), aspiración folicular transvaginal guiada por ultrasonografía (OPU, por sus siglas en inglés Ovum Pick Up) y la producción de embriones in vitro (PIVE por sus siglas en inglés), han demostrado un progreso significativo en los últimos años y por lo tanto, son consideradas alternativas que contribuyen al rápido mejoramiento genético del ganado bovino (Bó y Mapletoft, 2014). Sin embargo; dichas técnicas están influenciadas por características fisiológicas ováricas individuales de la hembra bovina (Ireland et al., 2007), tal como el recuento de folículos antrales (RFA), que por su alta variabilidad entre donantes compromete la eficacia de estas biotécnicas (Ireland et al., 2011). Y según se afirma el tamaño del ovario, la presencia de cuerpo lúteo y el RFA podría ser un buen marcador para la selección de donadoras con mayor potencial para generar embriones u ovocitos competentes, y así elevar la media de animales con adecuada respuesta a estas biotecnologías reproductivas(Alward y Bohlen, 2020).
En la actualidad la ecografía transrectal es utilizada para identificar y seleccionar donantes con un alto RFA en el marco de programas MOET (por sus siglas en inglés Multiple Ovulation Embryo Transfer) de reproducción asistida en bovinos (Singh et al., 2004). No obstante, es una técnica que requiere personal capacitado, equipos costosos e instalaciones adecuadas que faciliten la valoración cuidadosa de las imágenes obtenidas (Perry y Cushman, 2016); además, es necesario realizar varias exploraciones ecográficas durante el ciclo estral para determinar con exactitud el RFA (Ginther, 2016), lo que implica un manejo complicado de los animales, y según la idiosincrasia de las ganaderías de la región, a veces es imposible (Requelme y Bonifaz, 2012).
La ultrasonografía es una herramienta fiable para la valoración de estructuras como cuerpo lúteo y folículos antrales (Ginther, 2014), comparado con la palpación transrectal (Zduńczyk et al., 2009); sin embargo, la experticia del operador es un atributo fundamental para una correcta interpretación de las imágenes, llegando a obtener una confiabilidad del 70,3% cuando el operador es inexperto y un 97% cuando tiene experiencia (Gómez et al., 2017).
Además, la resolución del ecógrafo es esencial para una correcta interpretación de estructuras pequeñas, ya que conceptualmente un equipo con una resolución de 3 mm, por ejemplo, permite distinguir dos interfases separadas por 3 mm como dos estructuras diferentes; sin embargo, si la distancia que separa a las dos interfases es menor a 2 mm, esta se observará como una solo estructura (Díez Bru, 1992). Por lo tanto, la determinación en forma correcta de folículos menores a 3 mm está ligada a la resolución del ecógrafo (Rico et al., 2011) y a nivel de campo, los ecógrafos que se utilizan no poseen generalmente alta resolución.
Por lo antes expuesto, se evidencia la importancia de comparar la eficiencia de la técnica ultrasonográfica con la visual directa en el recuento de folículos antrales y las características morfológicas ováricas de vaquillas sacrificadas.
MATERIALES Y MÉTODOS
Localización y unidad experimental
El experimento se realizó entre enero y julio del 2021, en el laboratorio de biotecnología de la reproducción de la Universidad de Cuenca-Ecuador. Se analizaron 102 vaquillas raza Holstein mestizas, que llegaron a ser faenadas en el camal de Cuenca (EMURPLAG). Todos los animales presentaron condición corporal mayor a 3 en escala de 1 a 5, de acuerdo a lo descrito por Song et al. (2019) y diagnosticadas como sanas previamente por el técnico sanitario del centro. Posterior al faenamiento se recuperaron los dos ovarios por separado, de cada uno de los animales seleccionados.
Diseño experimental
El experimento fue de corte transversal, en el cual en primera instancia se realizó la valoración del ovario, cuerpo lúteo y el recuento de folículos antrales <4 mm y >4 mm presentes en los dos ovarios mediante ultrasonografía; y en segunda instancia se determinó en forma visual directa: el peso, tamaño del ovario y cuerpo lúteo; además, se realizó el recuento de folículos antrales <4 mm y >4 mm. Finalmente se comparó la técnica ultrasonográfica con la visual directa en forma general y luego agrupado de acuerdo a la fase del ciclo estral y la fase de la onda folicular, en la cual se encontraban los animales al momento de su faenamiento.
Metodología
La selección de los animales fue realizada en el patio de espera (pre-faenamiento), luego los dos ovarios de cada uno de los animales fueron recuperados y colocados en frascos estériles con suero fisiológico a temperatura de 35°C por separado, y ubicados en un cooler para ser transportados al laboratorio de biotecnología de la Universidad de Cuenca. En este sitio se retiraron todos los tejidos adyacentes al ovario y luego éstos fueron lavados con suero fisiológico atemperado a 35°C.
Evaluación ultrasonográfica de los ovarios:
El ovario derecho e izquierdo en ese orden fueron colocados en un recipiente con agua, con el fin de ser escaneados con un ecógrafo Aloka ProSound 2®, (Tokyo-Japón), provisto de un transductor lineal de 7,5 MHz. Se estableció el tamaño del ovario, mediante la fórmula ancho x largo/2. Luego se determinó la presencia o no del cuerpo lúteo (CL) y su tamaño con la misma fórmula antes descrita. Finalmente, se procedió a contabilizar los folículos antrales <4 mm y los >4 mm utilizando la técnica descrita por Ayala et al. (2019) mediante un escaneo dorso-ventral y latero-medial de cada ovario, realizado siempre por el mismo técnico.
Valoración visual del ovario:
Los ovarios derecho e izquierdo en ese orden, fueron trasladados a una sala diferente, donde otro técnico que desconocía los resultados de la ecografía realizó la valoración visual directa de los mismos. En primera instancia en cada ovario se valoró el número de folículos antrales <4 mm y los >4 mm. Luego el ovario completo fue pesado en una balanza analítica de precisión FS-400C (g) y medido el ancho y largo con un calibrador pie de rey (200 mm), para determinar su tamaño (mm). Posteriormente, se determinó la presencia de CL y se procedió a enuclear el mismo, con la finalidad de establecer el peso y tamaño de esta estructura.
Determinación de la fase del ciclo estral:
Para establecer la fase fisiológica del CL del animal al momento de su faenamiento (en formación “metaestro”; funcional “diestro” y en regresión “proestro”), se conjugaron dos criterios: el primero basado en el tamaño del CL (<15 mm metaestro o proestro y >15 mm diestro, según lo determinado por Ayala et al. (2017) y el segundo criterio en base al color del CL (hemorrágico “metaestro; café oscuro “diestro”; amarillo “diestro”, según lo descrito por Adams y Singh (2014).
Fase de la onda folicular
La fase de la onda folicular (reclutamiento, selección o dominancia) fue determinada en base a dos criterios emitidos por (Ginther, 2016), sobre el tamaño de los folículos antrales presentes en los dos ovarios; así, si el tamaño de la mayoría de los folículos antrales fue <4 mm se consideró en fase de reclutamiento. Sin embargo, si la mayoría de los folículos poseían tamaños entre 5-8 mm, fueron clasificados como animales en fase de selección. Por último, si el folículo de mayor tamaño tenía más de 10 mm y no se observaban folículos <4 mm se consideró en fase de dominancia.
Estadística:
Los datos fueron procesados en el programa estadístico SPSS versión 25. Se establecieron estadígrafos principales de todas las variables analizadas del ovario y sus estructuras. Se aplicó la prueba de Kolmogorov-Smirnov para determinar la normalidad de los datos. Para analizar las variables tamaño del ovario; así como el número de folículos antrales <4 mm y >4 mm, mediante las dos técnicas de evaluación (ultrasonográfica y visual directa) se aplicó un análisis de varianza de dos vías (ANOVA) y para evaluar las características del cuerpo lúteo se aplicó un análisis de varianza simple (ANOVA) y para comparar medias se utilizó Tukey al 5%. Además, se aplicó la prueba de Pearson para establecer la correlación del recuento de cada variable en ambas técnicas.
RESULTADOS Y DISCUSIÓN
Resultados generales del peso de los ovarios:
El estudio determinó que el ovario derecho pesó 3,21 g más en promedio, que el ovario izquierdo (Tabla 1). Además, se observó que un 86,27% de los 102 animales analizados uno de sus ovarios presentó un cuerpo lúteo en diferentes estadios de desarrollo, con un peso medio de 3,38 g. Esta particularidad de un mayor peso en cuanto al ovario derecho respecto al ovario izquierdo guarda concordancia con los datos emitidos por González, De la Rosa y Mendoza, (2017), quiénes describen valores medios de 9,7 g para el ovario derecho y de 7,8 g para el ovario izquierdo; resultados que reafirman mayor actividad del ovario derecho en comparación al izquierdo en el ganado bovino (Condo Plaza et al., 2015).
Tabla 1 Peso promedio de los ovarios y del cuerpo lúteo.
| Variable | N | | EE | Valores | |
|---|---|---|---|---|---|
| Mínimo | Máximo | ||||
| Peso del ovario derecho (g) | 102 | 8,23 | 0,38 | 2,40 | 21,90 |
| Peso del ovario izquierdo (g) | 102 | 5,02 | 0,24 | 1,10 | 13,30 |
| Peso cuerpo lúteo (g) | 88 | 3,38 | 0,22 | 0,20 | 9,20 |
N=número de casos. X=media del valor. EE=error estándar.
Evaluación del tamaño de los ovarios y cuerpo lúteo mediante la técnica ultrasonográfica y visual directa:
Al evaluar el tamaño de los ovarios mediante la técnica visual directa se determinó que el derecho presentó mayor tamaño (22,9 ± 0,42 mm) comparado con el izquierdo (20,96 ± 0,33 mm), con diferencia estadística (P<0,05) entre los dos ovarios. Del mismo modo mediante ultrasonografía el ovario derecho se observó más grande (23,4 ± 0,38 mm), en comparación con el izquierdo (21,4 ± 0,35 mm; Fig. 1). Estos resultados fortalecen el criterio de un mayor tamaño del ovario derecho en relación al izquierdo, expresado por Condo Plaza et al. (2015) y que se encuentra justificado por un mayor grado de funcionalidad del ovario derecho (Alba et al., 2006).
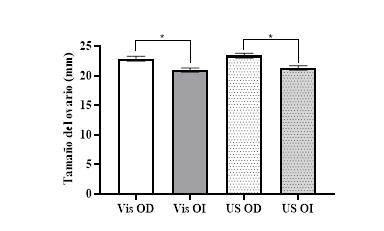
Fig. 1 Tamaño medio del ovario derecho e izquierdo, valorados mediante la técnica visual (Vis) y ultrasonográfica (US). *=diferencia estadística (P<0,05). Correlación de Pearson (r=0,75; P<0,001) entre la técnica visual directa y la ultrasonográfica.
Sin embargo, al comparar los valores medios del tamaño de los ovarios obtenidos en el presente estudio por las dos técnicas (ultrasonográfica y visual directa) se estableció que no existía diferencia estadística entre las mismas (P>0,05); además, la correlación entre los valores medios obtenidos por éstas dos técnicas son altas y significativas (r=0,75; P<0,001). Resultados similares fueron obtenidos al valorar el tamaño del cuerpo lúteo mediante las técnicas ultrasonografíca y visual directa determinando valores semejantes (15,3 ± 0,42 mm y 14,8 ± 0,44 mm respectivamente; Fig. 2), con una relación alta y significativa entre las dos técnicas (r=0,86; P<0,001). Por lo tanto, la utilización de la ultrasonografía como herramienta para determinar el tamaño del ovario y del cuerpo lúteo es altamente confiable en reproducción bovina (Crane y Muirhead, 2020).

Fig. 2: A. Tamaño medio del cuerpo lúteo (CL), valorados mediante la técnica visual (Visual) y ultrasonográfica (US). B. Tamaño medio del cuerpo lúteo (CL), en las fases del ciclo estral (metaestro, diestro y proestro). *=diferencia estadística, según Tukey (P<0,05).
Al evaluar el tamaño del cuerpo lúteo en fase de crecimiento (metaestro=13,6±0,28 mm), estática (diestro=19,9 ± 0,33 mm) y regresión (proestro=12,3 ± 0,88 mm; Fig. 2), se observaron valores similares a los descritos por Perea et al. (1998) en vaquillas mestizas (Holstein y Pardo Suizo con Brahman), quiénes fijaron un diámetro máximo de CL en el día 4 (fase de crecimiento) de 11 ± 0,2 mm y en el día 10 (fase de estática) un valor de 19 ± 0,3 mm. Estos resultados guardan concordancia con lo publicado por Ayala et al. (2019), respecto al tamaño del CL en las fases de crecimiento (14,4 ± 0,23 mm), estática (19,63 ± 1,06 mm) y regresión (12,3 ± 0,25 mm) para vaquillas de raza Holstein mestizas.
Resultados del recuento medio de folículos antrales <4 mm y >4 mm en el total de ovarios evaluados mediante las técnicas ultrasonográfica y visual directa:
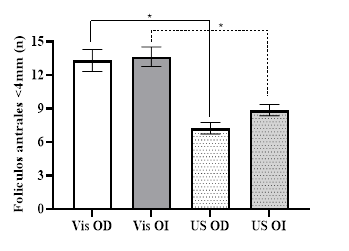
Fig. 3 Recuento medio de folículos antrales <4 mm en ovario derecho e izquierdo, valorados mediante la técnica visual (Vis) y ultrasonográfica (US). *=diferencia estadística (P<0,05).
El número medio de folículos antrales <4mm observados por la técnica visual directa en el ovario derecho (13,3 ± 0,99 folículos) e izquierdo (13,6 ± 0,88 folículos) fueron similares (P>0,05). Igual resultado se obtuvo al realizar el recuento folicular a través de la técnica ultrasonográfica derecho (7,2 ± 0,51 folículos) e izquierdo (8,9 ± 0,50 folículos; P>0,05).
Por el contrario, al comparar los valores promedios obtenidos por las técnicas visual directa y ultrasonográfica tanto en ovario derecho (13,3 ± 0,99 y 7,2 ± 0,51 folículos respectivamente) e izquierdo (13,6 ± 0,88 y 8,9 ± 0,50 folículos respectivamente) se determinó diferencia estadística entre las dos técnicas (Fig. 3). Estos resultados establecen que la técnica de ultrasonografía permite identificar el 54,13% del total de los folículos <4mm existentes en los ovarios, y que esto se relaciona directamente con el tamaño de los folículos y la resolución del equipo de ecografía, ya que conceptualmente un equipo con una resolución de 3mm; por ejemplo, permite distinguir dos interfases separadas por 3mm como dos estructuras diferentes; sin embargo, si la distancia que separa a las dos interfases es menor a 2 mm, ésta se observará como una solo estructura (Díez Bru, 1992). Por lo tanto, los folículos menores a 2 mm en este caso no son diferenciados por ultrasonografía como dos estructuras independientes y se considera una de las explicaciones del porque un 45,87% de los folículos de esta categoría no son identificados, a pesar de que la ecografía transrectal es una herramienta de gran utilidad para realizar el recuento de folículos antrales (Singh et al., 2004).
Otros factores que pueden incidir en el recuento de folículos antrales <4 mm (RFA), es que esta técnica requiere personal capacitado, equipos costosos e instalaciones adecuadas que faciliten la valoración cuidadosa de las imágenes obtenidas (Perry y Cushman, 2016) ya que el movimiento excesivo puede interferir con la interpretación de la imagen por lo que el animal debe estar bien restringido, así lo manifiestan Colazo y Kastelic, (2014). Además, Ginther, (2016) menciona que es necesario realizar varias exploraciones ecográficas durante cada ciclo estral para determinar con exactitud el recuento folicular.
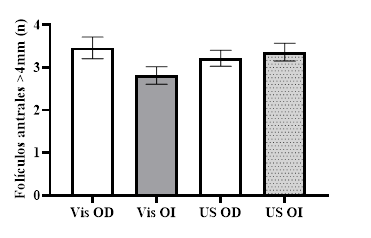
Fig. 4 Recuento medio de folículos antrales >4 mm en ovario derecho e izquierdo, valorados mediante la técnica visual (Vis) y ultrasonográfica (US). *=diferencia estadística (P<0,05).
Al contrario, al comparar el RFA realizado por las técnicas visual directa y ultrasonográfica a folículos >4 mm se observaron valores similares; en ovario derecho (3,46 ± 0,25 y 3,21 ± 0,18 folículos respectivamente) e izquierdo (2,81 ± 0,20 y 3,36 ± 0,21 folículos respectivamente; Fig. 4), lo cual reforzaría la teoría de que la ecografía transrectal es una técnica valiosa para el recuento de folículos antrales y efectiva en reproducción bovina.
Sin embargo, Gómez et al. (2017) establecen que los resultados son precisos cuando el ovario tiene pocos folículos grandes, pero la precisión disminuye cuando el ovario tiene gran cantidad de folículos pequeños; además, la presencia de estructuras similares a folículos como los vasos, complica aún más la interpretación de las imágenes.
Cushman et al. (2009) describen en sus resultados gran variación en el número de folículos entre vacas; sin embargo, observaron poca diferencia en el número de folículos en el ovario derecho e izquierdo dentro de un mismo animal. Estos enunciados concuerdan con los resultados observados en este estudio, donde no se evidenció diferencia significativa en el recuento medio de los folículos en ambos ovarios derecho e izquierdo; pero si diferencia entre las dos técnicas: visual directa y la ultrasonográfica (Fig. 5).
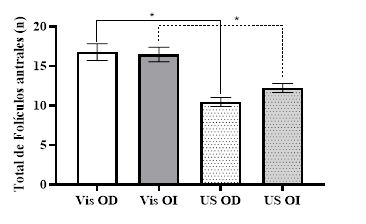
Fig. 5 Recuento medio total de folículos antrales en ovario derecho e izquierdo, valorados mediante la técnica visual (Vis) y ultrasonográfica (US). *=diferencia estadística (P<0,05).
Al agrupar el número de folículos antrales <4 mm establecido por la técnica visual directa y ultrasonográfica, según la fase del ciclo estral (metaestro, diestro y proestro), se observó una diferencia entre el 31,8% y el 48,6% en el RFA entre las dos técnicas. Sin embargo, al realizar el mismo análisis, pero con folículos >4 mm no se encontró diferencia entre los valores obtenidos mediante las dos técnicas (P>0,05; Tabla 2).
Tabla 2 Media y error estándar del número de folículos <4 mm y >4 mm, determinados por la técnica visual directa y ultrasonográfica (US), en las tres fases del ciclo estral (metaestro, diestro y proestro).
| Fase del ciclo estral | Técnica Visual | Técnica Ultrasonográfica | Significación | ||||||
|---|---|---|---|---|---|---|---|---|---|
| <4mm | >4mm | Total | <4mm | >4mm | Total | <4mm | >4mm | Total | |
| Metaestro | 22,0±1,97 | 5,9±0,40 | 28,0±2,06 | 14,9±0,91 | 6,5±0,39 | 21,4±1,08 | * | sn | * |
| Diestro | 32,4±3,65 | 6,3±0,99 | 38,7±3,76 | 18,9±2,69 | 6,6±0,68 | 25,6±2,91 | * | sn | * |
| Proestro | 34,9±4,28 | 7,0±0,79 | 41,9±4,38 | 18,3±2,03 | 6,7±0,65 | 25,0±2,12 | * | sn | * |
*=diferencia estadística al 5% en cada línea para cada variable entre folículos de un mismo tamaño al comparar las técnicas de valoración visual vs ultrasonográfica. ns=no hay diferencia entre grupos.
El tamaño del folículo es fundamental al momento de identificar y cuantificar eficientemente mediante la técnica ultrasonográfica; así, en la Tabla 3 se observa que el RFA >4 mm en las tres fases de la onda folicular: reclutamiento, selección y dominancia es tan efectiva como el realizado por conteo visual directo (P>0,05). Sin embargo, cuando el tamaño de la mayoría de los folículos evaluados es <4 mm como en las fases de reclutamiento y selección la técnica ultrasonográfica presenta menor efectividad (P<0,05; Tabla 3). Esta particularidad no se observa en la fase de dominancia (P>0,05) al evaluar folículos <4 mm, debido a que en esta fase (dominancia) el número de folículos <4 mm se reduce en un 57,15% y 31,82% comparado con las fases de reclutamiento y selección respectivamente (Webb et al., 2004).
Tabla 3 Media y error estándar del número de folículos <4 mm y >4 mm, determinados por la técnica visual y ultrasonográfica (US), en las tres fases de la onda folicular (reclutamiento, selección y dominancia).
| Fase de la onda folicular | Técnica Visual | Técnica Ultrasonográfica | Significación | ||||||
|---|---|---|---|---|---|---|---|---|---|
| <4mm | >4mm | Total | <4mm | >4mm | Total | <4mm | >4mm | Total | |
| Reclutamiento | 35,3±2,64 | 6,5±0,53 | 41,8±2,66 | 24,1±139 | 7,9±0,97 | 32,0±1,83 | * | sn | * |
| Selección | 22,3±2,15 | 7,3±0,74 | 29,6±2,53 | 14,9±0,95 | 7,6±0,39 | 22,6±1,11 | * | sn | * |
| Dominancia | 15,3±2,31 | 4,8±0,44 | 20,1±2,37 | 14,0±0,31 | 4,7±0,31 | 18,7±1,71 | sn | sn | sn |
*=diferencia estadística al 5% en cada línea para cada variable entre folículos de un mismo tamaño al comparar las técnicas de valoración visual vs ultrasonográfica. ns=no hay diferencia entre grupos.
CONCLUSIONES
La ultrasonografía es una herramienta valiosa que permite observar estructuras ováricas mayores de 4 mm con gran eficiencia; sin embargo, folículos menores de 4 mm presentan problemas en su identificación correcta mediante esta técnica en condiciones de campo. Por lo tanto, si el trabajo es investigativo y se busca identificar y valorar folículos antrales < a 4 mm; se debe contar con un ecógrafo con alta resolución, un técnico capacitado e instalaciones adecuadas para el óptimo manejo de los animales














