Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.43 n.3 Ciudad de la Habana sep.-nov. 2009
ARTÍCULOS ORIGINALES
Determinación de diclofenaco de sodio por cromatografía líquida de alta resolución en un colirio al 0,1 %
Determination of Diclofenac sodium by high-performance liquid chromatography in 0,1 % eyedrops
Caridad Margarita García PeñaI; Diana Pereda RodríguezII; Ania González CortezónI; Yanet Montes de Oca PortoIII; Yanara Cañizares ArencibiaIV; Gissel María León GuerreroV
I Licenciada en Ciencias Farmacéuticas. Máster en Tecnología y Control de Medicamentos. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
II Licenciada en Ciencias Farmacéuticas. CIDEM. La Habana, Cuba.
III Técnico Medio en Química Industrial. CIDEM. La Habana, Cuba.
IV Técnico Medio en Tecnología de la Salud. CIDEM. La Habana, Cuba.
V Licenciada en Química. CIDEM. La Habana, Cuba.
RESUMEN
El diclofenaco de sodio es un medicamento que se indica para los tratamientos posoperatorios de la inflamación del segmento anterior del ojo, la inhibición de la miosis pre y posoperatoria de cataratas, el tratamiento sintomático de las conjuntivitis crónicas no infecciosas y de la inflamación ocular, del dolor ocular y fotofobia poscirugía refractiva. En este trabajo se desarrolló y validó un método analítico por cromatografía líquida de alta resolución, para el control de la calidad y los estudios de estabilidad del diclofenaco de sodio 0,1 %, colirio. El método se basó en la separación del principio activo a través una columna cromatográfica Lichrospher 100 RP-8 endcapped (5 µm) (250 x 4 mm), con detección UV a 254 nm, para lo cual se empleó una fase móvil compuesta por solución de hidrógeno fosfato de sodio a pH 2,5:metanol, en proporción 34:60. La curva de calibración se realizó en el intervalo de 60 al 140 %, donde fue lineal con un coeficiente de correlación igual a 0,9995; la prueba estadística para el intercepto y la pendiente se consideró no significativa. Se obtuvo un recobrado del 100,25 % en el intervalo de concentraciones estudiados y las pruebas de Cochran´(G) y Student´s (t) resultaron no significativas. El coeficiente de variación en el estudio de la repetibilidad fue igual a 0,39 % para las 6 réplicas ensayadas, mientras que en los análisis de la precisión intermedia las pruebas de Fischer y Student fueron no significativas. El método analítico resultó lineal, preciso, específico y exacto en el intervalo de concentraciones estudiadas.
Palabras clave: CLAR/métodos, diclofenaco de sodio, validación, colirio.
ABSTRACT
Diclofenac sodium is a drug prescribed in eye anterior segment inflammation postoperative treatments, preoperative and postoperative cataract miosis inhibition, symptomatic treatment of non-infectious chronic conjunctivitis, of ocular inflammation, of ocular pain, and of refractory postsurgical photophobia. In present paper we developed and validated an analytical method by high-performance liquid chromatography to quality control, and stability studies of Diclofenac sodium of 1 % eyedrops. Method was based on active principle separation through endcapped 1 00RP-8 Lichrospher chromatographic column (5 µ) (250 x 4 mm) using UV detection to 254 nm, thus using a mobile phase including sodium a solution of hydrogen phosphate to a 2.5 pH: methanol in a 34:60 ratio. Calibration curve was plotted during the interval of 60 to 140 % where it was linear with a correlation coefficient equal to 0.9995; statistic test for interception and slope was considered as non-significant. We achieved a recovery rate of 100.25 % during study concentration interval, and Cochran (G) and Student (t) tests were not significant. Variation coefficient in repeating study was equal to 0.39 % for the 6 assayed replica, whereas in average precision analysis Fischer and Student tests were non-significant. Analytical method was linear, precise, specific and exact during the interval of study concentrations.
Key words: CLAR/methods, Diclofenac sodium, validation, eyedrops.
INTRODUCCIÓN
El colirio de diclofenaco de sodio al 0,1 % (fig. 1) es una solución empleada en el tratamiento posoperatorio de la inflamación del segmento anterior del ojo, en el tratamiento de la inhibición de la miosis pre y posoperatoria de cataratas, el tratamiento sintomático de las conjuntivitis crónicas no infecciosas, el tratamiento de la inflamación ocular, del dolor ocular y fotofobia poscirugía refractiva. El medicamento se presenta en frascos de polietileno de baja densidad, elaborados in situ, de 5 mL de volumen teórico, de color blanco opaco que protege a la formulación del efecto negativo de la luz.1
No se reportan en la Farmacopea de los Estados Unidos (USP 30, 2007),2 ni en la Farmacopea Británica (BP 2007),3 para este medicamento, métodos analíticos por cromatografía líquida de alta resolución (CLAR) para la cuantificación de principio activo, por esta razón se desarrolló un método cromatográfico para el control de la calidad y el estudio de estabilidad, teniendo en cuenta el método reportado en la BP 2007 para la materia prima de diclofenaco de sodio, y aplicarlo en el control de la calidad y el estudio de estabilidad del producto terminado.
Hirawatari4 emplea un método para determinar diclofenaco de sodio por CLAR, que utiliza una mezcla de acetato de sodio: solución de tetrabutilamonio a pH 4,8, en proporción 3:2; la determinación analítica se realiza a 279 nm.
El desarrollo de técnicas o métodos analíticos novedosos o la adecuación de algunos ya reportados es un problema cotidiano. Siempre que esto suceda se exige como parte integral del estudio, la validación del método en cuestión. La validación proporciona un alto grado de confianza y seguridad del proceso productivo o del método analítico así como también en la calidad de los resultados.5,6
El objetivo del presente trabajo fue el desarrollo de un método analítico para la determinación del principio activo en el colirio de diclofenaco de sodio al 0,1 %, por CLAR. Los parámetros evaluados en la validación del método analítico fueron exactitud, precisión, especificidad, robustez y linealidad.4,7
MÉTODOS
La sustancia de referencia química de diclofenaco de sodio fue suministrada por el grupo de sustancias de referencia del Centro de Investigación y Desarrollo de Medicamentos (CIDEM), la cual fue analizada por el método cromatográfico establecido para realizar el control de la calidad de la materia prima, con una pureza de 99,8 %. El producto terminado en forma de colirio fue elaborado en la UCTB Tecnologías Básicas, perteneciente al CIDEM, identificado como el lote 7001, fabricado en noviembre del 2007, el cual cumplió con las especificaciones de calidad establecidas para el control de la calidad del colirio.
Todos los reactivos utilizados fueron de grado HPLC, procedentes de la Riedel-de Haen.
En el ensayo se empleó un cromatógrafo (KNAUER) con detector UV/VIS (KNAUER) ajustado a 254 µm, un inyector con un rulo de 20 µL e integrador (SHIMADZU CR 8 A). La separación se realizó isocráticamente con el empleo de una columna Lichrospher 100 RP-8 endcapped (5 µm) (250 x 4 mm), y un flujo de 1,0 mL/min. La fase móvil óptima, consistió en una mezcla solución de hidrógeno fosfato de sodio a pH 2,5:metanol, de proporción 34:60.5,6
Para el análisis se disolvió una cantidad exacta de la sustancia de referencia química en agua destilada primeramente y después en fase móvil, de modo que se obtuviera una solución con una concentración final de 10 µg/mL. Las muestras fueron preparadas de forma similar.
Validación del método analítico
La validación fue realizada según la categoría I (USP-30) y la Regulación 41-2007 del Centro para el Control Estatal de la Calidad de los Medicamentos de Cuba (CECMED), para la Validación de métodos de análisis, en la que se evaluaron los parámetros que a continuación se describen:4,7
Linealidad. El análisis de la linealidad se realizó con la aplicación del modelo de 3 determinaciones para 5 concentraciones diferentes: 60, 80, 100, 120, y 140 %; se determinó la ecuación de la recta, el coeficiente de correlación, la prueba de significación estadística de la pendiente Sbrel (%), los coeficiente de variación de los factores de respuesta y el ensayo de proporcionalidad.
Exactitud. El análisis de exactitud se realizó por el modelo de 3 réplicas para 3 concentraciones diferentes: 80, 100, 120 %; se determinó el porcentaje de recuperación, la desviación estándar, el coeficiente de variación, la prueba de Cochran con vistas a comprobar si la variación de la concentración producía diferencias significativas en los resultados y la prueba de la t de Student para determinar diferencias significativas entre la recuperación media y el 100 %.
Precisión. El estudio de la precisión se realizó a través del modelo de repetibilidad 6 réplicas; se determinaron los valores medios, la desviación estándar y el coeficiente de variación.
De igual manera para el ensayo de la precisión intermedia se utilizaron 3 valores de concentración que correspondieron al 80, 100 y 120 % para 2 analistas y 3 días diferentes. Se aplicaron las pruebas de Fisher y de la t de Student para determinar si existían diferencias significativas entre los resultados al variar las condiciones de análisis.
Especificidad. Para el estudio de especificidad se analizaron: la sustancia de referencia de diclofenaco de sodio, el placebo; las muestras de producto terminado y muestras sometidas a condiciones drásticas como: hidrólisis ácida HCl 1 N y hidrólisis básica NaOH 1 N, a una temperatura de 100 °C por espacio de 2 h, para determinar si existen interferencias de los excipientes de la formulación o de los productos de degradación en la determinación del principio activo.
RESULTADOS
La figura 2 muestra los resultados del estudio de especificidad del método. Como se observa en el cromatograma correspondiente a la muestra placebo (A) no se obtuvo ninguna señal en la zona de interés, al ser comparado con la señal obtenida para la solución estándar de referencia (B) y de la muestra de diclofenaco de sodio colirio 0,1 % (C), lo cual indica que los excipientes o sustancias auxiliares de la solución no interfieren en la determinación del principio activo. En cuanto a las muestras sometidas a condiciones drásticas de hidrólisis básica y hidrólisis ácida, se observan en los cromatogramas (D, E), que la molécula resultó ser bastante estable, solo se pudo apreciar una ligera degradación por la disminución de la altura de los picos y la aparición de pequeños picos secundarios como posibles productos de degradación, lo cual no interfiere en la determinación del principio activo.
En la tabla 1 se reportan los resultados del estudio de la linealidad del sistema, la ecuación de la recta resultó ser Y= 232,49X + 118,07, el coeficiente de regresión lineal fue de 0,9995 y el coeficiente de variación del factor de respuesta resultó igual a 4,82 %.
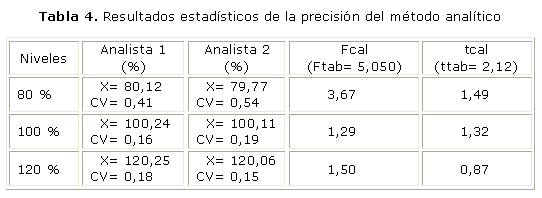
El resultado del estudio de precisión del método desarrollado aparece reportados en las tablas 2, 3 y 4. En el estudio de repetibilidad realizado, el coeficiente de variación fue de 0,39 %, mientras que los valores de F calculadas y los valores de t calculadas resultaron menores que los valores tabulados, para un 95 % de confianza, para cada uno de los niveles estudiados.
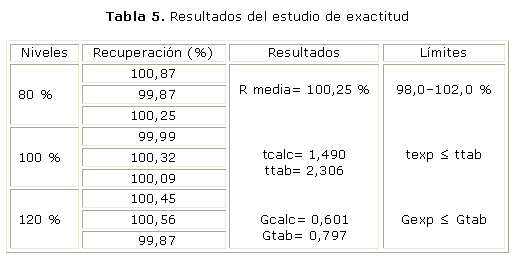
En la tabla 5 aparecen reportados los resultados del estudio de exactitud. La recuperación media fue de 100, 25 %, y los valores de t calculada (1,490) y de G calculada (0,601) fueron menores que los valores tabulados, para un 95 % de confianza, t tabulada 2,306 y G tabulada 0,797.
DISCUSIÓN
Los resultados de la validación del método para el control de la calidad y el estudio de estabilidad del colirio de diclofenaco de sodio 0,1 %, desarrollado realizando modificaciones al método descrito en la Farmacopea de los Estados Unidos (USP 30)2 para el control de la calidad de la materia prima de diclofenaco de sodio, en las proporciones de la fase móvil, así como en las columnas cromatográficas, demostraron la fiabilidad del método así como el establecimiento del método de análisis en el control de la calidad y el estudio de estabilidad del producto terminado.
Los resultados del estudio de especificidad del método (fig. 2), demuestran la especificidad del método al no presentarse interferencias de picos adicionales en la zona de elución del producto principal, ya que los productos de degradación y los excipientes de la formulación (Cremophor EL, trometamina, ácido bórico, cloruro de benzalconio) presentan tiempos de retenciones diferentes al principio activo, todos inferiores al tiempo de retención del diclofenaco de sodio. Dicho estudio permite concluir que el método cromatográfico resultó ser específico, pues permite cuantificar el principio activo después de la degradación de este en muestras de medicamento sin interferencias de excipientes o producto de degradación.4,6,7
Los resultados del estudio de linealidad muestran coeficientes de regresión y de determinación superiores a los exigidos, 0,99 y 0,98 respectivamente, lo que demuetra con el valor del coeficiente de correlación obtenido, cercano a la unidad, la existencia de correlación con una probabilidad elevada, así como el grado de relación entre las variables concentración y respuesta detectada por el equipo empleado. También el coeficiente de variación de los factores de respuesta y la desviación estándar relativa de la pendiente fueron inferiores al normado como máximo para estos indicadores: 5 y 2 %, respectivamente, ambos son considerados estimadores puntuales que permiten caracterizar la variabilidad. El valor del CVf permitió demostrar que existe variabilidad en la relación respuesta y concentración para cada nivel evaluado. El intervalo de confianza del intercepto incluye al cero, lo que permitió excluir la significación del error del intercepto. Se demuestra con los resultados la linealidad del método propuesto.7
En el estudio de la repetibilidad (tabla 2) realizado a una misma muestra, por el mismo analista, el mismo día, a través de 6 réplicas, se alcanzó un coeficiente de variación adecuado (0,39 %), lo que demostró la buena precisión del método, y se observó una variabilidad de los resultados dentro de los límites establecidos para los métodos cromatográficos: CV £ 2,0 %.7
Los valores que se obtienen en el estudio de precisión intermedia, de las pruebas de Fischer y de la t de Student, para el estudio de la precisión intermedia demuestran que no existen diferencias significativas entre las precisiones alcanzadas por los analistas en diferentes días, para una probabilidad de 0,05 %, ya que el valor de F calculada es menor que la F tabulada, este resultado permite establecer que las precisiones son similares (tabla 4). Al realizar la prueba de la t de Student el valor calculado resultó menor que el tabulado, para una probabilidad de 0,05, lo cual demuestra que no existen diferencias significativas entre las medias alcanzadas, con un nivel de significación de un 5 %.
Los valores de porcentaje de recobrado estuvieron dentro de los límites establecidos para los métodos cromatográficos (98-102 %), y los valores del coeficiente de variación para cada uno de los valores de concentración estudiados resultaron ser menores que el 2 %.4 Al aplicar la prueba de Cochran para analizar la influencia del factor concentración sobre la variabilidad, se obtuvo que G calculada fue menor que G tabulada, para una probabilidad de 0,05, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes, lo que indica que la concentración no influye en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, con un coeficiente de variación de 0,15 %, se obtuvo una t calculada menor que t tabulada.7 Los resultados demostraron la capacidad del método para detectar valores de concentración cercanos al valor verdadero, observándose una buena exactitud.
En resumen, el método analítico desarrollado por CLAR para la cuantificación del principio activo del colirio de diclofenaco de sodio para el control de la calidad y el estudio de estabilidad resultó ser lineal, preciso, exacto, robusto y específico en el intervalo de concentraciones establecido y puede ser establecido como método de control de calidad químico al medicamento diclofenaco de sodio colirio 0,1 %.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosenstein E. Diccionario de Especialidades Farmacéuticas. 47 ed. México, DF: Ed. PLM, SA de CV; 2001.
2. Farmacopea de los Estados Unidos-USP 30. Ed. The United States Pharmacopeial Convention. Estados Unidos de América NF-25. Copyright. Inc. Versión Electrónica (CD). 2007.
3. British Pharmacopoeia. The Stationery OfficeCopyright. Inc. Versión Electrónica (CD). London, 2004.
4. Hirowatari T. Evaluation of a new preoperative ophthalmic solution. Can J Ophthalmol. 2005;40:58-62.
5. Quattrocchi OA, Laba RF. Introducción a la HPLC. En: Aplicación y práctica. Buenos Aires: Ed. Artes Gráficas Farro SA; 1992. p. 106-122, 284, 302-28.
6. Dierksneier G. Métodos cromatográficos. La Habana: Ed. Científico-Técnica; 2005. p. 1-4, 256-412.
7. Validation of Analytical Procedures. Technical Requirements For The Registration of Pharmaceuticals For Human Use. En: International Conference on Harmonization, ICH-Q2A. Geneva Farmacopea de los Estados Unidos-USP 30 Ed. The United States Pharmacopeial Convention. Estados Unidos de América NF-25. 2007.
Recibido: 2 de marzo de 2009.
Aprobado: 7 de abril de 2009.
M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No. 1605 e/ Boyeros y Puentes Grandes, municipio Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu