INTRODUCCIÓN
La paramfistomosis es una enfermedad parasitaria emergente con áreas endémicas en las regiones tropicales y subtropicales, presente en Asia, Europa, África, América y Australia (Hayider, Mekuria y Mekibib, 2018). Las prevalencias de esta parasitosis en ganado bovino varían entre el 1,2 % en ciertas regiones de Argelia, 32,17 % en la India, 39,10 % en América y el 55.9 % al Noroeste de España (Siben, Domatsky, Nikonov y Beletskaya, 2018).
Es producida por diferentes especies de trematodos (Digenea), pertenecientes a la superfamilia Paramphistomoidea, donde están incluidas las principales especies que poseen interés en medicina veterinaria. Entre ellas encontramos a Paramphistomum cervi; P. microbothrioides, Calicophoron daubneyi, Calicophoron calicophoron y Cotylophoron cotyloforum. Tienen un ciclo biológico indirecto en el que participan como hospederos intermediarios los moluscos de agua dulce (Tandon, Roy, Shylla y Ghatani, 2014; Sargison, Shahzad, Mazeri y Chaudhry, 2019). De ellos, Galba cubensis se comportó como un eficiente hospedero intermediario en el continente americano, específicamente en Cuba (Vázquez, Sánchez, Alba, Rodríguez y Pino, 2013; Abreu, Piña, Diéguez, Vázquez y Fimia, 2019).
La paramfistomosis tiene dos formas clínicas, una aguda intestinal causada por las formas inmaduras y la otra crónica ruminal ocasionada por los parásitos adultos. Cuando las formas larvales se adhieren a la mucosa, atrofian las vellosidades intestinales, producen gastroenteritis, deshidratación y pérdida grave de la condición corporal, pues se reduce la ingesta voluntaria de alimentos y/o reducciones en la eficiencia de absorción de los nutrientes (Sanguankiat et al., 2016; Ploeger et al., 2017).
Los anfistómidos adultos también llevan a cabo una acción expoliadora del fluido ruminal, en especial sobre lípidos y ácidos grasos. Por todo ello, se puede afirmar que la parampfistomosis produce un descenso de la producción de ácidos grasos volátiles (AGV), de proteínas microbianas en el rumen y proteínas by-pass. Como consecuencia hay disminución de la conversión alimenticia y reducción de la producción de leche (Casas, 2018; Forbes, 2018).
En Cuba existen condiciones climáticas favorables de precipitación, humedad relativa y temperatura (Palacio, Bertot, Molento, Vázquez, Izquierdo y Arenal, 2017). Esto permite el desarrollo y la sobrevivencia de los estadios larvales en el pasto y del hospedero intermediario. El objetivo de esta investigación es determinar la presencia de la paramfistomosis en bovinos de sacrificio en Camagüey.
MATERIALES Y MÉTODOS
Para la investigación se utilizaron los datos de la inspección visual post-mortem de 550 bovinos sacrificados en el período marzo-mayo del 2017, en los mataderos pertenecientes a la industria alimentaria de Camagüey.
Los animales muestreados procedieron de 6 de los 13 municipios con que cuenta la provincia Camagüey, distribuidos de la siguiente forma: 105 de Camagüey, 92 de Jimaguayú, 60 de Minas, 135 de Najasa, 49 de Sibanicú y 109 de Vertientes.
Análisis de la prevalencia
Examen de la necropsia helmintológica
Durante el examen post-mortem, se inspeccionaron de forma sistemática el rumen y el retículo con el fin de detectar la presencia o ausencia de Paramphistomum sp. y la intensidad de infestación. Cada día de trabajo se inspeccionaron todos los animales sacrificados. En el proceso de faenado se extrajeron los pre-estómagos ligados en sus extremos con el fin de evitar pérdida de parásitos y su contenido. La disección del Rumen coincidió con los bordes o curvaturas dorsal y ventral y la del retículo con las curvaturas mayor y menor. Todo ello con el fin de exponer los paramfistómidos.
Se calculó la prevalencia por municipios. Para la intensidad de infestación de los paramfistómidos se establecieron cuatro niveles: Nulo (cero presencias), bajo (de 1 a 500), medio (de 501 a 1000) y alto (más de 1000).
Identificación molecular de Paramphistomum sp
Extracción de ADN
Se tomaron 10 parásitos por cada rumen de animales procedentes del municipio Vertientes. Se colocaron en alcohol al 70 %.
El ADN se extrajo mediante un tratamiento con 100 μg / ml de proteinasa K (Boeringer Manheim, Alemania) en tampón de lisis (Tris-HCl 10 Mm, pH 8,0, EDTA 100 mM, SDS al 0,5 %) por 5 a 8 h a 60 ºC bajo agitación suave. Las muestras se trataron tres veces con fenol y una vez con cloroformo. Luego, la fase acuosa se trató con 20 μg/ml de RNaseA (Sigma, EE. UU) durante 1 h a 37ºC. El ADN se purificó por extracción sucesiva con fenol: cloroformo y cloroformo, y se precipitó con dos volúmenes de etanol en acetato de sodio 0,3 M a -20ºC durante 2 h. Después de la centrifugación, el sedimento de ADN se secó y se resuspendió en 200 μl de agua doblemente destilada.
Reacción en cadena de la polimerasa
El gen del ARN ribosómico 18S (ARNr) se amplificó mediante cebadores universales 27F adelante (5´-CCAGAATTCAGAGTTTGATCMTGGCTCA-3´) y 1492 contrario, reverso (5´-ACCAAGCTTTACGGYTACCTTGTTAGGACTT-3´) en un termociclador (Eppendorf, Hamburg, Germany) bajo las siguientes condiciones: desnaturalización inicial (95°C durante 5 min), seguido de 34 ciclos cada uno a 94°C por 1 min, 58°C por 1 min y 72°C por 3 min, seguido de un paso de extensión final a 72°C por 7 min. Los productos del PCR se analizaron por electroforesis en gel de agarosa (1 %, w/v). Los amplicones se eluyeron y los productos de ADN purificado se secuenciaron en Myleus (MG, Brasil). Las secuencias de nucleótidos se analizaron mediante el programa de herramienta de búsqueda de alineación local básica (BLAST). En la determinación final de Paramphistomum sp se utilizó software MEGA 6 para el análisis de ADN probabilístico por el método Neighbo-Joining, con un Bootstrap de 1000 réplicas. Cada especie que se incluyó en el análisis contiene su número de referencia en GenBank.
Análisis estadístico
Se contabilizaron las variables municipios y órgano infestados (rumen, retículo y rumen+retículo) e intensidad de infestación.
Se empleó el software STATGRAPHICS Centurión XV ver 20.2.06 del 2007 para realizar una tabla de contingencia entre las variables intensidad de infestación y los municipios. Se compararon las proporciones de la prevalencia de los municipios con respecto a la media. Se realizó una comparación de la proporción media de la intensidad de infestación según los órganos infestados. Se aplicó en todos los casos la prueba de independencia Chi-cuadrado para P<0,05.
RESULTADOS
De un total de 550 animales analizados, la prevalencia arrojó un valor del 68,54 %.
El nivel de intensidad de infestación predominante en todos los municipios fue el bajo con un 46,18% (Fig. 1). De ellos, Vertientes y Camagüey con el 9,82 % y 9,45 % de los casos respectivamente alcanzaron los mayores valores, mientras que Sibanicú, con solo el 4,73 % de los casos, fue el de menor intensidad de infestación en este nivel.

Fig. 1 Resultado de la Tabla de Contingencia para la Intensidad de infestación según los municipios.
Nota: los valores representados corresponden a la frecuencia observada de cada municipio según la intensidad de infestación.
El análisis de comparación de proporciones evidenció diferencias significativas de la media del municipio Najasa con respecto al resto de los municipios (Fig. 2). La proporción que se obtuvo en el resto de los municipios en estudio se encuentra entre los límites establecidos, según su frecuencia observada.
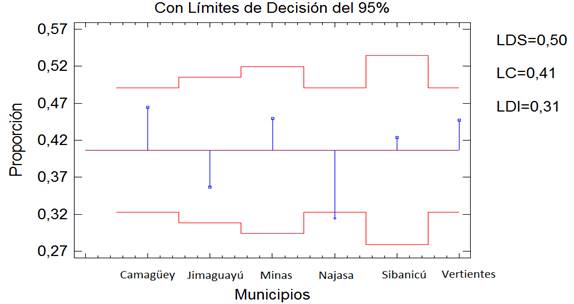
Fig. 2 Comparación de proporciones de la prevalencia de los municipios con respecto a la media. LSD: Límite Decisión Superior LC: Línea Central LDI: Límite Decisión Inferior.
Al realizar un análisis de proporciones con un 95 % de confianza entre la intensidad de infestación según los órganos infestados se comprobó que el nivel rumen+retículo es el que presenta diferencias significativas con respecto al rumen y retículo (Fig. 3).
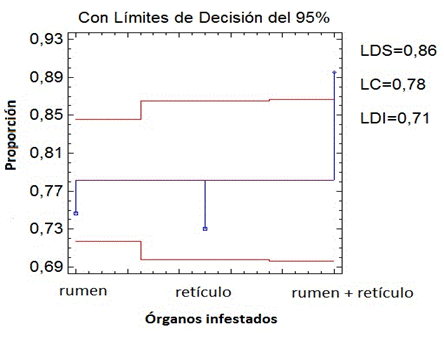
Fig. 3 Comparación de la proporción media de la intensidad de infestación según los órganos infestados. LSD: Límite Decisión Superior LC: Límite Central LDI: Límite Decisión Inferior.
Se secuenciaron 348 bases nitrogenedas de la región intergénica ribosomal del 18S. Los individuos encontrados en la provincia Camagüey tienen una identidad del 99,7 % con Cotylophoron cotylophorum.
El mejor alineamiento de la secuencia según BLAST se muestra en la Fig. 4 El único cambio que se observó es una transición de timina por citosina. No aparece ningún espacio en el alineamiento de la secuencia (E 3e-175). Otras especies mostraron identidades entre 93 y 99%, con menos cobertura de la secuencia.
El análisis filogenético indicó que la especie encontrada en estos muestreos tiene un 85 % de probabilidad de pertenecer al clade donde se encuentra Cotylophoron cotylophorum (Fig. 5). Sin embargo, Bacillus licheniformis no tiene ninguna probabilidad de pertenecer a este grupo, lo que confirma que el análisis es correcto.
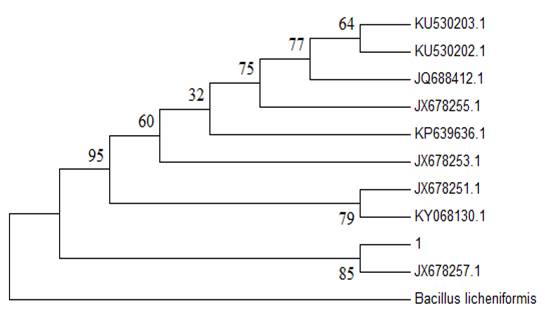
Fig. 5: Análisis filogenético de acuerdo al método Neighbo-Joining (Bootstrap de 1000 réplicas). Secuencias de referencia que se muestran por especie (10) y sus respectivos números de acceso GenBank. Cotylophoron cotylophorum JX678257.1, Calicophoron shillongensis, JX678251.1, Orthocoelium orthocoelium JX678255.1, Fischoederius elongatus KU530203.1, Fischoederius cobboldi KU530202.1, Orthocoelium orthocoelium JX678255.1, Olveria bosi JX678253.1, Gastrothylax crumenifer JQ688412.1, Carmyerius dollfusi KP639636.1, Explanatum explanatum KY068130.1. La secuencia KT924442.1 de Bacillus licheniformis se usó como un grupo externo.
DISCUSIÓN
Al analizar la prevalencia obtenida, se comprobó que obtuvimos valores similares (68,54 %) a los de Cauquil et al. (2016) en el Archipiélago Melanesio francés de Nueva Caledonia, quienes determinaron una prevalencia del 70 % de paramfistomosis en vacas adultas. Los autores refirieron que estos niveles podrían ser porque esta parasitosis no se considera un problema clínico o de producción en Nueva Caledonia y el tratamiento dirigido a este parásito es improbable, lo que se corresponde con la situación actual de Cuba. Este elevado nivel de prevalencia también está influenciado por las características del ecosistema en la provincia de Camagüey. El mismo está constituido por terrenos bajos llanos, típicos de sabanas inundables en períodos lluviosos, lo que resulta en una mayor dispersión del hospedero intermediario.
La prevalencia en Italia que reportaron Sanna et al. (2016) fue de un 55,9 % en vacas adultas, resultado que se puede considerar elevado pues más del 50 % de los animales están afectados con la paramfistomosis, lo que podría ser consecuencia de la presencia de reservorios de agua, lagos, ríos y disponibilidad de hospederos intermedios adecuados en estos lugares. Así mismo ocurre en Etiopía, donde se determinaron prevalencias de 51,82 % (Ayalew, Tilahun, Aylate, Teshale y Getachew, 2016). Esto ocurre probablemente porque existen factores ambientales favorables similares a las de nuestro país para el desarrollo de los moluscos de agua dulce.
La diferencia entre las proporciones de la prevalencia de los municipios pudo estar condicionado por las características de los ecosistemas, precipitaciones y temperatura que poseen cada uno e incluso, puede estar asociado a las formas productivas ganaderas en los lugares que se hace indispensable realizar embalses o tranques para garantizar el abasto de agua a los animales. Todo ello puede traducirse en condiciones propicias para el crecimiento y desarrollo del hospedero intermediario.
Cuando los animales inspeccionados presentan infestación en rumen+retículo, es mayor que cuando la infestación ocurre en un solo órgano, ya sea rumen o retículo. Esto demuestra que no existe especificidad tópica de las duelas por rumen o retículo, a pesar que, desde el punto de vista anatómico, el retículo no presenta las mismas condiciones que el rumen para su establecimiento.
En Galicia, España, se registró una proporción de 94,3 % en el rumen y solo un 5,7 % en el retículo (González-Warleta et al., 2013). Los autores infirieron que la menor carga en este último órgano puede estar relacionada con la escasez de papilas y por la acumulación de CO2 y metano presente. Además, la forma de las papilas en el atrio ruminal pueden tener un efecto protector sobre los tremátodos y la presencia de una capa fluida puede favorecer la ingesta de nutrientes por parte del parásito.
Los resultados moleculares obtenidos confirman los de Kotrla y Prokopic (1973) quienes determinaron, según su morfología, que en Cuba circulaba el Cotylophoron cotylophorum. Asimismo, evidenciaron que, en Camagüey, entre las especies encontradas era la que más abundaba. Sin embargo, durante esta investigación no se encontró ninguna de las otras especies detectadas por estos autores, lo que implicaría un estudio molecular específico para estas variedades.
La confirmación de la presencia de esta especie está en concordancia con uno de los géneros (Cotylophoron) determinados por Alarcón y Velásquez (2009) en regiones tropicales y subtropicales de mayor impacto en la producción ganadera de América. Estos investigadores demostraron que C. cotylophorum es una de las especies que circulan en Colombia. Así mismo, Morales, Pino y Moreno (2015) informaron su presencia en Venezuela en los estados Aragua, Zulia y Bolívar. En el sureste de Irán, ésta fue la segunda especie con mayor prevalencia (20%) detectada en mataderos de bovinos (Khedri et al., 2015).
CONCLUSIONES
Se detecta paramfistomosis en los bovinos de sacrificio en tres mataderos de Camagüey, con diferencias entre los municipios.
Se demuestra baja intensidad de infestación en los animales de abasto, sin encontrar especificidad por un órgano en particular.
La especie de Paramphystomum que circula en los bovinos de sacrificio pertenece al clade donde se encuentra Cotylophoron cotylophorum.
La alta prevalencia de esta especie evidencia que la paramfistomosis constituye una enfermedad desatendida en las poblaciones bovinas cubanas















